Die Familie der Herpesviridae
Werbung
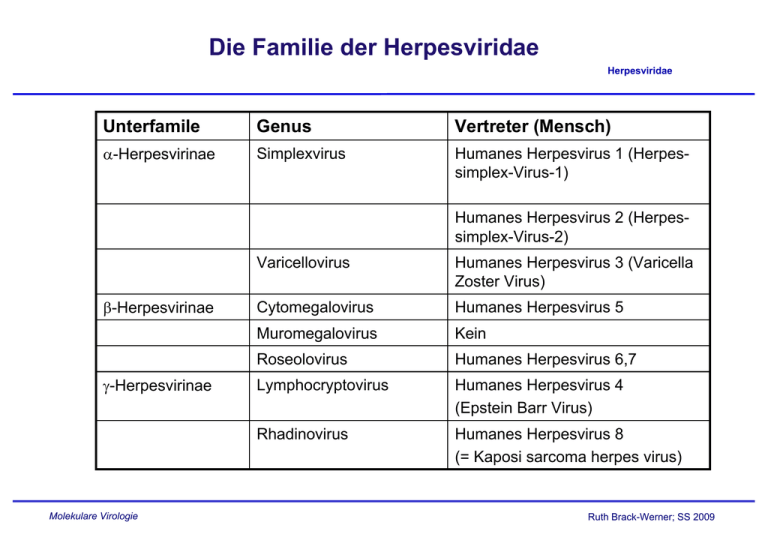
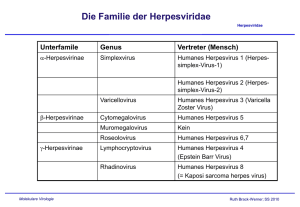
Die Familie der Herpesviridae Herpesviridae Unterfamile Genus Vertreter (Mensch) α-Herpesvirinae Simplexvirus Humanes Herpesvirus 1 (Herpessimplex-Virus-1) Humanes Herpesvirus 2 (Herpessimplex-Virus-2) β-Herpesvirinae γ-Herpesvirinae Molekulare Virologie Varicellovirus Humanes Herpesvirus 3 (Varicella Zoster Virus) Cytomegalovirus Humanes Herpesvirus 5 Muromegalovirus Kein Roseolovirus Humanes Herpesvirus 6,7 Lymphocryptovirus Humanes Herpesvirus 4 (Epstein Barr Virus) Rhadinovirus Humanes Herpesvirus 8 (= Kaposi sarcoma herpes virus) Ruth Brack-Werner; SS 2009 Herpesviridae: Gemeinsame, charakteristische MerkmaleHerpesviridae . • Partikel enthalten Faktoren, die u.a. die virale Transkription aktivieren und die in die zelluläre Genexpression eingreifen; • Zusammenbau der Viruskapside und Virus-Genomsynthese im Zellkern; • Virusvermehrung = Zerstörung der Wirtszelle; • Latenz; • Kodieren mehrere Enzyme/Proteine für die Genomreplikation (z.B. DNA Polymerase, Korrekturenzyme und Enzyme für die Bereitstellung von Nukleotid-Bausteinen ); • Genome linear, dsDNA, bis zu 230 kB lang. Molekulare Virologie Ruth Brack-Werner; SS 2009 Herpesviridae: Merkmale der einzelnen Unterfamilien Herpesviridae Zell-Spektrum Zell-Spektrum Zell-Spektrum http://www.vu-wien.ac.at/i123/SPEZVIR/HERPESGEN1.HTML Molekulare Virologie Ruth Brack-Werner; SS 2009 Struktur von Herpesviren Herpesviridae Lipidhülle; Tegument Grösse: 180-200 nM Durchmesser; Lipidmembran Schematische Darstellung (Beispiel: HCMV); Elektronen Mikroskopische Aufnahme http://www.biografix.de/ http://web.uct.ac.za/depts/mmi/stannard/emimages.html Molekulare Virologie Ruth Brack-Werner; SS 2009 Herpesvirus Genome Herpesviridae http://www-micro.msb.le.ac.uk/3035/3035pics/Herpes1.gif Molekulare Virologie Ruth Brack-Werner; SS 2009 Isomere des Cytomegalovirus Genoms Herpesviridae Molekulare Virologie Aus”Molekulare Virologie”, Modrow, Falk, Truyen, 2.Auflage, 2003, Spektrum Akademischer Verlag, Kap. 19l, Fig.19.24B Ruth Brack-Werner; SS 2009 Herpesvirus Genome liegen als Episom in Herpesviridae infizierter Zelle vor Gene für: DNA Synthese Kapsid Membranproteine LAT Replikationsursprung http://darwin.bio.uci.edu/~faculty/wagner/hsvimg04.jpg Molekulare Virologie Ruth Brack-Werner; SS 2009 Beispiele für Herpesvirus Promotoren Herpesviridae Fast jedes Gen hat seinen eigenen Promotor. Aus Fields Virology 4th edition, 2002, Chapter727, Lippincott, Williams and Wilkins, 2002 Fig. 67-6 Molekulare Virologie Ruth Brack-Werner; SS 2009 Latency VP16 500 - 1000 molecules α-genes β-genes γ-genes Immediate early early late + Molekulare Virologie Ruth Brack-Werner; SS 2009 Virus particle:http://www.stdgen.lanl.gov/stdgen/bacteria/hhv1/herpes.html Beispiel eines viralen Transkriptionsregulators: Herpesviridae HSV VP16 „Immediate early“ (α) virale Proteine: Beispiel Herpesviridae HSV Proteine Modifikation/Grösse (kD) Funktionen ICP4 Phosphoryliert; UDP und ADP-Reste/ 140 Aktivierung der Transkription von β und γ Genen; Repression der Transkription von α-Genen (ICP0, ICP4) ICP0 79 Transkriptionsaktivator; wirkt synergistisch mit ICP4; ICP27 Phosphoryliert/ 63 Post-transkriptioneller Regulator; Trägt zur Ausschaltung der Expression zellulärer Proteine bei indem es Splicing inhibiert* Fördert den Export ungespleißter viraler mRNAs; ICP47 Molekulare Virologie Verhindert Präsentation von viralen Antigenen für CD8 Zellen; Ruth Brack-Werner; SS 2009 „Early“ Proteine/Enzyme für die virale DNA Replikation (I) Funktion Polymerasekomplex HelikasePrimaseKomplex Grösse (kD) /Genort ) HSV CMV EBV HHV-8 Bindet an oriLyt 94/ UL9 70 /UL84 38-40/ BZLF1 ? DNA Polymerase:Polymerase und Exonukleaseaktvität 140/ UL30 150/ UL50 110/ BALF-5 Bindet ds DNA (processivity factor) 62/ UL42 52/ UL44 50 /BMRF1 orf59 Bindung von Einzelstrang DNA an Replikationsgabel 124/ UL29 140/ UL57 138/ BALF2 110/ Orf6 5’,-3’Helikase, DNA-Primasekomplex 99/ UL5 115/ UL105 -/BSLF1 orf56 5’,-3’Helikase, DNA-Primasekomplex 114/ UL52 110/ UL70 /BBLF2/3 0rf40/41 Stimuliert Primersynthese 80/UL8 -/UL102? -/BBL4 Orf44 Orf 9 Replikation des Genoms zur Verpackung in Virione: „Rolling circle“ Mechanismus Herpesviridae Aus”An Introduction to Genetic Analysis” Griffiths, Miller, Suzuki, Lewontin, Gelbart, , 7th Ed, 2000, W.H. Freeman and Co, Fig. 8-19, Molekulare Virologie Ruth Brack-Werner; SS 2009 Beteiligung von Herpesvirus Proteinen bei Herpesviridae der lytischen Genomreplikation Aus”Molekulare Virologie”, Modrow, Falk, Truyen, 2.Auflage, 2003, Spektrum Akademischer Verlag, Kap. 19l, Fig.19.25 Molekulare Virologie Ruth Brack-Werner; SS 2009 „Early“ Proteine/Enzyme für die virale DNA Replikation (II) Aktivität Grösse (kD) /Genort ) HSV CMV EBV HHV-8 Thymidinkinase; Phosphoryliert Thymidine und andere Nukleoside; 41/ UL23 -/- 70/ BXLF-1 Orf 21 Ribonukleotidreduktase* Untereinheit (gross) 140/ UL39 -/ UL45 85/ BORF2 Orf61 Ribonukleotidreduktase* Untereinheit (klein) 38/ UL40 ? 34/ BaRF1 Orf60 Uracilglycosylase: Katalysiert die Freisetzung von Uracil aus DNA: DNA Reparatur? 39/ UL2 -/ UL114 78-88 /BKRF3 orf46 Alkalische Endo-/Exonuklease: Auflösung von Verzweigten Strukturen in der DNA. 68/UL12 -/UL98 70/BGLF5 Orf37 dUTPase: dUTP -> dUMP zur Verhinderung des Einbaus von dUTP in die DNA; 39/ UL50 -/ UL72 -/BLLF3 orf55 *Katalysiert die Umwandlung von Ribonukleotiden zu Desoxyribonukleotiden; Essentiell für die Replikation in nicht-teilenden Zellen. Exemplarische „Späte“ Proteine Herpesviridae Aktivität Grösse (kD)/Bezeichnung /Genort ) HSV CMV EBV Tegument Protein; aktiviert die Transkription der “immediate early” Gene 54/α-TIF, ICP25, VP16, UL48 71/-/UL82 -/-/BPLF1? Hauptkapsidprotein 155/VP5/ UL19 153/-/UL86 154//BCLF1 HHV-8 153//orf25 Diverse Membranproteine (Glykosyliert) Molekulare Virologie Ruth Brack-Werner; SS 2009 VP16 funktioniert als Komplex mit zellularen Faktoren Herpesviridae Acidic activation domain HCF-1: human factor C1 Oct-1: Octamer 1 transcription factor Wysocka J and Herr W. 2003.TIBS 28, 294-304. Molekulare Virologie POU domains Ruth Brack-Werner; SS 2009 Replikationszyklus: Eintritt in die Zelle (HSV) Herpesviridae ry t n E = 3-O-S: 3-O-Sulfotransferase; spezifische durch 3-O-S modifizierte HS können als Fusionsrezeptoren dienen. HS: Heparan sulphate HVEM: Herpes virus entry mediator: Mitglied der TNF-α Rezeptor Familie Nectin 1, 2: Mitglieder der Immunoglobulin superfamilie Spear PG et al. 2004, Molekulare Virologie Ruth Brack-Werner; SS 2009 Heparin Sulphat Herpesviridae GAG: glycosaminoglycan Disaccharid bestehend aus D-glucosamin und NAcetyl-D-Glucosamin http://www.med.unibs.it/~airc/hspgs.html Negative Ladungen Aus: Molecular Biology of the Cell. 4th ed. Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter. New York: Garland Publishing; 2002.Fig. 19-39 Molekulare Virologie Ruth Brack-Werner; SS 2009 Bindung von Herpesviren an Zelloberfläche führt zur Transduktion von Signale (Bsp. HCMV) Herpesviridae Molekulare Virologie Compton T. 2004. TCB. 14, 5-9. Ruth Brack-Werner; SS 2009 Replikationszyklus: HSV I “Immediate Early” Ereignisse 1-9: Anheftung des Virus an Zelloberfläche; Fusion der viralen und zellulären Membrane; Eintritt des Kapsids und Ausschüttung der Tegumentproteine in die Zelle; Transport des NC zur Kernpore und Freisetzung der HSV DNA in den Kern; Expression der α-Gene und Synthese der Proteine; “Early” Ereignisse 1011: α-Proteine aktivieren die Synthese der βProteine; Principles of Virology, 2004. Flint SJ, Enquist LW, Racaniello VR,Skalka AM, 2nd edition. ASM Press. Appendix, Fig. 6. “Späte” Ereignisse 1224-: DNA Replikation: Bildung von Konkatameren, die zur Transkription der γ Gene verwendet werden; Synthese von Hüllproteinen am ER; Transport von viralen Glykoproteinen in den Golgi; Zusammenbau von Nukleo-Kapsiden (NC) im Kern; Ausknospung von NC in das ER und dann ins Zytoplasma; Fusion der zytoplasm. NC mit Golgi-Membran; Erneute Behüllung des Virus; Ausknospung des behüllten Virus in Vesikel und Freisetzung der Vesikel durch Exozytose Verbreitung von HSV im Wirt Molekulare Virologie Principles of Virology, 2004. Flint SJ, Enquist LW, Racaniello VR,Skalka AM, 2nd edition. ASM Press. Appendix, p.853. Herpesviridae Ruth Brack-Werner; SS 2009 HSV-Seroprevalenz Herpesviridae Anteil der Bevölkerung > Molekulare Virologie Alter 40% 12-19 80% über 60 Ruth Brack-Werner; SS 2009 Weitere HSV-1 und HSV-2 assoziierte Krankheiten Herpesviridae http://pathmicro.med.sc.edu/virol/herpes.htm Molekulare Virologie Principles of Virology, 2004. Flint SJ, Enquist LW, Racaniello VR,Skalka AM, 2nd edition. ASM Press. Appendix, p.853. Ruth Brack-Werner; SS 2009 HSV Latenz und Aktivierung Herpesviridae http://pathmicro.med.sc.edu/virol/herpes.htm Molekulare Virologie Ruth Brack-Werner; SS 2009 Reaktivierung von HSV Herpesviridae • Verletzungen; • Schwere Erkrankungen mit Intubationen; • Chirurgische Eingriffe in dem Trigeminus Nerv; • Immunsuppression, z.B. nach Organtransplantationen; Molekulare Virologie Ruth Brack-Werner; SS 2009 Latente Infektion (HSV) Herpesviridae Schritte 1-6: Wie bei produktiver Infektion; Zirkularisierung des viralen Genoms; Snythese der LAT (Latency Associated Transcripts Neuron in Ganglion Molekulare Virologie Principles of Virology, 2004. Flint SJ, Enquist LW, Racaniello VR,Skalka AM, 2nd edition. ASM Press. Appendix, Fig. 6. Ruth Brack-Werner; SS 2009 HSV Latenz LAT RNA • Herpesviridae Die LAT RNAs sind die einzigen RNAs deren Expression während der Latenz nicht unterdrückt wird. • Lat Promotoren (2) sind Neuronen-spezifisch; • LAT-RNAs sind komplementär zu mRNAs die für ICP0 kodieren (Inhibition durch Antisense-Effekt?) • • Werden gespleißt zu stabilen, ringförmigen RNAs; Vermutlich nicht kodierend; Molekulare Virologie Ruth Brack-Werner; SS 2009 LAT Transkripte sind komplementär zu ICPO Transkripte Molekulare Virologie Jones C., 2003. Clin.Microb. Reviews 16, 79-95. Herpesviridae Ruth Brack-Werner; SS 2009 Verbreitung von Varicella zoster Virus im Wirt Herpesviridae T-cells Molekulare Virologie Principles of Virology, 2004. Flint SJ, Enquist LW, Racaniello VR,Skalka AM, 2nd edition. ASM Press. Appendix, p.856. Ruth Brack-Werner; SS 2009 Varizella Zoster assoziierte Krankheiten Herpesviridae http://www.lib.uiowa.edu/hardin/md/dermatlas/chickenpox.html Primäre Krankheit (Kind): Windpocken Molekulare Virologie http://pathmicro.med.sc.edu/virol/herpes.htm Reaktivierung der Infektion (Erwachsener): Gürtelrose Ruth Brack-Werner; SS 2009 Vakzine gegen Varizella Herpesviridae • Zwei Vakzine verfügbar: • Varivax® (Zostoavax®) • Varilrix® • “Lebender” attenuierter Virusstamm (“Oka”) • Kann zu Hautauschlag mit Virämie führen (Verbreitung des Virus durch die geimpfte Person!) • Schutz beruht in erster Linie auf zelluläre Immunantwort (Antigene: Peptide aus Glycoprotein E und Tegumentprotein IE62) Molekulare Virologie Ruth Brack-Werner; SS 2009 Cytomegalovirus: Verbreitung Molekulare Virologie Principles of Virology, 2004. Flint SJ, Enquist LW, Racaniello VR,Skalka AM, 2nd edition. ASM Press. Appendix, p.854. Herpesviridae Ruth Brack-Werner; SS 2009 Zytomegalovirus-assoziierte Krankheiten Herpesviridae • Infektion ist meistens inapparent; • Ernsthafte Erkrankungen • Bei Neugeborenen, die im Zuge der primären Infektion der Mutter infiziert wurden (Kongenitale Krankheit): Geistige Behinderung, Taubheit. • Bei Immunsupprimierten Personen (AIDS, Organtransplantation): CMV Retinitis (u.a.); Molekulare Virologie Ruth Brack-Werner; SS 2009 Epstein-Barr Virus: Krankheiten und Verbreitung Herpesviridae Molekulare Virologie Principles of Virology, 2004. Flint SJ, Enquist LW, Racaniello VR,Skalka AM, 2nd edition. ASM Press. Appendix, p.854. Ruth Brack-Werner; SS 2009 Epstein-Barr Virus-assoziierte Krankheiten Herpesviridae • Verschiedene B-Zell Lymphome; • Burkitt’s Lymphom: Tumor im Gesicht-Kiefer Bereich; (Aktivierung der cmyc Expression auf Grund von einer Translokation zwischen den Chromosomen 8 und 14); Endemisch in Äquatorial Afrika; • Nasopharynx Karzinom: Endemisch in Afrika; • Infektiöse Mononukleose: Kommt vor bei Jugendlichen bei primärer Infektion; Molekulare Virologie Ruth Brack-Werner; SS 2009 Tumorerkrankungen assoziiert mit Infektionen Herpesviridae von γ-Herpesvirinae Molekulare Virologie Ruth Brack-Werner; SS 2009 Epstein-Barr Virus Latenz-Gene/Proteine Herpesviridae Damania, B. Oncogen ic gamma-herpesviruses: comparison of viral proteins involved in tumorigenesis.Nat Rev Microbiol. 2004 Aug ;2(8):656- Molekulare Virologie Principles of Virology, 2004. Flint SJ, Enquist LW, Racaniello VR,Skalka AM, 2nd edition. ASM Press. Fig. 16.. Ruth Brack-Werner; SS 2009 Latenz-Gene/Proteine von γ-Herpesvirinae Herpesviridae Damania, B. Oncogen ic gamma-herpesviruses: comparison of viral proteins involved in tumorigenesis.Nat Rev Microbiol. 2004 Aug ;2(8):656Molekulare Virologie Ruth Brack-Werner; SS 2009 EBV Latenz-Muster und ihre Assoziation mit verschiedenen Tumorerkrankungen Herpesviridae Damania, B. Oncogen ic gamma-herpesviruses: comparison of viral proteins involved in tumorigenesis.Nat Rev Microbiol. 2004 Aug ;2(8):656- Molekulare Virologie Ruth Brack-Werner; SS 2009 Replikationsgabel in Säugetierzellen © 2002 by Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walter