Chemie – Grundwissen der 9 - Melanchthon Gymnasium Nürnberg
Werbung

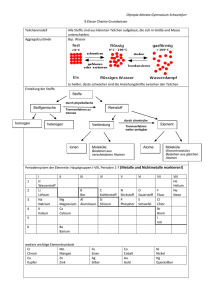
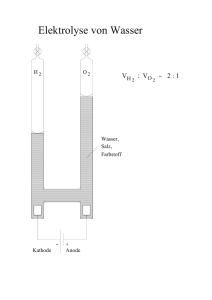
Lernhilfen zur Chemie der 9. Jahrgangsstufe Die Inhalte des Chemieunterrichts der 9. Jahrgangsstufe am humanistischen Gymnasium sind im Folgenden stichpunktartig zusammengestellt. Das Beherrschen und Anwenden dieses Grundwissens ist die notwendige Voraussetzung für eine sinnvolle Erweiterung und Vertiefung des Faches Chemie in der 10. Jahrgangsstufe. 1. Stoffe und Reaktionen 1.1 Reinstoffe (Bsp. Wasser) besitzen bei gleichen Bedingungen (Temperatur, Druck) bestimmte qualitative und quantitative Eigenschaften: z.B. Farbe, Dichte, Geruch, Aggregatzustand, Schmelz- und Siedetemperatur. Messbare Stoffeigenschaften (Dichte, Schmelz- und Siedetemperatur) werden als Kenneigenschaften bezeichnet. 1.2 Eine Verbindung ist ein Reinstoff, der sich in Elemente zerlegen lässt. Ein Element ist ein Reinstoff, der sich mit chemischen Verfahren nicht weiter in andere Stoffe zerlegen lässt. Ein Element besteht aus gleichartigen Atomen. Ein Molekül ist ein Atomverband, der bei Elementen aus gleichartigen Atomen, bei Verbindungen aus verschiedenartigen Atomen besteht. 1.3 Unter einer Analyse versteht man die Zerlegung einer Verbindung in einfachere Bestandteile, häufig in Elemente. Bsp.: Wasser Sauerstoff + Wasserstoff Die Synthese ist die Vereinigung von Elementen zu einer Verbindung. Bsp.: Magnesium + Sauerstoff Magnesiumoxid Die Umsetzung ist die Kopplung von Analyse und Synthese. Bei einer Umsetzung entstehen aus zwei oder mehr Edukten (= Ausgangsstoffe) zwei oder mehr Produkte (= Endstoffe). Bsp.: Wasser + Magnesium Wasserstoff + Magnesiumoxid 1.4 Energiebeteiligung Eine Reaktion, bei der Wärme abgegeben wird, ist eine exotherme Reaktion. Eine Reaktion, bei der Wärme aus der Umgebung entzogen wird, ist eine endotherme Reaktion. Die Aktivierungsenergie ist die Energie, die zum Starten einer chemischen Reaktion benötigt wird. Ein Katalysator ist ein Stoff, der Reaktionen beschleunigt, indem er die Aktivierungsenergie erniedrigt, dabei selbst aber nicht verbraucht wird. 1.5 Chemische Formeln und Formelgleichungen Die Molekülformel (Bsp.: H2O) gibt die beteiligten Atomsorten in ihrer tatsächlichen Anzahl wieder. Die Verhältnisformel (Bsp.: AlCl3) gibt nur das Zahlenverhältnis der Ionen in der Verbindung wieder. Die stöchiometrische Wertigkeit eines Elements ist die Anzahl der Wasserstoffatome, die von einem Atom dieses Elements gebunden werden kann. Die Wertigkeit lässt sich aus dem Periodensystem der Elemente (PSE) ablesen: Hauptgruppennummer I II III IV V VI VII Wertigkeit 1 2 3 4 3 2 1 Sind mehrere gleichartige Ionen, Atome oder Atomgruppen miteinander verbunden, so drückt man dies durch eine tiefgestellte Zahl aus, den Index. Der Index (Plural: Indices) steht hinter dem Elementsymbol oder hinter der in Klammern stehenden Atomgruppe, auf die er sich bezieht. Die Zahl vor einer Formel, der Koeffizient, bezieht sich auf das gesamte folgende Teilchen mit allen enthaltenen Ionen oder Atomen. 1.6 Erstellung einer Formel: - Elementsymbole nebeneinander schreiben - Feststellen der Wertigkeiten (aus dem Namen oder aus Hauptgruppe des PSE) - Ermitteln des kleinsten gemeinsamen Vielfachen (kgV) der jeweiligen Wertigkeiten - kgV dividiert durch die jeweilige Wertigkeit ergibt den Index des Elemtsymbols 1.7 Reaktionsgleichungen Eine Reaktionsgleichung gibt an, welche Teilchen in welchem kleinstmöglichen Teilchenanzahlverhältnis miteinander reagieren bzw. entstehen. 1.8 Erstellung einer chemischen Formelgleichung - Elementsymbole der Edukte (= Ausgangsstoffe) stehen links vom Reaktionspfeil. - Elementsymbole der Produkte (= Endstoffe) stehen rechts vom Reaktionspfeil. - Bei Stoffen die im elementaren Zustand vorkommen prüfen, ob sie zweiatomig sind (H2, O2, N2, Cl2, Br2, I2, F2). - Bei Verbindungen ist die Formel über den Namen oder die Wertigkeit zu ermitteln. - Ausgleichen, d.h. mathematisches Richtigstellen durch Einsetzen von Koeffizienten. - Indices von Verbindungen dürfen nicht verändert werden. - Probe: Die Anzahl der Atome eines Elements (Produkt aus Koeffizient und Index) muss auf beiden Seiten einer Gleichung identisch sein. 2. Atombau und gekürztes Periodensystem der Elemente (PSE) 2.1 Das Atom ist das kleinste Teilchen eines Elements. Negativ geladene Elektronen (e-) bilden die Atomhülle, die positiv geladenen Protonen (p+) und die neutralen Neutronen (n) bilden den Atomkern. Die Protonenzahl definiert die Atomart. Die Nukleonenzahl ist die Anzahl der Kernbausteine. Sie gibt die Masse der Atomsorte in der Einheit u an und wird daher auch als Massenzahl bezeichnet. Isotope sind unterschiedliche Atomsorten eines Elements, die sich in ihrer Neutronenanzahl und damit in ihrer Masse unterscheiden. Beispiel: Kohlenstoff Massenzahl od. Nukleonenzahl Kernladungszahl Protonenzahl Elektronenzahl Ordnungszahl 12 6 C 2.2 Energiestufenmodell der Atomhülle Die Ionisierungsenergie (IE) ist die Energie, die aufgebracht werden muss, um ein Elektron aus einem isolierten Atom abzutrennen. Dabei entsteht ein positiv geladenes Ion, ein Kation. Die Ionisierungsenergiebeträge für verschiedene Elektronen eines Atoms unterschieden sich. Daraus lassen sich das Energiestufenmodell (mit Hauptquantenzahlen n = 1, 2, 3, ...7 gekennzeichnet) und das Schalenmodell (mit K-, L-, M-, ...Q-Schalen gekennzeichnet) ableiten. Die maximale Elektronenanzahl pro Energiestufe errechnet sich aus der Hauptquantenzahl [ 2n2 ]. 2.3 Periodensystem der Elemente (PSE) Im Periodensystem sind die Atomarten nach steigender Protonenzahl angeordnet. Atome mit der gleichen Anzahl von Außenelektronen (sog. Valenzelektronen) stehen in Gruppen untereinander. Atomarten einer Gruppe zeigen ein ähnliches chemisches Verhalten. - Die Gruppennummer (I – VIII) gibt die Anzahl der Valenzelektronen der Atome an. - Die Periodennummer (1-7) gibt die Anzahl der Energiestufen (bzw. Schalen) an, auf denen die Elektronen des betreffenden Atoms verteilt sind. Valenzelektronen befinden sich auf der höchsten Energiestufe (bzw. äußersten Schale). - In einer Periode nimmt der Atomradius von links nach rechts ab. - In einer Gruppe nimmt der Atomradius von oben nach unten zu. - Metalle stehen im Periodensystem links einer gedachten Diagonalen von Bor zu Astat. - Nichtmetalle stehen im PSE rechts der Diagonalen von Bor zu Astat. 2.4 Edelgasregel In chemischen Reaktionen erreichen Atome durch Abgabe oder Aufnahme von Elektronen die gleiche Anzahl von Valenzelektronen wie die Edelgasatome der nächstgeringeren oder gleichen Periode. Dabei entstehen stabile Ionen mit sogenannter Edelgaskonfiguration. 3. Chemische Bindung 3.1 Salze – Ionenbindung Metallatome besitzen relativ wenige Valenzelektronen. Sie geben bei chemischen Reaktionen bis zur Erreichung der Edelgaskonfiguration Elektronen ab und werden zu positiv geladenen Kationen. Metallatome sind Elektronendonatoren. Bsp.: Na Na+ + e Nichtmetallatome verfügen über relativ viele Valenzelektronen. Bei chemischen Reaktionen nehmen sie bis zur Erreichung der Edelgaskonfiguration Valenzelektronen auf und werden zu negativ geladenen Anionen. Sie wirken als Elektronenakzeptoren. Bsp.: Cl2 + 2 e - 2 Cl Die Ionenbindung ist die chemische Bindung, die in Salzen als Anziehungskraft zwischen Kationen und Anionen wirkt. Dabei entsteht ein Ionengitter. Beispiel einer Salzbildungsreaktion aus Metall und Nichtmetall 2 Na+ + 2 e - (Elektronenabgabe) 1. Teilgleichung 2 Na 2. Teilgleichung Cl2 + 2 e - 2 Cl -_____ + Ionengleichung 2 Na + Cl2 2 Na + 2 Cl Stoffgleichung 2 Na + Cl2 2 NaCl (Elektronenaufnahme) - Salze sind also Stoffe, die z.B. aus positiv geladenen Metallkationen und negativ geladenen Nichtmetallanionen bestehen. Bsp.: NaCl Na+ + Cl + + + Cl - Na Cl - Na Cl - Na Cl + + + Na Cl - Na Cl - Na Cl - Na+ + + + + ClNa+ Na Cl - Cl Na+Na Cl - Cl Na+Na Cl - Cl Na Cl Cl - Na+ Na+ Cl - Na+ Cl + + +Na+ Na Cl - Cl Na+Na Cl - Cl Na+Na+Cl - Cl Na Cl Cl - Na+ Cl - Na+ Cl - Na+ Na+ Cl - Na+ Cl - Na+ Cl - Na+ Cl - Schematischer Ausschnitt eines Natriumchloridkristalls (Kochsalz). 3.2 Molekular gebaute Stoffe – Elektronenpaarbindung Die Elektronenpaarbindung ist die chemische Bindung, die zwischen Nichtmetallatomen auftritt. Die an der Bindung beteiligten Atome verfügen gemeinsam über Valenzelektronenpaare und erreichen auf diese Weise die Edelgaskonfiguration. Dabei entstehen Moleküle. .... .. O.. H H Wassermolekül ..O .. .. .. C . .. .. O... Kohlenstoffdioxidmolekül Je nach Anzahl der gemeinsam beanspruchten Elektronenpaare kommen Einfach-, Doppelund Dreifachbindungen vor. Beispiele: H H ; O O ; IN NI Regeln zur Erstellung von Valenzstrichformeln: - Addiert man die Anzahl der Valenzelektronen der beteiligten Atome, erhält man die im Molekül insgesamt vorhandenen Valenzelektronen. - Man ermittelt die Gesamtzahl der Valenzelektronen, welche die isoliert betrachteten Atome in ihrer Edelgaskonfiguration hätten. - Man ermittelt die Zahl der bindenden Elektronen als Differenz zwischen dieser Gesamtzahl und der Zahl der vorhandenen Elektronen. - Man berechnet die Zahl der freien Elektronen als Differenz zwischen der Zahl der vorhandenen Valenzelektronen und der Zahl der bindenden Elektronen. - Aufstellen der Valenzstrichformel unter Beachtung der Edelgasregel; Wasserstoffatome sind stets einwertig und daher endständig; symmetrische Atomanordnung ist bevorzugt. 3.3 Metalle – Metallbindung Metallbindung ist die chemische Bindung, die in elementaren Metallen oder Legierungen vorkommt. Sie resultiert aus der Anziehungskraft zwischen den positiv geladenen Metallatomrümpfen und dem aus den Valenzelektronen gebildeten Elektronengas. + + + + + + + + + + + + + + + + + + + + + + + + + + Die Metallatome stellen ihre Valenzelektronen dem gemeinsamen Gitter zur Verfügung. Die positiv geladenen Atomrümpfe + besetzten die Gitterplätze einer dichtesten Kugelpackung. Die Valenzelektronen sind beweglich und delokalisiert. Sie bilden das „Elektronengas“. 4. Quantitative Aspekte chemischer Reaktionen Atom- und Molekülmasse Die Masse eines Teilchens (Atom, Molekül, Ion) wird in der atomaren Masseneinheit u angegeben. 1u ist definiert als der 12. Teil der Masse eines Atoms des Kohlenstoffisotops 12C. Für die Angabe der Quantität einer Stoffportion stehen folgende Größen zur Verfügung: Größe Stoffmenge n Molare Masse M Masse m Avogadro-Konstante NA Einheit mol g / mol g mol -1 Größe (Stoffmengen-)Konzentration c Molares Volumen Vm Volumen V Teilchenanzahl N Einheit mol / l l / mol l - Zusammenhänge zwischen diesen Größen: Die Stoffmenge n ist direkt proportional zu der Teilchenanzahl N. Die Avogadro-Konstante NA ist der Quotient aus der Teilchenanzahl einer Stoffportion und der Stoffmenge dieser Stoffportion: N A (X ) = N(X ) n( X ) ; [NA] = 1 mol Die Avogadro-Konstante hat für alle Stoffe den gleichen Wert: N A = 6,02 ⋅ 10 23 1 mol Die molare Masse M ist der Quotient aus der Masse einer Stoffportion und der Stoffmenge dieser Stoffportion: M (X ) = m( X ) ; n( X ) [M ] = 1 g mol Die molare Masse ist abhängig von der Stoffart. Der Zahlenwert der Atom- oder Molekülmasse ist gleich dem Zahlenwert der molaren Masse. Das molare Volumen Vm ist der Quotient aus dem Volumen einer Stoffportion und der Stoffmenge dieser Stoffportion: Vm ( X ) = V (X ) l ; [Vm ] = 1 n( X ) mol Das molare Volumen ist von der Stoffart und wie das Volumen von Druck (p) und Temperatur (T) abhängig. Das molare Normvolumen Vmn ist der Quotient aus dem Normvolumen Vn einer Stoffportion und der Stoffmenge dieser Stoffportion: V mn ( X ) = Vn ( X ) ; n( X ) Für gasförmige Stoffportionen ist das molare Normvolumen (bei T = 0 °C und p = 105 Pa) l Vmn = 22,4 unabhängig von der Stoffart und beträgt: mol