Indikation und Technik des interventionellen Verschlusses beim
Werbung

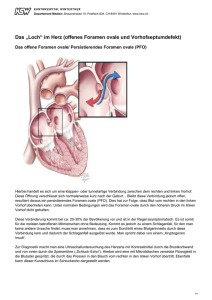
2000 39. BAYERISCHER INTERNISTEN-KONGRESS © 2001 W. Zuckschwerdt Verlag München 1 Indikation und Technik des interventionellen Verschlusses beim Vorhofseptumdefekt und offenen Foramen ovale Dietmar Elsner Klinik und Poliklinik für Innere Medizin II, Universität Regensburg Eine persistierende Verbindung zwischen linkem und rechten Herzvorhof wurde bereits 1513 von Leonardo da Vinci beschrieben, der in einer seiner anatomischen Zeichnungen einen solchen Verbindungskanal dokumentierte. Anatomisch unterscheiden wir die Vorhofseptumdefekte (ASD), die je nach Größe zu einem signifikanten LinksRechts-Shunt führen, von den offenen Foramina ovalia (PFO). Diese haben bei normalen Druckverhältnissen im Kreislauf keine hämodynamische Wirksamkeit, können jedoch als Durchtrittspforte für paradoxe Embolien eine erhebliche klinische Bedeutung erlangen. Vorhofseptumdefekte (ASD) Vorhofseptumdefekte sind neben der bikuspiden Aortenklappe der häufigste im Erwachsenenalter diagnostizierte angeborene Herzfehler (3,8/10000 Geburten). Die häufigste Form ist der Ostium secundum-Defekt im Bereich der Fossa ovalis, seltener sind der Sinus venosusDefekt im Bereich der Einmündung der Vena cava superior sowie der Ostium primum-Defekt als unvollständiger Endokardkissendefekt. Abhängig von der Größe des Defektes kommt es zu einem mehr oder minder großen Links-RechtsShunt mit daraus resultierender Volumenbelastung des rechten Herzens. Die Folgen bei großen Defekten sind pulmonale Hypertonie, Herzinsuffizienz, Vorhofflimmern sowie pulmonale Infekte. Die Lebenserwartung bei großen ASD betrug früher unbehandelt etwa 36 Jahre (75% der Patienten erreichten das 30. Lebensjahr,nur 10% des 60.Lebensjahr). Daher herrscht seit langem Übereinstimmung darüber, dass bei Kindern und Jugendlichen mit großem ASD ein chirurgischer Verschluss erfolgen sollte. Umstritten war lange die Frage, ob auch Patienten von einem Verschluss profitie- ren, bei denen der ASD erst im Erwachsenenalter diagnostiziert wird. Es konnte jedoch in der Zwischenzeit gezeigt werden, dass auch Patienten, die bei Erstdiagnose bereits über 40 Jahre alt waren, nach chirurgischem Verschluss einen deutlichen Überlebensvorteil hatten gegenüber einer rein medikamentös therapierten Vergleichsgruppe (9). In dieser Studie hatten alle Patienten einen ASD mit signifikantem Rechts-Links-Shunt (> 33%) und waren leicht- bis mittelgradig symptomatisch. Darüberhinaus führt ein Verschluss eines signifikanten ASD im Erwachsenenalter auch bei milder Symptomatik und normalen Druckwerten im Lungenkreislauf zu einer deutlichen Steigerung der Belastbarkeit (Belastungstoleranz, maximale Sauerstoffaufnahme) innerhalb von 10 Jahren nach Operation (8). Als Indikationen zum ASD-Verschluss gelten daher bei Patienten unter 25 Jahren der Nachweis eines signifikanten Links-Rechts-Shuntes (> 33% in Bezug Abbildung 1. Der Amplatzer ASD-Occluder. auf den Lungendurchfluss), unabhängig von Symptomen. Bei Patienten über 25 Jahren wird als Indikation angesehen der Nachweis eines signifikanten LinksRechts-Shuntes verbunden mit Symptomen, Zeichen der Rechtsherzbelastung oder einer Druckerhöhung im Lungenkreislauf. Unabhängig von Alter und Größe des ASD besteht die Indikation zum Verschluss bei stattgehabter paradoxer Embolie. Interventioneller ASD-Verschluss Der operative ASD-Verschluss ist zwar seit langem herzchirurgischer Standard mit geringer perioperativer Mortalität und Morbidität, jedoch wurde seit über 20 Jahren nach nichtoperativen interventionellen Verfahren geforscht,um Patienten die Operation am offenen Herzen zu ersparen.Eine ganze Reihe von interventionellen Verschluss-Systemen wurden entwickelt: Das Double-disk-System von King 1976, Clamshall-device 1989, Sideris buttoned occluding device 1994, ASDOS 1996,Angel wings 1996 und Cardioseal 1997. Die meisten der früheren Systeme hatten erhebliche Nachteile, da sie technisch sehr schwierig zu handhaben waren und mit einer hohen Komplikationsrate behaftet waren, sowohl im Rahmen der Implantation als auch im Langzeitverlauf. Daher konnten sich diese Techniken weitgehend nicht durchsetzen. Einen wesentlichen Fortschritt brachte die Einführung eines relativ einfach zu handhabenden, selbst zentrierenden Doppelschirms, des Amplatzer Septal Occluders (12) (Abbildung). Dieser besteht aus einem flexiblen, superelastischen Nitinol-Maschenwerk, welches mit Dacrongewebe ausgekleidet ist. Ein rechtsatrialer und ein etwas größerer linksatrialer Schirmanteil sind durch einen zylindrischen Steg, dem zentralen Stent, mit unterschiedlich wählbaren 2 Durchmessern (entsprechend der Größe des ASD) verbunden. Es sind inzwischen Stent-Größen bis 38 mm verfügbar, so dass auch große ASD verschlossen werden können. Aufgrund des Stents zentriert sich der Doppelschirm selbst im Defekt. Die Defektgröße und damit die Stent-Größe wird vor Implantation invasiv mit Hilfe eines Ballon-Okklusionskatheters bestimmt. Über die Vena femoralis wird ein 7–10 French Führungskatheter über den Defekt bis in den linken Vorhof vorgebracht.Aufgrund seiner superelastischen Eigenschaften kann der Doppelschirm durch diesen Führungskatheter vorgeführt werden. Unter Kontrolle mittels transösophagealer Echokardiographie wird der linksatriale Schirmanteil im linken Vorhof freigegeben, ans Vorhofseptum zurückgezogen, danach wird der rechtsatriale Schirmanteil freigegeben. Aufgrund seiner Elastizität nimmt der Schirm seine ursprüngliche Gestalt wieder an und verschließt den Defekt zwischen seinen beiden Anteilen. Der korrekte Sitz wird transösophageal echokardiographisch verifiziert, ebenso kann festgestellt werden, ob noch ein Rest-Shunt besteht. Erst danach wird der Schirm durch Losschrauben des Implantationsdrahtes freigegeben. Ein erheblicher Vorteil dieses Systems ist, dass der Schirm, solange er noch mit dem Implantationsdraht verbunden ist, jederzeit repositioniert werden kann oder ggf. bei suboptimalem Sitz komplett in den Führungskatheter retrahiert werden kann. Gewisse anatomische Voraussetzungen müssen gegeben sein und in der Vordiagnostik mittels transösophagealer Echokardiographie abgeklärt werden, damit ein Interventioneller Verschluss möglich ist:ASD vom Secundum-Typ, Defektgröße kleiner als 38 mm (wobei wir bei sehr großen Defekten eher zum chirurgischen Verschluss raten), ausreichender Septumrand zur Verankerung des Schirms, ausreichender Abstand (5 mm) zu Lungenvenen, Koronarsinus und AV-Klappen, keine Mehrfachdefekte und keine Lungenvenenfehlmündung. Insgesamt kommt von der Morphologie her etwa zwei Drittel der erwachsenen ASD-Patienten für einen interventionellen Verschluss in Frage. Der interventionelle Verschluss wird beim wachen, sedierten Patienten durchgeführt. Periinterventionell erfolgt die Heparinisierung und antibiotische Abdeckung. Nach erfolgreichem Verschluss wird eine Antikoagulation (Marcumar) oder Thrombozytenaggregationshemmung (Acetylsalicylsäure) für 6 Monate angeschlossen, eine Endokarditisprophylaxe sollte im ersten Jahr nach Verschluss durchgeführt werden. Trotz der Eleganz und Sicherheit des Verfahrens müssen während der Prozedur potentielle Probleme erkannt werden, um Komplikationen zu vermeiden. Eine Fehlpositionierung des gesamten Systems im linken Vorhof, eine falsche Größenwahl, eine erfolglose Platzierung bei zu großem Defekt, Mehrfachdefekten oder zu schwachem Septumrand sowie eine Beeinträchtigung anderer Strukturen wie Lungenvenen, Koronarsinus und AV-Klappen ist möglich. Dies sollte jedoch kein Problem darstellen, wenn die Implantation unter transösophagealer echokardiographischer Kontrolle durchgeführt wird, da dann das System problemlos repositioniert oder retrahiert werden kann. Gravierender ist der Verlust oder die Embolisierung des Schirmes mit der Notwendigkeit der chirurgischen Bergung oder das Auftreten von Luftembolien. Weiterhin können atriale Rhythmusstörungen und Gefäßkomplikationen in der Leiste auftreten. In der Literatur werden signifikante periprozedurale Komplikationen mit einer Häufigkeit von insgesamt etwa 2% beschrieben (4). Schwere Komplikationen wie Todesfälle oder Schlaganfälle sind bislang nicht beschrieben. Auch langfristig sind potentielle Probleme zu bedenken: Eine Thrombusbildung, insbesondere am linken Schirmanteil, weswegen eine mehrmonatige Antikoagulation oder Thrombozytenaggregationshemmung empfohlen wird, das Verbleiben eines Rest-Shunts, das Auftreten einer Endokarditis, Vorhofrhythmusstörungen, eine mechanische Ermüdung (Drahtbruch) oder Korrosion sowie eine chronische Nickeltoxizität.In Tierexperimenten ist allerdings die Materialverträglichkeit nachgewiesen, bereits 8 Wochen nach Implantation ist der Occluder von einer vollständigen Neoendothelschicht überzogen. Das Dacron-Maschengewebe im Drahtgeflecht führt zu einer gewünschten Thrombosierung innerhalb des Systems und damit zur kompletten Abdichtung. So ist es nicht selten, dass geringe Rest-Shunts, welche unmittelbar nach Implantation nachweisbar sind, im weiteren Verlauf verschwinden. Gravierende Komplikationen im bisher überschaubaren Beobachtungszeitraum wurden bislang nicht berichtet. Über Langzeitfolgen Jahre bzw.Jahrzehnte nach Implantation liegen naturgemäß noch keine Erfahrungen vor. Kürzlich wurde die erste vergleichende Studie zum interventionellen vs. chirurgischen ASD-Verschluß veröffentlicht (1). Hierbei handelte es allerdings um keine randomisierte Studie, sondern die Gruppe der operierten Patienten rekrutierte sich aus denjenigen Patienten, die aufgrund größerer Defekte nicht für die Intervention geeignet waren. Die primäre Erfolgsrate beider Verfahren war identisch (kein Rest-Shunt in 98%).Die Komplikationsrate in der operierten Gruppe war allerdings signifikant höher (18% vs. 7%). Hierbei handelte es sich in der OPGruppe um 11% atriale Arrhythmien, 3% Perikarderguss, 2% Wundinfekt und 2% perforiertes Magenulkus, in der Interventionsgruppe 5% atriale Rhythmusstörungen und 2% Schirmembolisation mit chirurgischer Bergung. Tödliche Komplikationen oder Schlaganfälle traten in keiner Gruppe auf. An der Universität Regensburg führten wir von Frühjahr 1999 bis Herbst 2000 33 Interventionen durch (20 PFO- und 13 ASD-Verschlüsse). Bei 3 Patienten war ein Interventioneller Verschluss aufgrund eines insuffizienten Septumrandes nicht möglich. Die primäre Verschlußrate (kein Rest-Shunt) war 93%, nach 3 Monaten 100%. An Komplikationen sahen wir eine passagere Hämaturie unter Marcumar, einen infizierten venösen Zugang (mehrtägige Antibiose), sowie bei einem Patienten das Abkippen des Schirmes 3 Tage nach Implantation bei instabilem Septum primum (Vorhofseptumaneurysma), sodass der Patient elektiv chirurgisch revidiert und verschlossen wurde. Offenes Foramen ovale (PFO) Das offene Foramen ovale ist eine schlitzförmige Öffnung zwischen dem atrialen Septum primum und Septum secundum im Bereich der Fossa ovalis. In utero dient es als physiologische Verbindung für den Rechts-Links-Shunt des Embryonalkreis- 3 laufs. Wenn nach der Geburt die Lunge perfundiert wird und der linksatriale Druck steigt, kommt es zum funktionellen Verschluss dieser Öffnung. Der funktionelle Verschluss wird in der Regel gefolgt vom kompletten anatomischen Verschluss. Jedoch ist in etwa 25–30% aller Erwachsenen eine persistierende Öffnung im Bereich des Foramen ovale nachweisbar. Dies hat unter normalen Bedingungen,bei normalen Druckverhältnissen keine hämodynamische Bedeutung. Jedoch kann es bei Druckerhöhung auf der rechten Seite des Herzens (z. B. Lungenembolie) zu einem signifikanten RechtsLinks-Shunt kommen, mit entsprechender Entsättigung des arteriellen Blutes. Besondere Bedeutung hat das offene Foramen ovale als mögliche Durchtrittsstelle für paradoxe Embolien. Solche paradoxe Embolien können in der Regel nicht nachgewiesen werden. Sie werden jedoch als mögliche Ursache für Schlaganfälle ansonsten unbekannter Ursache (kryptogener Schlaganfall) diskutiert. Bei Patienten mit ischämischem Schlaganfall unter 60 Jahren kann in etwa 40% keine vaskuläre, kardiale oder entzündliche Ursache gefunden werden sowie keine Koagulopathie, so dass hier von kryptogenen Schlaganfällen gesprochen wird. Während im transösophagealen Echokardiogramm ein PFO in etwa 25% der Normalbevölkerung nachweisbar ist und praktisch mit der selben Häufigkeit bei Patienten mit Schlaganfällen bekannter Ursache, findet sich ein PFO bei Patienten unter 60 Jahren und kryptogenem Schlaganfall in 54% (10), so dass zumindest bei einem größeren Teil dieser Patienten paradoxe Embolie als Ursache diskutiert werden muss.Generell sind für die Annahme einer paradoxen Embolie 4 Voraussetzungen erforderlich: 1. Eine arterielle Embolie unklarer Ursache (z. B. kryptogener Schlaganfall bei jüngeren Patienten). 2. Eine anatomische Verbindung zwischen rechtem und linken Herzen (z.B. PFO oder ASD). 3. Eine zumindest passagere Druckerhöhung im rechten Vorhof. Dies ist gegeben bei pathologischer Druckerhöhung (pulmonale Hypertonie, Lungenembolie), aber auch unter physiologischen Bedingungen, z. B. beim Valsalva-Versuch, beim Husten oder Pressen. 4. Ein venöser Embolus, d. h. eine venöse Emboliequelle. Dies können Thrombosen,Fettembolien und Luftembolien sein.Meist kann jedoch keine klinisch manifeste Thrombose dokumentiert werden. Allerdings können auch klinisch inapparente Mikrothombosen oder Fibrinaggregate im venösen Stromgebiet als Ursachen kleiner zerebraler Embolien ausreichen. Das exakte Rezidivrisiko bei stattgehabtem kryptogenem Schlaganfall und PFO ist unbekannt. In einer Verlaufsuntersuchung von Schlaganfallpatienten mit einem mittleren Alter von 61 Jahren fanden sich bei Patienten ohne PFO eine jährliche Rezidivrate (Schlaganfall oder TIA) von 6,9%, während diese bei Patienten mit PFO bei 14,4% pro Jahr lag (5). Ein erhöhtes Rezidivrisiko für zerebrale Ischämien bei PFO besteht beim Nachweis eines großen Rechts-Links-Shunts im transösophagealen Echokardiogramm bei Valsalva-Versuch (mehr als 20 Mikrobläschen), bei einem großen Rechts-Links-Shunt im transkraniellen Doppler, bei zusätzlichem Vorhandensein eines Vorhofseptumaneurysmas, bei anamnestischer Angabe eines Valsalvaähnlichen Manövers vor dem klinischen Ereignis (Husten, Pressen), was die Annahme einer paradoxen Embolie wahrscheinlicher macht, beim Auftreten mehrfacher zerebraler Ischämien bzw. beim Nachweis multipler Läsionen im CT oder NMR (2). Völlig unklar ist bislang, wie Patienten mit kryptogenem Schlaganfall und PFO am besten behandelt werden, da es dazu keine randomisierten prospektiven Studien gibt. An Therapieoptionen bestehen die medikamentöse Therapie mittels Thrombozytenaggregationshemmung (Aspirin), die Antikoagulation (Marcumar), der chirurgische PFO-Verschluss und seit neuestem der interventionelle PFO-Verschluss. Während ohne Therapie von einem Rezidivrisiko von über 10% pro Jahr auszugehen ist, fand sich bei Patienten, die medikamentös therapiert wurden (Aspirin oder Marcumar) eine Rezidivrate zwischen 3,4 und 3,8% (2,11). Nach chirurgischem PFO-Verschluss wurden in einer Studie keine Rezidive gefunden (7), während in einer anderen Analyse immerhin in 7,5% jährliche Rezidive beobachtet wurden (6).Vor kurzem wur- den erstmals die Langzeitergebnisse nach interventionellem PFO-Verschluss vorgestellt, hier gelangten mehrere verschiedene Schirmsysteme zur Anwendung (13). In dieser Studie konnte das PFO in 98% primär erfolgreich verschlossen werden, allerdings kam es in 10% zu Komplikationen (3% Schirmembolisationen,1% TIA,1% Perikardtamponade, 1% retroperitoneales Hämatom, 2% Luftembolie). Im Laufe von 5 Jahren Nachbeobachtung war kein Schlaganfallrezidiv zu verzeichnen, jedoch kam es mit einer Rate von 2,5% pro Jahr zu einem Rezidiv einer TIA.Diese Rezidivrate war signifikant assoziiert mit einem nachweisbaren Rest-Shunt nach PFO-Verschluss, des weiteren müssen andere Ursache außer einer paradoxen Embolie diskutiert werden. Potentielle Vorteile des interventionellen PFO-Verschlusses gegenüber der Antikoagulation sind die Vermeidung kumulativer Blutungskomplikationen im Langzeitverlauf, möglicherweise eine höhere Effektivität sowie eine definitive Therapie, die von vielen Patienten gegenüber der Langzeitantikoagulation bevorzugt wird. Gegenüber dem operativen PFOVerschluss bietet das interventionelle Verfahren den Vorteil der geringeren perioperativen Morbidität, der geringeren subjektiven Belastung, des Vermeidens einer Narbe, die geringere Hospitalisierungsdauer und geringere Kosten. Für die Indikationsstellung zum interventionellen PFO-Verschluss beim kryptogenen Schlaganfall ist unseres Erachtens die enge Kooperation zwischen Kardiologen und Neurologen erforderlich.In Frage kommen jüngere Patienten (unter 55–60 Jahren), bei denen durch eine umfangreiche spezielle Diagnostik anderweitige kardioembolische, vaskuläre und entzündliche Ursachen ausgeschlossen sind und bei denen sich kein Anhalt ergibt für eine Koagulopathie. Zu unserem Diagnostikprogramm gehört daher EKG und Langzeit-EKG (Ausschluss von intermittierendem Vorhoffflimmern),eine transthorakale und transösophageale Echokardiographie mit Valsalva-Versuch und Kontrastmittel, eine Doppler- und Duplexuntersuchung der extrakraniellen Hirngefäße, eine transkranielle Kontrastmittel-Doppleruntersuchung, ein kraniales NMR, meist auch eine NMR-Angiographie der Hirn- 4 gefäße sowie eine ausführliche Gerinnungsanalyse (Protein C, Protein S, AT-III, APC-Resistenz, Faktor V-Leiden-Mutation, Homozystein, Prothrombin 20210 Polymorphismus, Anticardiolipin-Antikörper, Anti-β2-Glykoprotein 1-Antikörper sowie Lupus-Antikoagulans). Zwei große Multizenter-Studien prüfen derzeit die Frage, welches die beste Therapie für Patienten mit kryptogenem Schlaganfall und PFO ist. Die deutsche PEPSISStudie (Paradoxical Embolism Prevention Study in Ischaemic Stroke) ist eine prospektive,kontrollierte,randomisierte Multizenter-Studie. Sie schließt ein Patienten zwischen 18 und 55 Jahren mit zerebraler Ischämie und PFO. Diese werden in 3 Behandlungsarme randomisiert:Interventioneller PFO-Verschluss vs.Marcumar für 6 Wochen gefolgt von Thrombozytenaggregationshemmung vs. Thrombozytenaggregationshemmung dauerhaft. Der primäre Endpunkt ist die Rezidivrate zerebraler Ischämien, das Ziel ist, 400 Patienten einzuschließen und über 3 Jahre zu beobachten.Erst wenn die Ergebnisse dieser Studien vorliegen, wird definitiv der Stellenwert und die Langzeiteffektivität des interventionellen PFO-Verschlusses klar sein. heiten geeignet sind, die Operation am offenen Herzen ersparen. Bei Patienten mit kryptogenem Schlaganfall und PFO kann dadurch eine dauerhafte Antikoagulation bzw. der chirurgische Verschluss vermieden werden. Bei allem Enthusiasmus Interventioneller Kardiologen muss jedoch betont werden, dass dieses Verfahren nur an entsprechenden kardiologischen Zentren mit entsprechender Erfahrung sowie der Möglichkeit der akuten herzchirurgischen Versorgung durchgeführt werden sollte.Darüber hinaus darf nicht außer acht gelassen werden, dass Langzeiterfahrungen noch fehlen und dass es keine randomisierten, prospektiven Studien zum Vergleich mit Alternativverfahren gibt. Diese sind erfreulicherweise allerdings derzeit im Gange. 7. 8. 9. 10. 11. Literatur 1. 2. 3. Fazit Der interventionelle Verschluss von Defekten des Vorhofseptums mit dem Amplatzer Occluder System ist eine viel versprechende Technik mit hoher Erfolgsrate und geringer Komplikationsrate. Er kann bei Patienten mit ASD, so weit sie von den anatomischen Gegeben- 6. 4. 5. Berger F, Vogel M, Alexi-Meskishvili V, Lange PE. Comparison of results and complications of surgical and Amplatzer device closure of atrial septal defects. J Thorac Cardiovasc Surg 1999;118:674-80 Bogousslavsky J, Garazi S, Jeanrenaud X, et al. Stroke recurrence in patients with patent foramen ovale: The Lausanne study. Neurology 1996;46:1301-5 Bogousslavsky J, Devuyst G, Nendaz M, et al. Prevention of stroke recurrence with presumed paradoxical embolism.J Neurol 1997;244:71-5 Chan KC, Godman MJ, Walsh K, et al. Transcatheter closure of atrial septal defect and interatrial communications with new self expanding nitinol double disc device (Amplatzer septal occluder): multicentre UK experience. Heart 1999;82:3006 Comess KA, Derook FA, Beach KW, et al. Transesophageal echocardiography and 12. 13. carotid ultrasound in patients with cerebral ischemia: Prevalence of findings and recurrent stroke risk. JACC 1994;23:1598603 Dearani JA, Ugurlu BS, Danielson GK, et al. Surgical patent formane ovale closure for prevention of paradoxical embolismrelated cerebrovascular ischemic events. Circulation 1999;100(suppl. II): II-171-II175 Devuyst G, Bogousslavsky J, Ruchat P, et al. Prognosis after stroke followed by surgical closure of patent foramen ovale. Neurology 1996;47:1162-6 Helber U, Baumann, R, Seboldt H, et al. Atrial septal defect in adults: Cardiopulmonary exercise capacity before and 4 months and 10 years after defect closure. J Am Coll Cardiol 1997;29:1345-50 Konstantinides S, Geibel A, Olschewski M, et al. A comparison of surgical and medical therapy for atrial septal defect in adults. New Engl J Med 1995;333:469-73 Lechat P, Mas JL, Lascault G, et al. Prevalence of patent formen ovale in patients with stroke. New Engl J Med 1988;318:1148-52 Mas JL, Zuber M. Recurrent cerebrovascular events in patients with patent foramen ovale, atrial septal aneurysm, or both and cryptogenic stroke or transient ischemic attack.Am Heart J 1995;130:10838 Sharafuddin MJ, Gu X, Titus JL, et al. Transvenous closure of secundum atrial septal defects: preliminary results with a new self-expanding nitinol prosthesis in a swine-model. Circulation 1997;95:2162-8 Windecker S, Wahl A, Chatterjee T, et al. Percutaneous closure of patent foramen ovale in patients with paradoxical embolism. Longterm risk of recurrent thromboembolic events. Circulation 2000;101:893-8 Anschrift des Verfassers: Prof. Dr. med. D. Elsner Klinik und Poliklinik für Innere Medizin II Universität Regensburg 93042 Regensburg