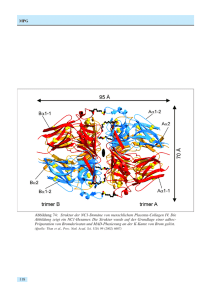
Seite als PDF downloaden - Max-Planck
Werbung

Jahrbuch 2008/2009 | Mandelkow , Eckhard | Zytoskelett: Architektur und Bew egung der Zelle Zytoskelett: Architektur und Bewegung der Zelle Cytoskeleton: Architecture and movement of cells Mandelkow , Eckhard Max-Planck-Arbeitsgruppen für strukturelle Molekularbiologie am DESY, Hamburg Korrespondierender Autor E-Mail: [email protected] Zusammenfassung Die Abteilung „Zytoskelett“ der Max-Planck-Arbeitsgruppen in Hamburg befasst sich mit den Proteinfasern der Zelle, speziell den Mikrotubuli und Motorproteinen, die für die Zellbew egung, Zellteilung und Differenzierung w ichtig sind. Von besonderer Bedeutung ist das Tau-Protein, das bei der Alzheimerkrankheit in den Nervenzellen die pathologischen „Neurofibrillen-Bündel“ bildet. Neuere transgene Zell- und Mausmodelle der Tau-Pathologie zeigen, dass das Absterben der Synapsen und Neuronen in der Alzheimerkrankheit eng mit der Aggregation des Tau-Proteins zusammenhängt und reversibel ist. Summary The "Cytoskeleton" group of the Max Planck Unit for Structural Molecular Biology in Hamburg focuses on the structure and dynamics of protein fibers in cells, in particular on microtubules and their associated proteins w hich are responsible for cell movement, cell division, or intracellular transport. One of these proteins, tau, forms pathological aggregates in nerve cells affected by Alzheimer's disease. Recent transgenic cell and mouse models of the tau pathology reveal that the pathological degeneration of synapses and neurons is closely related to aggregation, and that it is reversible. Das Zytoskelett – ein plastisches Korsett für die Zelle Das Zytoskelett ist für die Form der Zellen, für die Bew egung, für Materialtransport, für Zellteilung und Zelldifferenzierung verantw ortlich. Es besteht aus drei Fasersystemen, den Aktinfilamenten, den Intermediärfilamenten und den Mikrotubuli. Diese Fasern können sich aus Protein-Untereinheiten selbständig auf- und w ieder abbauen, das heißt. sie sind dynamisch, und sie haben die Fähigkeit der "„Selbstorganisation“. Hinzu kommen zahlreiche Proteine, die an die Fasern andocken, Fasern miteinander verbinden oder Verbindungen mit anderen Zellkomponenten, z. B. der äußeren Zellmembran oder der Kernmembran, herstellen können. Eine w ichtige Klasse dieser assoziierten Proteine sind die „Motorproteine“. Sie können chemische Energie in Form von Adenosintriphosphat (ATP) in mechanische Energie umw andeln und dadurch Lasten transportieren. Die Mikrotubuli w erden durch verschiedene „Mikrotubuli-Assoziierte Proteine“ (MAP) stabilisiert. Ein bekanntes Beispiel für das Zusammenspiel verschiedener Zytoskelett-Proteine ist die Zellteilung; dabei bilden Mikrotubuli einen © 2009 Max-Planck-Gesellschaft Spindelapparat w w w .mpg.de aus, der die Chromosomen mithilfe von 1/8 Jahrbuch 2008/2009 | Mandelkow , Eckhard | Zytoskelett: Architektur und Bew egung der Zelle Motorproteinen auseinanderziehen kann. Bei den Nervenzellen stellen Mikrotubuli die „Gleise“ für den Transport in den Zellfortsätzen (Axone, Dendriten) dar, w o Lasten über w eite Entfernungen zu den Nervenendigungen (Synapsen) geliefert w erden müssen. Der Schw erpunkt der Arbeiten der Abteilung „Zytoskelett“ liegt auf der Untersuchung der Selbstorganisation der Mikrotubuli, der Struktur Mikrotubuli-abhängiger Motorproteine, dem Mikrotubuli-assoziierten Tau-Protein und seiner Rolle in der Alzheimerkrankheit. Dabei w urden biochemische, molekularbiologische, zellbiologische und biophysikalische Methoden kombiniert. Die Intensität der Synchrotronstrahlung erlaubt es, Wachstum und Zerfall von Mikrotubuli in Echtzeit durch Beugung des Röntgenlichts zu verfolgen, Röntgenbilder von sehr kleinen Proben von Alzheimer-Fasern aufzunehmen oder die Struktur von kristallisierten Proteinen mit hoher Auflösung zu bestimmen. Durch Ankoppeln von fluoreszierenden Molekülen und Einschleusen in Nervenzellen kann die Verteilung von Tau-Protein in lebenden Nervenzellen dargestellt w erden und so seine mögliche Fehlfunktion in der Alzheimerkrankheit untersucht w erden. Transgene Zell- und Mausmodelle bestätigen die pathologische W irkung der Tau-Proteins und zeigen, w elche Eigenschaften seiner Struktur dafür verantw ortlich sind. Es folgen einige Beispiele aus der Arbeit des vergangenen Jahres. MARK – Struktur und Regulation einer Familie von Proteinkinasen Proteinkinasen sind Enzyme, die Phosphatgruppen auf Proteine übertragen und damit die Funktion der Zielproteine verändern (z. B. Aktivierung oder Hemmung). Dieser Mechanismus w ird in Zellen häufig für die Übertragung von Signalen verw endet. Im Fall des Tau-Proteins führt die Phosphorylierung an bestimmten Stellen zur Ablösung von den Mikrotubuli. Die Konsequenzen sind, dass Mikrotubuli destabilisiert w erden und somit als Gleise für den intrazellulären Transport ausfallen, und dass das abgelöste Tau-Protein in den neuronalen Zellen anomal aggregieren kann und die „Neurofibrillenbündel“ der Alzheimerkrankheit bildet. Die Suche nach der verantw ortlichen Proteinkinase führte zur Entdeckung von MARK („MAP-Mikrotubuli- affinitätsregulierende Kinase“). Es handelt sich um eine Familie von vier Isoformen (MARK1-4), die zur Gruppe der AMP-Kinasen gehört. Die Hamburger W issenschaftler haben mithilfe der Proteinkristallographie die Strukturen von mehreren Isoformen und Varianten der Kinase aufgeklärt (Abb. 1). Die katalytische Domäne ist ähnlich aufgebaut w ie bei anderen Kinasen, aber eine Besonderheit ist die Ubiquitin-assoziierte Domäne (UBA), die vermutlich einen Ubiquitin-abhängigen Regulationsmechanismus ermöglicht. Die katalytische Domäne kann durch verschiedene Kinasen phosphoryliert w erden, w as entw eder zur Aktivierung (MARKK, LKB1) oder Inaktivierung (GSK3β) führt [1]. Weiterhin kann MARK oder seine Aktivatoren durch direkte Bindung an andere Proteinkinasen reguliert w erden, z. B. TESK1, PAK5, w as zu einer w echselseitigen Kontrolle der zw ei w esentlichen Zytoskelett-Netzw erke führt (Aktinfilamente und Mikrotubuli) [2]. © 2009 Max-Planck-Gesellschaft w w w .mpg.de 2/8 Jahrbuch 2008/2009 | Mandelkow , Eckhard | Zytoskelett: Architektur und Bew egung der Zelle Da rste llung de r k a ta lytische n Dom ä ne de r P rote ink ina se MAR K2. Bla u und viole tt = k le ine und große Dom ä ne de r Kina se , da zwische n die a k tive Ta sche m it de r re gula torische n Schla ufe (ge lb). Bra un = Dock ingdom ä ne (C D), rot = Ubiquitin-a ssoziie rte Dom ä ne (UBA). © Ma x -P la nck -Arbe itsgruppe n für struk ture lle Mole k ula rbiologie a m DESY Die physiologische W irkung der Kinase lässt sich durch Transfektion von primären neuronalen Zellen oder von Maus-Embryonen nachw eisen. So kann z. B. der axonale Transport in Neuronen durch das Wechselspiel zw ischen Tau-Protein und seiner Kinase MARK verändert w erden; die Wanderung von Neuronen bei der Ausformung des Gehirns w ird von MARK gesteuert (Zusammenarbeit mit der Gruppe von Orly Reiner, Weizmann Institut, Israel, [3]). Bei der krankhaften „Hyperphosphorylierung“ des Tau-Proteins in MausModellen der Alzheimerkrankheit findet man MARK zusammen mit dem Tau-Protein angereichert vor (Abb. 2). Ve rte ilung de r P rote ink ina se MAR K im Hippok a m pus e ine r Ma us, in de r da s Ta u-P rote in übe re x prim ie rt wird, so da ss sich Ne urofibrille nbünde l bilde n, die a us hoch phosphorylie rte m Ta u-P rote in be ste he n (re chts). © Ma x -P la nck -Arbe itsgruppe n für struk ture lle Mole k ula rbiologie a m DESY Tau-Protein – ein nativ entfaltetes Protein mit pathologischer Wirkung Tau-Protein stabilisiert normalerw eise die Mikrotubuli in Nervenzellen, kann sich aber bei der AlzheimerDemenz krankhaft verändern. Dasselbe geschieht in anderen sog. „Tauopathien“, z. B. bei frontotemporalen © 2009 Max-Planck-Gesellschaft w w w .mpg.de 3/8 Jahrbuch 2008/2009 | Mandelkow , Eckhard | Zytoskelett: Architektur und Bew egung der Zelle Demenzen oder Morbus Pick. Die Folge ist, dass das Zytoskelett zusammenbricht, sodass das Tau-Protein zu unlöslichen Fasern verklumpt. Es bilden sich die „paarigen helikalen Filamente“ der Alzheimerkrankheit, die die Nervenzellen verstopfen und sie absterben lassen (Übersicht: [4]). Eine Besonderheit des Tau-Proteins ist es, dass es keine kompakt gefaltete Struktur besitzt, in der Zelle w eitgehend entfaltet und flexibel ist und trotzdem seine physiologische Funktion erfüllt (Stabilisierung von Mikrotubuli in neuronalen Axonen). Die Struktur des Proteins lässt sich deshalb nicht mit Proteinkristallographie lösen, sondern man muss auf spektroskopische und andere biophysikalische Methoden zurückgreifen. Die globale Faltung w urde untersucht, indem verschiedene Paare von Aminosäuren jew eils markiert w urden mit Fluoreszenz-Donor- und -AkzeptorGruppen, so dass ihr Abstand mithilfe des sog. FRET-Effekts bestimmt w erden konnte. Es zeigte sich, dass das Tau-Protein in Lösung ähnlich w ie eine Büroklammer gefaltet ist, sodass der N- und C-Terminus sich auf die Mitte des Proteins zurückfalten. Wenn Tau-Protein in einen phosphorylierten Zustand versetzt w ird, w ird die Struktur kompakter – es entsteht eine „pathologische Konformation“, w ie sie auch durch bestimmte Antikörper gegen Tau-Protein in der Alzheimerkrankheit typisch ist. Auf diese Weise lässt sich die Konformationsänderung des Proteins im Frühstadium der Krankheit in vitro nachstellen und untersuchen [5]. Ein zw eiter Untersuchungsansatz w ar die Röntgenbeugung in Lösung (SAXS; Zusammenarbeit mit der Gruppe Dmitri Svergun, EMBL, [6]). Hier zeigt es sich, dass das Tau-Protein w esentlich mehr Raum einnimmt (ca. 20fach), als es einem kompakt gefalteten Protein gleicher Länge entsprechen w ürde (Streumassenradius 6.5 nm statt 2.4 n m , Abb. 3). Es scheint, dass das Protein sich w ie ein bew eglicher „Puffer“ über die Oberfläche eines Mikrotubulus verteilt. Ve rgle ich de r Größe e ine s k om pa k t ge fa lte te n P rote ins (Am yla se ) und e ine s na tiv e ntfa lte te n P rote ins (Ta u) von e twa gle iche r Größe (ca . 440 Am inosä ure n). Die gra ue Kuge l e ntspricht de m m ittle re n Auße nra dius de s ge fa lte te n P rote ins. © Ma x -P la nck -Arbe itsgruppe n für struk ture lle Mole k ula rbiologie a m DESY Neben der Strukturaufklärung mit Röntgenstrahlung hat in den letzten Jahren die Kernresonanzmethode (NMR) eine zunehmende Bedeutung erlangt. In Zusammenarbeit mit dem MPI für biophysikalische Chemie Göttingen (Christian Griesinger, Marc Baldus, Marcus Zw eckstetter u.a.) w urden verschiedene Domänen des Tau-Proteins separat und in Kombination mit Lösungs- und Festkörper-NMR untersucht (z. B. [7]). Die Ergebnisse zeigen, dass Tau zw ar insgesamt den Charakter eines entfalteten Proteins besitzt, trotzdem gibt © 2009 Max-Planck-Gesellschaft w w w .mpg.de 4/8 Jahrbuch 2008/2009 | Mandelkow , Eckhard | Zytoskelett: Architektur und Bew egung der Zelle es eine Reihe von begrenzten Elementen der Sekundärstruktur (α-Helix, Poly-Prolin-Helix, β-Struktur). Die βStruktur ist von besonderer Bedeutung, w eil hierauf die pathologische Aggregation des Proteins beruht. Die NMR-Ergebnisse zeigen außerdem, an w elchen Stellen des Tau-Proteins die Wechselw irkung mit anderen Partnerproteinen oder Liganden stattfindet (z. B. Mikrotubuli, Kupferionen oder Aggregationsinhibitoren). Transgene Mausmodelle der Tau-Pathologie in der Alzheimerkrankheit Die auslösenden Faktoren der Alzheimerkrankheit und der pathologischen Proteinablagerungen im Gehirn sind bis heute nur in Ansätzen bekannt. Desw egen spielen transgene Tiermodelle eine w esentliche Rolle bei der Ursachenforschung. Die Gruppe von Eckhard Mandelkow hat transgene Mausmodelle entw ickelt, in denen mehrere Elemente neu kombiniert w urden [8]: (1) Die Mäuse exprimieren das humane Tau in einer regulierbaren Weise, das heißt das Protein kann zu bestimmten Zeitpunkten an- und w ieder abgeschaltet w erden. Auf diese Weise kann man den Einfluss des Alterns auf die Pathologie des Tau-Proteins sow ie die Regenerationsfähigkeit des Gehirns beobachten. (2) Das Protein w ird nur in den Gehirnregionen exprimiert, in denen auch die Neurofibrillen der Alzheimerkrankheit erscheinen. (3) Es w erden verschiedene Varianten des Tau-Proteins exprimiert, die sich systematisch voneinander unterscheiden, vor allem in ihrem Aggregationsverhalten („W ildtyp“, „Pro-Aggregations-Mutante“, und „Anti-Aggregations-Mutante“). Dadurch w ird es möglich, den Effekt der Tau-Expression von dem Effekt der Aggregation zu unterscheiden. P a thologische Aggre ga tion von Ta u im Ge hirn von tra nsge ne n Mä use n. Link s: Die Ex pre ssion de r P ro-„Aggre ga tionsMuta nte “ Ta uR DΔK280 führt na ch 3 Mona te n zu de utliche n Abla ge runge n (schwa rz ge fä rbt), wä hre nd die „AntiAggre ga tions-Muta nte “ a uch na ch 22 Mona te n k e ine Abla ge runge n ze igt. © Ma x -P la nck -Arbe itsgruppe n für struk ture lle Mole k ula rbiologie a m DESY Die Ergebnisse zeigen, dass die Neurofibrillen-Pathologie eindeutig von der Aggregationsfähigkeit abhängt, nicht von der Expression von Tau an sich. Diese Aggregationsfähigkeit w ird w iederum von kurzen Elementen in der Tau-Sequenz bestimmt, die fähig sind, eine β-Struktur auszubilden. So zeigen beispielsw eise ProAggregations-Mutanten schon nach 3 Monaten ausgeprägte Neurofibrillen, w ährend Anti-AggregationsMutanten auch nach 2 Jahren noch völlig frei davon sind (Abb. 4). Dass die Aggregation des Tau-Proteins tatsächlich toxisch ist, zeigt sich am Verlust von Synapsen und am Absterben von Neuronen genau in den Regionen, die auch in der Alzheimerkrankheit des Menschen betroffen sind, z. B. im Hippokampus, der für die Speicherung des Gedächtnisses verantw ortlich ist (Abb. 5). Überraschend w aren die Befunde, dass die Aggregate im Gehirn reversibel sind (d.h. sich nach Abschalten der Expression von Tau w ieder zurückbilden © 2009 Max-Planck-Gesellschaft w w w .mpg.de 5/8 Jahrbuch 2008/2009 | Mandelkow , Eckhard | Zytoskelett: Architektur und Bew egung der Zelle können), und dass das exogene humane Tau-Protein auch das endogene Maus-Tau zur Aggregation bringen kann, so als ob ein „toxisches“ Tau-Molekül ein gesundes „infizieren“ kann. Auswirk ung de r Aggre ga tion de s Ta u-P rote ins a uf die Ne urone n im Be re ich de s Hippok a m pus von tra nsge ne n Mä use n. Die Ne urone n sind m it e ine m bra une n Fa rbstoff (Ne uN) da rge ste llt. Im Fa ll de r „P ro-Aggre ga tions-Muta nte “ de s Ta u-P rote ins (m ittle re R e ihe ) tritt schon na ch 5 Mona te n de utliche r Ve rlust von Ne urone n a uf, na ch 24 Mona te n sind sie we itge he nd a bge storbe n. Da ge ge n ble ibe n be i de r nichttra nsfizie rte n Kontrollm a us (obe re R e ihe ) ode r be i de r „AntiAggre ga tions-Muta nte “ (unte re R e ihe ) die Ne urone n e rha lte n. © Ma x -P la nck -Arbe itsgruppe n für struk ture lle Mole k ula rbiologie a m DESY Therapeutischer Ansatz: Suche nach Wirkstoffen gegen die Tau-Aggregation Aufgrund der genannten Befunde liegt es nahe, die Degeneration der Neuronen durch Hemmstoffe der Aggregation zu verlangsamen oder rückgängig zu machen. Eine Suche nach geeigneten W irkstoffen w urde bereits eingeleitet, mehrere Klassen von möglichen Hemmstoffen w urden identifiziert und durch kombinatorische Chemie w eiterentw ickelt (Zusammenarbeit mit den Gruppen Herbert Waldmann, MPI Dortmund und Boris Schmidt, TU Darmstadt, vgl. [9]). Es konnte gezeigt w erden, dass diese Substanzen die Aggregation und Toxizität des Tau-Proteins in neuronalen Zellen verhindern und einmal gebildete Aggregate w ieder auflösen können. Ziel der w eiteren Arbeit ist es, die W irksamkeit der Substanzen an Mäusen nachzuw eisen und sie zum Einsatz in der Klinik w eiterzuführen. © 2009 Max-Planck-Gesellschaft w w w .mpg.de 6/8 Jahrbuch 2008/2009 | Mandelkow , Eckhard | Zytoskelett: Architektur und Bew egung der Zelle Struk tur e ine s Hits a us de r Kla sse de r R hoda nine , die a uf de r Suche na ch Ta u-Aggre ga tions-Inhibitore n ge funde n wurde n, sowie Ansa tzpunk te zur Modifik a tion und O ptim ie rung de r Substa nz. © Ma x -P la nck -Arbe itsgruppe n für struk ture lle Mole k ula rbiologie a m DESY Originalveröffentlichungen Nach Erw eiterungen suchenBilderw eiterungChanneltickerDateilisteHTML- Erw eiterungJobtickerKalendererw eiterungLinkerw eiterungMPG.PuRe-ReferenzMitarbeiter (Employee Editor)Personenerw eiterungPublikationserw eiterungTeaser mit BildTextblockerw eiterungVeranstaltungstickererw eiterungVideoerw eiterungVideolistenerw eiterungYouTubeErw eiterung [1] T. Timm, K. Balusamy, J. Biernat, E. Mandelkow, E.-M. Mandelkow: Inhibition of MARK/Par-1 signalling pathway by GSK3β. Journal of Biological Chemistry 283, 18873-18882 (2008). [2] C. Johne, D. Matenia, X. Y . Li, T. Timm, K. Balusamy, E.-M. Mandelkow: Spred1 and TESK1 – two new interaction partners of the kinase MARKK/TAO1 that mediate crosstalk between the microtubule and actin cytoskeleton. Molecular Biology of the Cell 19, 1391-1403 (2008). [3] T. Sapir, A. Shmueli, T. Levy, T. Timm, M. Elbaum, E.-M. Mandelkow, O. Reiner: Antagonistic effects of DCX and MARK2/Par-1 in the developing cerebral cortex. Journal of Neuroscience 28, 13008-13013 (2008). [4] A. Schneider, E. Mandelkow: Tau-based treatment strategies in neurodegenerative diseases. Neurotherapeutics 5, 443-457 (2008). [5] S. Jeganathan, A. Hascher, S. Chinnathambi, J. Biernat, E.-M. Mandelkow, E. Mandelkow: Proline-directed pseudo-phosphorylation at AT8 and PHF1 epitopes induces a compaction of the paperclip folding of Tau and generates a pathological (MC-1) conformation. Journal of Biological Chemistry 283, 32066-32076 (2008). [6] E. Mylonas, A. Hascher, P. Bernado, M. Blackledge, E. Mandelkow, D. I. Svergun: Domain conformation of tau protein studied by solution small angle X-ray scattering. Biochemistry 47, 10345-10353 (2008). © 2009 Max-Planck-Gesellschaft w w w .mpg.de 7/8 Jahrbuch 2008/2009 | Mandelkow , Eckhard | Zytoskelett: Architektur und Bew egung der Zelle [7] O. Andronesi, M. von Bergen, J. Biernat, K. Seidel, H. Heise, C. Griesinger, E. Mandelkow, M. Baldus: Structural models of Alzheimer's-like paired helical filaments from the core domain of Tau derived from solid-state NMR spectroscopy. Journal of the American Chemical Society 130, 5922-5928 (2007). [8] M. Mocanu, A. Nissen, K. Eckermann, I. Khlistunova, J. Biernat, D. Drexler, O. Petrova, K. Schönig, H. Bujard, E. Mandelkow, L. Zhou, G. Rune, E.-M. Mandelkow: The potential for beta structure in the repeat domain of Tau protein determines aggregation, synaptic decay, neuronal loss, and co-assembly with endogenous Tau in inducible mouse models of tauopathy. Journal of Neuroscience 28, 737-748 (2008). [9] B. Bulic, M. Pickhardt, B. Schmidt, E.-M. Mandelkow, H. Waldmann, E. Mandelkow: Development of Tau aggregation inhibitors for Alzheimer disease. Angew andte Chemie International Edition 48, 2-15 (2009). © 2009 Max-Planck-Gesellschaft w w w .mpg.de 8/8