Zytoskelett: Architektur und Bewegung der Zelle - Max
Werbung

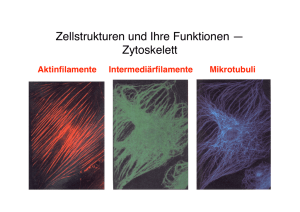
Mandelkow, Eckhard | Zytoskelett: Architektur und Bewegung der Zelle Tätigkeitsbericht 2006 Struktur- und Zellbiologie Zytoskelett: Architektur und Bewegung der Zelle Mandelkow, Eckhard, E-Mail: [email protected] Max-Planck-Arbeitsgruppen für strukturelle Molekularbiologie am DESY, Hamburg Arbeitsgruppe - Zytoskelett Zusammenfassung Die „Max-Planck-Arbeitsgruppen für strukturelle Molekularbiologie“ in Hamburg beschäftigen sich mit der Struktur und Funktion von Biomolekülen, speziell mit der Anwendung der Synchrotronstrahlung auf die Strukturaufklärung von Proteinen, die von medizinischem Interesse sind. Die Arbeitsgruppe „Zytoskelett“ befasst sich mit den Proteinfasern der Zelle, vor allem den Mikrotubuli und Motorproteinen, die für die Zellbewegung, Zellteilung und Differenzierung wichtig sind. Von besonderer Bedeutung ist das Tau-Protein, das bei der Alzheimer-Krankheit in den Nervenzellen pathologische Aggregate bildet. Neuere Untersuchungen deuten auf eine Verflechtung der Funktionen des Tau-Proteins mit dem zellulären Transport hin, was für die Entstehung der Alzheimer-Erkrankung eine Rolle spielen könnte. Abstract The „Max-Planck-Unit for Structural Molecular Biology“ in Hamburg investigates the structure and function of biomolecules, with particular emphasis on the applications of synchrotron radiation for the elucidation of protein structures of biomedical interest. The „Cytoskeleton“ group focuses on the structure, self-assembly, and dynamics of protein fibers in cells, in particular on microtubules and their associated proteins which are responsible for cell movement, cell division, cell differentiation, or intracellular transport. One of the microtubule associated proteins, tau protein, forms pathological aggregates in nerve cells affected by Alzheimer‘s disease. Recent findings reveal a linkage between tau‘s multiple functions and the cellular transport system which could prove essential for the aetiology of Alzheimer‘s disease. Das Zytoskelett – ein plastisches Korsett für die Zelle Das Zytoskelett ist für die Form der Zellen, für die Bewegung, für Materialtransport, für Zellteilung und Zelldifferenzierung verantwortlich. Es besteht aus drei Fasersystemen: den Aktinfilamenten, den Intermediärfilamenten und den Mikrotubuli. Diese Fasern können sich aus Protein-Untereinheiten selbständig auf- und wieder abbauen, d. h. sie sind dynamisch und haben die Fähigkeit der „Selbstorganisation“. Hinzu kommen zahlreiche Proteine, die an die Fasern andocken, Fasern miteinander verbinden oder Verbindungen mit anderen Zellkomponenten, z. B. der äußeren Zellmembran oder der Kernmembran, herstellen können. Eine wichtige Klasse dieser assoziierten Proteine sind die „Motorproteine“. Sie können chemische Energie in Form von Adenosintriphosphat (ATP) in mechanische Energie umwandeln und dadurch Lasten transportieren. Die Mikrotubuli werden durch verschiedene „Mikrotubuli-assoziierte Proteine“ (MAP) stabilisiert. Ein bekanntes Beispiel für das Zusammenspiel verschiedener Zytoskelett-Proteine ist die Zellteilung; dabei bilden Mikrotubuli einen Spindelapparat aus, der die Chromosomen mithilfe von Motorproteinen auseinanderziehen kann. Bei den Nervenzellen stellen Mikrotubuli die „Gleise“ für den Transport in den Zellfortsätzen (Axone, Dendriten) dar, wo Lasten über weite Entfernungen zu den Nervenendigungen (Synapsen) geliefert werden müssen. © 2007 Max-Planck-Gesellschaft www.mpg.de 421 Tätigkeitsbericht 2006 Mandelkow, Eckhard | Zytoskelett: Architektur und Bewegung der Zelle Diese Vorgänge lassen sich im Reagenzglas oder in Zellmodellen nachstellen und untersuchen. Der Schwerpunkt der Arbeiten der Abteilung „Zytoskelett“ lag auf der Untersuchung der Selbstorganisation der Mikrotubuli, der Struktur Mikrotubuli-abhängiger Motorproteine, dem Mikrotubuli-assoziierten Tau-Protein und seiner Rolle in der Alzheimer-Krankheit. Dabei wurden biochemische, molekularund zell-biologische sowie biophysikalische Methoden kombiniert. Die Intensität der Synchrotronstrahlung erlaubt es, Wachstum und Zerfall von Mikrotubuli in Echtzeit durch Beugung des Röntgenlichts zu verfolgen, Röntgenbilder von sehr kleinen Proben von Alzheimer-Fasern aufzunehmen oder die Struktur von kristallisierten Proteinen mit hoher Auflösung zu bestimmen. Die Proteine wurden teils aus Zellgewebe isoliert, teils rekombinant in Bakterienkulturen hergestellt, was die Überprüfung ihrer Funktion durch gezielte Mutationen ermöglicht. Durch Ankoppeln von fluoreszierenden Molekülen und Einschleusen in Nervenzellen wurde die Verteilung und die Funktion Mikrotubuli-assoziierter Proteine in situ in lebenden Zellen untersucht. Motorproteine für den Transport in Zellen Motorproteine der Kinesin-Klasse bestehen häufig aus zwei schweren und zwei leichten Polypeptidketten. Die Motordomänen der schweren Ketten binden an die Oberfläche der Mikrotubuli und wandeln chemische Energie in Form energiereicher Moleküle (ATP) in gerichtete Bewegung um. Obwohl die Moleküle nur wenige Nanometer Durchmesser haben, kann man die Bewegung mithilfe der Videomikroskopie in Echtzeit sichtbar machen. Aus der Kombination hochauflösender Röntgenstrukturanalyse einzelner Motordomänen mit elektronenmikroskopischen Aufnahmen des Kinesin-Mikrotubuli-Komplexes zeichnet sich folgendes Modell für den Bewegungsmechanismus ab: Konventionelles Kinesin hangelt sich an Mikrotubuli entlang, indem die beiden Motordomänen abwechselnd an den Mikrotubulus binden und sich wieder ablösen, wobei zu jedem Zeitpunkt mindestens eine Motordomäne gebunden ist. Dieser „Hand-über-Hand“- Mechanismus ist für Kinesin durch kinetische und spektroskopische Messungen gut belegt [1]. Daneben gibt es aber auch Kinesine, wie zum Beispiel die monomeren Kinesine der Kif1A-Familie, die andere, im Einzelnen noch nicht geklärte Mechanismen zur Fortbewegung benutzen. Das Kif1A-ähnliche NcKin3 aus Pilzen (Abb. 1) zeichnet sich z. B. dadurch aus, dass es zwar als Dimer (also mit zwei Motordomänen) auftritt, bei der Bewegung aber bleibt eine der Motordomänen scheinbar unbeteiligt. Abb. 1: Darstellung einer Motordomäne des Kinesins NcKin3 aus der Hefe Neurospora crassa. N und C bezeichnen das N- und C-terminale Ende der Motordomäne. ADP: Adenosindiphosphat (Spaltprodukt der Hydrolyse von ATP, Adenosintriphosphat, das die Energie für die Bewegung liefert). Flexible Bereiche sind gestrichelt angedeutet. Urheber: Max-Planck-Arbeitsgruppen für strukturelle Molekularbiologie am DESY 422 www.mpg.de © 2007 Max-Planck-Gesellschaft Mandelkow, Eckhard | Zytoskelett: Architektur und Bewegung der Zelle Tätigkeitsbericht 2006 Tau-Protein – Verklumpung im Gehirn bei der Alzheimerkrankheit Das sog. Tau-Protein, das die Mikrotubuli in Nervenzellen stabilisieren soll, kann sich bei der Alzheimer-Demenz krankhaft verändern. Die Folge ist, dass das Zytoskelett zusammenbricht, sodass das Tau-Protein zu unlöslichen Fasern verklumpt. Es bilden sich die „paarigen helikalen Filamente“ der Alzheimer-Krankheit, die die Nervenzellen verstopfen und sie absterben lassen [2]. Abb. 2: Illustration zur Flexibilität der Tau-Moleküle in Lösung. Menschliches Tau-Protein besteht aus einer Kette von bis zu 441 Aminosäureresten, darunter drei oder vier einander sehr ähnliche Sequenzmotive von jeweils etwa 40 Aminosäuren (die so genannten Pseudo-Repeats, roter Bereich), die für die Bindung an Mikrotubuli verantwortlich sind. Fluoreszenzspektroskopische Untersuchungen haben gezeigt, dass Tau-Moleküle in Lösung trotz der hohen Flexibilität eine gewisse Präferenz für gefaltete Konformationen haben, in denen sich die Molekülenden der zentralen Bindungsdomäne annähern, und die für das frühe Stadium der Alzheimer-Degeneration einer Zelle typisch sind („Heftklammer-Konformation“,[3]). Urheber: Max-Planck-Arbeitsgruppen für strukturelle Molekularbiologie am DESY An sich ist Tau-Protein sehr gut löslich. Die einzelnen Tau-Moleküle sind in Lösung „nativ entfaltet“, das heißt weitgehend unstrukturiert und flexibel (Abb. 2). Der eigentliche Auslöser der pathologischen Aggregation von Tau-Protein ist noch unbekannt, aber es konnten in den letzten Jahren einige strukturelle Eigenschaften der anomalen Tau-Fasern aufgeklärt werden [3;4]. Tau und intrazellulärer Verkehrsstau Auf der Suche nach Faktoren, die für das Absterben von Nervenzellen in der Alzheimer-Krankheit verantwortlich sein könnten, stößt man schnell auf Störungen im zellulären Transportsystem. Einer der Faktoren ist möglicherweise, dass das Tau-Protein nicht nur Mikrotubuli (die Gleise des Transports) stabil hält, sondern sie auch „verklebt“ und damit unbrauchbar machen kann [5; 6]. Das Ergebnis ist, dass die Transportvorgänge gestört werden, sodass die äußeren Bereiche der Zelle unterversorgt bleiben (Abb. 3). In der Nervenzelle wird das Transportsystem durch Proteinkinasen reguliert, die mehrere funktionelle Domänen besitzen und so die Wechselwirkungen von verschiedenen Proteinen des Zytoskeletts beeinflussen [6; 7]. © 2007 Max-Planck-Gesellschaft www.mpg.de 423 Tätigkeitsbericht 2006 Mandelkow, Eckhard | Zytoskelett: Architektur und Bewegung der Zelle Abb. 3: Überproduktion von Tau-Protein führt zum Verlust von Synapsen. Dendriten sind baumartig verzweigte Fortsätze von Nervenzellen, die die Signale anderer Nervenzellen aufnehmen und zum Zellkörper leiten. Die Signalübertragung erfolgt über spezielle Kontaktstellen (Synapsen). Das Bild zeigt oben in Rot eine „gesunde“ Zelle, in der die Dornfortsätze der Dendriten durch einen speziellen Fluoreszenzfarbstoff markiert sind. Die Aufnahmen darunter zeigen Ausschnitte aus Dendriten von Neuronen, die fluoreszenzmarkiertes Tau-Protein überexprimieren (in Blau). Im Lauf von 1-2 Tagen zerfallen die Dornfortsätze, die neuronale Signalübertragung wird unterbrochen. Innerhalb von Dendriten und Axonen bricht der Transport von Vesikeln und Mitochondrien zusammen [5]. Urheber: Max-Planck-Arbeitsgruppen für strukturelle Molekularbiologie am DESY Im gesunden Zustand der Zelle sind die Mitochondrien, die Kraftwerke der Zelle, überall im Zellkörper und in den langen Zellfortsätzen verteilt, sodass die Zelle gleichmäßig mit Energie versorgt wird. Wenn aber eine Fehlfunktion des Tau-Proteins die Transportwege beeinträchtigt, können die Zellorganellen und Transportvesikel nicht mehr in die Zellfortsätze einwandern, sondern bleiben im Zellkörper liegen [8]. Das führt zu einer Unterversorgung der Zellfortsätze, zum Absterben der Synapsen (Abb. 3) und schließlich zum Tod der ganzen Nervenzelle [5]. Suche nach Wirkstoffen gegen die Tau-Aggregation Die klinischen Stadien der Alzheimer-Erkrankung korrelieren eng mit der Verteilung von verklumptem Tau-Protein in den sog. „Neurofibrillenbündeln“. Ein Ansatz der Alzheimer-Forschung besteht deswegen darin, Wirkstoffe zu finden, die die Aggregation des Proteins verhindern oder rückgängig machen, um auf diese Weise die Degeneration von Nervenzellen zu verhindern [9; 10]. Auf der Suche nach solchen Substanzen wurden Testverfahren entwickelt und eine Bibliothek von 200.000 Substanzen überprüft. Abbildung 4 zeigt, dass solche Substanzen tatsächlich die erwartete Wirkung zeigen können, nicht nur als Hemmstoff in vitro (rechts), sondern auch in Zellen (links). Aufgrund der gefundenen Ausgangssubstanzen wird nun versucht, ihre Wirksamkeit durch chemische Modifikation zu erhöhen. 424 www.mpg.de © 2007 Max-Planck-Gesellschaft Mandelkow, Eckhard | Zytoskelett: Architektur und Bewegung der Zelle Tätigkeitsbericht 2006 Abb. 4: Test eines Wirkstoffs gegen die Aggregation von Tau-Protein. Rechts oben ist eine chemische Verbindung aus der Familie der N-Phenylamine dargestellt, die als möglicher Wirkstoff zur Verhinderung der Aggregation und zur Auflösung bereits bestehender Tau-Aggregationen in Frage kommt. Die Mikroskop-Aufnahmen lebender Zellen links zeigen in Immunofärbung den Gesamtgehalt an Tau-Protein in Rot (Färbung durch einen Antikörper) und den Anteil des aggregierten Tau-Proteins in Grün (Thioflavin-S-Färbung), einmal ohne Wirkstoff (oben) und einmal mit Wirkstoff (unten). Der Anteil der Tau-Aggregate wird durch die Zugabe des Wirkstoffs deutlich reduziert. Das Diagramm rechts unten gibt die Konzentrationsabhängigkeit des Effekts wieder. Urheber: Max-Planck-Arbeitsgruppen für strukturelle Molekularbiologie am DESY Literaturhinweise [1] Marx, A., Müller, J., Mandelkow, E.: The structure of microtubule motors. Advances in Protein Chemistry 71, 299-344 (2005). [2] Mandelkow, E., von Bergen, M., Biernat, J., Mandelkow, E.-M.: Structural Principles of Tau and Alzheimer Paired Helical Filaments. Brain Pathology 17, 84-91 (2007). [3] Jeganathan, S., von Bergen, M., Brutlach, H., Steinhoff, H.-J., Mandelkow, E.: Global hairpin folding of tau in solution. Biochemistry 45, 2283-2293 (2006). [4] von Bergen, M., Barghorn, S., Müller, S. A., Pickhardt, M., Biernat, J., Mandelkow, E.-M., Davies, P., Aebi, U., Mandelkow, E.: The core of Tau paired helical filaments studied by STEM and limited proteolysis. Biochemistry 45, 6446-6457 (2006). [5] Thies, E., Mandelkow, E.-M.: Missorting of tau in neurons causes degeneration of synapses that can be rescued by MARK2/Par-1. Journal of Neuroscience 27, 2896-2907 (2007). © 2007 Max-Planck-Gesellschaft www.mpg.de 425 Tätigkeitsbericht 2006 Mandelkow, Eckhard | Zytoskelett: Architektur und Bewegung der Zelle [6] Matenia, D., Griesshaber, B., Li, X-Y., Thiessen, A., Johne, C., Jiao, J., Mandelkow, E., Mandelkow, E.-M.: PAK5 kinase is an inhibitor of MARK/Par-1 which leads to stable microtubules and dynamic actin. Molecular Biology of the Cell 16, 4410-4422 (2005). [7] Panneerselvam, S., Marx, A., Mandelkow, E.-M., Mandelkow, E.: Structure of the catalytic and ubiquitin-associated domains of the protein kinase MARK / Par-1. Structure 14, 173-183 (2006). [8] Goldsbury, C., Mocanu, M., Thies, E., Kaether, C., Haass, C., Keller, P., Biernat, J., Mandelkow, E.-M., Mandelkow, E.: Inhibition of APP trafficking by tau protein does not increase the generation of amyloid-beta. Traffic 7, 873-888 (2006). [9] Pickhardt, M., Gazova, Z., von Bergen, M., Khlistunova, I., Wang, Y.-P., Hascher, A., Mandelkow, E.-M., Biernat, J., Mandelkow, E.: Anthraquinones inhibit tau aggregation and dissolve Alzheimer paired helical filaments in vitro and in cells. Journal of Biological Chemistry 280, 3628-3635 (2005). [10] Khlistunova, I., Biernat, J., Wang, Y.-P., Pickhardt, M., von Bergen, M., Gazova, Z., Mandelkow, E., Mandelkow, E.-M.: Inducible expression of tau in cell models of Alzheimer´s disease: Aggregation is toxic to cells but can be rescued by inhibitor drugs. Journal of Biological Chemistry 281, 1205-1214 (2006). 426 www.mpg.de © 2007 Max-Planck-Gesellschaft