Resektion zystischer Pankreastumoren
Werbung

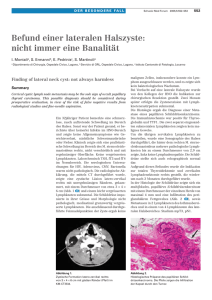
Der Gastroenterologe Zeitschrift für Gastroenterologie und Hepatologie Elektronischer Sonderdruck für J. Werner Ein Service von Springer Medizin Gastroenterologe 2014 · 9:31–37 · DOI 10.1007/s11377-013-0821-z © Springer-Verlag Berlin Heidelberg 2014 W. Hartwig · J. Werner Resektion zystischer Pankreastumoren Diese PDF-Datei darf ausschließlich für nichtkommerzielle Zwecke verwendet werden und ist nicht für die Einstellung in Repositorien vorgesehen – hierzu zählen auch soziale und wissenschaftliche Netzwerke und Austauschplattformen. www.DerGastroenterologe.springer.de Schwerpunkt: Chronische Pankreatitis und Pankreastumoren Gastroenterologe 2014 · 9:31–37 DOI 10.1007/s11377-013-0821-z Online publiziert: 17. Januar 2014 © Springer-Verlag Berlin Heidelberg 2014 Redaktion R. Jakobs, Ludwigshafen R. Schmid, München Hintergrund In den letzten Jahren hat die klinische Bedeutung von zystischen Pankreastumoren enorm zugenommen. Mit der Einführung und inzwischen weitverbreiteten Verfügbarkeit moderner Bildgebungsverfahren wie Multi-Slice-CT oder MRT werden heute viele zystische Pankreastumoren als Zufallsbefund entdeckt [25, 36]. Nach der Charakterisierung und Definition von intra­duktalen papillär-muzinösen Neoplasien (IPMNs) durch die WHO 1996 [17] gewannen diese Tumoren weltweit an Bedeutung und wurden in der Folge zunehmend diagnostiziert. Im Gegensatz zum duktalen Pankreaskarzinom, bei dem bei Diagnosestellung bereits mehr als 80% der Patienten aufgrund von Fernmetastasen oder lokaler Gefäßinfiltration inoperabel sind, stehen für die meist früh diagnostizierten zystischen Pankreastumoren eine Vielzahl von Therapieoptionen und chirurgischen Resektionsverfahren zur Verfügung, die in Pankreaszentren mit geringer Morbidität und Mortalität durchgeführt werden können [24]. Bis in die späten 80er Jahre wurden zystische Tumoren als eher seltene Tumorentität angesehen. In den letzten Jahren haben jedoch Autopsiestudien, CTUntersuchungsserien und große chirurgische Fallserien gezeigt, dass zystische Neoplasien inklusive IPMNs und MCNs sehr viel häufiger vorkommen als bislang angenommen. Mittlerweile machen zystische Tumoren in chirurgischen Pankreaszentren etwa 10–30% aller chirurgischen Resektionen aus [7, 36]. Es wird vermutet, dass etwa 2–3% der Gesamtbevölkerung zystische Pankreasneoplasien/-tumoren aufweisen. In einer kürzlich von der Johns W. Hartwig · J. Werner Klinik für Allgemeine, Viszeral- und Transplantationschirurgie, ­ Ludwig-Maximilians-Universität München Resektion zystischer Pankreastumoren Hopkins University publizierten Studie zeigten 73 (2,6%) von 2832 Personen ohne pankreasspezifische Symptome bei einer abdominellen CT-Untersuchung Zysten des Pankreas [19]. Bei der Auswertung der Daten fand sich eine strenge Korrelation zwischen dem Alter der Patienten und der Prävalenz einer zystischen Pankreasläsion. So konnte in der Gruppe der bis zu 40-Jährigen keine einzige Zyste diagnostiziert werden, während in der Gruppe der 80- bis 89-Jährigen in 8,7% der Fälle eine zystische Pankreasläsion gefunden wurde. In einer ähnlichen Studie zeigten sich in der MRT in 2,4% der Fälle unerwartet Zysten in der Bauchspeicheldrüse­ [6]. ­Diese Zahlen zeigen, welche große Relevanz zystische Pankreastumoren in Zukunft im klinischen Alltag haben werden, insbesondere auch im Hinblick auf die zu erwartende Altersstruktur in den west­ lichen Industriestaaten. Malignitätspotenzial und Operationsindikation Seröse zystische Tumoren Das Malignitätspotenzial von zystischen Tumoren ist sehr unterschiedlich. Seröse zystische Tumoren (SCN) entarten praktisch nie maligne und sollten somit nur bei Symptomen (Schmerz, Passagestörung, etc.) reseziert werden. SCN ­sitzen vermehrt im Pankreaskorpus und ­-schwanz (ca. 70%). Sie sind häufiger bei Frauen (80–90%) im höheren Lebensalter (>60 Jahre) zu beobachten [22]. Da das Wachstum seröser Zysten von der Größe abhängt, wird allgemein empfohlen, seröse zystische Neoplasien ab einer Größe von ca. 4 cm Durchmesser zu resezieren ([22]; . Abb. 1). Muzinöse zystische Neoplasien Im Gegensatz zu den serösen zystischen Neoplasien entarten muzinöse zystische Neoplasien (MCN) häufig und sollten somit in der Regel reseziert werden [7, 32, 36]. MCN sind ebenfalls vor allem im Pankreasschwanz lokalisiert (65–95%), werden im mittleren Lebensalter (50– 70 Jahre) diagnostiziert. » Muzinöse zystische Neoplasien entarten häufig und sollten in der Regel reseziert werden Sie sind multilobuläre Tumoren mit einer dicken Zystenwand, die histologisch durch das Vorhandensein von ovariellem Stroma charakterisiert sind [7, 25, 32]. Deshalb sind auch nur Frauen betroffen. Die Malignitätsrate ist mit 30–50% hoch, so dass alle MCNs reseziert werden sollten [7, 32]. Solide pseudopapilläre Neoplasien Solide pseudopapilläre Neoplasien (SPN) werden in der Regel bei jungen Frauen diagnostiziert. Oft handelt es sich um Zufallsbefunde im Rahmen von diagnostischen Abklärungen eines Bagatelltraumas. Während eine Lymphknotenmetastasierung sehr selten auftritt, sind in bis zu 5% der Fälle Leberfiliae synchron oder metachron zu diagnostizieren. SPN sollten aufgrund ihrer exzellenten LangzeitDer Gastroenterologe 1 · 2014 | 31 Schwerpunkt: Chronische Pankreatitis und Pankreastumoren Abb. 1 8 Seröses Zystadenom. a CT einer Patientin mit einem großen serös-zystischen Tumor im Pankreaskopf (9 cm) mit Passagestörung. b Intraoperativer Situs. Das Pankreaskorpus ist auf der Pfortaderebene (Resektionsebene) mit einem Zügel untertunnelt (Pfeil). Pankreaskopf (Stern) und Duodenum sind mobilisiert. c Pankreaskopfresektat mit einem durch die Zyste komprimierten Duodenum (Pfeil). d Pathognomonische Zeichen: klar umschriebene, multinoduläre, polyzystische Neoplasie mit zentraler Verkalkung prognose immer, auch im metasasierten Stadium, reseziert werden [33]. Intraduktale papillär-muzinöse Neoplasien In den meisten Fällen werden intraduktale papillär-muzinöse Neoplasien (IPMNs) bei Patienten diagnostiziert, die ­älter als 60 Jahre sind. Eine Reihe von Autoren berichtete über einen Altersunterschied von etwa 5 Jahren zwischen Patienten, bei denen benigne IPMNs mit lediglich niedriggradigen oder mäßiggradigen Epitheldysplasien diagnostiziert wurden, und Patienten mit IPMNs, die Areale mit hochgradigen Epitheldysplasien oder sogar Anteilen eines invasiven Karzinoms aufwiesen [26, 36]. Aus diesen Daten wird indirekt gefolgert, dass mit der Zeit eine Progression von gutartigen zystischen Läsionen hin zum invasiven Karzinom stattfindet. Bis heute ist jedoch nicht bekannt, ob alle IPMNs, insbesondere auch kleine Seitengangs-IPMNs, das Potenzial für eine solche neoplastische Transformation aufweisen, wie der Zeitablauf dieser Entwicklung aussieht und welche Prozesse dabei auf zellulärer und molekularer Ebene stattfinden. 32 | Der Gastroenterologe 1 · 2014 Es wird heute davon ausgegangen, dass IPMNs Vorstufen darstellen, die mit der Zeit maligne entarten können. In etwa 30% aller chirurgisch resezierten IPMNs findet man histologisch Anteile eines invasiv wachsenden Adenokarzinoms, das auf dem Boden der zystischen Läsion entstanden ist [2]. Während resezierte Seitengangs-IPMNs zu etwa 6–46% histologisch maligne Merkmale aufweisen, liegt das Malignitätsrisiko bei Hauptgangs-IPMNs bei 57–92% [31, 32]. Neuere Studien haben gezeigt, dass sich im Verlauf über 3–5 Jahre auch aus kleinen SeitengangsIPMNs Karzinome entwickeln können [11, 16, 20, 27, 28]. Diese Entwicklung ist prinzipiell vergleichbar mit der AdenomKarzinom-Sequenz, wie sie von Kolonpolypen bekannt ist. Im Gegensatz zu früheren Berichten, nach denen das Malignitätsrisiko von Seitengangs-IPMNs mit der Größe zunimmt, wurde in den letzten Jahren von verschiedenen Forschungsgruppen festgestellt, dass die Größe der Läsion nicht mit der Prävalenz eines Karzinoms korreliert [11, 28, 29], so dass die ursprünglichen Sendai-Kriterien mit dem Cut-off-Durchmesser von 3 cm inzwischen als obsolet gelten [28, 32, 36]. Die therapeutischen Richtlinien für IPMNs haben sich in den letzten 20 Jahren grundlegend gewandelt. Während vor dem Hintergrund ihres malignen Potenzials bis in die 90er Jahre die chirurgische Resektion aller IPMNs empfohlen wurde, richten sich heute die meisten Chirurgen weltweit nach den sog. Sendai-Kriterien, die aufgrund neuer Erkenntnisse vor kurzem in den USA und Europa modifiziert wurden [7, 11, 31, 32, 36]. Hiernach werden alle Hauptgangs-IPMNs und Mischtypen als prämaligne Läsionen eingestuft und sollten dementsprechend immer chirurgisch reseziert werden. Im Gegensatz hierzu ist das Vorgehen bei Seitengangs-IPMNs derzeit umstritten. Nach den Sendai-Kriterien können Seitengangs-IPMNs dann konservativ behandelt werden, wenn sie einen Durchmesser von weniger als 3 cm aufweisen, asymptomatisch sind und keine als morphologische Risikobefunde einer malignen Entartung eingeschätzten Befunde wie wandständige Knoten, eine Dilatation des Pankreashauptgangs oder eine negative Zytologie aufweisen [31, 32]. In den letzten Jahren wurden jedoch mehrere Fallserien publiziert, die zeigen, dass auch kleine Seitengangs-IPMNs ein signifikantes Malignitätsrisiko aufweisen und dass keine Korrelation zwischen den sog. Risikofaktoren (Symptomen, Größe etc.) und maligner Entartung besteht [11, 15, 25, 28]. Das Auftreten von wandständigen Knoten in IPMNs korreliert gut mit dem Malignitätsrisiko, allerdings bestehen auch bei Zysten ohne präoperativ nachweisbaren Knoten bereits in 10–20% der Fälle bereits maligne Transformationen. Es kann somit bei Fehlen von Knoten nicht geschlussfolgert werden, dass die Zyste auf jeden Fall gutartig ist [15]. Insgesamt zeigen viele Publikationen der letzten Jahre, dass keines der Sendai-Kriterien für Seitengangs-IPMNs sicher Malignität ausschließen kann. Derzeit stehen auch keine anderen morphologischen, zytologischen oder molekularen Prognosemarker zur Verfügung, die eine höhere Sicherheit bei der präoperativen Einschätzung der Dignität der Seitengangs-IPMNs erlauben. Somit empfehlen wir eine Verlaufsbeobachtung von Seitengangs-IPMNs nur dann, wenn sie kleiner als 1–1,5 cm Durchmesser aufweisen und Zusammenfassung · Abstract natürlich immer dann, wenn der Patient aufgrund relevanter Komorbidität (z. B. kardial oder pulmonal) ein entsprechend erhöhtes Operationsrisiko aufweist. Es ist sicherlich auch entscheidend, das Alter des Patienten zu berücksichtigen, da die Tumorprogression bei IPMNs insgesamt eher als langsam einzuschätzen ist, so dass bei fortgeschrittenem Lebensalter auf eine Resektion kleiner IPMNs primär verzichtet werden sollte und der Verlauf beobachtet werden kann [11, 36]. Eine Alternative bieten die neuerdings möglichen funktions- und organerhaltenden minimalinvasiven Eingriffe für Seitengangs-IPMNs [12]. Präoperative Abklärung Gerade bei den zystischen Pankreastumoren kommt der ausführlichen Anamnese eine wichtige Bedeutung zu. Pankreatitisassoziierte Pseudozysten repräsentieren insgesamt die häufigsten Pankreaszysten und stellen in der Regel keine Operationsindikation dar. Entscheidend für das weitere Vorgehen ist, ob der Patient Beschwerden hat (z. B. Schmerzen, Passagestörungen, B-Symtomatik) oder ob Anzeichen für eine exokrine (z. B. Fettstühle, Gewichtsverlust) oder endokrine Pankreasinsuffizienz (bestehender oder neu aufgetretener Diabetes mellitus) vorliegen [7, 32]. Für die präoperative diagnostische Abkärung spielen heute CT und MRT bzw. MRCP (MR-Cholangiopankreatikographie) die größte Rolle [25]. Wichtig ist es, zwischen Hauptgangs- und SeitengangsIPMNs zu unterscheiden, sowie malignitätsverdächtige Risikokonstellationen wie z. B. Wandverdickungen, wandständige Knoten oder Lymphknotenvergrößerungen zu diagnostizieren. Die morphologische Unterscheidung zwischen Hauptgangs-IPMNs und Seitengangs-IPMNs spielt eine entscheidende Rolle, da ihr jeweiliges Malignitätsrisiko unterschiedlich ist [31, 32]. Für die Unterscheidung dieser beiden Subtypen eignet sich insbesondere die MRCP [34]. SeitengangsIPMNs stellen sich in der Schnittbildgebung als zystische Pankreastumoren mit Verbindung zum Pankreashauptgang dar, jedoch ohne Dilatation desselben (Durchmesser <6 mm). Hauptgangs-IPMNs da- 34 | Der Gastroenterologe 1 · 2014 Gastroenterologe 2014 · 9:31–37 DOI 10.1007/s11377-013-0821-z © Springer-Verlag Berlin Heidelberg 2014 W. Hartwig · J. Werner Resektion zystischer Pankreastumoren Zusammenfassung Zystische Läsionen des Pankreas werden heute aufgrund des steigenden Lebensalters und moderner Schnittbildverfahren zunehmend häufig diagnostiziert. Intraduktale papillärmuzinöse Neoplasien (IPMN), muzinöse zystische Neoplasien (MCN), solide pseudopapilläre Neoplasien (SPN) sowie seröse zystische Neoplasien (SCN) machen insgesamt über 90% der zystischen Neoplasien aus. Während seröse Zysten ein geringes Malignitätspotenzial haben und somit nur bei Symptomen reseziert werden sollten, haben alle muzinösen Neoplasien ein erhöhtes Malignitätspotenzial, das eine Resektion in der Regel erforderlich macht. Nur bei IPMNs wird diese klare Indikation zur Resektion differenziert diskutiert. IPMNs können eine Vielzahl von morphologischen Variationen aufweisen und gehen entweder vom Pankreashauptgang, von seinen größeren Seitenästen oder von beidem aus (sog. Mischtyp). Bis heute ist allerdings nicht bekannt, ob alle IPMNs das Potenzial zur neoplastischen Transformation besitzen und wie der zeitliche Ablauf einer solchen Entwick- lung aussieht. Aufgrund der heute fehlenden sicheren Differenzierung zwischen benignen und malignen IPMNs ist für die Mehrzahl aller neu diagnostizierten Tumoren eine chirurgische Resektion indiziert. Gemäß den aktuellen Therapieempfehlungen (Sendai-Kriterien) kann jedoch bei asymptomatischen Seitengangs-IPMNs mit weniger als 2–3 cm Durchmesser ohne Risikofaktoren wie Knoten, Wandverdickungen und ohne Anhalt für Größenprogression beobachtet und auf eine Resektion verzichtet werden. Allerdings sind diese Therapierichtlinien in den letzten Jahren zunehmend kritisch bewertet worden, da auch sog. Sendai-negative IPMNs nach histologischer Aufarbeitung bereits in vielen Fällen Zeichen einer malignen Transformation aufweisen. Schlüsselwörter Intraduktale papillär-muzinöse Neoplasien · Operationsindikationen · Chirurgische Therapie · Operationsstrategien · Sendai-Kriterien Surgical resection of cystic tumors of the pancreas Abstract Cystic tumors of the pancreas are diagnosed increasingly more due to increasing life expectancy and the moderate use of modern radiological diagnostics. Intraductal papillary mucinous neoplasms of the pancreas (IPMN), mucinous cystic neoplasms (MCN), solid pseudopapillary neoplasms (SPN) and serous cystic neoplasms (SCN) represent over 90% of all cystic neoplasms of the pancreas. Although serous cystic lesions have a low or even no potential for malignant transformation, they are mostly resected when symptomatic. In contrast, mucinous lesions have an increased malignant potential and should therefore be resected in almost all cases. While this is true for all cases of MCNs and SPNs this is controversial for all IPMNs as they show a wide spectrum of morphological variants. The IPMNs may arise in the main pancreatic duct, major side branches or in both (mixed type). Although all IPMNs are considered to be precursor lesions to pancreatic adenocarcinomas it is not clear what gegen sind gekennzeichnet durch eine Erweiterung des Pankreasgangs auf mehr als 6 mm Durchmesser [7, 31, 32]. the time course of such potential neoplastic transformation might be and whether all lesions progress to malignant tumors. As no currently used diagnostic test can reliably differentiate between benign and malignant tumors, the majority of newly diagnosed IPMNs should undergo surgical resection. According to current treatment guidelines (Sendai criteria), asymptomatic side branch IPMNs of less than 3 cm in diameter without suspicious radiological features, such as nodules, thickness of the cystic wall or size progression can be treated conservatively without the need for surgical resection. Recently, this approach has become controversial due to a relevant number of IPMNs reported as Sendai negative that showed malignant transformation on final histological examination. Keywords Intraductal papillary mucinous neoplasm · Indications for surgery · Surgical treatment · Surgical strategies · Sendai criteria In Ergänzung zur Schnittbildgebung mittels CT und MRT kann auch eine Endosonographie (endoskopischer Ultra- Abb. 2 8 Patient mit ausgedehnter intraduktaler papillär-muzinöser Neoplasie (Hauptgangs-IPMN). a MRT eines 67-jährigen Patienten ausgedehnter IPMN, welche die gesamte Bauchspeicheldrüse einnimmt. b Resektionspräparat nach totaler Pankreatektomie und Splenektomie. c Eröffnetes Operationspräparat; invasiv wachsende Hauptgangs-IPMN vom kolloidalen Typ: pT2, pN0 (0/38), G2, R0 Abb. 3 9 Enukleation einer Seitengangs-IPMN, histopathologisch: High-Grade-Dysplasie (IPMN intraduktale papillär-muzinöse Neoplasie) schall, EUS) durchgeführt werden. Mithilfe des EUS kann ein erfahrener Untersucher auch kleine Strukturen wie wandständige Knoten oder kleine Unregelmäßigkeiten des Pankreasgangs in hoher lokaler Auflösung darstellen [18]. Dennoch gelingt es auch an hochspezialisierten Zentren mit modernster bildgebender Technik nicht immer, die korrekte Diagnose präoperativ zu stellen (ca. 20%) [5]. Der Zystenflüssigkeitsanalyse nach Feinnadelaspiration kommt derzeit keine wesentliche Bedeutung zu, da zum einen auch bei Vorliegen einer negativen Zytologie ein Karzinom nicht sicher auszuschließen ist [21], zum anderen auch die Tumormarker CEA und CA 19-9 nicht helfen, um zwischen benignen und malignen IPMNs zu unterscheiden. Ein erhöhter CEA-Wert beispielsweise liefert lediglich einen Hinweis, dass es sich eher um eine muzinöse zystische Läsion handelt als um eine seröse Zyste oder Pseudozyste [10, 21, 36]. Operationsstrategie und perioperative Ergebnisse Die chirurgische Resektion verfolgt 3 Ziele: F Behandlung klinischer Symptome, F Entfernung maligner Tumoren in einem Stadium, in dem noch keine Metastasierung stattgefunden hat, F prophylaktische Resektion benigner Läsionen, bevor es zu einer neoplastischen Transformation gekommen ist. Lediglich bei den serösen zystischen Tumoren wie dem serösen Zystadenom ist eine onkologische Resektion wegen des fehlenden Malignitätspotenzials nicht notwendigerweise durchzuführen und eine Lymphknotendissektion muss nicht erfolgen. Auch ist in diesen Fällen ggf. eine Segmentresektion oder der Milzerhalt möglich [36]. In der Regel sollte bei dem präoperativen Verdacht auf ein MCN, SPN oder IPMN eine onkologische Resektion mit systematischer Lymphadenektomie gemäß den operativen Leitlinien zur Therapie des Pankreaskarzinoms durchge- führt werden [1]. In den meisten Fällen ist dies durch eine Whipple-Operation oder durch eine Pankreaslinksresektion mit Splenektomie möglich [13]. Handelt es sich um ausgedehnte zystische Tumoren, die das gesamte Pankreas betreffen (. Abb. 2), so ist eine totale En-blocPankreatektomie mit Splenektomie indiziert. Bei lokal fortgeschrittenen, invasiv wachsenden Tumoren kann eine erweiterte Resektion bis hin zur Multiviszeralresektion indiziert sein, um eine R0-Resektion und damit eine gute Chance auf Kuration zu erreichen [3]. Bei kleinen Seitengangs-IPMNs mit einem Durchmesser von weniger als 2 cm, bei denen kein Malignitätsverdacht besteht, können unserer Auffassung nach lokale Resektionsverfahren zur Anwendung kommen. Da das Malignitätsrisiko dieser Zysten als gering einzuschätzen ist, kann in solchen Fällen eine Pankreassegmentresektion oder eine Enukleation (. Abb. 3) in Betracht gezogen werden. Ziel ist es hier auch, den Tumor komplett, im Sinne einer R0-Resektion, zu entfernen. Der Vorteil von limitierten Resektionen ist zum einen die geringere Mortalität im Vergleich zu den formal onkologischen Resektionen, zum anderen kann dadurch mehr funktionelles Pankreasgewebe erhalten werden [12]. In der Literatur wird beschrieben, dass auch nach R0-Resektion von benignen IPMNs nach Jahren eine maligne Transformation im Restpankreas auftreten kann [4]. Diese Berichte sprechen eher dafür, dass eine metachrone neoplastische Transformation im Restpankreas auftritt als am Absetzungsrand selbst. In unserer Klinik wird daher bei AbsetzungsDer Gastroenterologe 1 · 2014 | 35 Schwerpunkt: Chronische Pankreatitis und Pankreastumoren rändern, die niedriggradige Epitheldysplasien nachweisen, nicht nachreseziert, während bei hochgradiger Epitheldysplasie nachreseziert wird. Hierbei ist auch zu berücksichtigen, dass sich die Prognose fortgeschrittener IPMN-assoziierter Karzinome nicht von der Prognose eines duktalen Pankreaskarzinoms unterscheidet, so dass die Rezidivgefahr bzw. das Auftreten von Zweittumoren und ggf. -karzinomen vor allem bei den präneoplastischen und Frühkarzinomen berücksichtigt werden muss [23]. Prognose und Langzeitverlauf Die Prognose von Patienten mit chirurgisch resezierten benignen bzw. prämalignen zystischen Tumoren ist für MCNs, SPNs sowie alle Formen der IPMNs exzellent, mit einer krankheitsspezifischen 10-Jahres-Überlebensrate von mehr als 95%. Invasive MCNs haben eine deutlich bessere Prognose als invasiv wachsende Pankreaskarzinome [7, 32] Werden invasiv wachsende IPMNs in einem frühen Stadium (T1N0) diagnostiziert und reseziert, so liegt die 5-Jahres-Überlebensrate noch bei etwa 40% [9]. Diese Rate ist signifikant höher im Vergleich zur 5-Jahres-Überlebensrate von etwa 20% in Patienten, die in kurativer Absicht an einem duktalen Adenokarzinom des Pankreas operiert wurden. Vergleicht man dagegen fortgeschrittene Tumorstadien (>T2 oder lymphknotenpositiv), so findet sich kein signifikanter Unterschied mehr [23]. Da heutzutage Pankreasresektionen bei IPMNs mit einer geringen Mortalität von weniger als 1% durchgeführt werden können [24], stellt die frühzeitige prophylaktische Resektion eine Möglichkeit dar, der Entwicklung eines Pankreaskarzinoms zuvorzukommen. Dies gilt auch für Seitengangs-IPMNs, die zwar insgesamt ein geringeres Entartungsrisiko (ca. 25%) aufweisen, bei denen dafür aber auch in vielen Fällen limitierte Resektionen durchgeführt werden können [11, 32, 36]. Seit der Einführung der Sendai-Kriterien wurden einige Langzeit-Verlaufsbeobachtungsstudien von SeitengangsIPMNs durchgeführt. Die meisten Studien weisen eine Progressionsrate von etwa 20% über 10 Jahre auf [20, 27]. In ein- 36 | Der Gastroenterologe 1 · 2014 zelnen Serien wird sogar von einer Progressionsrate von bis zu 45% über 5 Jahre berichtet [16]. Trotz engmaschiger Verlaufskontrollen waren darunter auch Patienten, die zum Zeitpunkt der Diagnose des Karzinoms bereits inoperabel waren. Dies zeigt, dass auch mit modernster Bildgebung, regelmäßigen Nachsorgeuntersuchungen und selbst bei guter Compliance des Patienten die Beobachtung bekannter Läsionen nicht sicher ist und daher gerade bei jungen und ansonsten gesunden Menschen frühzeitig die Indikation zur Pankreasresektion gestellt werden sollte. Fazit für die Praxis F Mit der modernen Schnittbildgebung hat die Diagnose von zystischen Tumoren des Pankreas stark zugenommen. F Es ist nachgewiesen, dass die meisten muzinösen Tumoren inkl. MCN, SPN, Hauptgangs-IPMNs wie auch Seitengangs-IPMNs Präkanzerosen darstellen die somit in der Regel chirurgisch reseziert werden sollten. F Limitierte minimalinvasive Resektionsstrategien ermöglichen bei kleineren Zysten eine zuverlässige Diagnostik mit guten funktionellen Ergebnissen und niedriger perioperativer Morbidität. Lediglich seröse zystische Neoplasien des Pankreas sind aufgrund ihres fehlenden malignen Potenzials nur bei Symptomen oder starker Größenzunahme zu resezieren. Korrespondenzadresse Prof. Dr. J. Werner Klinik für Allgemeine, Viszeral- und Transplantationschirurgie, Ludwig-Maximilians-Universität München Marchioninistr. 15, 81377 München [email protected] Einhaltung ethischer Richtlinien Interessenkonflikt. W. Hartwig und J. Werner geben an, dass kein Interessenkonflikt besteht. Dieser Beitrag beinhaltet keine Studien an Menschen oder Tieren. Literatur 1. Adler G, Seufferlein T, Bischoff SC et al (2007) S3Guidelines „Exocrine pancreatic cancer“ 2007. Z Gastroenterol 45: 487–523 2. Basturk O, Coban I, Adsay NV (2009) Pancreatic cysts: pathologic classification, differential diagnosis, and clinical implications. Arch Pathol Lab Med 133: 423–438 3. Butturini G, Pisano M, Scarpa A et al (2011) Aggressive approach to acinar cell carcinoma of the pancreas: a single-institution experience and a literature review. Langenbecks Arch Surg 396: 363–369 4. Chari ST, Yadav D, Smyrk TC et al (2002) Study of recurrence after surgical resection of intraductal papillary mucinous neoplasm of the pancreas. Gastroenterology 123: 1500–1507 5. Correa-Gallego C, Ferrone CR, Thayer SP et al (2010) Incidental pancreatic cysts: do we really know what we are watching? Pancreatology 10: 144–150 6. Jong K de, Nio CY, Hermans JJ et al (2010) High prevalence of pancreatic cysts detected by screening magnetic resonance imaging examinations. Clin Gastroenterol Hepatol 8: 806–811 7. Del Chiaro M, Verbeke C, Salvia R et al (2013) European experts consensus statement on cystic tumours of the pancreas. Dig Liver Dis 45: 703–711 8. Eguchi H, Ishikawa O, Ohigashi H et al (2006) Patients with pancreatic intraductal papillary mucinous neoplasms are at high risk of colorectal cancer development. Surgery 139: 749–754 9. Fernandez-del Castillo C, Adsay NV (2010) Intraductal papillary mucinous neoplasms of the pancreas. Gastroenterology 139: 708–713 10. Fritz S, Hackert T, Hinz U et al (2011) Role of serum carbohydrate antigen 19-9 and carcinoembryonic antigen in distinguishing between benign and invasive intraductal papillary mucinous neoplasm of the pancreas. Br J Surg 98: 104–110 11. Fritz S, Klauss M, Bergmann F et al (2012) Small (Sendai negative) branch-duct IPMNs: not harmless. Ann Surg 256: 313–320 12. Hackert T, Hinz U, Fritz S et al (2011) Enucleation in pancreatic surgery: indications, technique, and outcome compared to standard pancreatic resections. Langenbecks Arch Surg 396: 1197–1203 13. Hwang DW, Jang JY, Lee SE et al (2010) Clinicopathologic analysis of surgically proven intraductal papillary mucinous neoplasms of the pancreas in SNUH: a 15-year experience at a single academic institution. Langenbecks Arch Surg 14. Ingkakul T, Sadakari Y, Ienaga J et al (2010) Predictors of the presence of concomitant invasive ductal carcinoma in intraductal papillary mucinous neoplasm of the pancreas. Ann Surg 251: 70–75 15. Jang JY, Kim SW, Lee SE et al (2008) Treatment guidelines for branch duct type intraductal papillary mucinous neoplasms of the pancreas: when can we operate or observe? Ann Surg Oncol 15: 199– 205 16. Kang MJ, Jang JY, Kim SJ et al (2011) Cyst growth rate predicts malignancy in patients with branch duct intraductal papillary mucinous neoplasms. Clin Gastroenterol Hepatol 9: 87–93 17. Kloppel G, Solcia E, Longnecker DS, Sobin LH (1996) Histological typing of tumours of the exocrine pancreas. In: World Health Organization (Hrsg) International histological classification of tumours, 2. Aufl. Springer, Berlin, S 15–21 Lesetipp 18. Kubo H, Chijiiwa Y, Akahoshi K et al (2001) Intraductal papillary-mucinous tumors of the pancreas: differential diagnosis between benign and malignant tumors by endoscopic ultrasonography. Am J Gastroenterol 96: 1429–1434 19. Laffan TA, Horton KM, Klein AP et al (2008) Prevalence of unsuspected pancreatic cysts on MDCT. AJR Am J Roentgenol 191: 802–807 20. Maguchi H, Tanno S, Mizuno N et al (2011) Natural history of branch duct intraductal papillary mucinous neoplasms of the pancreas: a multicenter study in Japan. Pancreas 40: 364–370 21. Maker AV, Lee LS, Raut CP et al (2008) Cytology from pancreatic cysts has marginal utility in surgical decision-making. Ann Surg Oncol 15: 3187– 3192 22. Matsumoto T, Hirano S, Yada K et al (2005) Malignant serous cystic neoplasm of the pancreas: report of a case and review of the literature. J Clin Gastroenterol 39: 253–256 23. Poultsides GA, Reddy S, Cameron JL et al (2010) Histopathologic basis for the favorable survival after resection of intraductal papillary mucinous neoplasm-associated invasive adenocarcinoma of the pancreas. Ann Surg 251: 470–476 24. Rodriguez JR, Salvia R, Crippa S et al (2007) Branch-duct intraductal papillary mucinous neoplasms: observations in 145 patients who underwent resection. Gastroenterology 133: 72–79 25. Sahani DV, Shah ZK, Catalano OA et al (2008) Radiology of pancreatic adenocarcinoma: current status of imaging. J Gastroenterol Hepatol 23: 23– 33 26. Salvia R, Fernandez-del Castillo C, Bassi C et al (2004) Main-duct intraductal papillary mucinous neoplasms of the pancreas: clinical predictors of malignancy and long-term survival following resection. Ann Surg 239: 678–685 (discussion 685– 677) 27. Sawai Y, Yamao K, Bhatia V et al (2010) Development of pancreatic cancers during long-term follow-up of side-branch intraductal papillary mucinous neoplasms. Endoscopy 42: 1077–1084 28. Schmidt CM, White PB, Waters JA et al (2007) Intraductal papillary mucinous neoplasms: predictors of malignant and invasive pathology. Ann Surg 246: 644–651 (discussion 651–644) 29. Schnelldorfer T, Sarr MG, Nagorney DM et al (2008) Experience with 208 resections for intraductal papillary mucinous neoplasm of the pancreas. Arch Surg 143: 639–646 (discussion 646) 30. Steger U, Range P, Mayer F et al (2010) Pancreatic duct anatomy in the corpus area: implications for closure and anastomotic technique in pancreas surgery. Langenbecks Arch Surg 395: 201–206 31. Tanaka M, Chari S, Adsay V et al (2006) International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology 6: 17–32 32. Tanaka M, Fernández-del Castillo C, Adsay V et al (2012) International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas. Pancreatology 12: 183–197 33. Vassos N, Agaimy A, Klein P et al (2013) Solidpseudopapillary neoplasm (SPN) of the pancreas: case series and literature review on an enigmatic entity. Int J Clin Exp Pathol 6: 1051–1059 34. Waters JA, Schmidt CM, Pinchot JW et al (2008) CT vs MRCP: optimal classification of IPMN type and extent. J Gastrointest Surg 12: 101–109 35. Weinberg BM, Spiegel BM, Tomlinson JS, Farrell JJ (2010) Asymptomatic pancreatic cystic neoplasms: maximizing survival and quality of life using Markov-based clinical nomograms. Gastroenterology 138: 531–540 36. Werner J, Fritz S, Büchler MW (2012) Intraductal papillary mucinous neoplasms of the pancreas – a surgical disease. Nat Rev Gastroenterol Hepatol 9: 253–259 Magenkarzinom In Deutschland erkranken jährlich ca. 15.000 Frauen und Männer an einem Magenkarzinom, weltweit sind es fast 1 Mio. Die Aussicht auf Überleben ist vergleichsweise schlecht. Nur ca. ein Viertel aller Patienten überlebt 5 Jahre nach Diagnosestellung. In den vergangenen Jahren hat sich in der Diagnostik und Therapie des Magenkarzinoms besonders viel bewegt und neue wissenschaftliche Erkenntnisse lassen auf eine baldige Besserung der Therapieergebnisse hoffen. Aktuelle Entwicklungen werden in der Zeitschrift Der Onkologe 5/2013 mit unter anderem folgenden Themen vorgestellt: 5 Frühe Karzinome des Magens und ösophagogastralen Übergangs 5 Pathologie des ösophagogastralen Adenokarzinoms 5 Adenokarzinome des Magens und gastroösophagealen Übergangs 5 Chirurgische Therapie von Magenkarzinomen und Adenokarzinomen des ösophagogastralen Übergangs 5 Therapie des fortgeschrittenen Magenkarzinoms 5 Prä- und postoperative Ernährungstherapie beim Magenkarzinom Kommentieren Sie diesen Beitrag auf springermedizin.de 7 Geben Sie hierzu den Bei- tragstitel in die Suche ein und nutzen Sie anschließend die Kommentarfunktion am Beitragsende. Bestellen Sie diese Ausgabe zum Preis von 36 EUR zzgl. Versandkosten bei Springer Customer Service Center Kundenservice Zeitschriften Haberstr. 7 69126 Heidelberg Tel.: +49 6221-345-4303 Fax: +49 6221-345-4229 E-Mail: [email protected] Suchen Sie noch mehr zum Thema? Mit e.Med, dem Online-Paket von Springer Medizin, können Sie schnell und komfortabel in über 500 medizinischen Fachzeitschriften recherchieren. Weitere Infos unter springermedizin.de/eMed. Der Gastroenterologe 1 · 2014 | 37