2008-WHO-Klassifikation der malignen Lymphome im Jahr 2011.
Werbung

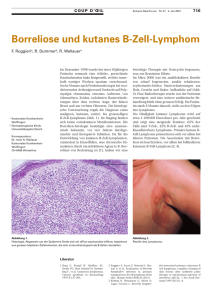
Der Onkologe Organ der Deutschen Krebsgesellschaft e.V. Elektronischer Sonderdruck für H. Stein Ein Service von Springer Medizin Onkologe 2011 · 17:769–788 · DOI 10.1007/s00761-011-2126-5 © Springer-Verlag 2011 zur nichtkommerziellen Nutzung auf der privaten Homepage und Institutssite des Autors H. Dürkop · H.-D. Foss · H. Stein 2008-WHO-Klassifikation der malignen Lymphome im Jahr 2011 Neue Erkenntnisse und praktische Anwendung www.DerOnkologe.de Leitthema Onkologe 2011 · 17:769–788 DOI 10.1007/s00761-011-2126-5 © Springer-Verlag 2011 H. Dürkop · H.-D. Foss · H. Stein Berliner Referenz- und Konsultationszentrum für Lymphom- und Hämatopathologie am Institut für Pathodiagnostik Berlin 2008-WHO-Klassifikation der malignen Lymphome im Jahr 2011 Neue Erkenntnisse und praktische Anwendung Die vorliegende Übersicht beschäftigt sich mit neuen Definitionen und Präzisierung von diagnostischen Kriterien, neuen Entitäten und Kategorien, Vorläufer- bzw. frühen Läsionen, krankheitsdefinierenden klinischen Merkmalen sowie provisorischen Grauzonenlymphomen und folgt damit weitgehend dem kürzlich in der Zeitschrift Blood von dem WHO-Editoren-Team publizierten Review über die 2008-Klassifikation der lymphatischen Neoplasien [9]. Klassifikationen von Krankheiten sind die Sprache der Medizin. Die WHO-Klassifikation von lymphatischen und hämatopoietischen Neoplasien – publiziert 2001 und aktualisiert 2008 – repräsentiert einen weltweiten Konsensus, zu dem Pathologen, Kliniker und Grundlagenwissenschaftler beigetragen haben [79]. Das vornehmliche Prinzip der WHO-Klassifikation ist die Erkennung von gut definierten Krankheiten unter Heranziehung morphologischer, immunphänotypischer, genetischer, molekularer und klinischer Merkmale. Die Lymphomentitäten werden – soweit möglich – nach ihrer zellulären Herkunft und zusätzlich nach ihrer Ableitung von Vorläuferzellen und reifen Zellen geordnet. Dieses Prinzip hatte ursprünglich die „International Lymphoma Study Group“ für die Etablierung der Revised European-American Lymphoma Classification (REAL) entworfen [32]. Umfangreiche Studien an großen Serien von Tumoren aus verschiedenen Teilen unseres Erdballs [1] bestätigten die praktische Anwendbarkeit, die Reproduzierbarkeit und die klinische Bedeutung dieses Klassifikationsprinzips. Damit endete der lange Meinungsstreit über die Klassifikation von Lymphomen [38]. Neue Definitionen und Präzisierung von diagnostischen Kriterien Die 2008 vorgenommene Aktualisierung der WHO-Klassifikation hat Konsensusrichtlinien und Empfehlungen für die Definition einiger gut etablierter Lymphomentitäten übernommen. Diese betreffen die lymphoblastischen Vorläuferzelllymphome, die chronische lymphatische Leukämie (CLL; [30]), das lymphoplasmozytische Lymphom (LPL), die Waldenström-Makroglobulinämie (WM; [56]), die Kategorien des Plasmozytoms/ Plasmazellmyeloms [15] sowie die kutanen Lymphome [43, 85]. Das Grading der follikulären Lymphome wurde revidiert. Die Definition einiger T-Zelllymphome wurde präzisiert einschließlich des enteropathie­assoziierten T-Zell-Lymphoms, des anaplastischen großzelligen Lymphoms (ALCL) und des subkutanen pannikulitisartigen T-Zell-Lymphoms. Lymphoblastische Leukämien/ Lymphome (LBL) Konventionell morphologisch und immunhistologisch bilden die LBL der BZell-Reihe (B-LBL) und der T-Zell-Reihe (T-LBL) jeweils eine weitgehend homogene Gruppe. Neu in der 2008-WHO-Klassifikation ist die Unterteilung der LBL vom B-Zell-Typ in zwei Subgruppen: BLBL, nicht weiter spezifiziert (NOS) und in B-LBL mit rekurrenten genetischen Anomalien [79]. Bei dem B-LBL mit rekurrenten genetischen Anomalien können 7 genetische Subtypen voneinander abgegrenzt werden (. Tab. 1), die sich auch im klinischen Verlauf unterscheiden. In der Vergangenheit hatte die BCR/ABLpositive B-LBL die ungünstigste Prognose. Das hat sich seit der Einführung der Therapie mit Tyrosinkinasehemmern wie Imatinib und seiner neueren Varianten hochgradig geändert. Dank dieser neuen Therapie gehört jetzt die BCR/ABLpositive B-LBL zu der günstigsten B-LBLKategorie. Das bedeutet, dass sämtliche B-LBL auf die Präsenz einer BCR/ABLTranslokation untersucht werden müssen (. Abb. 1). Der Onkologe 9 · 2011 | 769 Kleinzellige B-Zell-Lymphome Chronische lymphatische Leukämie (CLL) Die enorm gestiegene Empfindlichkeit immunphänotypischer Verfahren hat bei Gesunden zur Entdeckung von klonalen Lymphoproliferationen mit einem abnormen Immunphänotyp (CD23 und CD5) geführt. Diese Proliferationen wurden als monoklonale B-Zell-Lymphozytose (MBL) bezeichnet [47]. Aufgrund dieser Beobachtung schlug der kürzliche Internationale Workshop über die chronische lymphatische Leukämie (CLL) neue diagnostische Kriterien für diese Krankheit vor [30]. Für die Diagnose einer CLL wird jetzt nicht mehr nur eine chronische absolute Lymphozytose von > 5,0 × 109/l, sondern eine absolute monoklonale Lymphozytose mit einem CLL-Immunphänotyp im peripheren Blut (PB) von > 5,0 × 109/l gefordert [30]. Diese neue Definition hat Auswirkung auf die Diagnose CLL. Ein lymphozytisches Lymphom und nicht eine CLL wird diagnostiziert, wenn im Lymphknoten oder extranodalen Gewebe (d. h. außerhalb des Knochenmarks) CLL-artige Zellinfiltrate vorkommen und der Absolutwert von CLL-Typ-Zellen im PB unter 5,0 × 109/l liegt. Lymphoplasmozytisches Lymphom (LPL) und WaldenströmMakroglobulinämie (WM) Da verschiedene kleinzellige B-Zell-Lymphome eine plasmazelluläre Differenzierung aufweisen können und bisher keine spezifischen immunphänotypischen oder genetischen Marker für das LPL entdeckt wurden, wird dieses weiter als eine B-ZellNeoplasie definiert, welche sich aus kleinen B-Zellen und plasmazellulär differenzierten Zellen zusammensetzt und keine Merkmale einer anderen kleinzelligen BZell-Entität mit plasmazellulärer Differenzierung aufweist. Da auch Marginalzonenlymphomen (MZL) mit plasmazellulärer Differenzierung definierende Biomarker fehlen, empfiehlt die 2008-WHOKlassifikation [79] in unklaren Fällen ganz offen die Diagnose eines kleinzelligen B-Zell-Lymphoms mit plasmazellulärer Differenzierung zu stellen und die Dif- Tab. 1 WHO-Klassifikation der lymphatischen Neoplasien Vorläuferzellneoplasien B-lymphoblastische(s) Leukämie/Lymphom (B-LBL) - B-LBL, nicht weiter spezifiziert - B-LBL mit rekurrenten zytogenetischen/molekulargenetischen Anomalien - B-LBL mit einer t(9;22) (q34;q11.2); BCR/ABL - B-LBL mit einer t(v;11q23); MLL umgelagert - B-LBL mit einer t(12;21) (p13;q22); TEL/AML1 (ETV6-RUNX1) - B-LBL mit Hyperdiploidie - B-LBL mit einer Hypodiploidie - B-LBL mit einer t(5;14)(q31;q32)(IL3-IGH) - B-LBL mit einer t(1;19)(Q23;P13.3); (E2 A-PBX1; CF3/PBX) T-lymphoblastische (s) Leukämie/Lymphom NK-Zell-lymphoblastische (s) Leukämie/Lymphom Reife B-Zell-Neoplasien Chronische lymphatische Leukämie (CLL)/lymphozytisches Lymphom Prolymphozytenleukämie vom B-Zell-Typ Splenisches Marginalzonenlymphom Haarzellleukämie Splenisches B-Zell-Lymphom/Leukämie, nicht klassifizierbar - Splenisches diffuses kleinzelliges B-Zell-Lymphom der roten Pulpa - Haarzellleukämievariante Lymphoplasmozytisches Lymphom Waldenström-Makroglobulinämie Schwerkettenkrankheiten - α-Schwerkettenkrankheit - γ-Schwerkettenkrankheit - Mu-Schwerkettenkrankheit Plasmazellmyelom Solitäres Plasmozytom des Knochens Extraossäres Plasmazytom Extranodales Marginalzonenlymphom des mukosaassoziierten lymphatischen Gewebes (MALTLymphom) Nodales Marginalzonenlymphom - Pädiatrisches nodales Marginalzonenlymphom Follikuläres Lymphom - Pädiatrisches follikuläres Lymphom - Primäres intestinales follikuläres Lymphom Primäres kutanes Follikelzentrumslymphom Mantelzelllymphom Diffuses großzelliges B-Zell-Lymphom (DLBCL) - DLBCL, NOS - DLBCL-Subtypen - T-Zell/histiozytenreiches großzelliges B-Zell-Lymphom - Primäres DLBCL des Zentralnervensystems (ZNS) - Primär kutanes DLBCL, vom Beintyp - EBV-positives DLBCL der Älteren - DLBCL bei chronischer Entzündung - Lymphomatoide Granulomatose -Primär mediastinales (thymisches) großzelliges B-Zell-Lymphom - Intravaskuläres großzelliges B-Zell-Lymphom - ALK-positives großzelliges B-Zell-Lymphom - Plasmoblastisches Lymphom Der Onkologe 9 · 2011 | 771 Tab. 1 WHO-Klassifikation der lymphatischen Neoplasien Vorläuferzellneoplasien - Großzelliges B-Zell-Lymphom auf dem Boden einer HHV8-assoziierten multizentrischen Castleman-Krankheit - Primäres Ergusslymphom Burkitt-Lymphom B-Zell-Lymphom, nicht klassifizierbar, mit intermediären Merkmalen zwischen einem diffusen großzelligen B-Zell-Lymphom und einem Burkitt-Lymphom B-Zell-Lymphom, nicht klassifizierbar, mit intermediären Merkmalen zwischen einem diffusen großzelligen B-Zell-Lymphom und einem klassischen Hodgkin-Lymphom Reife T-Zell- und NK-Zell-Neoplasien Prolymphozytenleukämie vom T-Zell-Typ Großgranuläre T-lymphatische Leukämie Chronische Lymphoproliferation der NK-Zellen Aggressive NK-Zell-Leukämie Systemische EBV-positive T-Zell-Lymphoproliferation des Kindesalters Hydroa-vacciniform-artiges Lymphom Adulte(s) T-Zell-Leukämie/-Lymphom Extranodales NK-/T-Zell-Lymphom, nasaler Typ Enteropathieassoziiertes T-Zell-Lymphom Hepatosplenisches T-Zell-Lymphom Subkutanes panniculitisartiges T-Zell-Lymphom Mycosis fungoides Sézary-Syndrom Primär kutane CD30-positive T-Zell-Lymphoproliferation - Lymphomatoide Papulose - Primäres kutanes anaplastisches großzelliges Lymphom Primäres kutanes γδ-T-Zell-Lymphom Primär kutanes CD8-positives aggressives epidermotropes zytotoxisches T-Zell-Lymphom Primär kutanes CD4-positives klein bis mittelgroßzelliges T-Zell-Lymphom Peripheres T-Zell-Lymphom, NOS Angioimmunoblastisches T-Zell-Lymphom Anaplastisches großzelliges Lymphom, ALK-positiv Anaplastisches großzelliges Lymphom, ALK-negativ Hodgkin-Lymphom Noduläres lymphozytenprädominantes Hodgkin-Lymphom Klassisches Hodgkin-Lymphom - Nodulärsklerosierendes klassisches Hodgkin-Lymphom - Lymphozytenreiches klassisches Hodgkin-Lymphom - Gemischtzelliges klassisches Hodgkin-Lymphom - Lymphozytenarmes klassisches Hodgkin-Lymphom Posttransplantatassoziierte Lymphoproliferation (Ptld) Frühe Läsionen - Plasmazytische Hyperplasie - Infektiöse mononukleoseartige PTLD Polymorphe PTLD (B- und T-/NK-Zelltypen) Klassisches Hodgkin-Lymphom, PTLD-Typ NOS „not otherwise specified“, nicht weiter spezifiziert. Die in kursiv geschrieben histologischen Typen repräsentieren provisorische Entitäten. Für diese sah die WHOArbeitsgruppe nicht genügend Kriterien erfüllt, um sie als eigenständige Tumorentitäten anzuerkennen. 772 | Der Onkologe 9 · 2011 ferenzialdiagnose LPL und MZL zu diskutieren. Auch die Beziehung zwischen der WM und dem LPL war bisher unklar. Der zweite internationale Workshop über die WM hat weitgehend Klarheit schaffen können [56]. Der Workshop definierte die WM als eine monoklonale IgM-Gammopathie jeglicher Konzentration mit Infil­ tration des Knochenmarks durch ein LPL (. Abb. 2). Die 2008-WHO-Klassifikation hat diese Definition übernommen. Plasmazellneoplasien Plasmazellmyelom (PCM, multiples Myelom) Plasmozytome können sich in sehr unterschiedlicher Weise präsentieren. Sie gehen fast immer mit einer monoklonalen Gammopathie und Immunglobulinablagerungen in Organen wie z. B. in der Niere einher. Ausnahme ist das seltene, nichtsekretorische Plasmozytom. Viele Jahre war eine Subklassifikation für die klinische Anwendung in Diskussion. Die 2008-WH0-Klassifikation übernahm die Definition der monoklonalen Gammopa­ thie mit unbekannter klinischer Signifikanz (MGUS), allerdings mit der von der Internationalen Myeloma-Working-GroupErgänzung [15], in welcher die „smoldering“ und indolenten Plasmazellmyelome zu einer Gruppe unter der Bezeichnung asymptomatisches Plasmazellmyelom zusammengefasst und die MGUS dem symptomatischen Plasmazellmyelom gegenüber gestellt wurde. Der Grund für die Zusammenfassung ist, dass „smoldering“ und indolente Plasmazellmyelome ein Kontinuum darstellen und die bisherige Unterteilung mehr oder weniger willkürlich war. 2009 wurden die Kriterien für die 3 unterschiedenen klinischen Gruppen überarbeitet [42]. Diese sind in . Tab. 2 gelistet. Seit der Publikation der 2001-WHOKlassifikation wurden bei den Plasmazellmyelomen viele genetische Anomalien beschrieben, die mit einer unterschiedlichen Prognose einhergehen. Diese genetischen Kategorien und Risikogruppen wurden in die 2008-WHO-Klassifikation aufgenommen, obwohl gegenwärtig morphologische und klinische Kriterien in der Regel noch das alleinige Fundament für Zusammenfassung · Abstract Onkologe 2011 · 17:769–788 DOI 10.1007/s00761-011-2126-5 © Springer-Verlag 2011 (Fortsetzung) H. Dürkop · H.-D. Foss · H. Stein 2008-WHO-Klassifikation der malignen Lymphome im Jahr 2011. Neue Erkenntnisse und praktische Anwendung Zusammenfassung Die 2008 aktualisierte WHO-Klassifikation der lymphatischen Neoplasien stellt einen weltweiten Konsensus über die Diagnose dieser Tumoren dar. Sie basiert auf einem multidisziplinären Ansatz zur Definition von eigenständigen Lymphomentitäten. Bekannte Lymphomkrankheiten wurden genauer definiert, neue Entitäten identifiziert sowie neue Konzepte und Erkenntnisse, die zu einem besseren Verständnis der malignen Lymphome beitragen, integriert. Eine Reihe von Fragen blieben allerdings ungelöst. Zu diesen gehörten insbesondere die Frage, welcher Grad genetischer oder molekularer Veränderungen für die Definition einer eigenständi- gen Lymphomentität notwendig ist und der Status der provisorischen Entitäten. In der Zeit nach der Veröffentlichung der WHO-Klassifikation von 2008 gab es eine Reihe neuer wissenschaftlicher Beobachtungen. Außerdem wurden neue Konzepte zum Verständnis der malignen Lymphome entwickelt. Dieser Fortschritt ist der Schwerpunkt nach folgender Übersicht, soweit er Einfluss auf die diagnostischen Kriterien hat. Schlüsselwörter WHO-Klassifikation · Lymphatische Neoplasien · Maligne Lymphome · Lymphomentitäten · Diagnostische Kriterien The 2008 WHO classification of malignant lymphomas in 2011. New knowledge and practical application Abstract The 2008 updated WHO classification of lymphoid neoplasms represents a worldwide consensus on the diagnosis of these tumors. It is based on a multidisciplinary approach aimed at the recognition of distinct diseases. The definition of well recognized diseases were refined, new entities and variants were identified and new emerging concepts which contribute to a better understanding of lymphoid neoplasms were incorporated. However, a number of questions remain unresolved, such as the extent to which specif- ic genetic or molecular alterations define certain tumors and the status of provisional entities. In the time after the publication of 2008 WHO classification new findings, ideas and concepts have been generated. Their description is the focus of this review insofar as these have an impact on diagnostic criteria. Keywords WHO classification · Lymphoid neoplasms · Malignant lymphoma · Entities of lymphoma · Diagnostic criteria die Diagnose und Behandlung von Plasmazellmyelomen darstellen. Die WHOArbeitsgruppe empfiehlt aber, zytogenetische oder Fluoreszenz-in-situ-Hybridisierung- (FISH-)Analysen durchzuführen, wann immer es möglich ist. Diese Analysen sind im Rahmen von klinischen Studien obligat. Follikuläres Lymphom – Grading und Varianten Das follikuläre Lymphom (FL) wurde in den USA seit der Zeit der RappaportKlassifikation in 3 Grade unterteilt [33, 62]. Die REAL- und die 2001-WHO-Klassifikation empfahlen eine Unterteilung in 3 Grade nach der Zahl von Zentroblasten (0–5; 6–15 und > 15) pro stark vergrößertem mikroskopischem Gesichtsfeld. Grad 3 wurde für Forschungszwecke weiter unterteilt in einen Grad 3A (Zentrozyten sind noch anwesend) und in einen Grad 3B (Rasen von Zentroblasten ohne Zentrozyten; . Abb. 3). Die klinischen Teilnehmer an dem 2007 WHO Clinical Advisory Committee Meeting im Airlie House/USA waren mit den Pathologen einer Meinung, dass dieses Gradierungsschema problematisch ist. Erstens erwies sich dieses Schema als wenig reproduzierbar. Zweitens war deutlich geworden, dass zwischen FL Grad 1 und Grad 2 weder biologische noch klinische Unterschiede erkennbar sind. Drittens deuteten mehrere Studien darauf hin, dass sich das FL Grad 3B biologisch vom FL Grad 1–3A unterscheidet und in mancher Hinsicht (häufigeres Fehlen von CD10 und BCL2, Expression von MUM1/IRF4 und Umlagerung des BCL-6-Gens bei Fehlen einer Umlagerung des BCL-2-Gens) dem diffusen großzelligen B-Zell-Lymhom mehr ähnelt als dem FL 1–3A [29, 41, 54]. Diese Befunde veranlassten das WHO-Editorenteam, die Grade 1 und 2 zu einem Grad 1–2 zusammenzufassen und die Unterscheidung zwischen dem FL Grad 3A und 3B obligat zu machen. Neu definierte Entitäten und Gruppierungen Die 2008-WHO-Klassifikation integrierte einige Lymphoproliferationen als neue Lymphomentitäten. Davon waren einige 774 | Der Onkologe 9 · 2011 Abb. 1 7 a–i Knochenmarkstanze eines BCR-ABLpositiven B-lymphoblastischen Lymphoms. a,b HEFärbung. c–g Immunreaktionen zum Nachweis von CD20 (c), PAX5 (d), CD3e, TdT (f), CD34 (g) und CD10 (h). i Nachweis einer BCRABL-Fusion mit Hilfe der Fluoreszenz-in-situ-Hybridisierung (FISH) am formalinfixierten Gewebe schon früher beschrieben, aber als morphologische oder phänotypische Varianten anderer Entitäten angesehen worden. Neue Befunde sprechen dafür, dass eine Abgrenzung als eigene unabhängige Lymphomkrankheiten oder Subentitäten berechtigt ist. Follikuläres Lymphom Die 2008-WHO-Klassifikation grenzt aufgrund von charakteristischen klinischen und genetischen Merkmalen zusätzlich zum kutanen Follikelzentrumslymphom die folgenden Subtypen ab: das primäre intestinale FL und das pädiatrische FL (. Tab. 1). Das intestinale FL trägt die t(14;18) wie das nodale FL, unterscheidet sich aber von diesem, indem es nicht systemisch auftritt, sondern in der Regel lange auf die Darmmukosa lokalisiert bleibt. Beim pädiatrischen FL ist die Der Onkologe 9 · 2011 | 775 t(14;18) in der Regel nicht nachweisbar; es manifestiert sich meist als lokalisierte Krankheit mit einer großzelligen Morphologie. Trotz der High-grade-Morphologie ist die Prognose günstig. Obwohl die t(14;18) häufig nicht nachweisbar ist, exprimieren die Tumorzellen in bis zu 50% der Fälle das BCL2-Protein. Zwar wurden rekurrente Brüche in IG-Schwerkettengen bei diesen Läsionen beschrieben, allerdings konnten die beteiligten Partner noch nicht identifiziert werden. Seit der Veröffentlichung der 2008-WHO-Klassifikation haben mehrere Arbeitsgruppen Befunde erhoben, die dafür sprechen, dass nicht alle BZell-Lymphome mit einem follikulärem Wachstum derselben Krankheitsentität angehören. Zum Beispiel ähneln die Tumorzellen von einigen t(14;18)-negativen FL späten Keimzentrum-B-Zellen. Diese zeigen nicht selten eine intrafollikuläre Plasmazelldifferenzierung [28]. Die gegenwärtige WHO-Klassifikation belässt diese t(14;18)-negativen Fälle innerhalb der breiten Gruppe der FL, bis weitere klinische und genetische Daten verfügbar sind. Diffuses großzelliges B-Zell-Lymphom (DLBCL) Das diffuse großzellige B-Zell-Lymphom (DLBCL) ist eine heterogene Gruppe von mehreren Entitäten. Die 2008-WHOArbeitsgruppe hat viele neue Subtypen/ Entitäten aufgrund charakteristischer klinischer, histopathologischer und biologischer Merkmale abgegrenzt (. Tab. 1). Diese umfangreiche Subtypisierung hat zu erheblicher Kritik geführt, weil eine spezifische Therapie für Patienten mit diesen vielen verschiedenen und seltenen Subtypen schwerlich bzw. unmöglich entwickelt werden kann. Die WHO-Arbeitsgruppe hält allerdings die Unterscheidung dieser Subtypen für gerechtfertigt, da sie nicht nur biologische, sondern auch klinische, morphologische und/oder immunphänotypische Besonderheiten aufweisen. Da bei der großen Mehrheit der DLBCL keine spezifischen klinischen und pathologischen Merkmale erkennbar sind, werden diese Fälle nach wie vor in der großen Gruppe der DLBCL, nicht weiter spezifiziert (NOS), zusammengefasst. Die Analy- Abb. 2 8 a,b Ausschnitt aus Knochenmarkstanzen von 2 Patienten mit einem lymphoplasmozytischen Lymphom. Da sich im peripheren Blut beider Patienten ein IgM-Paraprotein nachweisen ließ, handelt es sich in beiden Fällen um eine Waldenström-Makroglobulinämie. a,b Immunreaktionen zum Nachweis von IgM. a Die schwach und ringförmig für IgM markierten Zellen sind B-Zellen, die stark im Zytoplasma für IgM markierten Zellen mit exzentrisch gelegenem Zellkern sind IgM sezernierende Plasmazellen. Es dominieren die B-Zellen. b In dem Knochenmark dieses Patienten ist der Anteil der IgM sezernierenden Plasmazellen deutlich höher als im Mark des Patienten in Abb. a. Dieser Befund korrelierte mit dem Paraproteinspiegel im peripheren Blut DLBCL Grad 1 WHO 2008 Grad 2 Grad 3A Grad 3B Grad 1/2 diffuses großzelliges B-Zell-Lymphom Zentroblasten Zentrozyten follikuläre dendritische Zelle (FDC) Abb. 3 8 Schematische Darstellung der Gradierung des follikulären Lymphoms. (Nach W. Klapper, persönliche Mitteilung) se von Genexpressionsprofilen führte bei dieser Gruppe zur Unterscheidung von zwei molekularen Subtypen: dem Keimzentrumstyp („GCB-like type“) und dem aktivierten B-Zell-Typ („ABC-like type“). >Bei den meisten DLBCL sind keine spezifischen klinischen und pathologischen Merkmale erkennbar Diese molekularen Subtypen sind verbunden mit spezifischen genetischen Anoma- lien, verschiedenen Signaltransduktionskaskaden und unterschiedlichen Prognosen [68]. Neue therapeutische Strategien wurden entwickelt, um die beiden molekularen Subtypen einer differenzierten Therapie zuzuführen. Da die Genexpressionsanalyse Frischmaterial erfordert und sehr aufwendig ist, wurden immunhistochemische Algorithmen vorgeschlagen, um die beiden molekularen Subtypen in der täglichen Routinediagnostik voneinander abgrenzen zu können [30, 11]. Bisher haben sich die vorgeschlagenen AlDer Onkologe 9 · 2011 | 777 Leitthema Tab. 2 Kurze Zusammenfassung der diagnostischen Kriterien für Plasmazellenmyelome und deren mögliche Vorläuferläsionen Symptomatisches Plasmazellenmyelom 1. Klonale Plasmazellen > 10% im Knochenmark 2. Monoklonales Protein (Paraprotein) im Serum oder Urin (ausgenommen echte nichtsekretorische Plasmazellenmyelome) 3. Hinweise auf einen Endorganschaden, der im Zusammenhang mit der Plasmazellenneoplasie steht: - Hyperkalzämie (> 2,75 mmol/l) - Niereninsuffizienz - Anämie (Hämoglobin < 10 g/dl) - Knochenläsionen (lytische Prozesse oder Osteoporose mit Kompressionsfrakturen) Asymptomatisches Plasmazellenmyelom 1. Serum-Paraprotein > 30 g/l und/oder 2. klonale Plasmazellen > 10% im Knochenmark und 3. keine Plasmazellenmyelom-verursachten Endorganschäden oder Gewebeschäden oder Symptome Monoklonale Gammopathie unbestimmter Signifikanz (MGUS) 1. Serum-Paraprotein < 30 g/l und 2. klonale Plasmazellen < 10% im Knochenmark 3. keine Plasmazellenmyelom-verursachten Endorganschäden oder Gewebeschäden oder Symptome gorithmen nicht als verlässlich erwiesen. Das gilt insbesondere für den Hans-Klassifikator [20]. Dagegen hat eine kürzliche Studie der deutschen Referenzpathologen überzeugend bestätigt, dass aufgrund rein morphologischer Merkmale zwei prognostisch unterschiedliche Gruppen bei den DLBCL unterschieden werden können: a)eine DLBCL-Gruppe, die aus zentroblastenartigen Zellen besteht, und b)eine DLBCL-Gruppe, die vornehmlich aus immunoblastenartigen Zellen besteht [55]. Da die DLBCL vom immunoblastischen Typ weniger als 10% der DLBCL ausmachen, bleibt die Notwendigkeit, die DLBCL vom zentroblastischen Typ weiter zu subtypisieren. Das wird wohl nur mit molekularen Verfahren gelingen. Die 2008-WHO-Klassifikation betont den Einfluss der Lokalisation und andere klinische Aspekte auf das klinische Verhalten bestimmter DLBCL-Subtypen. Ähnlich wie das gut charakterisierte primär mediastinale großzellige B-Zell-Lymphom (PMBCL) werden andere DLBCL, die in bestimmten topographischen Lokalisationen entstehen, als eigenständige Subtypen betrachtet. Zu diesen Tumoren zählen das DLBCL des zentralen Nervensystems (ZNS) und das primär ku- 778 | Der Onkologe 9 · 2011 tane DLBCL vom Beintyp. Das primäre ZNS-DLBCL besitzt ein Genexpressionsprofil und ein genomisches Profil, welches sich von den Profilen der nodalen DLBCL unterscheidet. Auch werden die im ZNS auftretenden DLBCL mit anderen Therapieprotokollen behandelt [6, 71, 83]. Die Abgrenzung des primär kutanen DLBCL vom Beintyp beruht auf seinem aggressiven klinischen Verhalten und seinem Phänotyp, der sich von dem des mehr indolenten primären kutanen Follikelzentrumslymphom unterscheidet, obwohl dessen Zellen in einem Teil der Fälle die Merkmale von großen B-Zellen aufweisen. In seinem Genexpressionsprofil gleicht das primär kutane DLBCL vom Beintyp dem systemischen DLBCL vom ABC-Typ [19, 34]. Die Anerkennung des T-Zell-/histiozytenreichen großzelligen B-Zell-Lymphoms (THRLBCL) als eigenständigen Subtyp des DLBCL zeigt, welche Bedeutung dem Mikromilieu für die Biologie bestimmter Tumoren eingeräumt wird. Die morphologische und immunphänotypische Ähnlichkeit zwischen dem THRLBCL und progressiven Formen des nodulären lymphozytenprädominanten Hodgkin-Lymphoms (NLPHL) könnte für eine Beziehung zwischen diesen beiden Neoplasien sprechen. Weitere Studien sind zur Klärung der Frage notwendig, ob sich De- novo-THRLBCL von sekundären/progressiven Formen des NLPHL unterscheiden lassen. Die 2008-WHO-Klassifikation betrachtet einige EBV-assoziierte DLBCL als eigene Entitäten. Hierzu gehören die lymphomatoide Granulomatose (LYG) und die EBV-positiven DLBCL der Älteren, die ursprünglich in Asien beschrieben wurden [3, 57, 58, 59]. Allerdings vergab die 2008-Klassifikation für die EBV-positiven DLBCL der Älteren nur den Status einer provisorischen Entität, weil eine präzisere Definition für die Anerkennung als eine eigenständige Entität als notwendig erachtet wurde. Die 2008-WHO-Klassifikation hat aggressive Tumoren, die sich aus terminal differenzierten B-Zellen zusammensetzen, als eigenständige DLBCL-Subtypen aufgenommen. Zytologisch ähneln diese Zellen Immunoblasten, besitzen aber den Immunphänotyp von Plasmazellen, der durch das Fehlen von CD20 und PAX5 und eine Expression von CD38, CD138 und BLIMP1 gekennzeichnet ist [13, 49]. Zu dieser DLBCL-Kategorie zählen das ALK-positive großzellige BZell Lymphom, das plasmoblastische Lymphom (PBL) und das HHV-8-positive primäre Ergusslymphom sowie das großzellige B-Zell-Lymphom, welches sich aus der multizentrischen Castleman-Krankheit entwickelt. Das PBL und die HHV-8-assoziierten Lymphome treten häufig bei Patienten mit einer Immundefizienz auf, die meist durch eine HIV-Infektion induziert ist. Diese Tumoren weisen häufig einen Latenztyp-1 der EBV-Infektion auf. Das ALK-positive großzellige B-ZellLymphom besitzt dieselbe Morphologie und denselben Immunphänotyp (außer der Expression von ALK) wie die vorgenannten Lymphomtypen, tritt aber interessanterweise bei jüngeren Patienten ohne Hinweise auf eine Immundefizienz auf und ist immer EBV-negativ. Reifzellige T-/NK-Zell-Lymphome Die 2008-WHO-Klassifikation hat einige neue Entitäten in die Gruppe der reifzelligen T-/NK-Zell-Lymphome aufgenommen (. Tab. 1). Da die systemische EBVpositive T-Zell-lymphoproliferative Krankheit des Kindesalters und das Hydroa vac- Leitthema sätzlich Hinweise auf das Vorliegen einer Zöliakie gefordert, z. B. genetisch/immunologisch durch Nachweis entsprechender HLA-Phänotypen oder histologisch durch Nachweis einer Vermehrung von intraepithelialen Lymphozyten in der angrenzenden, vom Lymphom nicht befallenen Dünndarmschleimhaut. Entsprechend dieser stringenteren Definition wurde die bisherige Bezeichnung „Enteropathie-Typ-T-Zell-Lymphom“ in EATCL geändert. Chott et al. [12] beschrieben 1998 eine Variante des EATCL, auch als Typ II bezeichnet. Diese Variante hat Eingang in die 2008-WHO-Klassifikation gefunden. Histologisch ist sie durch eine monomorphe Population mittelgroßer Tumorzellen ohne wesentliches entzündliches Infiltrat und immunhistologisch durch eine Koexpression von CD8, CD56 und der T-ZellRezeptor-γ-Kette charakterisiert. Auf genetischer Ebene liegen häufig cMYC-Amplifikationen vor [18]. Dieser Tumor tritt in der Regel ohne Assoziation mit einer Zöliakie auf und stellt offensichtlich eine eigenständige Krankheitsentität dar, die sich von γδ-T-Zellen herleiten. Die Prognose beider Subtypen des EATCL ist sehr ungünstig. Kutane T-Zellen-Neoplasien Abb. 4 8 Antioimmunoblastistisches T-Zell-Lymphom (AITCL). a PAS-Reaktion. Es stellen sich die verzweigten Kapillaren violett dar. Dazwischen mittelgroße und größere lymphatische Blasten. b Immunreaktion für CD3. Die Mehrzahl der Infiltratzellen ist positiv. Viele der CD3-markierten Zellen weisen eine atypische Morphologie auf. c Immunreaktion für CD21. Bei CD21 handelt es sich um den CD3d-Rezeptor des Komplementsystems. Dieser Rezeptor ist ein geeigneter Marker für die follikulären dendritischen Zellen, die – wie im Bild sichtbar – ein ausgedehntes Maschenwerk um und zwischen den verzweigten Kapillaren bilden. Dieses Phänomen ist ein wichtiger diagnostischer Marker für das AITCL. d Immunreaktion für PD-1. Dieses Molekül ist ein Marker für follikuläre T-Zellen. Die Tumorzellen zeigen eine starke und selektive Anfärbung für PD-1 und erweisen sich damit als mutmaßliche Abkömmlinge der follikulären T-Zellen ciniformartige Lymphom selten sind und in unseren Breiten praktisch nicht auftreten, wird auf eine Besprechung verzichtet und auf die entsprechende Literatur verwiesen. Besprochen werden hier das enteropathieassoziierte T-Zell-Lymphom, die neu abgegrenzten primär kutanen T-Zell Lymphome, das ALK-positive anaplastische großzellige Lymphom sowie sowie andere nodale periphere T-Zell-Lymphome. 780 | Der Onkologe 9 · 2011 Enteropathieassoziiertes T-Zell-Lymphom (EATCL) Für die Diagnose dieser Entität hat die 2008-WHO-Klassifikation stringentere Kriterien eingeführt. Da extranodale NK/T-Zell-Lymphome und periphere T-ZellLymphome wie die γδ-T-Zell-Lymphome den Darm sekundär befallen können, werden für die Diagnose eines EATCL zu- In die 2008-WHO-Klassifikation wurden 3 primär kutane T-Zell-Lymphome teils als provisorische Entitäten aufgenommen: a)das primär kutane γδ-T-Zell-Lym­ phom, b)das primär kutane CD8-positive aggressive epidermotrope zytotoxische T-Zell-Lymphom und c)das primär kutane CD4-positive klein- bis mittelgrosszellige T-ZellLymphom [5]. Für die Diagnose dieser neuen Kategorien gilt, dass eine Mykosis fungoides durch eine komplette klinische Untersuchung und Anamnese auszuschließen ist. ALK-positives und ALK-negatives anaplastisches großzelliges Lymphom Im Gegensatz zur WHO-Klassifikation von 2001 wird in der Klassifikation von 2008 das ALK-positive anaplastische großzellige Lymphom (ALCL) aufgrund seiner klinischen Besonderheiten (bevorzugtes Auftreten bei jungen Patienten, günstige Prognose), seiner typischen genetischen Veränderungen unter Beteiligung des ALK-Lokus und seines charakteristischen Genexpressionsmusters als eigene Krankheitsentität abgegrenzt. Da das ALK-negative ALCL morphologisch vom ALK-positiven ALCL nicht unterscheidbar ist, eine günstigere Prognose als das periphere T-Zell-Lymphom (PTCL, NOS) besitzt [73] und sich auch im Genexpressionsmuster vom PTCL, NOS, unterscheidet [59], wird es weiterhin vom PTCL, NOS, abgegrenzt und als eigene Krankheitsentität angesehen – allerdings mit provisorischem Charakter. Es ist noch nicht klar, ob dieses Lymphom nur aus einer oder mehreren Lymphomformen besteht. Andere nodale T-Zell-Lymphome Bei peripheren, nicht weiter spezifizierten T-Zell-Lymphomen wurden in den letzten Jahren keine signifikanten Fortschritte in der Subklassifizierung erzielt. Hingegen konnte gezeigt werden, dass die Tumorzellen des angioimmunoblastischen T-Zell-Lymphoms (AITCL) den Phänotyp von follikulären T-Helferzellen aufweisen (CD10−/+, CXCL13+, PD-1+ ; . Abb. 4d). Bei den follikulären T-Zellen handelt es sich um eine in Keimzentren lokalisierte Subpopulation von T-Helferzellen. Diese Abstammung der neoplastischen Zellen des AITCL passt gut zu den bei dieser Krankheit vorkommenden ausgedehnten Maschenwerken follikulärer dendritischer Zellen (FDC; . Abb. 4c). Vorläuferläsionen Die Vorstellung, dass die maligne Transformation von Zellen aufgrund eines mehrstufigen Prozesses durch Ansammlung von genetischen und molekularen Ereignissen zustandekommt, ist weithin akzeptiert. Dieses Konzept wurde durch Untersuchungen an soliden, insbesondere epithelialen Tumoren etabliert. Es ist ungleich schwieriger, dieses Konzept auf die Tumoren des lymphatischen Systems, deren Zellen normalerweise zirku- lieren und verschiedene Gewebe besiedeln, anzuwenden [40]. Molekulare Studien der letzten Jahre haben onkogene chromosomale Translokationen in Zellen des peripheren Blutes und Knochenmarks von ansonsten gesunden Individuen aufgedeckt. Kürzlich wurden hierfür histologische und immunphänotypische Korrelate identifiziert. Das WHO-EditorenTeam hat diese Befunde, die frühen Stufen in der malignen Transformation entsprechen können, in die 2008-WHO-Klassifikation aufgenommen. Es ist nicht klar, ob diese klonalen Expansionen jemals in ein manifestes Lymphom übergehen oder ob diese als eine stabile benigne Läsion ohne weitere Progression im Organismus verbleiben. Die Entdeckung dieser Läsionen wirft die Frage auf, wie Patienten mit solchen Läsionen zu betreuen sind. Die Entdeckung der monoklonalen BZell-Lymhozytose (MBL) als eine potenzielle Vorläuferläsion für die CLL und andere lymphatische Neoplasien war Anlass für eine Reihe von Studien. Bei Verwandten 1. Grades von CLL-Patienten wurde eine MBL oft beobachtet [47, 64, 76]. Populationsbasierte Studien spürten unter Anwendung hoch sensitiver Nachweismethoden bei 12% der über 60-Jährigen und in 20% bei Individuen über 65 Jahre monoklonal expandierte B-Zellen auf [51]. In epidemiologischen Studien wurden klonale B-Zellen mit einem CLL-Phänotyp viele Jahre vor der Diagnose einer manifesten CLL aufgefunden. Allerdings scheint die überwiegende Mehrzahl von MBLs während Lebzeiten nicht in eine manifeste lymphatische Neoplasie überzugehen. Die geschätzte Progressionsrate liegt bei 1–2% pro Jahr [76]. Kürzlich wurden potenziell präneoplastische lymphatische Proliferationen in Biopsaten beschrieben. Diese wiesen immunphänotypische und genetische Merkmale von follikulären Lymphomen (FL) oder Mantelzelllymphomen (MCL) auf. Diese Proliferationen wurden mit den provokativen Bezeichnungen „In-situ-FL“ oder „In-situ-MCL“ belegt [14, 21, 52, 65, 72]. Die Bezeichnungen sollen darauf hinweisen, dass die klonalen und anomalen Proliferationen in ihrem Vorkommen und ihrer Ausbreitung auf die normale anatomische Lokalisation beschränkt sind, d. h. entweder auf das Keimzentrum oder die Mantelzone. Diese Läsionen müssen von einem partiellen Lymphknotenbefall durch ein an anderer Stelle manifestes Lymphom differenziert werden. „In-situ-FL“, die in der 2008-WHOKlassifikation auch als intrafollikuläre Neoplasie bezeichnet wurden, repräsentieren klonale Expansionen von CD10 und BCL2 koexprimierenden B-Zellen, die die t(14;18) tragen und in Keimzentren von sonst reaktiven Lymphknoten vorkommen (. Abb. 5a). Ausbreitungs(Staging-)Untersuchungen haben in weniger als 50% solcher Situationen ein manifestes FL an anderer Stelle entdecken können. Verlaufsstudien haben auch in den übrigen Fällen oft eine Progression in ein manifestes FL nicht feststellen können [14, 48]. Die „In-situ-FL“ ohne nachweisbares FL an anderer Stelle dürften den klonalen Expansionen von B-Zellen mit einer t(14;18) entsprechen, die bei gesunden Individuen entdeckt wurden [70]. Diese klonalen Zellen wurden als FL-artige B-Zellen bezeichnet. Sie besitzen offenbar keine der onkogenen Anomalien, die für eine Progression in ein manifestes FL erforderlich sind, können diese aber erwerben. Das scheint häufiger bei Individuen vorzukommen, die Pestiziden ausgesetzt waren. Interessanterweise tragen einige Hepatitis-C-Virus-infizierte Patienten Klone mit einer t(14;18), die nach einer erfolgreichen antiviralen Therapie verschwinden [86]. Es ist ergänzend anzumerken, dass die für FL spezifische Koexpression von CD10 und BCL-2 dem immunhistochemischen Nachweise aufgrund einer Deletion des Epitops entgehen kann (. Abb. 5b), gegen das der eingesetzte monoklonale Anti-BCL2-Antikörper gerichtet ist. Eine solche Epitop-Deletion läßt sich durch Anwendung eines zweiten Anti-BCL2 Antikörpers verifizieren, wenn dieser Antikörper ein anderes Epitop auf dem BCL-2-Protein erkennt (. Abb. 5c) Über geringe Lymphknoteninfiltrate von Cyclin-D1-positiven bzw. t(11;14)positiven B-Zellen wurde mehrfach berichtet [21, 52, 65]. Bei geringer Infiltration besiedeln Cyclin-D1-positve Zellen vornehmlich die innere Region der Mantelzone unter Aussparung der restlichen reaktiven Mantelzellzone. Solche minimalen Infiltrate werden gewöhnlich zufäl- Abb. 5 8 a Sogenanntes „in-situ“ follikuläres Lymphom bzw. intrafollikuläre Neoplasie: peripherer Lymphknoten immungefärbt für BCL-2. Fünf Keimzentren sind vollständig negativ für BCL-2 und erweisen sich damit als reaktiv. Das Keimzentrum am oberen Bildrand enthält eine dicht gelagerte Zellpopulation, die eine intensive Anfärbung für BCL-2 zeigt. Diese BCL-2-positive B-Zellpopulation koexprimiert CD10 und BCL-6 und weist damit den Immunphänotyp von follikulären Lymphomzellen auf. Nach bisheriger Datenlage entwickelt sich aus dieser Läsion nur in einigen Fällen ein manifestes follikuläres Lymphom. b,c Follikuläres Lymphom mit persistierenden reaktiven Keimzentren. b Die Immunreaktion für BCL-2 mit dem monoklonalen Antikörper Klon 124 ist in allen, d. h. in den reaktiven und neoplastischen Keimzentren negativ. c Dasselbe follikuläre Lymphom wie in b. Die Immunreaktion für BCL-2 erfolgte hier mit dem monoklonalen anti-BCL-2-Antikörper E17. Mit diesem Antikörper erweisen sich die neoplastischen Keimzentren als positiv, während die reaktiven Keimzentren ungefärbt bleiben. Der Befund in b und c zeigt, dass das Epitop auf dem BCL-2-Molekül, gegen welches der anti-BCL-2-Antikörper 124 gerichtet ist, infolge einer Mutation oder einer Deletion für den Antikörper 124 nicht mehr erkennbar ist. d–g Sogenanntes In-situ-Mantelzelllymphom. d,e Lymphknoten mit dem Bild einer follikulären Hyperplasie. f Derselbe Lymphknoten wie in d und e Immunreaktion für Cyclin D1: Es stellen sich einzelne Cyclin-D1-positive Zellen am inneren Rand des Follikelmantels dar. Dies ist das typische Bild eines In-situ-Mantelzelllymphoms. g Lymphknoten aus der Nachbarschaft des Lymphknotens von d und e. Hier stellt sich in der Immunreaktion für Cyclin D1 ein manifestes Mantelzelllymphom mit Ausbreitung in der gesamten Mantelzone dar. Dieser Fall zeigt, dass ein In-situ-Mantelzelllymphom in einem Lymphknoten mit einem manifesten Mantellzelllymphom in einem anderen Lymphknoten einhergehen kann Der Onkologe 9 · 2011 | 783 Leitthema Tab. 3 Eigenschaften des Burkitt-Lymphoms und der hoch malignen Lymphome mit intermediären Merkmalen zwischen einem DLBCL und einem Burkitt-Lymphom nach [77] Burkitt-Lymphom CD10- und BCL-6 Expression Ki-67 < 95% IRF4/MUM1 Expression BCL-2-Epression EBV-Infektion (EBER) IGH-MYC-Translokation IGL-MYC-Translokation Genexpressionsprofil Morphologie + 0% 4% 4%, schwach 20–33% 83% 17% BL-Signatur Burkitt lig entdeckt. Einige Patienten mit einem solchen Befund entwickeln ein manifestes Mantelzelllymphom, andere zeigen über Jahre keine Progression [21, 52]. Allerdings wiesen die bei 4 verschiedenen Patienten aufgetretenen In-situ-MCL, die die Autoren dieses Artikels (unveröffentlichte Beobachtung) in 2 Lymphknoten, einer Tonsille und einer Schilddrüse beobachtet haben, an anderer Stelle ein manifestes MCL auf (. Abb. 5g). Diese Beobachtung zeigt, dass bei der Diagnose eines In-situ-MCL auf eine ausgiebige Ausbreitungs- (Staging-)Diagnostik nicht verzichtet werden darf. Bedeutung klinischer Merkmale für die Definition von Krankheiten Klinische Merkmale haben Relevanz für die richtige Einordnung von Lymphomen und sind bei einigen Lymphomen das essenzielle Kriterium für die Definition der Entität. Die 2008-WHO-Klassifikation hat dieses Konzept weiter verfolgt und klinische Merkmale wie Alter- und Tumorlokalisation in die Definition von einigen neuen Lymphomformen inkorporiert. Beispiele sind das schon erwähnte EBV-positive DLBCL der Älteren, das pädiatrische follikuläre Lymphom, das PMBCL und das nodale Marginalzonenlymphom (NMZL) des Kindesalters [80, 81]. Grauzonenlymphome In den letzten 20 Jahren wurden überlappende Merkmale insbesondere zwischen den hoch malignen Lymphomkategorien sowie zwischen dem DLBCL und dem Hodgkin-Lymphom beobachtet. 784 | Der Onkologe 9 · 2011 Single Hit inter­ Double-Hitmediäres Lymphom Lymphom + + ? 75% ? 42% 10%, schwach 100%, stark ? 0% 50% 0% ? 82% Intermediäre Signatur Atypisches Burkitt-Lymphom bzw. DLBCL Grauzone zwischen dem Burkitt-Lymphom und DLBCL Zwei kürzliche Genexpressionsanalysen [16, 36] haben die Existenz von Grenzfällen zwischen dem Burkitt-Lymphom (BL) und dem DLBCL bestätigt. Diese Analysen haben gezeigt, dass es Fälle mit einer intermediären Transkriptionssignatur gibt, welche Charakteristika vom BL und Charakteristika des DLBCL aufweisen. Diese intermediären Fälle kommen vornehmlich bei Erwachsenen vor, haben meist einen Keimzentrumszellphänotyp (CD20 +, BCL6 +, CD10 +) und MYCBrüche, wodurch sie dem BL ähneln. Allerdings weisen diese intermediären Fälle auch Merkmale auf, die sie vom BL unterscheiden: eine vom klassischen BL abweichende Morphologie, ein Wachstumsfraktion, die zwar groß ist, jedoch in der Regel kleiner ist als beim BL und eine Expression von BCL-2. Diesem immunhistologischen Profil kann zytogenetisch eine zweite Translokation zugrunde liegen, sodass nicht nur das MYC-Gen, sondern auch das BCL-2-Gen unter die Kontrolle eines Enhancer/Promotor des IGH-Gens bzw. der IGL-Gene gelangt. Diese Lymphome werden als „Double-Hit“-Lymphome bezeichnet und gehen klinisch mit einer sehr schlechten Prognose einher [4, 77], so dass ihre frühzeitige diagnostische Separierung und Zuordnung der Patienten zu Hochrisikogruppen indiziert erscheint. Biologisch ist interessant, dass bei diesen Lymphomen in der Regel nicht die t(8;14), sondern fast ausschließlich die t(2;8) oder t(8;22) auftreten, d. h. dass das MYC-Gen auf eines der IGL-Gene und nicht auf das IGH-Gen transloziert ist. Eines der IGHGene ist bei diesen Lymphomen häufig in eine t(14;18) involviert, welches die Überexpression von BCL-2 erklärt. >„Double-Hit“-Lymphome gehen klinisch mit einer sehr schlechten Prognose einher Bei einigen wenigen Patienten wurde gleichzeitig ein follikuläres Lymphom mit t(14;18) und ein „Double-Hit“-Lymphom diagnostiziert. Diese Fälle deuten darauf hin, dass sich Double-Hit-Lymphome auf dem Boden eines follikulären Lymphoms durch Hinzutreten eines MYC-Bruches entwickeln können. Um zu vermeiden, dass diese intermediären Fälle nicht bei der Archivierung unauffinbar verloren gehen, sondern zukünftiger Forschung zur Verfügung stehen, hat die 2008-WHO-Klassifikation unter dem Namen B-Zell-Lymphom, unklassifiziert mit intermediären Eigenschaften zwischen einem diffusen großzelligen B-Zell-Lymphom und einem Burkitt-Lymphom eine Kategorie geschaffen, der diese intermediären Tumoren zugeordnet werden können (. Tab. 3). Klinisch kommt der Identifikation der Lymphome mit einem Double-Hitoder einem Tripple-Hit-Ereignis eine besondere Bedeutung zu, weil diese Tumoren eine sehr ungünstige Prognose haben und deshalb eine andere Therapie erfordern als das BL und das DLBCL. Das Vorliegen eines Double-Hit-Lymphoms kann vermutet werden, wenn eine High-GradeMorphologie verbunden mit einem Keimzentrumsphänotyp und einer starken Expression von BCL-2 und des MYC-Potein vorliegt. Die Double-Hit-Translokation kann bei diesen Fällen am Paraffinschnitt z. B. mit der FISH-Technik nachgewiesen oder ausgeschlossen werden. Grauzone zwischen dem PMBCL und dem klassischen Hodgkin-Lymphom Genexpressionsanalysen haben belegt, dass es nicht nur morphologische und immunhistologischen Überschneidungen zwischen dem PMBCL und dem im Mediastinum auftretenden klassischen Hodg­kin-Lymphom (cHL) vom nodulär sklerosierenden Typ gibt, sondern auch Gemeinsamkeiten bei den Trans­ kriptionsprofilen [69, 74]. Die enge Verwandtschaft zwischen dem PMBCL und dem cHL ist durch weitere Studien untermauert worden. In diesen wird über das simultane oder sequenzielle Auftreten von PMBCL und dem cHL in denselben Patienten und über Übergänge in der Morphologie und Immunphänotyp zwischen den zwei Entitäten berichtet [39]. Klinisch scheint die Identifikation dieser intermediären Fälle von Bedeutung zu sein, weil diese sich offenbar aggressiver verhalten als das PMBCL und das cHL. Eine optimale Therapie ist für diese Tumorgruppe bisher noch nicht gefunden worden. Offene Fragen und zukünftige Herausforderungen Eine Komponente des Erfolgs der 2008-WHO-Klassifikation geht auf die Erhöhung der Zahl der Mitwirkenden auf insgesamt 130 Pathologen und Hämatologen aus fast allen Teilen der Welt zurück, wodurch der Konsensus zum Klassifikationskonzept eine deutliche Verbreiterung erfuhr. Zum Erfolg gehören auch die Aktualisierung der Klassifikation und die Integration neuer Konzepte entsprechend dem wissenschaftlichen Fortschritt. Trotzdem bleiben viele Fragen offen. Die Kategorie der DLBCL, nicht weiter spezifiziert, und der peripheren TZell-Lymphome, nicht weiter spezifiziert (PTCL, NOS), setzen sich wahrscheinlich aus mehreren Entitäten zusammen. Diese ließen sich in Ermangelung von geeigneten Biomarkern bisher nicht identifizieren bzw. abgrenzen. Die kürzliche Identifikation von follikulären T-Zellen (TFH) machte die Ableitung der Tumorzellen des angioimmunoblastischen T-Zell Lymphoms von dieser neuen T-Zell-Subpopulation möglich (. Abb. 4d, [17, 60]). Die follikulär wachsende Variante des PTCL scheint auch von den follikulären T-Zellen auszugehen. Es ist berichtet, dass einige dieser Fälle, die t(5;9), tragen [35, 78], in der es zu einer Fusion zwischen dem ITK-Gen und dem SYK-Gen kommt. Es ist aber nicht klar, ob alle PTCL, die TFHMarker exprimieren, ein und derselben Entität angehören [67]. Das der REAL- und den WHO-Klassifikationen zugrunde liegende Konzept war, dass sich die malignen Lympho- me aus klar voneinander abgrenzbaren Krankheitsentitäten zusammensetzen. Die Forschung und Beobachtungen der letzten Jahre stellen dieses Konzept in seiner Absolutheit z. T. in Frage. >Die Grenze zwischen verschiedenen Lymphomentitäten ist nicht immer scharf Die Identifikation von Grauzonen zwischen dem BL und dem DLBCL sowie dem PMBCL und dem cHL zeigen, dass die Grenze zwischen verschiedenen Lymphomentitäten nicht immer scharf ist. In diese Richtung weist auch die klonale Verwandtschaft bei „Composite-Lymphomen“, die bei simultan oder sequenziell aufgetretenen Lymphomen wie FL und MZL, cHL und FL oder cHL und CLL oder cHL und MCL festgestellt wurden [2, 8, 46, 75]. Ferner ist kürzlich gezeigt worden, dass es identische klonale Umlagerungen der Antigenrezeptoren bei lympho­blastischen Lymphomen und nachfolgend aufgetretenen LangerhansZell-Histiozytosen [23, 63] sowie bei FL mit assoziierten echten histiozytischen Sarkomen geben kann [22]. Diese Befunde belegen, dass völlig verschiedene Tumoren von ein und derselben transformierten Zelle ausgehen können. Dieses im klinischen Bereich beobachtete Phänomen steht im Einklang mit experimentellen Modellen, in denen durch Modulation der Zusammensetzung der Trans­ kriptionsfaktoren der Zelltyp (z. B. B-Zelle in einen Makrophagen) geändert werden konnte. Fazit für die Praxis Die Zahl der inzwischen definierten Lymphomentitäten und ihrer Subformen ist erheblich größer als früher angenommen. Eine verlässliche Diagnostik reaktiver und neoplastischer Läsionen des lymphatischen Systems erfordert: 1.eine fundierte Kenntnis sämtlicher nichtneoplastischer Zellen des lymphatischen Systems einschließlich ihrer Differenzierungsformen und Genexpressionsprofile, 2.eine fundierte Kenntnis sämtlicher Lymphomentitäten, 3.die Verfügbarkeit von Sondermethoden zum Nachweis von 1molekularen Differenzierungsmarkern der verschiedenen Lymphozytentypen, 1genetischen Veränderungen bei Lymphomen, 1Klonalität im B-Zell- und T-ZellBereich und 4.die Bereitschaft, ständig neue Sonderverfahren zu etablieren, um die Diagnostik weiter zu verbessern. Korrespondenzadresse Prof. Dr. Dr. h.c. H. Stein Berliner Referenz- und Konsultationszentrum für Lymphom- und Hämatopathologie am Institut für Pathodiagnostik Berlin Komturstraße 58–62, 12099 Berlin [email protected] Danksagung. Die Autoren danken Frau Dr. Roshanak Bob für Ihre Diskussionsbeiträge zum Konzept und Inhalt dieses Artikels. Interessenkonflikt. Der korrespondierende Autor gibt an, dass kein Interessenkonflikt besteht. Literatur 1. (1997) A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin’s lymphoma. The Non-Hodgkin’s Lymphoma Classification Project. Blood 89:3909–3918 2. Aiello A, Du MQ, Diss TC et al (1999) Simultaneous phenotypically distinct but clonally identical mucosa-associated lymphoid tissue and follicular lymphoma in a patient with Sjogren’s syndrome. Blood 94:2247–2251 3. Asano N, Yamamoto K, Tamaru J et al (2009) Agerelated Epstein-Barr virus (EBV)-associated B-cell lymphoproliferative disorders: comparison with EBV-positive classic Hodgkin lymphoma in elderly patients. Blood 113:2629–2636 4. Aukema SM, Siebert R, Schuuring E, Imhoff GW van, Kluin-Nelemans HC, Boerma EJ, Kluin PM (2011) Double-hit B-cell lymphomas. Blood 117(8):2319–2331 Epub 2010 Nov 30 5. Bekkenk MW, Vermeer MH, Jansen PM et al (2003) Peripheral T-cell lymphoma unspecified presenting in the skin: analysis of prognostic factors in a group of 82 patients. Blood 102:2213–2219 6. Booman M, Douwes J, Glas AM et al (2006) Mechanisms and effects of loss of human leukocyte antigen class II expression in immune-privileged site-associated B-cell lymphoma. Clin Cancer Res 12:2698–2705 7. Bosga-Bouwer AG, Imhoff GW van, Boonstra R et al (2003) Follicular lymphoma grade 3B includes 3 cytogenetically defined subgroups with primary t (14;18), 3q27, or other translocations: t (14;18) and 3q27 are mutually exclusive. Blood 101:1149–1154 Der Onkologe 9 · 2011 | 785 Leitthema 8. Bräuninger A, Hansmann ML, Strickler JG, Dummer R, Burg G, Rajewsky K, Küppers R (1999) Identification of common germinal-center B-cell precursors in two patients with both Hodgkin’s disease and non-Hodgkin’s lymphoma. N Engl J Med 340(16):1239–1247 9. Campo E, Swerdlow SH, Harris NL, Pileri S, Stein H, Jaffe ES (o J) The 2008 WHO classification of lymphoid neoplasms and beyond: evolving concepts and practical apllications. Blood prepublished online 201 10. Chen W, Lau SK, Fong D et al (2009) High frequency of clonal immunoglobulin receptor gene rearrangements in sporadic histiocytic/dendritic cell sarcomas. Am J Surg Pathol 33:863–873 11. Choi WW, Weisenburger DD, Greiner TC et al (2009) A new immunostain algorithm classifies diffuse large B-cell lymphoma into molecular subtypes with high accuracy. Clin Cancer Res 15:5494–5502 12. Chott A, Haedecke W, Mosberger I, Fodinger M, Winkler K, Mannhalter C, Müller-Hermelink HK (1998) Most CD56 + intestinal lymphomas are CD8 + CD5- T-cell lymphomas of monomorphic small to medium size histology. AM J Pathol 153:1483–1490 13. Colomo L, Loong F, Rives S et al (2004) Diffuse large B-cell lymphomas with plasmablastic differentiation represent a heterogeneous group of disease entities. Am J Surg Pathol 28:736–747 14. Cong P, Raffeld M, Teruya-Feldstein J et al (2002) In situ localization of follicular lymphoma: description and analysis by laser capture microdissection. Blood 99:3376–3382 15. (o A) (o J) Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Br J Haematol 121:749–757 16. Dave SS, Fu K, Wright GW et al (2006) Molecular diagnosis of Burkitt’s lymphoma. N Engl J Med 354:2431–2442 17. Leval L de, Rickman DS, Thielen C et al (2007) The gene expression profile of nodal peripheral T-cell lymphoma demonstrates a molecular link between angioimmunoblastic T-cell lymphoma (AITL) and follicular helper T (TFH) cells. Blood 109:4952– 4963 18. Leeuw RJ de, Zettl A, Klinker E et al (2007) Whole-genome analysis and HLA genotyping of enteropathy-type T-cell lymphoma reveals 2 distinct lymphoma subtypes. Gastroenterology 132:1902– 1911 19. Dijkman R, Tensen CP, Jordanova ES et al (2006) Array-based comparative genomic hybridization analysis reveals recurrent chromosomal alterations and prognostic parameters in primary cutaneous large B-cell lymphoma. J Clin Oncol 24:296–305 20. Eberle FC, Rodriguez-Canales J, Wei L et al (2010) Methylation profiling of mediastinal gray zone lymphoma reveals a distinctive signature with elements shared by classical Hodgkin’s lymphoma and primary mediastinal large B-cell lymphoma. Haematologica, In Press 21. Espinet B, Sole F, Pedro C et al (2005) Clonal proliferation of cyclin D1-positive mantle lymphocytes in an asymptomatic patient: an early-stage event in the development or an indolent form of a mantle cell lymphoma? Hum Pathol 36:1232–1237 22. Feldman AL, Arber DA, Pittaluga S et al (2008) Clonally related follicular lymphomas and histiocytic/dendritic cell sarcomas: evidence for transdifferentiation of the follicular lymphoma clone. Blood 111:5433–5439 786 | Der Onkologe 9 · 2011 23. Feldman AL, Berthold F, Arceci RJ et al (2005) Clonal relationship between precursor T-lymphoblastic leukaemia/lymphoma and Langerhans-cell histiocytosis. Lancet Oncol 6:435–437 24. Finn LS, Viswanatha DS, Belasco JB et al (1999) Primary follicular lymphoma of the testis in childhood. Cancer 85:1626–1635 25. Garcia JF, Mollejo M, Fraga M et al (2005) Large Bcell lymphoma with Hodgkin’s features. Histopathology 47:101–110 26. Guillermo A, Estrach T, Campo E (2008) Primary cutaneous small/medium CD4 + T-cell lymphomas: a heterogeneous group of tumors with different clinicopathologic features and outcome. J Clin Oncol 26(20):3364–3371 Epub 2008 Jun 9.39 27. Wird ergänzt 28. Gradowski JF, Jaffe ES, Warnke RA et al (2010) Follicular lymphomas with plasmacytic differentiation include two subtypes. Mod Pathol 23:71–79 29. Gu K, Fu K, Jain S et al (2009) t (14;18)-negative follicular lymphomas are associated with a high frequency of BCL6 rearrangement at the alternative breakpoint region. Mod Pathol 22:1251–1257 30. Hallek M, Cheson BD, Catovsky D et al (2008) Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood 111:5446–5456 31. Hans CP, Weisenburger DD, Vose JM et al (2003) A significant diffuse component predicts for inferior survival in grade 3 follicular lymphoma, but cytologic subtypes do not predict survival. Blood 101:2363–2367 32. Harris NL, Jaffe ES, Stein H et al (1994) A revised European-American classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group. Blood 84:1361–1392 33. Hicks EB, Rappaport H, Winter W (1956) Follicular lymphoma; a re-evaluation of its position in the scheme of malignant lymphoma, based on a survey of 253 cases. Cancer 9:792–821 34. Hoefnagel JJ, Dijkman R, Basso K et al (2005) Distinct types of primary cutaneous large B-cell lymphoma identified by gene expression profiling. Blood 105:3671–3678 35. Huang Y, RA de, LL de et al (2010) Gene expression profiling identifies emerging oncogenic pathways operating in extranodal NK/T-cell lymphoma, nasal type. Blood 115:1226–1237 36. Hummel M, Bentink S, Berger H et al (2006) A biologic definition of Burkitt’s lymphoma from transcriptional and genomic profiling. N Engl J Med 354:2419–2430 37. International Myeloma Working Group (2003) Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Br J Haematol 121(5):749–757 38. Jaffe ES, Harris NL, Stein H, Isaacson PG (2008) Classification of lymphoid neoplasms: the microscope as a tool for disease discovery. Blood 112:4384–4399 39. Jaffe ES, Zarate-Osorno A, Medeiros LJ (1992) The interrelationship of Hodgkin’s disease and nonHodgkin’s lymphomas – lessons learned from composite and sequential malignancies. Semin Diagn Pathol 9:297–303 40. Jaffe ES (1983) Follicular lymphomas: possibility that they are benign tumors of the lymphoid system. J Natl Cancer Inst 70:401–403 41. Karube K, Guo Y, Suzumiya J et al (2007) CD10MUM1 + follicular lymphoma lacks BCL2 gene translocation and shows characteristic biologic and clinical features. Blood 109:3076–3079 42. Kyle RA, Rajkumar SV (2009) Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma. Leukemia 23(1):3–9. doi:10.1038/leu.2008.291. PMC 2627786. PMID 18971951 43. LeBoit PE, Burg G, Weedon D, Sarasin A (Hrsg) (2007) World Health Organization classification of tumours. Pathology and genetics of skin tumours. 3. Aufl, IARC Press, Lyon 44. Lecluse Y, Lebailly P, Roulland S et al (2009) t (11;14)-positive clones can persist over a long period of time in the peripheral blood of healthy individuals. Leukemia 23:1190–1193 45. Lorsbach RB, Shay-Seymore D, Moore J et al (2002) Clinicopathologic analysis of follicular lymphoma occurring in children. Blood 99:1959–1964 46. Marafioti T, Hummel M, Anagnostopoulos I, Foss HD, Huhn D, Stein H (1999).Classical Hodgkin’s Disease and Follicular Lymphoma Originating from the Same Germinal Centre B Cell. J Clin Oncol 17:3804–3809 47. Marti GE, Rawstron AC, Ghia P et al (2005) Diagnostic criteria for monoclonal B-cell lymphocytosis. Br J Haematol 130:325–332 48. Montes-Moreno S, Castro Y, Rodriguez-Pinilla SM et al (2010) Intrafollicular neoplasia/in situ follicular lymphoma: review of a series of 13 cases. Histopathology 56:658–662 49. Montes-Moreno S, Gonzalez-Medina AR, Rodriguez-Pinilla SM et al (2010) Aggressive large B-cell lymphoma with plasma cell differentiation: immunohistochemical characterization of plasmablastic lymphoma and diffuse large B-cell lymphoma with partial plasmablastic phenotype. Haematologica 95:1342–1349 50. Monti S, Savage KJ, Kutok JL et al (2005) Molecular profiling of diffuse large B-cell lymphoma identifies robust subtypes including one characterized by host inflammatory response. Blood 105:1851– 1861 51. Nieto WG, Almeida J, Romero A et al (2009) Increased frequency (12%) of circulating chronic lymphocytic leukemia-like B-cell clones in healthy subjects using a highly sensitive multicolor flow cytometry approach. Blood 114:33–37 52. Nodit L, Bahler DW, Jacobs SA, Locker J, Swerdlow SH (2003) Indolent mantle cell lymphoma with nodal involvement and mutated immunoglobulin heavy chain genes. Hum Pathol 34:1030–1034 53. Oschlies I, Salaverria I, Mahn F et al (2010) Pediatric follicular lymphoma–a clinico-pathological study of a population-based series of patients treated within the Non-Hodgkin’s Lymphoma-BerlinFrankfurt-Munster (NHL-BFM) multicenter trials. Haematologica 95:253–259 54. Ott G, Katzenberger T, Lohr A et al (2002) Cytomorphologic, immunohistochemical, and cytogenetic profiles of follicular lymphoma: 2 types of follicular lymphoma grade 3. Blood 99:3806–3812 55. Ott G, Ziepert M, Klapper W et al (2010) Immunoblastic morphology but not the immunohistochemical GCB/nonGCB classifier predicts outcome in diffuse large B-cell lymphoma in the RICOVER-60 trial of the DSHNHL. Blood 116(23):4916–4925 Epub 2010 Aug 24 Lesetipp 56. Owen RG, Treon SP, Al-Katib A et al (2003) Clinicopathological definition of Waldenstrom’s macroglobulinemia: consensus panel recommendations from the Second International Workshop on Waldenstrom’s Macroglobulinemia. Semin Oncol 30:110–115 57. Oyama T, Ichimura K, Suzuki R et al (2003) Senile EBV + B-cell lymphoproliferative disorders: a clinicopathologic study of 22 patients. Am J Surg Pathol 27:16–26 58. Oyama T, Yamamoto K, Asano N et al (2007) Agerelated EBV-associated B-cell lymphoproliferative disorders constitute a distinct clinicopathologic group: a study of 96 patients. Clin Cancer Res 13:5124–5132 59. Park S, Lee J, Ko YH et al (2007) The impact of Epstein-Barr virus status on clinical outcome in diffuse large B-cell lymphoma. Blood 110:972–978 60. Piccaluga PP, Agostinelli C, Califano A et al (2007) Gene expression analysis of angioimmunoblastic lymphoma indicates derivation from T follicular helper cells and vascular endothelial growth factor deregulation. Cancer Res 67:10703–10710 61. Piva R, Agnelli L, Pellegrino E et al (2010) Gene expression profiling uncovers molecular classifiers for the recognition of anaplastic large-cell lymphoma within peripheral T-cell neoplasms. J Clin Oncol 28:1583–1590 62. Rappaport H (1996) Tumours of the Haematopoietic system. AFIP, Washington DC 63. Ratei R, Hummel M, Anagnostopoulos I et al (2010) Common clonal origin of an acute B-lymphoblastic leukemia and a Langerhans‘ cell sarcoma: evidence for hematopoietic plasticity. Haematologica 95(9):1461–1466 64. Rawstron AC, Bennett FL, O’Connor SJ et al (2008) Monoclonal B-cell lymphocytosis and chronic lymphocytic leukemia. N Engl J Med 359:575–583 65. Richard P, Vassallo J, Valmary S et al (2006) In situlike mantle cell lymphoma: a report of two cases. J Clin Pathol 59:995–996 66. Rodríguez Pinilla SM, Roncador G, Rodríguez-Peralto JL et al (2009) Piris MA. Am J Surg Pathol 33(1):81–90 67. Rodriguez-Pinilla SM, Atienza L, Murillo C et al (2008) Peripheral T-cell lymphoma with follicular Tcell markers. Am J Surg Pathol 32:1787–1799 68. Rosenwald A, Wright G, Chan WC et al (2002) The use of molecular profiling to predict survival after chemotherapy for diffuse large-B-cell lymphoma. N Engl J Med 346:1937–1947 69. Rosenwald A, Wright G, Leroy K et al (2003) Molecular diagnosis of primary mediastinal B cell lymphoma identifies a clinically favorable subgroup of diffuse large B cell lymphoma related to Hodgkin lymphoma. J Exp Med 198:851–862 70. Roulland S, Navarro JM, Grenot P et al (2006) Follicular lymphoma-like B cells in healthy individuals: a novel intermediate step in early lymphomagenesis. J Exp Med 203:2425–2431 71. Rubenstein JL, Fridlyand J, Shen A et al (2006) Gene expression and angiotropism in primary CNS lymphoma. Blood 107:3716–3723 72. Salaverria I, Zettl A, Bea S et al (2008) Chromosomal alterations detected by comparative genomic hybridization in subgroups of gene expression-defined Burkitt’s lymphoma. Haematologica 93:1327–1334 788 | Der Onkologe 9 · 2011 73. Savage KJ, Harris NL, Vose JM et al (2008) ALKanaplastic large-cell lymphoma is clinically and immunophenotypically different from both ALK + ALCL and peripheral T-cell lymphoma, not otherwise specified: report from the International Peripheral T-Cell Lymphoma Project. Blood 111:5496–5504 74. Savage KJ, Monti S, Kutok JL et al (2003) The molecular signature of mediastinal large B-cell lymphoma differs from that of other diffuse large Bcell lymphomas and shares features with classical Hodgkin lymphoma. Blood 102:3871–3879 75. Schmitz R, Renne C, Rosenquist R et al (2005) Insights into the multistep transformation process of lymphomas: IgH-associated translocations and tumor suppressor gene mutations in clonally related composite Hodgkin’s and non-Hodgkin’s lymphomas. Leukemia 19:1452–1458 76. Shanafelt TD, Ghia P, Lanasa MC, Landgren O, Rawstron AC (2010) Monoclonal B-cell lymphocytosis (MBL): biology, natural history and clinical management. Leukemia 24:512–520 77. Snuderl M, Kolman OK, Chen YB et al (2010) B-cell lymphomas with concurrent IGH-BCL2 and MYC rearrangements are aggressive neoplasms with clinical and pathologic features distinct from Burkitt lymphoma and diffuse large B-cell lymphoma. Am J Surg Pathol 34:327–340 78. Streubel B, Scheucher B, Valencak J et al (2006) Molecular cytogenetic evidence of t (14;18) (IGH;BCL2) in a substantial proportion of primary cutaneous follicle center lymphomas. Am J Surg Pathol 30:529–536 79. Swerdlow SH, Campo E, Harris NL et al (2008) WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. IARC, Lyon 80. Swerdlow SH (2004) Pediatric follicular lymphomas, marginal zone lymphomas, and marginal zone hyperplasia. Am J Clin Pathol 122(Suppl):S98– S109 81. Taddesse-Heath L, Pittaluga S, Sorbara L et al (2003) Marginal zone B-cell lymphoma in children and young adults. Am J Surg Pathol 27:522–531 82. Traverse-Glehen A, Pittaluga S, Gaulard P et al (2005) Mediastinal gray zone lymphoma: the missing link between classic Hodgkin’s lymphoma and mediastinal large B-cell lymphoma. Am J Surg Pathol 29:1411–1421 83. Tun HW, Personett D, Baskerville KA et al (2008) Pathway analysis of primary central nervous system lymphoma. Blood 111:3200–3210 84. Vose J, Armitage J, Weisenburger D (2008) International peripheral T-cell and natural killer/T-cell lymphoma study: pathology findings and clinical outcomes. J Clin Oncol 26:4124–4130 85. Willemze R, Jaffe ES, Burg G et al (2005) WHOEORTC classification for cutaneous lymphomas. Blood 105:3768–3785 86. Zignego AL, Ferri C, Giannelli F et al (2002) Prevalence of bcl-2 rearrangement in patients with hepatitis C virus-related mixed cryoglobulinemia with or without B-cell lymphomas. Ann Intern Med 137:571–580 Medikamentöse Therapie von Hauttumoren Für die medikamentöse Therapie von Hauttumoren stehen neben verschiedenen Zytostatika und Immunmodulatoren auch spezifisch in die Signaltransduktion von Tumoren eingreifende Substanzen zur Verfügung. Das verbesserte Verständnis der Pathogenese von Hauttumoren zusammen mit den innovativen Methoden der medizinische Chemie, ermöglichte die rasante Entwicklung von Arzneistoffen mit zum Teil völlig neuen Wirkmechanismen – Arzneistoffe, die aktuell zur Therapie von Hauttumoren zugelassen wurden bzw. kurz vor der Zulassung stehen! In diesen spannenden Zeiten des Umbruchs, widmet Der Hautarzt diesen Entwicklungen das Leitthemenheft 06/2011. Mit u. a. folgenden Beiträgen wird darin der Bogen von der „altbewährten“ Therapie über die neuen Substanzen bis zu den zukünftigen Therapieansätzen gespannt: F Adjuvante systemische Therapie des Melanoms F Therapie des inoperabel metastasierten Melanoms F Medikamentöse Therapie nichtmelanozytärer epithelialer Tumore F Systemische Therapie kutaner Lymphome F Kutane Nebenwirkungen der medikamentösen Tumortherapie Bestellen Sie diese Ausgabe zum Preis von EUR 34,- zzgl. Versandkosten bei: Springer Customer Service Center GmbH Kundenservice Zeitschriften Haberstr. 7 69126 Heidelberg Tel.: +49 6221-345-4303 Fax: +49 6221-345-4229 [email protected] P.S. Vieles mehr rund um Ihr Fachgebiet finden Sie auf www.springermedizin.de