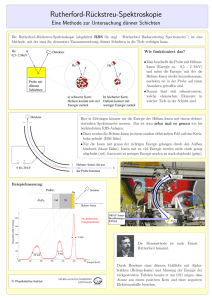
Lösungen, Salze, Ionen und Elektrolyte
Werbung

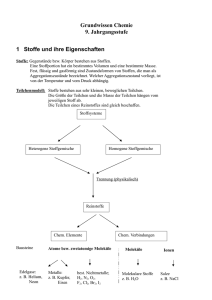
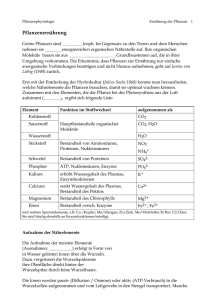
Lösungen, Salze, Ionen und Elektrolyte Lösungen Eine Lösung ist in der Chemie ein homogenes Gemisch, das aus zwei oder mehr chemisch reinen Stoffen besteht. Sie enthält einen oder mehrere gelöste Stoffe (die Solute) und ein Lösungsmittel (das selbst eine Lösung sein kann), meist der Stoff, der in größerer Menge vorhanden ist. Die Lösung kann fest, flüssig oder gasförmig sein. Lösungen sind rein äußerlich nicht als solche erkennbar, da sie per definitionem und anders als Dispersionen nur eine Phase besitzen und die gelösten Stoffe daher gleichmäßig im Lösungsmittel verteilt sind. Die Lösungsmittel sind üblicherweise Flüssigkeiten. Die gelösten Stoffe können sein: gasförmig (z. B. Luftgase wie Sauerstoff und Stickstoff in Wasser, Chlorwasserstoff oder Ammoniak in Wasser, Kohlenstoffdioxid in Sekt oder Mineralwasser), flüssig (z. B. Alkohol in Wasser) fest (z. B. Kochsalz oder Calciumhydrogencarbonat in Wasser) Ist Wasser das Lösungsmittel spricht man von wässrigen Lösungen; ist Alkohol das Lösungsmittel spricht man von alkoholischen Lösungen. Merke - Eine Lösung ist ein homogenes (gleichartiges) Gemisch von zwei oder mehreren Arten von Molekülen. Sie entsteht durch Auflösung. - Das Lösungsmittel ist die Flüssigkeit, in der die Auflösung stattfindet. Es ist im Allgemeinen in großer Menge vorhanden. - Die gelöste Substanz wird im Lösungsmittel aufgelöst. Sie ist meist in geringer Menge vorhanden und kann flüssig oder gasförmig sein, ist häufiger jedoch fest. Merke - Wenn das Lösungsmittel Wasser ist, wird dies als wässrige Lösung bezeichnet. - Ist das Lösungsmittel Alkohol, spricht man von einer alkoholischen Lösung. Merke - Ist die Lösung ein Gemisch aus Wasser und Alkohol, handelt es sich um eine hydroalkoholische Lösung. - Wenn die gelöste Substanz, die dem Lösungsmittel zugesetzt wird, eine Konzentration erreicht, bei der sie sich nicht mehr löst, spricht man von einer gesättigten Lösung. Handout Chemie Seite 1 von 6 Salze Salze sind chemische Verbindungen, die aus positiv geladenen Ionen, den sogenannten Kationen und negativ geladenen Ionen, den sogenannten Anionen aufgebaut sind. Zwischen diesen Ionen liegen ionische Bindungen vor. Fast alle Verbindungen mit diesem Bindungstyp nennt man Salze. Bei anorganischen Salzen werden die Kationen häufig von Metallen und die Anionen häufig von Nichtmetallen oder deren Oxiden gebildet. Als Feststoff bilden sie gemeinsam ein Kristallgitter. Als organische Salze bezeichnet man alle Verbindungen, bei denen mindestens ein Anion oder Kation eine organische Verbindung ist. Verbindungen, bei denen alle Kationen bzw. alle Anionen von Protonen (H+) oder Hydroxiden (OH−) gebildet werden, nennt man nicht Salze, da ihre Wirkung als Säure bzw. Base im Vordergrund steht. Eigenschaften von Salzen Viele Salze sind bei Raumtemperatur Feststoffe mit relativ hohen Schmelzpunkten. Etliche Salze sind recht hart und spröde und haben glatte Bruchkanten bei mechanischer Bearbeitung. Diese Eigenschaften sind recht typisch für Feststoffe, die durch ein Ionengitter aufgebaut sind und daher Kristalle bilden. Aber nicht jeder kristalline Stoff ist ein Salz. So bildet Zucker (Saccharose) auch Kristalle, hat aber kein Ionengitter und zählt nicht zu den Salzen. Zahlreiche Salze sind löslich in Wasser und fast immer unlöslich in organischen Lösungsmitteln. Bei wasserlöslichen Salzen überwindet das Wasser die Gitterenergie des Ionengitters durch Hydratisierung. Ist die Hydrationsenergie ähnlich groß oder größer als die Gitterenergie, ist das Salz mäßig oder gut löslich. In Lösungen sind die einzelnen Ionen von Wassermolekülen recht eng und intensiv ummantelt. Als Reaktion wird dies in der Chemie oft so dargestellt: NaCl(s) → Na+(aq) + Cl-(aq) Handout Chemie Das (s) weist auf einen Feststoff hin und (aq) markiert, dass das Ion hydratisiert vorliegt. Das Lösen von Salzen in Wasser kann den pH-Wert der jeweiligen Lösung verändern. Beeinflusst das Salz den Wert nicht, spricht man von neutralen Salzen. Zu den neutralen Salzen zählt auch das Natriumchlorid. Andere Salze heben oder senken den pH-Wert. Man spricht von basischen bzw. sauren Salzen. Wie ein bestimmtes Salz reagiert, lässt sich nur schwierig aus der Zusammensetzung der Verbindung abschätzen. Grundsätzlich gilt jedoch: Anionen (Säurereste) von starken Säuren reagieren meist neutral. Säurereste von schwachen Säuren reagieren meist basisch. Beispielhaft für Salze, von denen mehrprotonige Säuren bekannt sind, ist das Verhalten der Phosphate. Seite 2 von 6 Trockene Salzkristalle sind elektrische Isolatoren. Salzschmelzen und wässrige Lösungen leiten hingegen den elektrischen Strom aufgrund ihrer frei beweglichen Ionen als Ladungsträger; sie sind Elektrolyte. Kurzfassung Salze Der Begriff Salz ist in der Chemie eine Sammelbezeichnung für die ionisch aufgebauten Verbindungen, die durch die Kombination von Anionen und Kationen entstehen. Diese bilden ein sog. Ionengitter. Oft entstehen Salze beim Zusammenführen von Säuren und Basen: z. B. Salzsäure (HCl) plus Natronlauge (NaOH) gibt Kochsalz (NaCl) und Wasser (H2O). Die Salze bilden meist spröde, teilweise leicht spaltbare Kristalle aus. Viele lösen sich in Wasser mehr oder weniger leicht und bilden dabei – aufgrund ihrer elektrolytischen Dissoziation in Anionen und Kationen – elektrisch leitfähige Lösungen, die Elektrolyte genannt werden. Handout Chemie Seite 3 von 6 Ionen Ein Ion [i ̯oːn] (von altgr. ἰών bzw. ἰόν ión, „gehend“) ist ein elektrisch geladenes Atom oder Molekül. Es enthält mindestens einen positiv geladenen Atomkern. Dessen oder deren Ladung entspricht der Zahl der enthaltenen Protonen. Daneben kann ein Ion Elektronen enthalten. Die nach außen wirksame, beobachtbare Ladung des Ions entsteht durch die unterschiedlichen Anzahlen von Protonen und Elektronen. Ionen sind durch Elektronenmangel positiv, oder durch Elektronenüberschuss negativ geladen. Positiv geladene Ionen werden Kationen, negativ geladene Anionen genannt, da sie jeweils in einem elektrischen Feld zur Kathode (Minuspol) bzw. zur Anode (Pluspol) wandern. Bildung von Ionen Kationen Positiv geladene Ionen (Kationen) werden gebildet, wenn Atome Elektronen (in der Regel Außenelektronen) abgeben. Dadurch entsteht ein relativer Überschuss an Protonen (positive Ladungsträger), der durch die vorhandenen Elektronen (negative Ladungsträger) nicht mehr ausgeglichen wird – die positiven Ladungen überwiegen, das Ion ist positiv geladen! Beispiel: Metall-Ionen sind in der Regel positiv geladen. Gleichung für die Natrium-Ionen-Bildung: Na → Na+ + e− Gleichung für die Magnesium-Ionen-Bildung: Mg → Mg2+ + 2e− Anionen Negativ geladene Ionen (Anionen) werden gebildet, wenn Atome Elektronen aufnehmen. Dadurch entsteht ein relativer Überschuss an Elektronen (negative Ladungsträger), der durch die vorhandenen Protonen (positive Ladungsträger) nicht mehr ausgeglichen wird – die negativen Ladungen überwiegen, das Ion ist negativ geladen. Beispiel: Nichtmetall-Ionen sind in der Regel negativ geladen. Gleichung für die Chlorid-Ionen-Bildung: Cl + e− → Cl− Gleichung für die Sulfid-Ionen-Bildung: S + 2e− → S2− Bewegliche Ionen bilden sich in der Chemie vor allem spontan bei der Lösung von Salzen in polaren Lösungsmitteln (Wasser) z. B. NaCl (fest) + H2O → Na+(gelöst) + Cl−(gelöst), z.B. in den wässrigen Milieus von Zellen und Organismen (Elektrolytlösung). Hier spielen sie eine entscheidende Rolle für die elektrischen Erscheinungen an Membranen, insbesondere für die Erregbarkeit (Membranpotential, Aktionspotential). In reinem Wasser (H2O) liegen ebenfalls Ionen vor, da das Wasser zu einem gewissen Grad in Ionen dissoziiert (geteilt) vorliegt: H2O → H+ + OH-bzw. besser formuliert 2 H2O → H3O+ + OH- Handout Chemie Seite 4 von 6 Kurzfassung Ionen Als Ionen werden Atome oder Moleküle bezeichnet, welche nach Abgabe oder Aufnahme von Elektronen elektrisch geladen sind. Positiv geladene Kationen bilden sich durch Abgabe von Elektronen, negativ geladene Anionen durch Aufnahme von Elektronen. Im elektrischen Feld wandern die Kationen zur negativen Elektrode (Kathode) und die Anionen zur positiv geladenen Elektrode (Anode). Merke Die Eigenschaften der Ionen werden für viele Vorgänge, z. B. kosmetisch für die Wirkstoffeinschleusung in die Haut (Iontophorese) genutzt. Handout Chemie Seite 5 von 6 Elektrolyte Ein Elektrolyt (von agr. ηλεκτρόν elektron, „Bernstein“ i.ü.S „elektrisch“ und agr. λυτικός lytikós, „auflösbar“) ist ein Stoff, der beim Anlegen einer Spannung unter dem Einfluss des dabei entstehenden elektrischen Feldes den elektrischen Strom leitet (Leiter 2. Klasse), wobei seine elektrische Leitfähigkeit und der Ladungstransport durch die gerichtete Bewegung von Ionen bewirkt wird. Außerdem treten an den Elektroden chemische Vorgänge auf. Elektrolyte sind wie ionisierte Gase Ionenleiter. Die Leitfähigkeit von Elektrolyten ist geringer als es für Metalle typisch ist; Metalle werden deshalb als Leiter der 1. Klasse bezeichnet. Elektrolyte sind im weitesten Sinne Stoffe, die zumindest teilweise als Ionen vorliegen. Die wichtigsten Elektrolyte sind demzufolge entweder Säuren, Basen oder Salze. Alle Flüssigkeiten, die Ionen enthalten, sind Elektrolyte. Biologische Elektrolyte Die wichtigsten Ionen biologischer Elektrolyte sind Natrium, Kalium, Calcium, Magnesium, Chlorid, Phosphat und Hydrogencarbonat. Sie sind im Cytosol enthalten, und für die Funktion der Zellen unentbehrlich. Noch weitere Ionen sind als Spurenelemente für die Zelle notwendig, doch sind die genannten Ionen besonders bedeutend im Hinblick auf das Elektrolytgleichgewicht der Zelle, da sie bei der Regulierung des osmotischen Drucks eine herausragende Rolle spielen. Kurzfassung Elektrolyte Unter Elektrolyse versteht man die Zersetzung einer Verbindung durch elektrischen Strom. Sie kann nur bei Verbindungen angewendet werden, die aus Ionen aufgebaut sind, denn für die Durchführung der Elektrolyse benötigt man bewegliche Ladungsträger (sonst kann der Strom nicht fließen). Die Elektrolyse in wässriger oder kolloidaler (gelartiger) Lösung ist die Methode der Iontophorese. Hier gibt es eine bewegliche oder bei Körperbehandlung fest fixierbare Arbeitselektrode (Kathode, Minuspol) und eine am Körper zu fixierende Gegenelektrode (Anode, Pluspol), die dazu dient, den Stromkreis zu schließen. Handout Chemie Seite 6 von 6