Grundwissen Chemie 9. Jahrgangsstufe 1 Stoffe und ihre
Werbung
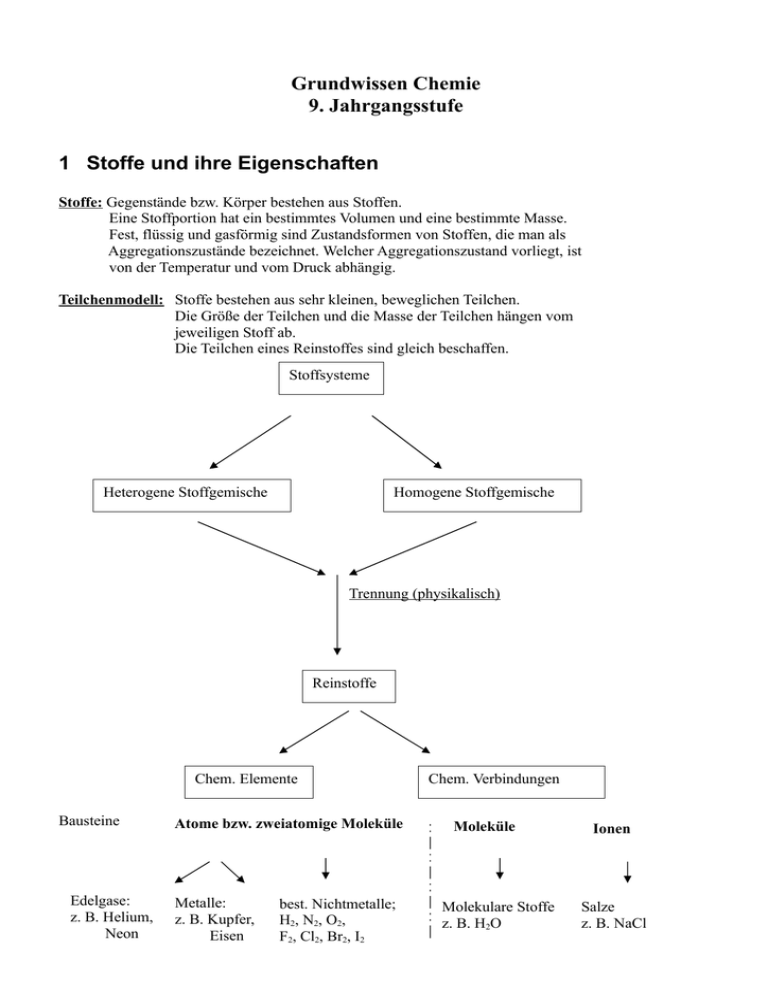
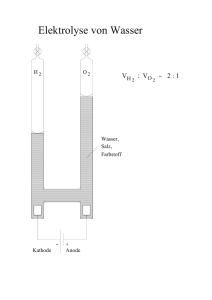
Grundwissen Chemie 9. Jahrgangsstufe 1 Stoffe und ihre Eigenschaften Stoffe: Gegenstände bzw. Körper bestehen aus Stoffen. Eine Stoffportion hat ein bestimmtes Volumen und eine bestimmte Masse. Fest, flüssig und gasförmig sind Zustandsformen von Stoffen, die man als Aggregationszustände bezeichnet. Welcher Aggregationszustand vorliegt, ist von der Temperatur und vom Druck abhängig. Teilchenmodell: Stoffe bestehen aus sehr kleinen, beweglichen Teilchen. Die Größe der Teilchen und die Masse der Teilchen hängen vom jeweiligen Stoff ab. Die Teilchen eines Reinstoffes sind gleich beschaffen. Stoffsysteme Heterogene Stoffgemische Homogene Stoffgemische Trennung (physikalisch) Reinstoffe Chem. Elemente Bausteine Edelgase: z. B. Helium, Neon Atome bzw. zweiatomige Moleküle Metalle: z. B. Kupfer, Eisen best. Nichtmetalle; H2, N2, O2, F2, Cl2, Br2, I2 Chem. Verbindungen Moleküle Molekulare Stoffe z. B. H2O Ionen Salze z. B. NaCl 2 2 Chemische Reaktionen Merkmale: Stoffumwandlung: Änderung der Stoffeigenschaften; Edukte reagieren zu Produkten Energieumsatz: Energieaufnahme: endotherme Reaktion Energieabnahme: exotherme Reaktion Teilchenebene: es findet eine Umgruppierung von Teilchen statt Gesetzmäßigkeiten bei chemischen Reaktionen: Gesetz von der Erhaltung der Masse: Bei chemischen Reaktionen bleibt die Gesamtmasse der beteiligten Stoffe erhalten. Gesetz der konstanten Massenverhältnisse: Zwei Elemente vereinigen sich zu einer bestimmten Verbindung immer im gleichen Massenverhältnis. Zwei Elemente können unterschiedliche Verbindungen mit jeweils unterschiedlichen Massenverhältnissen bilden. Systematik der Stoffänderungen: Analyse: Zerlegung einer chemischen Verbindung in ihre Elemente Synthese: Bildung einer chemischen Verbindung aus ihren Elementen. Energiebeteiligung bei chemischen Reaktionen: Innere Energie Ei: in Stoffportionen enthaltene Energie; Reaktionsenergie: ∆Ei = Ei (Produkte) – Ei (Edukte) Exotherme Reaktion: ∆Ei < 0; Ei (Edukte) > Ei (Produkte) Endotherme Reaktion: ∆Ei > 0; Ei (Edukte) < Ei (Produkte) Aktivierungsenergie: erforderlicher Energieaufwand für chemische Reaktionen Katalysator: Stoff der die Aktivierungsenergie einer Reaktion herabsetzt und sie dadurch beschleunigt. Der Katalysator wird bei der Reaktion nicht verbraucht. 3 Chemische Symbol- und Formelsprache Jedes chemische Element wird durch ein Elementsymbol beschrieben. Alle Elemente sind im PSE aufgelistet. Molekülformel:gibt die genaue Zusammensetzung (Art und Anzahl der Atome) eines Moleküls an Verhältnisformel eines Salzes: gibt an, in welchem Anzahlverhältnis die Ionenarten in der Verbindung enthalten sind. 3 Wertigkeit: Anzahl der H-Atome, die eine Atomart binden oder ersetzen kann. Aufstellen einer Reaktionsgleichung: z. B. Ammoniaksynthese Wortgleichung: Stickstoff + Wasserstoff → Ammoniak Reaktionsgleichung: N2 + 3H2 → 2NH3 Bedeutung: 1 Stickstoff- + 3 Wasserstoff- ergeben 2 Ammoniakmoleküle molelekül moleküle Atombilanz: 2 Stickstoff- + 6 Wasserstoff- ergeben 2 Stickstoffatome + Atome atome 6 Wasserstoffatome 4 Atombau Atommodelle: z. B. Demokrit kleinste Teilchen Dalton Atome, Moleküle Rutherford Kern- HülleModell Energiestufenmodell Dimension: ø Kern / ø Hülle = 1 / 105 = ø Stecknadelkopf / Allianz-Arena München Zeichen: A = Massenzahl = Nukleonenzahl 12 6 C Elementsymbol Z = Ordnungszahl = Kernladungszahl = Protonenzahl Elementarteilchen: Elektronen e- (Z, im neutralen Atom) Protonen p+ (Z) Neutronen n (A-Z) Kern: enthält Protonen und Neutronen (Nukleonen) ; positiv geladen; Massezentrum Isotope: gleiche Protonen – und Elektronenzahl; ungleiche Neutronenzahl → ungleiche Massenzahl Hülle: enthält Elektronen; negativ geladen; nahezu keine Masse Energiestufenmodell: den Elektronen stehen nur bestimmte Energiestufen zur Verfügung; je weiter 4 die Elektronen vom Kern entfernt sind, desto energiereicher sind sie. Elektronenkonfiguration: Kennzeichnung der Energiestufen erfolgt durch Hauptquantenzahlen n (n = 1, 2 … 7) oder durch Großbuchstaben (K, L, M … Q) Besetzung der Energiestufen mit maximal 2n 2 Elektronen. 5 Periodensystem der Elemente (PSE) Aufbau Elemente sind nach aufsteigender Kernladungszahl geordnet Gruppen Gruppen 8. Hauptgruppen - senkrecht - Elemente haben gleiche Anzahl von Valenzelektronen - ähnliches Reaktionsverhalten Perioden - 7 Perioden - waagrecht - Elemente haben gleiche Anzahl von Energiestufen - unterschiedliches Reaktionsverhalten. Edelgase: Edelgase besitzen Edelgaskonfiguration, d. h. sie haben alle - außer Helium (Elektronenduplett) – ein Elektronenoktett. Sie sind energetisch stabil und inert 6 Die chemische Bindung Salze - sind aus Ionen aufgebaut - sie besitzen Ionenbindungen: starke elektrostatische Anziehungskräfte zwischen Kation und Anion. - Salze entstehen bei der Reaktion von Metallatomen mit Nichtmetallatomen; - Metallatom gibt Elektronen ab → Kation (positiv geladen); - Nichtmetallatom nimmt Elektronen auf → Anion (negativ geladen) - → die Ionen besitzen ein Elektronenoktett = Edelgaskonfiguration - z. B. 2Na + Cl2 → 2Na+ + 2ClKation Anion Ionengitter: regelmäßige Anordnung von Ionen, die Ionen werden durch die Ionenbindung zusammengehalten. Eigenschaften der Salze: z. B. spröde, hohe Smp und Sdp, in Lösung und Schmelze: leitfähig (Leiter 2. Ordnung aufgrund freibeweglicher Ionen) Beispiele für Salze: Salze im Meerwasser (NaCl, MgSO 4, CaCl2, KCl) Mineralsalze – lebenswichtig für Menschen (z. B. NaCl, KCl) Salze in der Landwirtschaft (z. B. Phosphat- und Nitratsalze in Mineraldüngern) 5 Salze als Baustoffe (z. B. Kalk CaCO3, Gips CaSO4) Salzartige Oxide (z. B. viele Erze, z. B. Eisenoxide) Molekular gebaute Stoffen sie besitzen Elektronpaarbindung = Atombindung = kovalente Bindung sie entstehen bei der Reaktion von Nichtmetallen untereinander; die Bindung in Molekülen erfolgt durch gemeinsame e —Paare → jedes Atom erreicht damit die Edelgaskonfiguration. z. B. 2H2 + O2 → H2O Einfachbindung: ein gemeinsames e --Paar Doppelbindung: zwei gemeinsame e--Paare Dreifachbindung: drei gemeinsame e --Paare Valenzstrichformeln: Elektronenformeln, bei denen Elektronenpaare durch einen Strich symbolisiert werden. z. B. H – Cl nicht bindendes e--Paar (freies e--Paar) bindendes e--Paar (gemeinsames e--Paar) Beispiele: Molekular gebaute Oxide (Nichtmetalloxide) z. B. Oxide von N und S sind Luftschadstoffe Nichtmetalloxide bilden mit Wasser Säuren Wasserstoffverbindungen z. B. Ammoniak: zur Herstellung z. B. von Düngemitteln Salzsäure (HClaq) Organische Moleküle z. B. Methan im Erdöl Traubenzucker, Proteine, Fette Metalle sie besitzen eine Metallbindung: sie wird durch die Anziehung zwischen positiv geladenen Atomrümpfen und negativ geladenen Elektronen (Elektronengas) bewirkt. Metalle: erreichen die Edelgaskonfiguration dadurch, dass Metallatome ihre Valenzelektronen abgegeben → positiv geladene Metallatomrümpfe → Metallgitter: regelmäßig an Gitterplätzen gebundene positiv geladene Atomrümpfe, die von negativ gebundenem Elektronengas zusammen gehalten werden (Elektronengasmodell) z. B. Mg → Mg2+ + 2epositiver Atomrumpf Elektronengas Eigenschaften der Metalle: z. B. metallischer Glanz, elektrische Leitfähigkeit (Leiter 1. Ordnung), 6 Härte, gute Verformbarkeit, gute Wärmeleitfähigkeit Reaktionsverhalten der Metalle: Unedle Metalle: z. B. Zn, Fe, Cu; geben e-- leicht ab, stabile Metallionen, Reaktionen mit z. B. Sauerstoff, Säuren, Laugen, Wasser. Edle Metalle: z. B. Ag, Au, Pt reaktionsträge, geben e- nur schwer ab, instabile Metallionen Beispiele: Eisen (Stahlerstellung) Aluminium (Folien, Fahrzeugbau) Kupfer (Elektronik) Blei (Autobatterie, Röntgenschutz) 7 Quantitative Aspekte chemischer Reaktionen Beschreibung von Stoffportionen: Masse m [g] Volumen V [l] bzw. [cm3] Stoffmenge n [mol] Teilchenzahl N Avogadro-Konstante NA NA = N/n = 6,022 x 1023 pro mol Molare Masse M [g / mol] M=m/n Die molare Masse ist die Masse von einem Mol eines Stoffes in Gramm ausgedrückt, d. h. die Masse von 6,022 x 1023 Teilchen. Molares Volumen Vm [l / mol] Vm = V / n Molares Volumen für Normzustand: Vmn = 22,4 l / mol d. h. ein Mol eines Gases hat bei Normbedingungen das Volumen von 22,4 l Atommasse ma [u] ein u ist der 12. Teil der Masse des Kohlenstoffisotops 12C Molekülmasse mm [u]