31 3.4 Komplexe/Metallkomplexe - Medi
Werbung

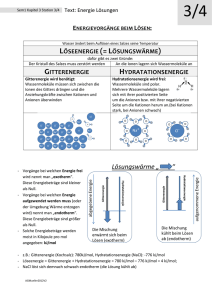
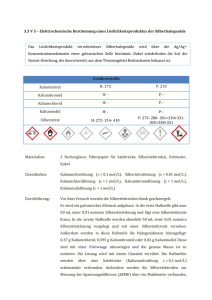
3.4 Komplexe/Metallkomplexe Beispiel Calciumoxalat dissoziiert beim Lösen in Wasser in Ca2+ und Oxalat2−. Gibt man jetzt Ca2+ zu, nähert sich das Löslichkeitsprodukt immer mehr dem Sättigungszustand (s. 3.3.1, S. 30, Gleichung Löslichkeitsprodukt), ohne dass überhaupt Calciumoxalat zugegeben wurde. Mit anderen Worten: Die Löslichkeit von Calciumoxalat nimmt bei Zugabe von einem der beiden Ionen ab. Frage: Etwa wie viel mol BaSO4 lösen sich in 1 l Wasser, wenn das Löslichkeitsprodukt in Wasser etwa 1 ∙ 10−10 mol2/l2 beträgt? Lösung: Zur Beantwortung dieser Frage musst du wissen, dass das Löslichkeitsprodukt L eines Salzes definiert ist als [Kationen] ∙ [Anionen], und dass BaSO4 aus zwei Ionensorten besteht (= Ba2+ Kationen und SO42− Anionen). Da diese beiden Ionen beim Lösen des Salzes zu gleichen Teilen entstehen, darf man die Gleichung vereinfachen zu: L = [Ionen]2. Mit dem Wert für L aus der Frage lautet die Gleichung 1 ∙ 10−10 mol2/l2 = [Ionen]2. Jetzt musst du nur noch wissen, dass man die Wurzel einer Potenz zieht, indem man die Hochzahl durch 2 teilt und schon hast du die richtige Antwort gefunden: Kationen, Anionen und damit auch das daraus bestehende Salz müssen in der Konzentration 10−5 mol/l vorliegen. Denn: 10−5 mol BaSO4 liefern ja 10−5 mol Ba2+ Kationen und 10−5 mol SO42− Anionen. 3.4 Komplexe/Metallkomplexe Die Gruppe der (Metall-)Komplexe hat einige Gemeinsamkeiten, von denen die besondere Bindungsart (koordinative Bindung) bereits weiter vorne in diesem Skript (s. 2.7.2, S. 16) beschrieben wurde. Weitere wichtige Eigenschaften der Metallkomplexe sind: –– Die besondere Art der Darstellung: Komplexe sind an eckigen Klammern um die Formel und an der „Form ihrer Bindungen“ (Pfeile oder gestrichelte Linien) zu erkennen. –– Die Gesamtladung eines Metallkomplexes ist gleich der Summe der Ladungen aus Liganden und Zentralion. Darstellungsform: Hochzahl rechts neben der eckigen Klammer. Beispiel: Im Komplex [Fe(H2O)4(SCN)2]+ ist SCN− einfach negativ geladen (wurde im Schriftlichen angegeben) und Wasser ist neutral (keine Ladung). Da der Gesamtkomplex einfach positiv geladen ist, ergibt sich für das Zentralion Eisen die Ladung 3+. –– Die Stabilität von Metallkomplexen hängt von den Liganden und dem Zentralion ab. –– Die stärksteTendenz zur Komplexbildung haben die Nebengruppenelemente. Neben Fe (Eisen) sind das auch Co (Kobalt), Zn (Zink), Cu (Kupfer), Mn (Mangan) und Cr (Chrom). 3 Merke! Eisen kommt nur in den Oxidationsstufen 2+ und 3+ vor. Sollten also bei einer deiner Rechnungen mit den Ladungen der Komplexe andere Werte für Eisen rauskommen, ist da was falsch gelaufen. O H2 N O– Cu2+ Dies ist ein überaus beliebtes Prüfungsthema mit gleichzeitig hoher Relevanz für die Biochemie! Man denke nur an Verbindungen wie Hämoglobin, Myoglobin, die Cytochrome und Vitamin B12, die alle zur Gruppe der Komplexverbindungen/Metallkomplexe gehören. www.medi-learn.de N H2 Abb. 15: [Cu (NH2CH2-COO)2] O– O medi-learn.de/7-ch1-15­ 31