Grundwissen 8. Jahrgangsstufe Chemie (NTG)
Werbung
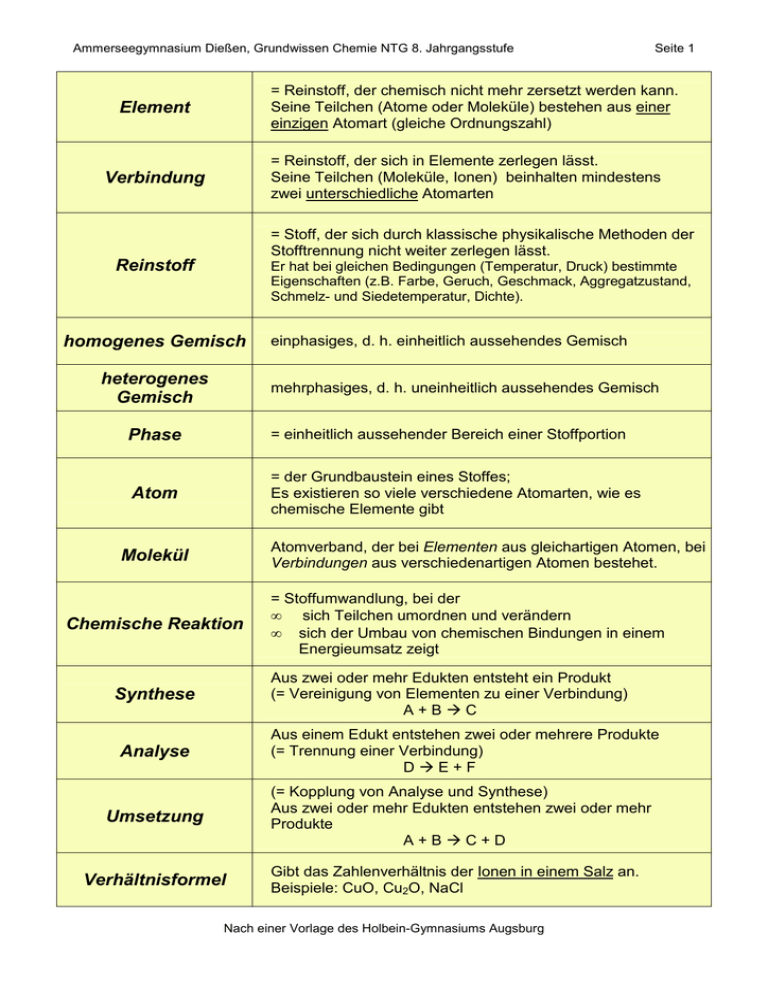
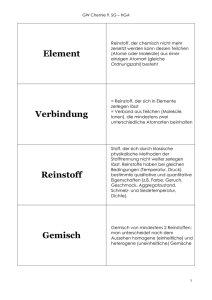
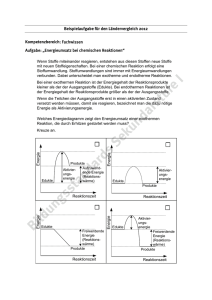
Ammerseegymnasium Dießen, Grundwissen Chemie NTG 8. Jahrgangsstufe Seite 1 = Reinstoff, der chemisch nicht mehr zersetzt werden kann. Seine Teilchen (Atome oder Moleküle) bestehen aus einer einzigen Atomart (gleiche Ordnungszahl) Element = Reinstoff, der sich in Elemente zerlegen lässt. Seine Teilchen (Moleküle, Ionen) beinhalten mindestens zwei unterschiedliche Atomarten Verbindung = Stoff, der sich durch klassische physikalische Methoden der Stofftrennung nicht weiter zerlegen lässt. Reinstoff Er hat bei gleichen Bedingungen (Temperatur, Druck) bestimmte Eigenschaften (z.B. Farbe, Geruch, Geschmack, Aggregatzustand, Schmelz- und Siedetemperatur, Dichte). homogenes Gemisch heterogenes Gemisch einphasiges, d. h. einheitlich aussehendes Gemisch mehrphasiges, d. h. uneinheitlich aussehendes Gemisch Phase = einheitlich aussehender Bereich einer Stoffportion Atom = der Grundbaustein eines Stoffes; Es existieren so viele verschiedene Atomarten, wie es chemische Elemente gibt Atomverband, der bei Elementen aus gleichartigen Atomen, bei Verbindungen aus verschiedenartigen Atomen bestehet. Molekül Chemische Reaktion = Stoffumwandlung, bei der • sich Teilchen umordnen und verändern • sich der Umbau von chemischen Bindungen in einem Energieumsatz zeigt Aus zwei oder mehr Edukten entsteht ein Produkt (= Vereinigung von Elementen zu einer Verbindung) A+BC Synthese Analyse Aus einem Edukt entstehen zwei oder mehrere Produkte (= Trennung einer Verbindung) DE+F Umsetzung (= Kopplung von Analyse und Synthese) Aus zwei oder mehr Edukten entstehen zwei oder mehr Produkte A+BC+D Verhältnisformel Gibt das Zahlenverhältnis der Ionen in einem Salz an. Beispiele: CuO, Cu2O, NaCl Nach einer Vorlage des Holbein-Gymnasiums Augsburg Ammerseegymnasium Dießen, Grundwissen Chemie NTG 8. Jahrgangsstufe Seite 2 gibt an, wie viele Atome jeweils in einem Molekül vorhanden sind Beispiel: H2O, C6H12O6 Molekülformel Reaktionsgleichung Sie gibt an, welche Teilchen in welchem kleinstmöglichen Anzahlverhältnis miteinander reagieren bzw. entstehen. Beispiel: CH4 + 2 O2 CO2 + 2 H2O bedeutet: Methan-Moleküle und Sauerstoff-Moleküle reagieren miteinander im Anzahlverhätnis 1:2 zu Kohlenstoffdioxid-Molekülen und Wasser-Molekülen im Anzahlverhältnis 1:2. Wird bei einem Vorgang Energie in Form von Wärme, Licht o. elektrischer Energie abgegeben, so bezeichnet man ihn als exotherm. exotherm Die innere Energie der Reaktionsprodukte ist geringer als die der Ausgangsstoffe (Edukte). Der Wärmebetrag erhält ein negatives Vorzeichen. Ei Aktivierungsenergie Edukte Energiediagramm einer exothermen Reaktion ∆Ei < 0 Produkte Reaktionskoordinate ∆Ei=E1 (Produkte) – E2 (Edukte) <0 Wird bei einem Vorgang Energie in Form von Wärme etc. zugeführt, so bezeichnet man ihn als endotherm. Der Wärmebetrag erhält ein positives Vorzeichen. endotherm Ei Aktivierungsenergie Energiediagramm einer endothermen Reaktion Produkte ∆Ei > 0 Edukte Reaktionskoordinate ∆Ei=E (Produkte) – E (Edukte) Aktivierungsenergie >0 Die zur Auslösung einer chemischen Reaktion erforderliche Energie nennt man Aktivierungsenergie. Ein Katalysator ist ein Stoff, der die Aktivierungsenergie herabsetzt u. damit die Reaktion ermöglicht und eschleunigt, Er liegt nach der Reaktion unverändert vor. Katalysator Bausteine der Atome Proton = positiv geladenes Teilchen im Atomkern Neutron = elektrisch neutrales Teilchen des Atomkerns Elektron = Träger negativer Ladung; nahezu masseloser Baustein der Atomhülle Nach einer Vorlage des Holbein-Gymnasiums Augsburg Ammerseegymnasium Dießen, Grundwissen Chemie NTG 8. Jahrgangsstufe Valenzelektronen Seite 3 Elektronen der äußersten Schale eines Atoms; sie bestimmen wesentlich die chemischen Eigenschaften des jeweiligen Elements; max. 8 Energiestufenmodell der Atomhülle Die Atomhülle ist in Energiestufen gegliedert. Die Energiestufen werden mit den Buchstaben K, L, M, ..., Q oder der Hauptquantenzahl n = 1,2,3,...,7 gekennzeichnet. Die Formel Zemax= 2n2 drückt die maximale Elektronenzahl pro Energiestufe aus. Edelgasregel Atome erreichen durch Aufnahme oder Abgabe von Valenzelektronen die gleiche Anzahl und Anordnung von Elektronen wie die ihnen im PSE am nächsten liegenden EdelgasAtome. Man spricht dann von Edelgaskonfiguration. Dabei entstehen Ionen. Periodensystem Ionen Im Periodensystem der Elemente (PSE) sind die Atomarten so nach steigender Protonenzahl angeordnet, dass die Atome mit gleicher Anzahl der Valenzelektronen untereinander stehen. Die Gruppennummer im PSE gibt die Anzahl der Außenelektronen der entsprechenden Atomarten an. Die Periodennummer gibt die Anzahl der durch die Hauptquantenzahl n charakterisierten Energiestufen an, auf denen die Elektronen der betreffenden Atomart angeordnet sind. = elektrisch geladene einfache (Atomionen) bzw. zusammengesetzte (Molekülionen) Teilchen. Sie können positiv (Kationen) oder negativ (Anionen) geladen sein. = Elemente mit typischen Eigenschaften wie Glanz, Leitfähigkeit (für Wärme und Elektrizität) und Verformbarkeit Metalle Die positiv geladenen Atomrümpfe sind in einem Gitter angeordnet, die Elektronen sind delokalisiert und können sich beim Anlegen von Strom bewegen. = die regelmäßige Anordnung von Teilchen in einem Feststoff. Gitter Man unterscheidet: • Atomgitter • Molekülgitter • Ionengitter • Metallgitter Salze … entstehen bei der Reaktion von Metallen mit Nichtmetallen. Dabei entstehen Ionen, die in einem festen Gitter angeordnet sind. Ihre Schmelzen und Lösungen leiten Strom,sie besitzen i.d.R. hohe Schmelz-und Siedepunkte. Nichtmetalle Nichtmetalle sind i. d. R. elektrische Nichtleiter, die aus Molekülen aufgebaut sind. Nach einer Vorlage des Holbein-Gymnasiums Augsburg