Das Periodensystem der Elemente [PSE]
Werbung
![Das Periodensystem der Elemente [PSE]](http://s1.studylibde.com/store/data/005521585_1-c88f4cf401000d64f6c18792d1b8009d-768x994.png)
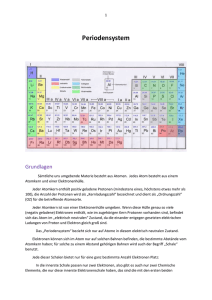
eqiooki.de | Periodensystem und Atombau | Seite 1 von 6 Das Periodensystem der Elemente [PSE] Das PSE ist das vielleicht wichtigste Hilfsmittel für jeden Chemiker. Kennt man sich gut damit aus, erleichtert man sich seine Arbeit wesentlich. Am wichtigsten sind die Zusammenhänge zwischen der Stellung im PSE und dem Atombau eines Elements. Unser interaktives PSE • PSE interaktiv → Benutze bitte hier Deinen Browser: http://eqiooki.de/chemistry/pse.html Du kannst das PSE mit der Maus überfahren. Bei jedem Element öffnet sich ein Tooltipp mit Informationen zum Element. Das Laden des PSE kann etwas dauern. Sollten die Tooltipps einmal haken, aktualisiere die Seite bzw. lade sie noch einmal. Bei alten kleinen Monitoren kann es wackeligen Tooltipps kommen, sobald das Fenster für das PSE nicht mehr ausreicht. • IUPAC Periodensystem → Das offizielle PSE der IUPAC [International Union of Pure and Applied Chemistry] findest Du auf der Homepage der IUPAC www.iuapc.org. Aus der Geschichte des Periodensystems der Elemente • v. Chr. DEMOKRIT → [ca. 460 v.Chr-380 v. Chr.] Aufbau der Natur aus kleinsten unteilbaren Einheiten, Begriff Atom [atomos, griech.: das Unteilbare] • 1661 Robert BOYLE → [1626-1691] Begriff chemisches Element eingeführt [mehr] • 1816 Johann Wolfgang DÖBEREINER → [1780-1849] Liste mit 48 chemischen Elementen • 1818 Jöns Jacob BERZELIUS → [1780-1849] Atommassen, chemische Symbole [Begründer der chemischen Zeichensprache], Begriff Atom konkretisiert • 1829 Johann Wolfgang DÖBEREINER → [1780-1849] Triaden chemisch ähnlicher Elemente zusammen gestellt, z.B. Chlor–Brom–Iod oder Lithium–Natrium–Kalium • 1858 Stanislao CANNIZARRO → [1826-1910] Unterscheidung von Atom und Molekül, Atomgewicht und Molekulargewicht • 1864 John Alexander Reina NEWLAND → [1837-1898] Gesetz der Oktaven, Eigenschaften wiederholen sich beim jeweils 8. Element in einer Ordnung der Elemente nach ihren Atommassen [das erkannte später auch Mendelejew] • 1869 Dmitri Iwanowitsch MENDELEJEW → [1834-1907] Ordnung der Elemente nach der Atommasse, Erkenntnis der periodischen Gesetzmäßigkeit der Eigenschaften [Gesetz der Periodizität], sinngemäß: Die Eigenschaften der Elemente ändern sich periodisch - also regelmäßig wiederkehrend - in Abhängigkeit von den Atomgewichten bzw. Massen. damit: Zusammenhang zwischen Atommassen und chemischen Eigenschaften der Elemente erkannt • 1869/70 Dmitri Iwanowitsch MENDELEJEW → [1834-1907] Aufstellung des Periodensystems der Elemente aus den damals 63 bekannten Elementen mit insgesamt 8 Gruppen [tabellarisch geordnet nach Atommassen; Elemente mit gleicher Außenelektronenzahl untereinander] • 1870 Lothar MEYER → [1830-1895] Aufstellung eines Periodensystems [unabhängig von Mendelejew, jedoch fast identisch] • 1869/70 Dmitri Iwanowitsch MENDELEJEW → [1834-1907] Voraussagen zu Eigenschaften unbekannter Elemente mit Hilfe seines PSE: Eka-Aluminium [heute Gallium], Eka-Silicium [jetzt Germanium] und Eka-Bor [Scandium] [eka: lat., nach] • 1875 Paul Émile Lecoq de BOISBAUDRAN → [1838-1912] Entdeckung des Galliums [EkaAluminium] und Bestätigung von Mendelejews Voraussage im Wesentlichen • 1879 Lars Fredrik NILSON → [1840-1899] Entdeckung von Scandium [Eka-Bor] • 1883 Lothar MEYER → [1830-1895] Neuberechnung einiger Atommassen • 1886 Clemens WINKLER → [1838-1904] Entdeckung des Eka-Silicum; benennt es Germanium [Mendelejews Voraussagen werden im Wesentlichen bestätigt] • 1923 DEMING → Entwurf eines Langperiodensystems • 1961 IUPAP, Internationale Atommassenkommission → IUPAP [International Union of Pure and Applied Physics] schlägt als Bezugsgröße für relative Atommassen das Kohlenstoffisotop 12C mit 12,00 vor [Atome dieses Isotops besitzen im Kern jeweils 12 Nukleonen: 6 Protonen und 6 Neutronen] eqiooki.de | Periodensystem und Atombau | Seite 2 von 6 • • 1987 IUPAC → IUPAC [International Union of Pure and Applied Chemistry] 18–Gruppen– Periodensystem mit arabischen Ziffern festgelegt [z.B. Gruppe 13 = III. Hauptgruppe], mehr hier auf der Homepage der IUPAC Hinweis → Aus urheberrechtlichen Gründen haben wir hier auf Porträts der genannten Wissenschaftler verzichtet. Grafiken findest Du z.B. auf wikipedia.de. Aufbau des Periodensystems, Elementbegriff, Atommasse • [chemisches] Element → Bezeichnung für eine Atomart [Atomsorte], die durch bestimmte Protonanzahl im Atomkern gekennzeichnet ist [z.B. Element Aluminium: Atomart, mit 13 Protonen im Atomkern] • Anzahl chemischer Elemente → derzeit sind ca. 120 Elemente bekannt [Du findest sie im PSE], die letzten [ab Ordnungszahl 95] allerdings nur künstlich in Teilchenbeschleunigern erzeugt und vermutlich nicht natürlich vorkommend • senkrechte Reihen → Gruppen [nach IUPAC 18 Gruppen, früher je 8 Haupt- und Nebengruppen - auch jetzt noch oft gebräuchlich] • waagerechte Reihen → Perioden [manchmal auch mit K-Schale, L-Schale usw. bezeichnet, da sie die Anzahl der Elektronenschalen des Atoms kennzeichnet] • Ordnungszahl → kennzeichnet Protonenanzahl und damit den Platz im PSE • Stellung eines Elements im PSE → gib dazu Nummer der Gruppe, der Periode und die Ordnungszahl an • Ordnungsprinzipien des PSE → Bau der Elektronenschalen in der Atomhülle, geordnet nach steigender Atommasse • [absolute] Atommasse → wirkliche Masse eines Atoms, z.B. Wasserstoffatom: m(H) = 0,000000000000000000000001674 g = 1,674 · 10–24 g • Atomare Masseneinheit → 12. Teil der Masse eines Kohlenstoffatoms; Einheit: 1 u [„unit“] = 1,661 ·10–24 g • relative Atommasse Ar → Quotient aus absoluter Atommasse eines Atoms und der atomaren Masseneinheit [Verhältniszahl ohne Einheit], z.B. Wasserstoffatom: Ar(H) = 1,008 ≈ 1 • Angaben über ein Element → Je nach Autor kann man [neben der Stellung] verschiedene Dinge über Elemente im PSE ablesen. Das kann etwas variieren, daher hier nur ein Beispiel [typisch für viele Lehrbücher und Formelsammlungen]: • • Farbe der Elementkästchen → je nach Autor werden damit meist der Metallcharakter oder die Eigenschaften der Oxide gekennzeichnet besondere Gruppenbezeichnungen → Alkalimetalle [I. Hauptgruppe, IUPAC-Gruppe 1] Erdalkalimetalle [II. Hauptgruppe, IUPAC-Gruppe 2] Erdmetalle oder Borgruppe [III. Hauptgruppe, IUPAC-Gruppe 13] Kohlenstoff-Silicium-Gruppe [IV. Hauptgruppe, IUPAC-Gruppe 14] Stickstoff-Phosphor-Gruppe [V. Hauptgruppe, IUPAC-Gruppe 15] Chalkogene [VI. Hauptgruppe, IUPAC-Gruppe 16] Halogene [VII. Hauptgruppe, IUPAC-Gruppe 17] Edelgase [VIII. Hauptgruppe, IUPAC-Gruppe 18] Aus der Geschichte der Atommodelle • DEMOKRIT [480–371 v. Chr.] → "Vater" der Atomtheorie, Natur besteht aus kleinsten Teilchen (atomos, griech., Das Unteilbare), Teilchenmodell • John DALTON [1786–1844] → Erstes Atommodell um 1808 [Kugelmodell]: Jedes Element besteht aus kleinsten, unteilbaren Teilchen, den Atomen. Alle Atome eines Elements [z.B. Gold] eqiooki.de | Periodensystem und Atombau | Seite 3 von 6 • • • • • • haben die gleiche Größe und die gleiche Masse. Atome können durch chemische Vorgänge weder vernichtet noch erzeugt werden. [Erhaltung der Masse] Bei chemischen Reaktionen werden die Atome der Ausgangsstoffe neu angeordnet und in bestimmten Anzahlverhältnissen verknüpft. Relative Atommassen, atomare Masseneinheit. George Johnstone STONEY [1826–1911] → 1881 Nachweis der negativen Ladung der Elektronen [Elementarladung]; Begriff Elektron [Beginn der Widerlegung der Hypothese von der Unteilbarkeit] Joseph John THOMSON [1856–1940] → 1904 weiterentwickeltes Atommodell; Atom als positiv geladene Kugel, in die die negativ geladenen Elektronen starr eingebettet sind Ernest RUTHERFORD [1871–1937] → entwickelt 1911 nach Streuungsversuchen das Kern–Hülle– Modell (Planetenmodell) des Atoms (Strahlen durch Goldfolie nur selten abgelenkt); Bau aus Protonen im Atomkern (3000-mal kleiner als Atom selbst; massives Zentrum) und Elektronen, Elektronen bewegen sich wie Planeten um den Kern; Anzahl der Elektronen gleich der Kernladungszahl [Protonenanzahl]; außerdem: Einteilung der Radioaktivität, Halbwertzeit Nils BOHR [1885-1965] → bereits 1913 gelang es Bohr, ein neues Atommodel zu erstellen: Das Schalenmodell der Atomhülle [BOHRsches Atommodell]: Elektronenschalen als Aufenthaltsräume für Elektronen mit annähernd gleicher Energie Elektronen mit der größten Energie in der Außenschale [Außenelektronen, Valenzelektronen]; je mehr Energie ein Elektron hat, umso weniger wird es vom Kern angezogen und desto weiter weg vom Atomkern bewegt es sich; Edelgasregel Arnold SOMMERFELD [1868-1951] → SOMMERFELDsches Atommodell als Erweiterung des BOHRschen Modells; neben Kreisbahnen gibt es auch Ellipsenbahnen; Quantenzahlen eingeführt SCHRÖDINGER u.a. 1928 → Orbitalmodell der Atomhülle [ein quantenmechanisches Modell] Orbitale beschreiben die Wahrscheinlichkeit der räumlichen Verteilung der Elektronen [genauer als die BOHRschen Kreisbahnen] Atombau: Das Schalenmodell der Atomhülle • BOHRsches Atommodell → Schema eines Natriumatoms • • Ladung als Ganzes → Atome sind elektrisch neutral, da die Anzahl der Protonen und Elektronen übereinstimmt Maximale Schalenbesetzung → 2 · n2 [n ist die Schalennummer] Zusammenhänge zwischen Atombau und PSE • Regel 1 → Ordnungszahl = Anzahl der Protonen [bei Atomen auch der Elektronen] • Regel 2 → Nummer der Periode = Anzahl besetzter Elektronenschalen des Atoms • Regel 3 → Nummer der Hauptgruppe = Anzahl der Außenelektronen des Atoms Bei Nebengruppenelementen trifft diese Regel nicht immer direkt so zu. • Beispiel → Natriumatom [siehe oben]: 11 Protonen und 11 Elektronen insgesamt [Ordnungszahl 11] davon 1 Außenelektron [I. Hauptgruppe] 3 Elektronenschalen [3. Periode] Ionen und PSE, Edelgasregel • Edelgasregel [Oktettregel] → Teilchen mit Edelgaskonfiguration, also meist 8 Außenelektronen [oder 2 Elektronen auf 1. Schale bei kleinen Atomen], z.B. alle Ionen; stabiler Zustand ist erreicht eqiooki.de | Periodensystem und Atombau | Seite 4 von 6 • • • [Atome ohne Edelgaskonfiguration hingegen sind sehr reaktionsfähig]; durch Ionenbildung oder gemeinsame Elektronenpaare [Atombindung] erreichen Teilchen Edelgaskonfiguration Edelgasatome → besitzen bereits eine stabile Achterschale und sind daher reaktionsträge und bilden keine Ionen Ionen → elektrisch geladene Teilchen atomarer Größe; entstehen durch Elektronenabgabe oder –aufnahme aus den entsprechenden Atomen; besitzen meist eine stabile Achterschale (Edelgaskonfiguration) Ionenbildung → durch Elektronenabgabe oder -aufnahme [maximal 4], so dass die Außenschale eine stabile Achterschale wird; die Außenschale erhält die Elektronenbesetzung wie das im PSE nächstgelegene Edelgas weniger als 4 Außenelektronen: Elektronenabgabe → positiv geladene Ionen [meist wird die darunterliegende Schale mit 8 Elektronen zur Außenschale], Beispiel: Natrium Na → Na+ + e- • • • mehr als 4 Außenelektronen: Elektronenaufnahme → negativ geladene Ionen [aufgenommene Elektronenanzahl bis zur vollen Edelgaskonfiguration], Beispiel: Chlor Cl + e- → Cl- Nebengruppenelemente → Nebengruppenelemente bilden stets positiv geladene Ionen; manchmal sind verschiedene Ladungen möglich; z.B. Fe2+ Eisen(II)-ion sowie Fe3+ Eisen(III)-ion. Edelgase bilden keine Ionen; in der IV. Hauptgruppe sind Sonderfälle [z.B. Kohlenstoff keine Ionen, Silicium unter bestimmten Bedingungen 4-fach positiv geladene Ionen] Ionenladung bei Hauptgruppenelementen und PSE → ... positiv geladene Ionen → I. – III. Hauptgruppe [Anzahl der Ladung = Hauptgruppennummer] negativ geladene Ionen → V. – VII. Hauptgruppe [Anzahl der Ladung = 8 – Hauptgruppennummer] Elektronegativitätswerte • Elektronegativitätswerte → geben an, wie stark ein Atom eines Elements im Vergleich zu anderen in der Lage ist, in einer chemischen Bindung ein gemeinsames Elektronenpaar anzuziehen [errechnete Modellwerte von Linus Carl PAULING, größter Wert bei Fluor mit 4,0] • Elektronegativitätswerte und PSE → innerhalb von Hauptgruppen abnehmend, innerhalb der Periode zunehmend [periodisch wiederkehrend; siehe auch Gesetz der Periodizität] • Differenz zweier Elektronegativitätswerte → Bindungsabschätzung mittels Differenz der ENWerte [ΔEN=0 unpolare Bindung, ΔEN=1...2 Übergang, ΔEN<1,7 polare Bindung, ΔEN>1,7 Ionenbindung] In wenigen Fällen führt die Methode aber zu einem falschen Ergebnis! • Beispiel → NaCl ... ΔEN = 3,0 - 0,9 = 2,1 ... also Ionenbindung eqiooki.de | Periodensystem und Atombau | Seite 5 von 6 Metallcharakter und Reaktionen der Oxide [Oxidcharakter] • Reaktionen von Oxiden mit Wasser → Oxide können mit Wasser Säure- bzw. Basenlösungen bilden ... Metalloxid + Wasser → Hydroxidlösung [Oxidcharakter basisch]; z.B.: MgO + H2O → Mg(OH)2 Nichtmetalloxid + Wasser → Säurelösung [Oxidcharakter sauer]; z.B.: SO2 + H2O → H2SO3 • Metallcharakter und PSE → am Anfang jeder Periode Metalle, dann Halbmetalle und am Ende Nichtmetalle bzw. ein Edelgas [periodisch wiederkehrend; siehe auch Gesetz der Periodizität] Gesetz der Periodizität • D. I. MENDELEJEW 1869 → Gesetz der Periodizität sinngemäß: Die Eigenschaften der Elemente ändern sich bei den nach ihren Atommassen geordneten chemischen Elementen periodisch, also regelmäßig wiederkehrend. • Beispiele → siehe z.B. Eigenschaften der Oxide sowie Metall/Nichtmetallcharakter • MENDELEJEW → siehe Geschichte des PSE weiter oben Besonderheiten der Nebengruppenelemente • Eigenschaften → Alle Nebengruppenelemente sind Metalle. Ihre Oxide können mit Wasser oft Hydroxidlösungen bilden. Einige Atome können verschieden viele Elektronen abgeben, so dass Ionen in mehreren Ladungsvarianten auftauchen, z.B. Cu+ Kupfer(I)-ion sowie Cu2+ Kupfer(II)-ion, andere Elemente wieder bilden nur eine Ionensorte, z.B. Ag+. • Natürlich? → Viele Elemente mit hohen Ordnungszahlen [ab Polonium] haben natürliche radioaktive Isotope. Die letzten Elemente [ab Americium] sind künstlich erzeugt worden. • Atombau der Nebengruppenelemente → Nach dem Element der II. Hauptgruppe folgen die Nebengruppenelemente. Hier wird die Unterschale weiter besetzt, anstatt der Schale mit der höchsten Nummer. Erst ab der III. Hauptgruppe wird die Schale mit der Periodennummer weiter vervollständigt. Beispiel: Die 3. Elektronenschale kann maximal 18 Elektronen fassen. Bei Argon enthält sie zunächst 8. Doch bei Kalium und Calcium wird bereits die 4. Schale begonnen und erst ab Scandium folgt die restliche Besetzung der 3. Schale. Die Weiterbesetzung der 4. Schale erfolgt erst wieder ab der III. Hauptgruppe, also ab Gallium. Grund: Jede Elektronenschale hat noch Unterschalen. Davon sind einige energetisch höher gelegen als die tiefste Unterschale der folgenden Elektronenschale. Erklärung einiger Fachbegriffe • Aggregatzustände [Kürzel] → (g) gasförmig [gaseous], (l) flüssig [liquid], (s) fest [solid]; (aq) wässrige Lösung • Elektronenpaarbindung [Atombindung] → Art der chemischen Bindung, die auf Anziehungskräften zwischen einem gemeinsamen Elektronenpaar [negativ geladen] und den positiv geladenen Atomkernen der beteiligten Atome beruht; typische Bindung in Molekülen; die beteiligten Atome erreichen dadurch Edelgaskonfiguration • Elektronenkonfiguration → Elektronenverteilung [-anordnung] auf den einzelnen Schalen • Edelgaskonfiguration → eine Elektronenkonfiguration wie ein Edelgasatom [d.h. meist 8 Außenelektronen; nur bei Teilchen mit wenigen Elektronen ist die 1. Schale mit 2 Elektronen voll besetzt] • Isotope → normales Atom: Anzahl der Protonen = Anzahl der Neutronen; radioaktives Isotop: Anzahl der Protonen ≠ Anzahl der Neutronen • Quantenzahlen → Elektronen können ihre Schale verlassen [durch Energiezufuhr bzw. Energieabgabe z.B. in Form von Licht [siehe Spektrallinien]; Hauptquantenzahlen n entsprechen den Schalen [Perioden]; außerdem gibt es die Nebenquantenzahlen l [sozusagen für die Unterschalen, d.h. Energieniveaus, einer Schale; gekennzeichnet mit s, p, d und f], Magnet- und Spinquantenzahlen • Orbital → Raum [dreidimensional] für die größte Aufenthaltswahrscheinlichkeit eines Elektrons; entsprechend der Nebenquantenzahlen gibt es beispielsweise s- oder p-Orbitale eqiooki.de | Periodensystem und Atombau | Seite 6 von 6 Beispiel: Elektronenkonfiguration eines Stickstoffatoms N 1s2 2s2 2p3 In der 1. Schale sind also auf dem einzigen Orbital 2 Elektronen, in der 2. Schale insgesamt 5, davon 2 im s-Orbital und 3 in p-Orbitalen. Näheres erfährst Du in der Abiturstufe. Quellenangaben Die Inhalte dieser Webseite wurden urheberrechtlich durch den Autor zusammengestellt und eigenes Wissen sowie Erfahrungen genutzt. Bilder und Grafiken sind ausschließlich selbst angefertigt. Für die Gestaltung dieser Internetseite verwendeten wir zur Information, fachlichen Absicherung sowie Prüfung unserer Inhalte auch folgende Internetangebote: wikipedia.de, schuelerlexikon.de, seilnacht.com, ce.cmu.edu, iupac.org, de.wikibooks.org. Zitate oder Kopien erfolgten nicht. Hinweis Die Orbitaltheorie [siehe Sek. II] findet hier keine ausführliche Erläuterung. Eine separate Webseite dazu folgt später.