Arzneimittelmetabolismus & Pharmakogenetik Präsentation
Werbung
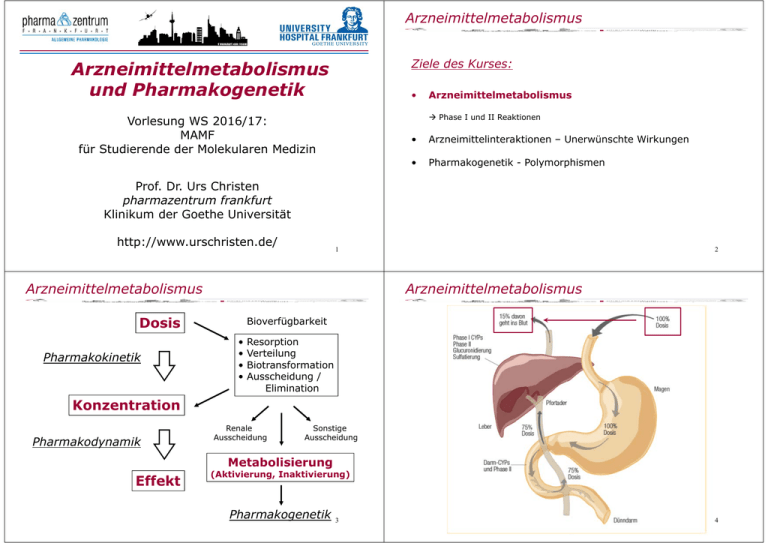
Arzneimittelmetabolismus Ziele des Kurses: Arzneimittelmetabolismus und Pharmakogenetik • Arzneimittelmetabolismus Phase I und II Reaktionen Vorlesung WS 2016/17: MAMF für Studierende der Molekularen Medizin • Arzneimittelinteraktionen – Unerwünschte Wirkungen • Pharmakogenetik - Polymorphismen Prof. Dr. Urs Christen pharmazentrum frankfurt Klinikum der Goethe Universität http://www.urschristen.de/ 1 Arzneimittelmetabolismus Arzneimittelmetabolismus Dosis Pharmakokinetik 2 Bioverfügbarkeit • • • • Resorption Verteilung Biotransformation Ausscheidung / Elimination Konzentration Pharmakodynamik Renale Ausscheidung Sonstige Ausscheidung Metabolisierung Effekt (Aktivierung, Inaktivierung) Pharmakogenetik 3 4 Arzneimittelmetabolismus Arzneimittelmetabolismus – First-Pass Effekt First-Pass Effekt Beispiel: Budosenid • Arzneimittelmetabolisierung während des ersten Durchgangs durch die Leber •Endogene Glucocorticoide (Cortisol, Cortison) haben einen sehr stark ausgeprägten First-Pass Effekt ungeeignet für perorale Applikation •Orale Glucocorticoide (Dexamethason) sind abgewandelt langsame Metabolisierung in der Leber • Inaktivierung / Aktivierung des Arzneimittels • Perorale Anwendungsform Darm Pfortader Leber Blut Wirkort • Ausgeprägter First-Pass Effekt: Metabolisierung / Ausscheidung des grössten Teils des Arzneimittels vor dem Erreichen des Wirkorts •Inhalative 20% • Bei Enzyminduktion kann der First-Pass Effekt bei wiederholter Anwendung verstärkt sein Budosenid • Umgehung des First-Pass Effekt durch andere Applikationswege (intravenöse / intramuskuläre Injektion, Suppositorium, transdermale Pflaster, etc.) Glucocorticoide (z.B. Budosenid) wurden wiederum „Inhalation“ 80% Lunge Bronchien Magen Darm Lokale Wirkung First Pass Effekt Inaktivierung Ausscheidung 5 Arzneimittelmetabolismus so abgewandelt, dass sie einen ausgeprägtem First-Pass Effekt besitzen 6 Arzneimittelmetabolismus Biotransformation: Lipophil Hydrophil Ziele des Kurses: • Oxidation Reduktion / Hydroxylierung Hydrolyse Arzneimittelmetabolismus Arzneimittel Xenobiotika Phase I und II Reaktionen • Arzneimittelinteraktionen – Unerwünschte Wirkungen • Pharmakogenetik - Polymorphismen Konjugation: akt. Glucuronsäure akt. Schwefelsäure Essigsäure Aminosäuren Phase I Metabolit Inaktiv oder aktiv 7 Phase II Metabolit Meist inaktiv 8 Arzneimittelmetabolismus Arzneimittelmetabolismus – Phase I Phase I Funktionalisierungsphase • • • • Einführung oder Freilegung von funktionellen Gruppen Vorbereitung der Phase II Inaktivierung oder Aktivierung (‚Prodrug‘) des Arzneimittels Enzyme der Oxidation / Reduktion: - Cytochrom P450-abhängige Monooxygenasen (CYP) - Oxidoreduktasen - Dehydrogenasen (z.B. Alkohol- / Aldehyd-Dehydrogenasen) • Enzyme der Hydrolyse: - Esterasen - Amidhydrolasen - Epoxidhydrolasen 9 10 Science 286: 487-491 (1999) Arzneimittelmetabolismus Arzneimittelmetabolismus – Phase I Biotransformation: Lipophil Hydrophil Cytochrom P450-abhängige Monooxygenasen (CYP) Wichtigster Reaktionstyp Hydoxylierung Arzneimittel Xenobiotika Oxidation Reduktion / Hydroxylierung Hydrolyse + O2 + NADPH + H+ Arzneimittel Xenobiotika CYP Konjugation: akt. Glucuronsäure akt. Schwefelsäure Essigsäure Aminosäuren Phase I Metabolit Phase II Metabolit Bei bereits bestehender funktioneller Gruppe Arzneimittel -OH + NADP+ + H2O Xenobiotika Reduktionsmittel NADPH; Flavine (z.B. Vit B2); Flavoproteine; Ferrodoxine 11 12 Arzneimittelmetabolismus Arzneimittelmetabolismus – Phase II Phase II Konjugationsphase • Konjugation an endogenes Substrat • Resultierende Arzeimittelkonjugate sind meist inaktiv • Enzyme der Konjugation: - UDP-Glucuronosyl-Transferasen (UGT-Enzyme) Glucuronsäure - Sulfotransferasen (SULT-Enyzme) Schwefelsäure - N-Acetyltransferasen (NAT-Enyzme) Essigsäure - Glutathion-S-Transferase (GST-Enzyme) Glutathion - Methyltransferasen Methylgruppen 13 14 Science 286: 487-491 (1999) Arzneimittelmetabolismus – Phase II Arzneimittelmetabolismus Biotransformation: Lipophil Hydrophil Beispiel – Paracetamol (Acetaminophen) Phase I Phase II Oxidation Reduktion / Hydroxylierung Hydrolyse Phase II Arzneimittel Xenobiotika Konjugation: akt. Glucuronsäure akt. Schwefelsäure Essigsäure Aminosäuren Phase I Metabolit Inaktiv oder aktiv 15 Phase II Metabolit Meist inaktiv 16 Arzneimittelmetabolismus Arzneimittelmetabolismus: Alter Altersbedingte Veränderungen: Ausscheidung • • • • Biotransformation ist beeinflussbar durch: • Arzneimittelwechselwirkungen • Genetische Prädisposition (Pharmakogenetik) Renale Durchblutung Anzahl der Nephrone Glomeruläre Filtrationsrate (GFR) um ca. 1 ml/min pro Jahr Tubulusfunktion um ca. 1 % pro Jahr • Alter, Geschlecht • Erkrankungen (Leberschädigungen) Klinische Konsequenzen: • Rauchen, Alkohol (Enzyminduktion) 17 Arzneimittelmetabolismus: Alter Verzögerte Elimination vorwiegend renal ausgeschiedener Arzeimittel • Amphotericin • Aminoglykoside • Gyrase-Hemmstoffe • Atenolol • Digoxin 18 Arzneimittelmetabolismus Altersbedingte Veränderungen: Biotranformation Ziele des Kurses: • Lebergrösse (bis 40%) • Leberdurchblutung (bis 30%) • Abnahme der Enzymaktivität vor allem CYP-abhängige Phase I Reaktionen • Phase II Reaktionen meist nicht beeinflusst • Arzneimittelmetabolismus Phase I und II Reaktionen Klinische Konsequenzen: • Arzneimittelinteraktionen – Unerwünschte Wirkungen • Pharmakogenetik - Polymorphismen Höhere Serumkonzentrationen von Arzneimitteln mit einem starken ‚firstpass effect‘ und/oder einer ‚high clearance‘ durch bessere Bioverfügbarkeit und langsamere Elimination • Propanolol • Metoprolol 19 20 Arzneimittelinteraktionen Arzneimittelinteraktionen Arzneimittelinteraktionen Dosis Pharmakokinetische und/oder pharmakodynamische Wirkung auf Grund der inhärenten Eigenschaften der beteiligten Arzneimittel Bioverfügbarkeit • • • • Pharmakokinetik Resorption Verteilung Biotransformation Ausscheidung / Elimination Konzentration Pharmakogenetik Interindividuelle, genetische Unterschiede (unerwünschte) Wirkung der Arzneimittel bestimmen die Renale Ausscheidung Pharmakodynamik Sonstige Ausscheidung Metabolisierung (Aktivierung, Inaktivierung) Effekt • Polymorphismen häufig (>1%) • Mutationen selten (<1%) Pharmakogenetik 22 21 Arzneimittelinteraktionen Arzneimittelinteraktionen Therapeutisches Fenster; Erforderlicher Wirkspiegel Blutspiegel Blutspiegel Toxisch Einnahme eines Zweitpharmakons Therapeutisches Fenster; Erforderlicher Wirkspiegel Einnahme eines Zweitpharmakons Unwirksam Zeit Zeit 23 24 Arzneimittelinteraktionen Arzneimittelinteraktionen Pharmakokinetische Interaktionen I Pharmakokinetische Interaktionen II 1) Resorption: • Veränderung des pH-Wertes durch das Erstpharmakon Veränderung der Resorptionsrate des Zweitpharmakons in der Magen-Darm Passage • Erhöhte Resorptionsrate lipophiler Substanzen (z.B durch Milch, Fette) • Verlängerung oder Verkürzung der Magen-Darm Passage (z.B. Loperamid, Laxantien) • Komplexbildung (z.B. Tetracycline mit Mg-, Ca-, Fe-Salzen; Milch) • Schädigung der Darmflora (Antibiotika) 2) Verteilung / Distribution: • Veränderung des Verteilungsgleichgewichts • Kompetition um Rezeptorbindungsstellen • Verdrängung bei höherer Bindungsaffinität 3) Biotransformation: • Kompetition um Bindungstellen an Enzyme, die zur Biotransformation / Aktivierung benötigt werden (Zytochrom P450 (CYP450) Superfamilie) Verzögerter Effekt, toxische Nebenprodukte, schnellere Elimination • Kompetition um Bindungsstellen an Enzyme, die zur Biotransformation / Eliminierung benötigt werden (CYP450 Superfamilie) Verlängerter Effekt, erhöhte Konzentration bis in den toxischen Bereich • Enzyminduktion durch Barbiturate schnellere Biotransformation (Aktivierung und Elimination) 4) Ausscheidung / Elimination: • Veränderung des pH-Wertes im Urin Veränderte Sekretionsrate und/oder Rückresporption • Erhöhte Elimination durch Gabe von Schleifendiuretika (z.B. Furosemid) 25 Arzneimittelinteraktionen 26 Arzneimittelinteraktionen: Beispiel – CYP3A4 • Metabolismus einiger besonders lipophiler Substanzen Pharmakodynamische Interaktionen • CYP3A4-Substrate: Synergistische oder antagonsitische Wirkung der interferierenden Substanzen • Rezeptorregulation oder • Beinflussung eines Feedback-Loops (Regelkreis) • Induzierung eines „Toleranz“- oder „Sucht“-Effekts durch ein Zweitpharmakon Zytostatika: Cyclophosphamid, Etoposid, Doxorubicin, Tamoxifen, Vinblastin, Paclitaxel (Taxol) Immunsuppressiva: Cyclosporin, Tacrolimus, Sirolimus Benzodiazepine: Diazepam, Midazolam Antidepressiva: Imipramin Proteaseinhibitoren: Indinavir, Sequinavir Statine: Lovastatin, Atorvastatin, Cerivastatin Verschiedene: Lidocain, Warfarin, Phenytoin, Loratadin, Amiodaron etc. • CYP3A4-Hemmstoffe: Clarithromycin, Grapefruitsaft, Ketoconazol, Cimetidin, Erythromycin, Verapamil Abbau verlangsamt Wirkungen und Nebenwirkungen verstärkt • CYP3A4-Induktoren: Carbamazepin Phenytocin, Rifampicin, Barbiturate und Johanniskraut beschleunigen Abbau Verminderung/Verlust der Wirkung (empfängnisverhütende Wirkung von Kontrazeptiva) 27 28 Arzneimittelinteraktionen: Enzyminhibition • Hemmung metabolisierender Enzyme Inhibition des Pharmakon-Abbaus • Arzneimittelinteraktionen ein Pharmakon hemmt den Abbau eines anderen Arzneimittelinteraktionen: CYP3A4 Grapefruitsaft Mechanismen: • Kompetitive Hemmung Substrat und Inhibitor konkurrieren um Bindung an aktives Zentrum Verdrängung möglich Suizid-Inhibitoren: Kovalente Bindung im aktiven Zentrum Keine Verdrängung möglich • Nichtkompetitive Hemmung Inhibitor bindet nicht an aktives Zentrum, sondern an entfernte Stelle • Irreversible Hemmung von CYP3A4 in der Darmwand Perorale Gabe des Medikaments betroffen Konformationsänderungen, die aktives Zentrum betreffen (allosterische WW) Substratbindung / -umsatz beeinträchtigt Inhibition des Abbaus von Anwendung durch Inhibitor Wirkung Warfarin (Cumarin-Derivat) Antikoagolanz (Vitamin K Antagonist) Chloramphenicol, Cimetidin, Omeprazol Blutungsgefahr Tolbutamid (Sulfonylharnstoff) Typ 2 Diabetes (Insulinsekretion ) Chloramphenicol, Cumarin-Derivate Hypoglykaemie Diphenylhydantoin (Phenytoin) Antikonvulsivum/Epilepsie (Na-Kanal Antagonist) Chloramphenicol, Cumarin-Derivate Ataxie, Verwirrtheit Diazepam (Benzodiazepin) Beruhigungsmittel (GABAA-Rez. Agonist) Cimetidin verstärkter, verlängerter Effekt Propanolol, Metoprolol (Beta-Blocker) Hypertonie, Herzinsuff. etc. (β-Adrenozeptor Antag.) Cimetidin verstärkter, verlängerter 29 Effekt Arzneimittelinteraktionen: Enzyminduktion Abbau der induzierenden Substanz und • Abbau des Medikaments wird verzögert und gleichzeitig wird der intestinale ‚first pass‘ Effekt verringert Bioverfügbarkeit nimmt zu • Effekt ca. 4h nach Einnahme >24 h aktiv 30 Arzneimittelinteraktionen: CYP3A4 • Aktivitätserhöhung des metabolisierenden Enzymsystems durch wiederholte Pharmakazufuhr • Gesteigerter Pharmaka • Wirksubstanzen: Furanocoumarine (Furocoumarine) – Bergamottin und Dihydoxybergamottin (Furanocoumarinfreier Grapefruitsaft hat keinen Einfluss auf CYP3A4) anderer Johanniskraut (St. John‘s Wort) • Wirksubstanzen: Hyperforin und Hypericin • Geringe bis mittelstarke cerebrale Wiederaufnahmehemmung von Serotonin, Noradrenalin und Dopamin Antidepressivum • Induziert CYP3A4 (und weniger stark CYP2C9) in der Leber Abbaurate von Arzneimitteln steigt Wirkung erniedrigt • Metabolisiert u.a. Hormone Wirkung der hormoneller Verhütungsmittel beeinträchtigt • Wechselwirkung mit AIDS-Medikamenten Antidepressiva Therapieversagen • Immunsuppressiva abgeschwächt Transplantations-Abstoßung möglich, Therapie von Autoimmunkrankheiten oder chronischer Entzündungen beeinträchtigt • Rascher Anstieg der Metabolisierungskapazität innerhalb weniger Tage • Langsamer Abfall auf Ursprungsniveau nach Absetzen des Induktors Beschleunigung des Abbaus von durch Enzyminduktion mit Bilirubin Phenobarbital Kortisol Phenytoin Vitamin D Phenytoin, Phenobarbital Östrogenen, Gestagenen Rifampicin, Phenytoin Digitoxin Phenobarbital, Phenylbutazon Antikoagulantien (Cumarintyp) Phenobarbital 31 Anti-Baby-Pille und anderer (Proteaseshemmer), Antibiotika, 32 Arzneimittelmetabolismus Arzneimittelinteraktionen Arzneimittelinteraktionen Ziele des Kurses: • Pharmakokinetische und/oder pharmakodynamische Wirkung auf Grund der inhärenten Eigenschaften der beteiligten Arzneimittel Arzneimittelmetabolismus Phase I und II Reaktionen • Arzneimittelinteraktionen – Unerwünschte Wirkungen • Pharmakogenetik - Polymorphismen Pharmakogenetik Interindividuelle, genetische Unterschiede (unerwünschte) Wirkung der Arzneimittel bestimmen die • Polymorphismen häufig (>1%) • Mutationen selten (<1%) 33 Pharmakogenetik Pharmakogenetik Dosis Pharmakokinetik 34 Bioverfügbarkeit • • • • Resorption Verteilung Biotransformation Ausscheidung / Elimination Wirkdifferenzen durch genetische Polymorphismen Mindestens zwei Genotypen Allelhäufigkeit von mindestens 1% Expression eines Genotyps (Phänotyp) Konzentration Pharmakodynamik Renale Ausscheidung Sonstige Ausscheidung langsame (poor metabolizer) Metabolisierer schnelle (rapid metabolizer) Metabolisierung Effekt (Aktivierung, Inaktivierung) Pharmakogenetik 35 Langsamere Aktivierung Langsamere Elimination Schnellere Aktivierung Schnellere Elimination Dosierung 36 Pharmakogenetik Pharmakogenetik: Polymorphismen Toxisch Poor / slow metabolizer Blutspiegel Therapeutisches Fenster; Erforderlicher Wirkspiegel Rapid / fast metabolizer Unwirksam Zeit 37 38 Science 286: 487-491 (1999) Pharmakogenetik Pharmakogenetik: Beispiele – CYP2D6 Biotransformation: Lipophil Hydrophil Arzneimittel Xenobiotika (Spartein-Debrisoquin) Polymorphismus Phase I Phase II Metabolit Metabolit Enzyme Enzyme (genetische Variabilität) CYP2D6 (Spartein-Debrisoquin) Polymorphismus Zytochrom P450 Enzymfamilie CYP2D6 Konjugation: akt. Glucuronsäure akt. Schwefelsäure Essigsäure Aminosäuren Oxidation Reduktion Hydrolyse Arzneimittel ~10% der Bevölkerung Phase I Metabolit Codein (3-Methylmorphin) ~10% CYP2D6 (genetische Variabilität) Morphin 70-75% Beispiele: CYP2C19 (Mephenytoin) Polymorhismus Oxidation Reduktion Hydrolyse N-AcetylTransferasePolymorphismus 39 BV: 25% CYP2D6 UGT2B7 ~10% poor metabolizer ~90% rapid metabolizer Morphin-6-Glucuronid 40 Analgetischer Effekt Analgetischer Effekt 80% Analgetischer Effekt Langsamer CYP2D6 Metabolismus <<10% 10% Keine Analgesie 41 42 Pharmakogenetik: Beispiele – CYP2D6 Oxidation Reduktion Hydrolyse CYP2D6 Analgetischer Effekt „Ultrarapid“ CYP2D6 Metabolismus + CYP3A4 Inhibition + Akutes Nierenversagen Morphin / Opioid Vergiftung (Spartein-Debrisoquin) Polymorphismus Phase I Metabolit ~10% der Bevölkerung 70-75% BV: 25% CYP2D6 43 Arzneimittel • • • • • -Blocker (Propanolol; Debrisoquin) Antiarrhythmika (Spartein) Antidepressiva Neuroleptika Opioide (Codein) ~10% poor metabolizer ~90% rapid metabolizer 44 Pharmakogenetik: Beispiele – CYP2D6 45 Pharmakogenetik: Beispiele – CYP2D6 46 Pharmakogenetik Microarrays: Empfohlene Dosierung für CYP2D6 metabolisierte Antidepessiva • • • • • ***** Jede 20-µm2-Zelle auf dem Array kann 107 DNA-Fragmente oder “Sonden” enthalten 47 >15‘000 versch. Sonden 25 bp Oligonukleotide 107 Kopien pro Sonde Hybridisierung mit Proben-DNA Fluoreszenzmikroscanner Analyse von Genexpressionsmustern 48 Pharmakogenetik Pharmakogenetik: Beispiele – CYP2C19 Demethylierung CYP2C19 (Mephenytoin) Polymorhismus Phase I Metabolit Arzneimittel Diazepam 3-6% Europa bis 23% Asien (Benzodiazepin - Beruhigungsmittel) CYP2C19 CYP3A4 (demethylierung) (hydroxylierung) Desmethyldiazepam (starke Wirkung) BV: 80% 49 Pharmakogenetik: Beispiele – NAT N-AcetylTransferasePolymorphismus 50% Europa 70-90% Asien Acetylierung Phase I Metabolit 90% CYP2C19 rapid metabolizer >80% 50 Phase II Metabolit poor metabolizer Überdosierung! 51 Phase I Metabolit Polymorphismus 50% Europa 70-90% Asien Zytotoxischer Effekt in der Leber durch Oxidationsprodukte! Acetylierung N-AcetylTransferase- (Antituberculotikum) NAT poor metabolizer Pharmakogenetik: Beispiele – NAT Isoniazid BV: 90% Temazepam (schwache Wirkung) • • • • • • BV: 90% Phase II Metabolit Isoniazid (anti-tuberkulotikum) Hydralazin (anti-hypertonikum) Clonazepam (anti-epileptikum) Koffein Metamizol (analgetikum) Sulfonamide (bacteriostatika) NAT 90% 52 Pharmakogenetik: Weitere Beispiele I Pharmakogenetik: Weitere Beispiele II Glucose-6-phosphat-Dehydrogenase Mangel Methämoglobin-Reduktase-Mangel • Antimalariamittel: Primaquin, Dapson schwere Hämolysen bei ~10% aller Afrikanern, Griechen, Sarden und Indern • Methämoglobin kann Sauerstoff nicht binden / transportieren • G-6PD: NADPH-Synthese durch Oxidation von Glucose-6-phosphat • Methämoglobin-Reduktase reduziert Fe3+ des Methämoglobins wieder zu Fe2+ (Hämoglobin) Bindung von Sauerstoff wird wieder möglich • NADPH: Regeneration von GSH • Methämoglobin-Reduktase-Mangel Erhöhter Methämoglobinspiegel • GSH-Mangel: Erhöhte Disulfidbrückenbildung membranen Membraninstabilität in Erythrozyten- • Primaquin und Dapson werden durch Konjugation an GSH eliminiert erniedrigen den GSH-Spiegel weiter • Paracetamol wird auch durch GSH-Konjugation acetylcystein Gabe bei Paracetamolvergiftung) eliminiert (N- • Methämoglobin-Reduktase-Mangel Methämoglobinbildner gefährlicher Nitrate, aromatische Amine) Vergiftungen (Chlorate, Perchlorate, • Redoxfarbstoffe (Toloniumchlorid/Toluidinblau) können die Methämoglobin-Reduktase unterstützen und die Reduktion zu Fe2+ beschleunigen Antidot bei Vergiftungen 53 Pharmakogenetik: Weitere Beispiele III durch Nitrite, 54 Arzneimittelmetabolismus Maligne Hyperthermie: Ziele des Kurses: • Seltener genetischer Defekt eines autosomal-dominanten Genes, das den sarkoplasmatischen Ca2+-Transport regelt • Arzneimittelmetabolismus • Phase I und II Reaktionen • Arzneimittelinteraktionen – Unerwünschte Wirkungen • Pharmakogenetik – Polymorphismen • Auslöser: Inhalationsnarkotika, Muskelrelaxantien Plötzliche Freisetzung von Ca2+ aus dem sarkoplasmatischen Retikulums der Skelettmuskulatur • Symptome: Unkontrollierte Muskelzuckungen während der Relaxationsphase mit sehr hohem O2-Verbrauch und grosser Wärmebildung Azidose, Hyperkaliämie, Tachykardie, Arrhymien, Hyperthermie • Therapie: Absetzen des Narkotikums/Muskelrelaxans, Gabe von Freisetzungshemmern (Dantrolen) (=Hemmung der Muskelrelaxantien), Kühlung 55 – Lipophil Hydrophil – Pharmakokinetsche / pharmakodynamische Interaktionen – Toleranz – Gegenseitige Inhibition / Induktion – Polymorphismen sind häufig – CYP450 Superfamilie, NAT, etc – Seltene Mutationen (G6P-dehydrogenase, Methamoglobin Reduktase, Maligne Hyperthermie) 56