Adenoviridae
Werbung
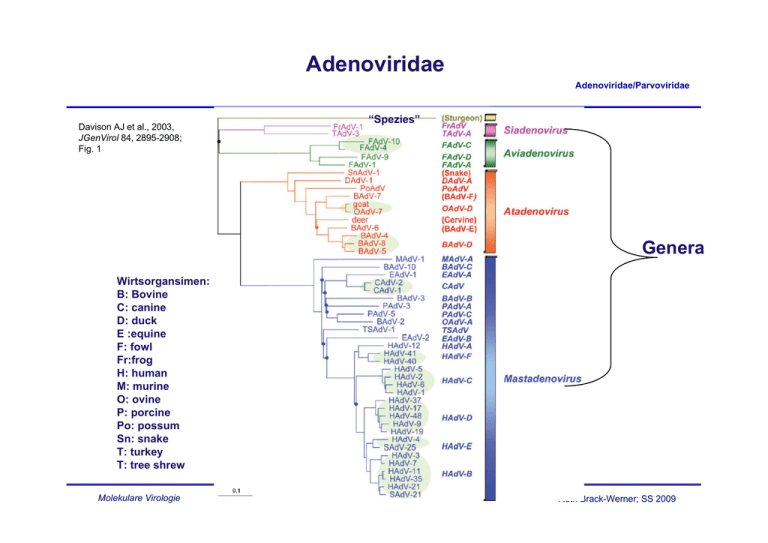
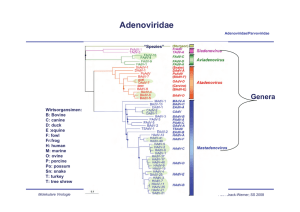
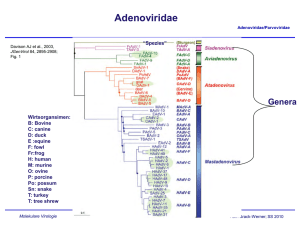
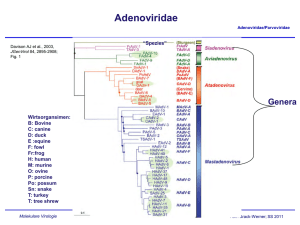
Adenoviridae Adenoviridae/Parvoviridae Davison AJ et al., 2003, JGenVirol 84, 2895-2908; Fig. 1 “Spezies” Genera Wirtsorgansimen: B: Bovine C: canine D: duck E :equine F: fowl Fr:frog H: human M: murine O: ovine P: porcine Po: possum Sn: snake T: turkey T: tree shrew Molekulare Virologie Ruth Brack-Werner; SS 2009 Adenovirus Merkmale Adenoviridae/Parvoviridae Partikel: Keine Behüllung; Ikosaeder. Genom: ds DNA, umgekehrt sich wiederholende Sequenzen an beiden Enden; Verbunden mit viralen Proteinen; Genom-Replikation: Semikonservative DNA Replikation; virale DNA Polymerase; Keine Okazaki Fragmente; Protein wirkt als Primer; Molekulare Virologie Ruth Brack-Werner; SS 2009 Adenovirus Adenoviridae/Parvoviridae RNA Splicing wurde erstmalig von P.A. Sharp und R.J. Roberts 1977 beschrieben; Nobel-Preis: 1993. RNA RNA loops: A, B, C Aus Fields Virology 4th edition, 2002, Chapter 67, Lippincott, Williams and Wilkins, 2002 Fig. 67-4 Molekulare Virologie Ruth Brack-Werner; SS 2009 Struktur von Adenoviren Adenoviridae/Parvoviridae Hexonprotein Coreprotein Pentonbasisprotein VII Coreprotein Fiberprotein http://pathmicro.med.sc.edu/mhunt/adeno-diag.jpg Durchmesser ca. 80-110 nm; unbehüllt http://www.accessexcellence.org/RC/VL/GG/images/adenovirus. gi Molekulare Virologie Ikosaedrische Struktur: 20 Flächen, 12 Ecken; 252 Capsomere: 240 Hexone; 12 Pentone 12 Fiber Ruth Brack-Werner; SS 2009 Adenovirus Genom-Struktur Adenoviridae/Parvoviridae “Quasi-zirkuläre” Struktur der ds DNA durch Interaktion der 5’ verknüpften terminalen Proteine “Pfannen-Stiel” Struktur vermittelt durch Basenpaarung an beiden Enden (umgekehrte sich wiederholende Sequenzen) Aus”Molekulare Virologie”, Modrow, Falk, Truyen, 2.Auflage, 2003, Spektrum Akademischer Verlag, Kap. 19l, Abb. 19.19. Molekulare Virologie Ruth Brack-Werner; SS 2009 Adenovirusgenom: Leserahmen Adenoviridae/Parvoviridae Davison AJ et al., 2003, JGenVirol 84, 2895-2908; Fig. 1 Molekulare Virologie Ruth Brack-Werner; SS 2009 Adenovirus: Genom und Transkripte Adenoviridae/Parvoviridae Aus Fields Virology 4th edition, 2002, Chapter 67, Lippincott, Williams and Wilkins, 2002 Fig. 67-3 Molekulare Virologie Ruth Brack-Werner; SS 2009 Sehr frühe (immediate early) virale Proteine Adenoviridae/Parvoviridae Transkriptionseinheit/ Protein Modifikation/ Grösse (kD) Funktionen Zelluläre Interaktionspartn er (Bsp) E1A Phosphoryliert 40 Trans-Aktivator der Transkription früher viraler Gene (E2.E3.E4) und zelluläre Gene; Immortalisierung; Transformation (gemeinsam mit E1B) TFIID (=TBP); andere TFs Phosphoryliert 26 Trans-Repressor; Immortalisation, Transformation Rb105; Phosphoryliert 55 Transformation zusammen mit E1A; Fördert Export von viralen mRNAs für Translation von späten Proteinen vom Zellkern zum Zytoplasma (zusammen mit E4/34 kD) p53 Phosphoryliert 20 Aktiv bei DNA Synthese; vermindert zytopathogene Effekte E1B Molekulare Virologie Rb105; Ruth Brack-Werner; SS 2009 Frühe (Early) virale Proteine (I) Adenoviridae/Parvoviridae Transkriptionseinheit Modifikation/Grösse (kD) Funktionen E2 E2A: Phosphoryliert 72 Aktiv bei DNA Replikation; bindet Einzelstrang DNA E2 E2B: 80 Vorläufer des Terminalen Proteins; Kovalent am 5’-Ende der viralen DNA gebunden; “Priming” bei der Initiation der DNA Synthese; E2 140 DNA Polymerase. Molekulare Virologie Ruth Brack-Werner; SS 2009 Adenovirus-Genomreplikation (I) Adenoviridae/Parvoviridae Veresterung von Serin im TP (80kD Vorläuferform) mit dCMP Rest WW von TP-80kDa mit kovalent an 5’Ende des Genoms gebundenem TP55kDa. Bildung des Initiationskomplexes; Cytosin an TP-80 kDa hybridisiert mit Guanin ; Verdrängung des an TP-55 kDa gebundenen Strangs; der verdrängete Strang komplexiert mit mit E2A; Synthese des neuen Strangs. Aus”Molekulare Virologie”, Modrow, Falk, Truyen, 2.Auflage, 2003, Spektrum Akademischer Verlag, Kap. 19l, Abb. 19.21a. Molekulare Virologie Ruth Brack-Werner; SS 2009 Adenovirus-Genomreplikation (II) Adenoviridae/Parvoviridae Elongation; DS mit einem neuen Strang Mit E2A komplexierter Einzelstrang (Elternstrang).; Synthese des zweiten Strangs Aus”Molekulare Virologie”, Modrow, Falk, Truyen, 2.Auflage, 2003, Spektrum Akademischer Verlag, Kap. 19l, Abb. 19.21b. Molekulare Virologie Ruth Brack-Werner; SS 2009 Frühe (Early) virale Proteine (II) Adenoviridae/Parvoviridae Transkriptionseinhei t/Protein Modifikation/Grösse (kD) Funktionen E3 34 “Akzessorische Proteine”; Fördern persistente Infektion; E3 Glykosyliert 19 Verringerung der Anzahl MCH-I Moleküle auf der Zelloberfläche; E3 14,7 Reduziert die Empfindlichkeit für Zellyse durch TNFα. E3 10,4 Wirkt als Mitogen: Interagiert mit EGF Rezeptor und fördert Proliferation der Zelle; Molekulare Virologie Ruth Brack-Werner; SS 2009 Frühe (Early) virale Proteine (II) Adenoviridae/Parvoviridae Transkriptionseinheit Modifikation/Grösse (kD) Funktionen E4 34 Fördert Export von viralen mRNAs für Translation von späten Proteinen vom Zellkern zum Zytoplasma (zusammen mit E1B/55 kD); Hemmt Export der zellulären mRNAs (host cell shutoff) E4 17 Interaktion und Aktivierung von E2F; E4 14 Proteinkinase; Phosphorylierung von zellulären (z.B. AP-1) und viralen (E1A) Proteinen; E4 10 Bindung an Kernmatrix. Molekulare Virologie Ruth Brack-Werner; SS 2009 1-4: Kontakt mit Rezeptor auf der Zelloberfläche (z.B. CAR = Coxsackie Adenovirus Receptor) sowie mit KoRezeptor (Integrine); Endozytose des Virus; Transport von Proteinassoziierter DNA in den Zellkern über Mikrotubuli; 5-8: Expression, Synthese und KerinImport von E1A; 9-14: Induktion der Synthese von Proteinen für Genomreplikation; Replikation des Genoms 15-18: Expression, Synthese und Kernimport von Strukturproteinen 19-21: Zusammenbau von Kapsiden; Proteaseabhängige Reifung der Virione; Freisetzung der Viruspartikel nach Zerstörung der Zelle. Principles of Virology, 2004. Flint SJ, Enquist LW, Racaniello VR, Skalka AM, 2nd edition. ASM Press. Appendix, Fig. 2. Adenovirus-assoziierte Krankheiten: Übertragung und Symptome Adenoviridae/Parvoviridae Übertragung: über Aerosole, kontaminierte Gegenstände, Flüssigkeiten (Schwimmbad!) Symptome • Ca. 50% der Infektionen asymptomatisch; • Hauptsächlich Erkrankungen der Atemwege: Erkältung, Bronchitis, Pneumonie • Fieber; • Gastroenteritis; • Bindehautentzündung; Molekulare Virologie Ruth Brack-Werner; SS 2009 Adenovirus-assoziierte Krankheiten Adenoviridae/Parvoviridae Molekulare Virologie Engler, 2005 www.microbio.uab.edu/Dental-Opt/ Lectures/engler102405.pdf Ruth Brack-Werner; SS 2009 Humane Adenoviren: Serotypen Molekulare Virologie Engler, 2005 www.microbio.uab.edu/Dental-Opt/ Adenoviridae/Parvoviridae Lectures/engler102405.pdf Ruth Brack-Werner; SS 2009 Übertragungswege von Adenoviren Adenoviridae/Parvoviridae Molekulare Virologie Engler, 2005 www.microbio.uab.edu/Dental-Opt/ Lectures/engler102405.pdf Ruth Brack-Werner; SS 2009 Verlauf der Adenovirus Infektion Adenoviridae/Parvoviridae Molekulare Virologie Engler, 2005 www.microbio.uab.edu/Dental-Opt/ Lectures/engler102405.pdf Ruth Brack-Werner; SS 2009 Parvoviridae Adenoviridae/Parvoviridae Mensch Mensch http://www.tulane.edu/~dmsander/WWW/335/Parvoviruses.html Molekulare Virologie Ruth Brack-Werner; SS 2009 Parvoviridae Adenoviridae/Parvoviridae Dependoviruspartikel: Ca. 20 nm Durchmesser Adenoviruspartikel: Ca. 90 nm Durchmesser http://www.tulane.edu/~dmsander/WWW/335/Parvoviruses.html Molekulare Virologie Ruth Brack-Werner; SS 2009 Parvoviridae: Genom Adenoviridae/Parvoviridae Lineare einzelsträngige DNA; 4860 Basen (AAV-2) bis 5600 Basen (Parvovirus B19); Palindromische Sequenzabschnitte an beiden Enden: Ermöglichen die Bildung von Haarnadelförmige Strukturen an beiden Enden bzw. die Faltung des Genoms in eine Pfannenstielstruktur; http://www.tulane.edu/~dmsander/WWW/335/Parvoviruses.html Molekulare Virologie Aus”Molekulare Virologie”, Modrow, Falk, Truyen, 2.Auflage, 2003, Spektrum Akademischer Verlag, Kap. 20.1, Abb. 20.2. Ruth Brack-Werner; SS 2009 AAV Gene Adenoviridae/Parvoviridae 2 ORFs: 6 mRNA Spezies (3 verschiedene Promotoren; Alternative splice sites) http://hvd.ens-lyon.fr/human_virology_dpt/teams/gs_aav/pr_aav/fp_aav Molekulare Virologie Ruth Brack-Werner; SS 2009 Parvovirusproteine Adenoviridae/Parvoviridae Proteine Grösse (kD) B19 AAV-2 VP1 VP2 VP3 83 58 NS1 Rep78 71 NS2 Rep68 11 Rep52,Rep40 - Funktionen 87 62 73 Kapsidproteine 78 Helikase, ATP-ase, Endonuklease, Transaktivator; Helikase, Endonuklease, Transaktivator, Tumorsuppressor, Genomintegration 68 ? Helikase, Endonuklease, Transaktivator, Tumorsuppressor*, Genomintegration 52, 40 Im Zytoplasma; Helikase; Verpackung der DNA *Fördert Apoptose; Stabilisiert RB105/E2F Komplexe Molekulare Virologie Ruth Brack-Werner; SS 2009 Parvovirus: Genomreplikation (Modell) Adenoviridae/Parvoviridae Auffaltung durch Helikaseaktivität von NS1/Rep78 Trs: terminal resolution site; Erkennungssequenz für Spaltung durch NS1/Rep 78 Endonuklease Aus”Molekulare Virologie”, Modrow, Falk, Truyen, 2.Auflage, 2003, Spektrum Akademischer Verlag, Kap. 20.1, Abb. 20.2. Molekulare Virologie Ruth Brack-Werner; SS 2009 AAV: Latente Phase Adenoviridae/Parvoviridae 1.-3. Eintritt des Virus; Einzelstrang Genom in d. Zellkern; 4. Synthese von Doppelstrang DNA; 5. Transkription am P5 Promoter; 6. Synthese von Rep 78; 7. Rep78 UNTERDRÜCKT die weiteren Promotoren; 8. Rep 78 fördert die Integration von mehreren Virus-Genomkopien in 19q13.3qter; Principles of Virology, 2004. Flint SJ, Enquist LW, Racaniello VR, Skalka AM, 2nd edition. ASM Press. Appendix, Fig. 11. Molekulare Virologie Ruth Brack-Werner; SS 2009 AAV: Produktive Replikation Adenoviridae/Parvoviridae 9. Infektion m. Adenovirus (= Helfervirus); 10. Synthese der Adenovirus “early” Genprodukte, die für die AAV Replikation nötig sind; (E1a, E1b, E2a, E4) 11. “Rescue” des AAV-Genoms; 12. E1A aktiviert den P5 Promoter und die Synthese von Rep78; 13. Rep 78 aktiviert die anderen Promotoren und die Synthese der weiteren Proteine; 14. Replikation der AAV-DANN; 17. Kapsidproteine werden in den Zellkern transportiert und assoziieren dort miteinander; 18. Verpackung der einzelsträngigen DNA in das Kapsid; 19. Zusammenbau des Partikels. Molekulare Virologie Ruth Brack-Werner; SS 2009 Principles of Virology, 2004. Flint SJ, Enquist LW, Racaniello VR, Pathogenität von Parvovirus B19 für Menschen Adenoviridae/Parvoviridae Übertragung: Virus wird über Speichel ausgeschieden; Übertragung durch Tröpfcheninfektion oder kontaminierte Blutkonserven; Verursacht Ringelröteln; Bei infektion von Schwangeren kann es zur schweren Schädigung des Fötus kommen; Symptome: Fieber, Gliederschmerzen, Ausschlag; bei Erwachsenen Entzündung der Gelenke; Vermehrt sich in erythroide Vorläuferzellen; Molekulare Virologie Ruth Brack-Werner; SS 2009 Pathogenität von Parvovirus B19 für Menschen Adenoviridae/Parvoviridae http://www.stanford.edu/group/virus/parvo/2005/B19.html Molekulare Virologie Ruth Brack-Werner; SS 2009