AB Eigenschaften idealer Gase
Werbung

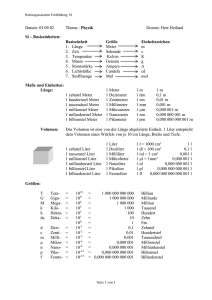
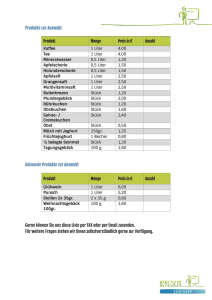
Klasse Fach : CTA : PC Datum : Übungsblatt Eigenschaften idealer Gase 1. Welche physikalische Eigenschaften habe ideale Gase ? Tipp: Betrachte das Verhalten von Gasen in einem geschlossenem Gefäß ! 2. Welche Zustandgrößen kennst Du, um den Momentanzustand eines ideales Gas beschreiben zu können ? 3. Welche Eigenschaften von Gasen lassen sich mit diesem Experiment beschreiben ? Tipp: Die Zunahme der Entropie (Unordnung) in einem Raum läuft meistens spontan ab ! 4. Was versteht man unter einer isobaren, isochoren und isothermen Zustandsänderung eines idealen Gases ? Tipp: Sehe in Deine Formelsammlung unter den Gasgesetzen nach 5. Was sagt das Gesetz von Avogadro über die Eigenschaften von Gasen aus ? Tipp: Welches Volumen haben 6 . 1023 Teilchen bei 271,15 K ? 6. Welche physikalischen Unterschiede bestehen zwischen einem realen und einem idealen Gas ? Tipp: Schaue Dir die Antworten von Frage 1 an ! Erstellt von Lb Datei unter Übungsblatt Gasgesetze.doc Seite 1 von 2 Klasse Fach : CTA : PC Datum : Übungsblatt Eigenschaften idealer Gase Aufgaben zum Berechnen ! 1. 50,0 Liter Sauerstoff werden ohne Druckänderung von 20 oC auf 35 oC erwärmt. Welches Volumen hat dann das Gas ? (V = 52,6 Liter) 2. 3,60 Liter Sauerstoff stehen bei 20 oC unter 970 hPa Druck a. Welchen Druck hat das Gas, wenn es auf 3,30 Liter komprimiert wird und sich dabei auf 23oC erwärmt ? (p = 1069 hPa) b. Welches Volumen hat das Gas bei 30 oC unter 940 hPa Druck ? ( V = 3,84 L) c. Welche Temperatur hat das Gas, wenn es unter 1020 hPa das Volumen 3,50 Liter einnimmt ? (T = 26,5 oC) 3. Welches Volumen haben a. 15,3 g CO2 im Normzustand ? (V = 7,79 L) b. 2,1 mg F2 unter 1024 hPa bei 16 oC ? (V = 9,74 L) c. 4 mol Ammonik unter 1,36 bar bei 88 oC ( V = 8718,3 m3) 4. Eine Stahlflasche von 40 Liter Inhalt enthält bei 20oC Sauerstoff unter 130 bar. Berechne die Masse des Gases. (m = 6830 g) 5. 180,5 mg einer organischen Verbindung nehmen nach der Verdampfung bei 145 kPa und 20oC ein Volumen von 36,4 mL ein. Wie groß ist die molare Masse M der Verbindung ? (M = 83,4 g/mol) Erstellt von Lb Datei unter Übungsblatt Gasgesetze.doc Seite 2 von 2