MRSA – die Gefahr lauert überall?!
Werbung

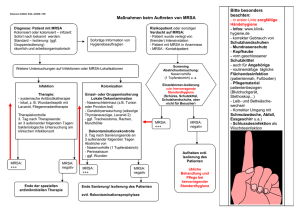
Steiermärkische Krankenanstaltengesellschaft m.b.H. Institut für Krankenhaushygiene und Mikrobiologie Hygiene Bakteriologie Serologie Molekularbiologie Tbc-Diagnostik Mykologie Parasitologie Ärztlicher Direktor: Prim. Dr. Klaus Vander MRSA – die Gefahr lauert überall?! OA Dr. Eva Schmon Institut für Krankenhaushygiene und Mikrobiologie Stiftingtalstrasse 14, 8010 Graz Multiresistente Erreger • MRSA • VRE Gram-positive Erreger MRGN: • ESBL • Carbapenemase-bildende Erreger • Pseudomonas aeruginosa • Acinetobacter baumannii • ….. Gramnegative Erreger Staphylococcus aureus Vorkommen: Sie besiedeln als Kommensalen und Krankheitserreger die Haut und Schleimhäute von Menschen und Tieren und kommen auch in der Umwelt, einschließlich auf Lebensmitteln, vor Etwa jeder dritte Mensch ist zumindest zeitweise Träger von S. aureus (d.h. S. aureus gehört zur physiologischen Flora, der Mensch wird „Keimträger“). Dieser Keimträgerstatus bleibt im Regelfall unbemerkt Staphylococcus aureus Besiedlung des gesunden Menschen durch S. aureus: MRSA MRSA Definition MRSA: • Methicillin resistenter Staphylokokkus aureus • weltweit ein eminentes Problem • Besiedlung häufig ohne Krankheitswert (Kolonisation) • Das Hauptproblem ist die schwierige Therapierbarkeit bei Infektion! • Wichtiger Erreger von nosokomialen Infektionen, zunehmend auch außerhalb des Krankenhauses Staphylococcus aureus Kolonisation mit S. aureus • 20 % der gesunden Bevölkerung dauerhaft besiedelt ( 60% zeitweise, 20 % nie) Krankenhauspersonal häufiger besiedelt • Hauptbesiedlungsort: Nasenvorhof • weitere Prädilektionsstellen: Rachen, Perineum, Leiste, Wunden, erkrankte Haut, Vagina, Haaransatz, Axilla, Hände • Kann schwere Haut- und Weichteilinfektionen, Fremdkörperinfektionen (Prothesen, Katheter), Pneumonien, Osteomyelitis, Sepsis verursachen Risikofaktoren MRSA 1) • Eine positive MRSA-Anamnese, d.h. einmal MRSA-Träger gewesen zu sein, auch wenn eine erfolgreiche Sanierung durchgeführt worden ist. • Kontakt zu einem MRSA-Träger • Krankenhausaufenthalt (>24 h) innerhalb der letzten 6 Monate bzw. (<3 Tage) innerhalb der letzten 12 Monate (Ausnahme: Krankenhaus ist bekanntermaßen MRSA-frei) • Aufenthalt in einem Alten-/Senioren-/Pflegeheim (>24 h) innerhalb der letzten 6 Monate (Ausnahme: Einrichtungen sind bekanntermaßen MRSA frei) • Beruflicher direkter Kontakt zu Tieren der landwirtschaftlichen Tiermast (Schweinen) Risikofaktoren MRSA 2) • • • • • • • • • • Hospitalisierung Mitarbeiter des Gesundheitswesens Dialysepatienten Immunsuppression Diabetes mellitus Vorhandensein von Fremdkörpern (Schrittmacher, Klappenersatz, Venenkatheter, implantierte Prothesen) Antibiotische Therapie innerhalb der letzten 6 Monate Chronische Pflegebedürftigkeit Katheter (DK, SPDK, PEG etc.) Offene chronische Wunden, tiefe Weichteilinfektionen oder Ulcera (“offenes Bein”) MRSA-Infektionen • Nosokomial: – Pneumonie – Sepsis – Harnweginfektionen – Wundinfektionen – Fremdkörperass. Infektionen • Ambulant erworben – Abszesse – Furunkulose – Tiefe Weichteilinfektionen Übertragung MRSA -Tier auf Mensch durch Antibiotikaeinsatz in der Tiermast (LA-MRSA ST-398) -Mensch auf Mensch wichtigster Übertragungsweg sind die Hände der Mitarbeiter -Umfeld des Patienten MRSA überlebt mehrere Monate auf nicht desinfizierten Flächen (Kittel, Instrumente, Geräte, …) Widerstand gegen Austrocknung und Wärme MRSA • durch Genmutation entstanden: Veränderung im Penicillin-bindenden Protein PBP2a, das durch das mecA-Gen kodiert wird • MRSA ist gegen alle β-Laktam-Antibiotika resistent: Penicillin, Oxacillin (Penicillinasefest), Methicillin, alle Cephalosporine und Carbapeneme • Hospital-acquired MRSA häufig auch Resistenzen gegen Erythromycin, Clindamycin, Tetracyclin oder Chinolone In vitro Resistenz gegen Oxacillin ist assoziiert mit in vivo Resistenz gegen alle β-Laktam-Antibiotika MRSA-Nachweis • Kultur: • Ein Abstrich des Patienten wird zuerst in einer speziellen Anreicherungsbouillon bebrütet, danach auf Spezialplatten für MRSA-screening ausgestrichen und 24h bei 37°C inkubiert (Gesamtuntersuchung: 48h) • Bei Wachstum von MRSA folgt eine Resistenztestung • Molekularbiologisch: • PCR vom Abstrich mit Nachweis von Staphylococcus aureus und mecA-Gen • Resistenztestung nicht möglich Screening-Empfehlung • In Anlehnung an die Screening- Empfehlungen des RKI sollte gemäß aktueller Risikostratifizierung ein Screening bei folgenden Indikationen (Risikopatienten, Kontaktpatienten, Risikointerventionen) erfolgen, um bereits die aus der vorstationären Ära mitgebrachten MRSAFälle zu erkennen. • Ein Patient mit einer MRSA- Anamnese hat ein fünf Mal höheres Risiko auch Jahre nach Feststellung der MRSA- Kolonisation erneut bei stationärer Aufnahme als besiedelt diagnostiziert zu werden als ein Patient ohne MRSA- Anamnese. Wozu Screening? • Identifizierung asymptomatischer MRSA-Träger • Vermeidung nosokomialer Übertragung: zeitnahe Einleitung von Hygienemaßnahmen und Dekolonisierungsmaßnahmen • folgende Indikationen: (Risikopatienten, Kontaktpatienten, Risikointerventionen) • Langzeitpflegeeinrichtungen: MRSA-positive Bewohner in den meisten Fällen eine reine Kolonisation ohne Anzeichen einer Infektion Kontaktpatienten • Definition: Mobile Patienten, die länger als 24 Stunden mit dem Indexpatienten im gleichen Zimmer untergebracht waren. • Ein Screening dieser Patienten erfolgt nach ärztlicher Anordnung bzw. nach Rücksprache mit der Krankenhaushygiene. Risikointerventionen: • Orthopädie (Implantation von alloplastischem Material) • Herzchirurgie • Dialyse • (Abteilungen mit bekannt erhöhter, postinterventioneller MRSA- Inzidenz) Screening Wo? Abstriche: • Nasenvorhöfe (beidseits-gepoolt) • Mund-Rachen • Haut (Axilla, Haargrenze, Leiste, Perineum) Höchste Sensitivität bei der Kombination von: Nase/Rachen, keratinisierter Haut und Perineum (gepoolter Abstrich) Optional: • Wunden • Austrittsstellen von Drainagen, Stomata und Kathetern • Trachealsekret (bei Intubation) MRSA Screening Methode Wie: • Bei Aufnahmescreening ► PCR • Bei suspiziertem Ausbruchsgeschehen ► PCR • Bei Positivität ► Kultivierung f. Antibiogramm bzw. Genotypisierung MRSA Sanierung • Täglich frische Leibwäsche, Kleidung, Waschlappen, Handtücher • Am 1., 2. und 5. Tag der Behandlung wird die Bettwäsche vollständig gewechselt • Täglich begleitende antiseptische Ganzkörperund Haarwäsche vorzugsweise mit Präparaten auf Octenidin-dihydrochlorid-Basis oder mit Chlorhexidin-Seife bei Nachweis von MRSA auf der Haut (z.B. mit Hibiscrub®, Stellisept®, Octenisan®) MRSA-Therapie • Bei Infektionen mit MRSA u. schwere S.-aureus-Infektionen sollten grundsätzlich keine ß-Laktam-Antibiotika eingesetzt werden. • Hier sind Kombinationen von Glykopeptiden mit Rifampicin, mit Clindamycin oder Gentamicin (je nach Antibiogramm) indiziert. Als weitere Kombinationspartner stehen Fosfomycin und Fusidinsäure zur Verfügung. Schließlich steht noch das Linezolid aus der Substanzgruppe der Oxazolidinone zur Monotherapie zur Verfügung (orale bzw. i.v. Applikation möglich). • Falls erforderlich, ist für die Behandlung von HautWeichgewebeinfektionen auch die Kombination von Rifampicin und Cotrimoxazol geeignet. • Ceftarolin (Zinforo®) bei Ceftarolin handelt es sich um ein parenteral applizierbares Cephalosporin der Gruppe 5 Sanierung - Wozu? • Die Sanierung dient dazu, eine Infektion des Patienten zu verhindern, die generelle MRSALast zu senken und somit die Wahrscheinlichkeit einer MRSA-Transmission im Krankenhaus auf andere Patienten zu minimieren. • Patienten mit MRSA-Besiedelung haben ein höheres Risiko, dass eine Kolonisierung zu einer MRSA-Infektion führt und konsekutiv eine erhöhte MRSA assoziierte Mortalität. MRSA Sanierung • bei jeglichem MRSA-Nachweis in der Nase sollte eine Sanierung mit Mupirocin-Nasensalbe (Bactroban® nasal) begonnen werden. Anwendungsempfehlung: 3x täglich über 5 Tage • Bei Auftreten von MRSA soll eine Antibiotika-Therapie nur dann durchgeführt werden, wenn klinische Zeichen einer Infektion vorliegen, also in keinem Fall, wenn es sich nur um eine Kolonisation des Patienten handelt • Antibiotika-Therapie nur bei Infektion →Nicht bei Kolonisation! MRSA Dekolonisierung Nasale Dekontamination: Antibiotika: • Bactroban® (Mupirocin Nasensalbe 2 %, 3x täglich während 5 T; Cave: Mupirocinresistenz) Alternativpräparate: • Betaisodona® (z.B. Spray 1,25% f. die Nase, magistrale Zubereitung) • Octenisan Nasengel® • PVP-Iod-Salbe (Braunovidon® Salbe ) • Prontoderm Nasal Gel ® (Polyhexanid-Betain-Komplex) • Fucidine® (Fusidinsäure) MRSA-Sanierung: • Ganzkörperwäsche mit Chlorhexidinseife 4 % für 7–10 Tage • Octenidin (Octenisan®Waschlotion, Octenidol® Mundspüllösung, Octenilin® Wundspüllösung) • Chlorhexidin (Hibiscrub Waschlotion®) • Polyhexanid-Präparate (z.B. Prontoderm® Solution, Prontoderm® Foam), MRSA-Follow up / Monitoring Was: kulturelle Kontrollabstriche Wann: • 2 Tage nach Eradikationstherapie • 1 x / Woche für alle Intensivpatienten Wo: • Nase • Vorangegangener Kolonisations-Infektionsort Wie oft: bis mind. 2 an aufeinanderfolgenden Tagen gewonnene Abstriche kulturell negativ sind Wie: • Kultur • Keine PCR unter Eradikationsmaßnahmen! Nosokomiale Infektionen….. Alles „nur ein Krankenhaus-Problem“? 2,2 % aller PatientInnen (Erstaufnahme aus dem kommunalen Bereich) sind MRSA positiv! (MRSAarNetz-2013) 4-8% der Bevölkerung sind - klinisch asymptomatisch - mit ESBL- Bildnern besiedelt! (Hyg Med 2013;38- 7/8) Kolonisation mit ESBL- Bildner auf der Intensivstation-, 15% waren bei der Erstaufnahme kolonisiert! (Razazzo K et al., Intensive Care Med 2012; 38:1769-1778) Übertragung • MRSA sind in der Lage in der unbelebten Umgebung des Patienten und im Staub über Wochen bis Monate (7 Tage bis 7 Monate) zu persistieren. • MRSA kann nicht nur bei direktem Kontakt mit dem Patienten, sondern auch bei Kontakt mit kontaminierten Gegenständen oder Oberflächen der Patientenumgebung übertragen werden. • Als wichtigster Übertragungsweg ist hierbei die direkte/indirekte kontaktassoziierte Übertragung über die Hände zu erachten. MRSA • ha-MRSA (hospital associated/acquired MRSA) • ca- MRSA (community associated MRSA) • la- MRSA (livestock associated MRSA) ha- MRSA • “hospital acquired MRSA” • medizinischen Einrichtungen • Pflegeeinrichtungen • überwiegend Kolonisation der Haut und Schleimhaut • 4-fach erhöhtes Risiko einer konsekutiven MRSA Infektion • vorbestehenden Komorbiditäten: bis zu 30 % im Verlauf MRSA- Infektion Ca-MRSA • neuer Stamm Ca-MRSA (community acquired) erstmals 1998 in USA (Michigan) beschrieben, bei nicht hospitalisierten Patienten • verursacht massiv nekrotisierende Pneumonien sowieUlzerationen im Bronchial- und Alveolarsystem mit sehr hoher Letalität, schwere Haut- und Weichteilinfektionen, Abszessbildung • hohe Letalität von 37 % innerhalb von 48 h bei Pneumonien • Ca-MRSA enthält als Pathogenitätsfaktor das PVL-Gen (Panton-Valentin-Leukozidin), das für ein Makrophagenabtötendes Toxin kodiert ca- MRSA • “community acquired MRSA” • meist im ambulanten Bereich • wenig Standardhygiene • sozialer Randgruppen • enge körperliche Kontakte (Saunabesuche, Sportklubs) • Auslandsaufenthalte • MSM- Szene (Men who have sex with Men) • Kann durch Panton-Valentin-Leucocidins (PVL) in die Haut eindringen und u.a. Furunkulosen, Abszesse bis hin zur nekrotisierenden Fasciitis hervorzurufen. la- MRSA • zumeist außerhalb von Krankenhäusern • vor allem in der Landwirtschaft - Masttierhaltung (Mastbetrieb, Schlachtbetriebe, etc.) • als auch bei in diesen Betrieben tätigen Personen nachzuweisen •Die Grenzen der hier dargestellten MRSA-Varianten sind nicht fest, sondern MRSA Stämme können durch besiedelte Patienten zwischen Krankenhaus und Allgemeinbevölkerung ausgetauscht werden bzw. auch aus der Bevölkerung (caMRSA; la-MRSA) ins Krankenhaus importiert werden. Selektion durch vorangegangene Antibiotikatherapie MRSA im Klinikalltag • Veröffentlichungen zeigen, dass in Deutschland inzwischen mehr als 50% der nachgewiesenen MRSAPatienten bereits bei Aufnahme positiv sind. • Untersuchungen des genetischen Fingerabdrucks der MRSA bei Entlassung, in Altenheimen, in der Arztpraxis und bei Wiederaufnahme zeigen, dass es sich oft um dieselben MRSA-Stämme handelt, die in diesem Kreislauf der stationären und ambulanten Versorgung zirkulieren. • Die mittlere Trägerdauer liegt – abhängig von den vorliegenden Risikofaktoren – zwischen 6 Monaten und 4 Jahre. MRSA im Klinikalltag • Das erklärt auch, warum ein Eingangsscreening (bei bekannter MRSA-Anamnese) von so herausragender Bedeutung für die Vermeidung der Verbreitung von MRSA ist. • Wird ein MRSA-Träger bei Wiederaufnahme nicht frühzeitig identifiziert und werden keine besonderen Hygienemaßnahmen durchgeführt, dann kann bei jedem Krankenhausaufenthalt MRSA auf weitere Menschen übertragen werden. • Der MRSA-Kreislauf dreht sich weiter und wird zu einer steigenden Spirale MRSA • MRSA ist ein Hautkeim und man kann ihn jeden Tag von anderen Menschen auf die Haut übertragen bekommen. • MRSA kann sich jedoch auf der (Schleim-)Haut und im Körper eines gesunden Menschen nicht ohne Weiteres einnisten und ausbreiten, da die gesunde Haut- und Schleimhaut(flora) des Menschen einen Schutz gegen MRSA darstellt (kolonisationsresistent). • Besitzt man jedoch bestimmte Risikofaktoren, wie z.B. Wunden, Punktionen, Operation etc., häufiger Kontakt zu MRSA-Patienten oder nimmt häufig und lange Antibiotika ein, kann MRSA sich dauerhaft auf der Haut/Schleimhaut festsetzen und auch Infektionen verursachen. Bekämpfungsstrategien • In den Niederlanden wurde bereits zu Beginn der 1980er Jahre mit der Bekämpfung von MRSA begonnen. • Seitdem werden Richtlinien umgesetzt, die eine Suche (search) nach MRSA besiedelten Patienten, eine konsequente Kontaktisolation von MRSA-Patienten im Krankenhaus und eine nachhaltige Dekontamination (destroy) des Keims bei MRSA-positiven Patienten beinhalten. • Diese Strategie wird deshalb auch „search and destroy policy“ genannt. NL: Search and destroy MRSA Häufigkeit Europäische Ländern (MRSA-Anteil an klinischen S. aureus-Isolaten) andere Länder • In Deutschland wurde die Verbreitungsdynamik von MRSA und deren Bedeutung als Verursacher von Krankenhaus-assoziierten Infektionen erst später erkannt, so dass sich MRSA vor der Einführung von MRSA-Bekämpfungsmaßnahmen schon weit ausbreiten konnten. • Zusätzlich geben niederländische Forschergruppen an, dass der Verbrauch von Antibiotika in den Niederlanden sehr niedrig sei, was einen positiven Effekt auf den Entstehungsdruck von multiresistenten Erregern hat. andere Länder • Begünstigt wird die Senkung der MRSA-Rate in den Niederlanden daher durch die größere allgemeine Akzeptanz der als notwendig erachteten Präventionsmaßnahmen, der konsequenten Auditierung von Einrichtungen wie Krankenhäusern, dem sehr zurückhaltendem Antibiotikaeinsatz, eine enge Vernetzung von ambulanten und stationären Versorgungseinrichtungen und durch eine konsequente Behandlung von MRSA-Trägern im ambulanten Bereich. • Schließlich muss die unterschiedliche Struktur der beiden Gesundheitswesen berücksichtigt werden. • Auf der einen Seite ist in den NL die Anzahl von Patientenbetten pro 1000 Einwohner um ca. 40-50% niedriger als in D, auf der anderen Seite sind Fachärzte nur in Krankenhäusern und Polikliniken verfügbar und nicht in eigener Praxis wie in Deutschland. Nosokomiale Infektionen….. Daten für Österreich AURES 2014 MRSA-Situation in Europa AURES 2014 MRSA-Situation in Europa AURES 2014 ein Erfolg? • In der Tat ist bekannt, dass bis zu 40% der Patienten nach Sanierung innerhalb der folgenden Monate wieder positiv werden. • Die Gründe sind bisher nicht hinreichend geklärt. • Diskutiert werden der verbleibende Risikofaktor, ein Neuerwerb von MRSA oder Versagen der Sanierung. • Da eine durchschnittliche Trägerdauer von 1 Jahr und länger beschrieben ist, wurde für die EUREGIO festgelegt, dass ein Patient im ambulanten Bereich nach einem einzigen negativen Abstrich (Nasenvorhof, Rachen, ggf. Wunde bzw. vormals positive Stelle) als vorläufig negativ zählt. • Endgültig negativ wird er jedoch erst nach einem 2. (3-6 Monate) und einem 3. (6-12 Monate) Abstrich. • Während dieser Zeit muss lediglich beachtet werden, dass bei Aufnahme in ein Akutkrankenhaus eine prophylaktische Isolierung bis zum Ausschluss erfolgen muss, da eine positive MRSA-Anamnese vorliegt. • In der Arztpraxis, im Altenheim und zuhause sind in dieser Phase keine über die Standardhygiene hinausgehenden Maßnahmen erforderlich. Kolonisierung • Wenn eine Kolonisierung mit MRSA erst einmal erfolgt ist, kann der Erreger über Monate oder sogar dauerhaft auf Häuten und Schleimhäuten persistieren. • Die genaue Transmissionsdosis von MRSA ist unbekannt, aber eine Menge von 100 KBE (koloniebildende Einheiten) beim Eintrag in eine offene Wunde oder Hautdefekt scheint für eine daraus resultierende Infektion ausreichend. MRSA in Lebensmitteln -Fleisch • Masthähnchenschlachtkörper: 48, 3 % • Hähnchenfleisch: 27,7 % • Die Anzahl von St. aureus/MRSA Isolaten in Geflügelfleisch ist gleich hoch wie im Schweinefleisch, jedoch höher als in Rindfleisch • Keimzahl: St. aureus in Geflügelfleisch: 102 CFU/g Fleisch • Keimzahl: St. aureus in faschiertem Geflügelfleisch: 104 CFU/g Fleisch • Keimzahl: MRSA in Hühnerfleisch: 10 – 30 CFU/g Fleisch • in Deutschland schwankt die Prävalenz von MRSA in Geflügelfleisch zwischen 24 und 50 % Allfällige Krankheitserreger im Lebensmittel-Fleisch Salmonellen: • Frisches Hähnchenfleisch: 6, 2 % • Frisches Schweinefleisch: 0,4% • Schweinehackfleisch: 1,4 % • Wildschweinfleisch: 3,4 % • Trockenpilze 1,6% Campylobacter: • Frisches Hähnchenfleisch: 31,6 % Mögliche Übertragungswege zwischen MenschTier- Lebensmittel Präventionsmöglichkeiten im häuslichen Bereich • Trennung Unrein / Rein • Reinigung /(Desinfektion) von Oberflächen und Gegenständen die mit rohem Fleisch in Berührung gekommen sind • Hände waschen (desinfizieren) • Erhitzen 70°C / mind. 10 min. des Lebensmittels Ambulanz Maßnahmen zur Prävention von Übertragungen multiresistenter Erreger im Ambulanzbereich: Standardhygiene = v.a. Händehygiene!!! Standardhygiene Schutzkleidung: • Flüssigkeitsdichte Einmalschürze (Einmalschutzkittel) bei erwartetem Kontakt mit Sekreten, und/oder Blut bzw. langärmeliger flüssigkeitsdichter Einmalschutzkittel bei geplanten Tätigkeiten mit engem Körper-(Patienten)kontakt • Flüssigkeitsdichter Einmalschutzkittel oder Einmalschürze sind patientenbezogen und einmalig zu verwenden • Nach Ablegen von Einmalschutzkittel oder Einmalschürze ist eine hygienische Händedesinfektion durchzuführen Handschuhe: • Einmalhandschuhe bei erwartetem Kontakt mit Sekreten, Exkreten und/oder Blut patientenbezogen verwenden • Vor dem Anziehen und nach dem Ablegen der Einmalhandschuhe ist eine hygienische Händedesinfektion durchzuführen Standardhygiene Mund-, Nasenschutz (MNS): • Bei MRSA- Nachweis im Nasen-Rachenraum und gleichzeitig bestehender Atemweginfektion des Patienten sowie bei starkem Hustenreiz anderer Genese (z.B. Asthma, COPD, starker Raucher, Cystische Fibrose, etc.) • Bei großflächigen, nicht abgedeckten Wunden und stark schuppenden Dermatosen • Bei Tätigkeiten mit möglicher Tröpfchenbildung (z. B. Absaugung, Intubation, Atemtherapie, etc.) • Nach Ablegen des MNS ist eine hygienische Händedesinfektion durchzuführen Standardhygiene Reinigung-, und Desinfektion: • MRSA werden sicher durch alle Desinfektionsmittel mit nachgewiesener bakterizider Wirksamkeit, unter der Berücksichtigung der vorgegebenen Einwirkzeit, inaktiviert • Tägliche Wischdesinfektion der patientennahen (Handkontakt-) Flächen (Nachttisch, Türgriffe etc.) und des Bodens bzw. nach potentieller Kontamination • Medizinische Geräte (Stethoskope, Blutdruckmessgeräte, etc.) mit direkten Patientenkontakt patientenbezogen verwenden bzw. unmittelbar nach Gebrauch desinfizieren • Wäsche direkt im Zimmer in einen entsprechenden Wäschesack geben und verschließen. • Bei potentieller Durchnässung ist ein flüssigkeitsdichter Übersack zu verwenden • Gebrauchte Instrumente direkt im Zimmer in einem geschlossenen Behälter entsorgen in der Ambulanz • Keine besondere Reihenfolge aus infektionspräventiven Aspekten notwendig • Kein Wechsel der Dienst-, und Bereichskleidung (außer nach Kontamination) • Normale Desinfektion der Oberflächen nach der Behandlung des Patienten • Nach Auftrocknen des Desinfektionsmittels sofortige Wiederbenutzung des Untersuchungs-, Behandlungs-, Eingriffs-, OP- Raumes möglich Infektionspräventive Maßnahmen gelten für alle Erreger! Räumliche Isolierung • Die Kontaktisolierung (Einzel oder Kohorte) von Patienten mit MRSA- Nachweis wird generell empfohlen • MRSA positive Patienten mit sezernierenden Erkrankungen, offenen Wunden, unkontrollierter Diarrhoe, frischen Stomata sowie komplett fehlender Compliance sind zu isolieren • Frisch operierte Patienten mit noch liegenden Drainagen und sezernierenden Wunden als auch immunsupprimierte Patienten sind nicht mit MRSA infizierten / kolonisierten Patienten in einem Zimmer unterzubringen Standardhygiene Die Maßnahmen der Standardhygiene sind bei allen Patienten, unabhängig von einer bekannten MRSAAnamnese, durchzuführen! Auf konsequente Händehygiene ist zu achten! Personal als MRSA- Träger • Personalscreening nur nach Rücksprache mit der Krankenhaushygiene • Nachweis als Momentaufnahme, in der Regel keine dauerhafte Besiedelung (CAVE: z.B. Dermatosen an den Unterarmen) • Zur epidemiologischen Abklärung ist die Typisierung der nachgewiesenen Erreger notwendig (Kultur) Zusammenfassung • MRSA ist in der Bevölkerung und auch im Krankenhaus zu finden • MRSA-Trägern „sieht“ man die Kolonisierung nicht an! • Die Maßnahmen der Standardhygiene sind bei ALLEN Patienten einzuhalten!!!! • Screening bei MRSA-Anamnese • Händedesinfektion als oberstes Gebot! • Persönliche Schutzausrüstung (PSA) verwenden! • Lebensmittelhygiene beachten Der sicherste Weg um Übertragung zu verhindern: Danke für die Aufmerksamkeit!