4.1.1 Energie und Arbeit Arbeit einer Kraft Die auf dem Weg von 1
Werbung
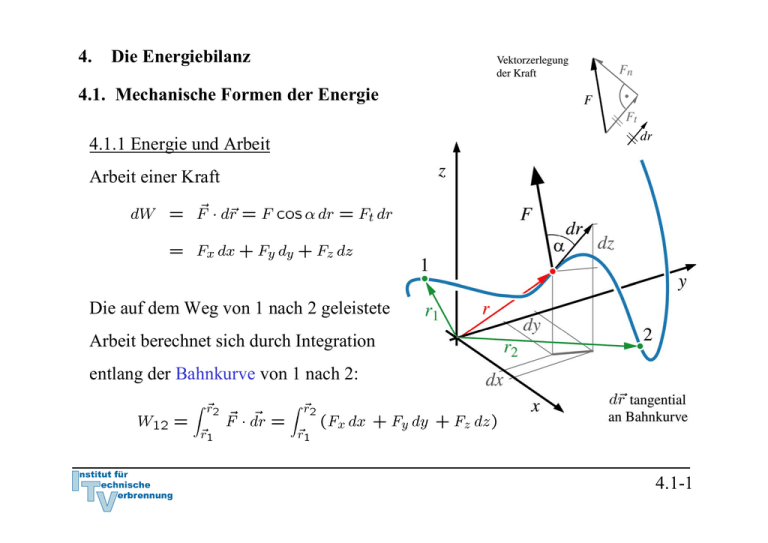
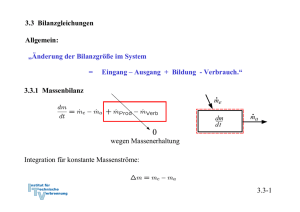
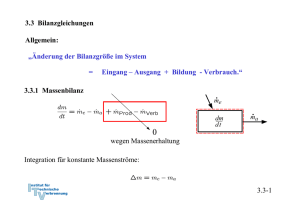
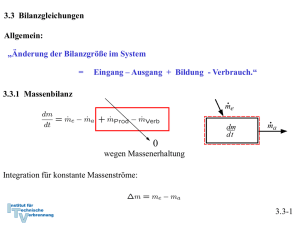
4. Die Energiebilanz 4.1. Mechanische Formen der Energie 4.1.1 Energie und Arbeit Arbeit einer Kraft Die auf dem Weg von 1 nach 2 geleistete Arbeit berechnet sich durch Integration entlang der Bahnkurve von 1 nach 2: 4.1-1 Wenn das angegebene Koordinatensystem ein Inertialsystem ist, sind nach Newton Beschleunigung und Kraft verknüpft: Definition Geschwindigkeit: Definition Beschleunigung: Es gilt mit der Kettenregel: Arbeit der Kraft: Dies ist der Arbeitssatz oder Energiesatz der Mechanik. 4.1-2 Definition kinetische Energie: Damit ist nach dem Arbeitssatz der Mechanik die Arbeit der Kraft mit der Änderung der kinetischen Energie des Massenpunktes verknüpft: 4.1-3 Beispiel: Bremsweg eines PKW bei konstanter Bremskraft (68iger Modell, Bremsen vorne kaputt) Die Arbeit der Bremskraft erwirkt eine Änderung der kinetischen Energie Befreiung des Systems PKW Bremsweg 4.1-4 Spezialfall: Arbeit der Gewichtskraft eines Massenpunktes bei Lageveränderung im Schwerefeld der Erde Falls z2 > z1 ist die vom System (Masse m) geleistete Arbeit negativ: Dies entspricht der auch in der Thermodynamik üblichen Vorzeichenkonvention, dass einem System zugeführte Arbeiten positiv, abgegebene Arbeiten dagegen negativ bewertet werden. 4.1-5 Definition: Potentielle Energie (Energie der Lage, die im System gespeichert) Wir erhalten damit: Falls z2 > z1 hat das System (Masse m) Arbeit gegen die Gewichtskraft geleistet, also Arbeit abgegeben. Nach dem Arbeitssatz muss dies einer Abnahme der kinetischen Energie des Systems entsprechen: 4.1-6 Die in einem einfachen mechanischen System insgesamt gespeicherten Energie setzt sich nach den getroffenen Definitionen aus der potentiellen und der kinetischen Energie zusammen: Offensichtlich bleibt ohne die Arbeit weiterer äußerer Kräfte die gesamte mechanische Energie aus kinetischer und potentieller Energie konstant. Dies ist die Aussage des Energieerhaltungssatzes. 4.1-7 Beispiel: Pendelversuch von Galilei Zustand 0: Zustand 1: Fadenkraft leistet keine Arbeit am System, da sie stets senkrecht auf der Bahnkurve steht ⇒ Energieerhaltung: Zustand 2: Freischnitt des Systems in allgemeiner Lage Eine Kenntnis der Zwischenzustände ist nicht nötig! 4.1-8 Der Arbeitssatz der Mechanik kann auch für ein thermodynamisches System angewandt werden. Wir müssen dazu jedoch voraussetzen, dass keine anderen inneren Energien des Systems in kinetische und potentielle Energie umgesetzt werden. Am System sollen neben der Gewichtskraft andere äußere Kräfte angreifen. Der Arbeitssatz liefert: 4.1-9 Reibung Makroskopische Bewegungen sind immer mit Reibungsverlusten verbunden. Die Reibungsarbeit wird in Wärme umgewandelt. Die Wärme steht dann nicht mehr unmittelbar als mechanische Energie zur Verfügung. Siehe Folie 4.1-9 mit der Reibkraft als äußerer Kraft: Da die Reibkraft der Bewegung immer entgegen gerichtet ist, ergibt das Integral einen negativen Wert oder 4.1-10 Potentielle Energie und mechanisches Gleichgewicht Ein Körper ist im Gleichgewicht, wenn er seinen Bewegungszustand nicht mehr ändert. Alle an ihm angreifenden Kräfte und Momente müssen dann in der Summe verschwinden. Aus der Erfahrung: Die Kugel kann an der Position 1 nicht in Ruhe verharren, wohl aber in Position 2 → stabiler Gleichgewichtszustand. Da die Bahnkurve auch gleichzeitig den Verlauf der potentiellen Energie darstellt, kann das Auftreten eines lokalen Minimums der potentiellen Energie als Bedingung für das stabile Gleichgewicht abgelesen werden. Darüberhinaus unterscheidet man noch labiles (3) und indifferentes Gleichgewicht (4). In jedem Fall verschwindet die Ableitung: 4.1-11 Dem stabilen Gleichgewicht (1) kommt gegenüber den anderen Gleichgewichtslagen eine Sonderstellung zu: Wird das System in den Position 3 gestört, so gelangt es in instabile Zustände und die Störung wird verstärkt → labiles Gleichgewicht. Nach der Störung sich selbst überlassen, wird der Körper freiwillig in eine stabile Lage übergehen. In Position 4 wird die Störung, wenn von Reibung abgesehen wird, nicht gedämpft oder verstärkt → indifferentes Gleichgewicht. Es ist nun die wesentliche Aufgabe der Thermodynamik, Gleichgewichte und Stabilitätsaussagen wie dEpot/dx = 0 abzuleiten, bei denen nicht nur mechanische Energieformen und einfache Körper sondern alle Energieformen und ganze Systeme betrachtet werden (vergl. Kapitel 8). 4.1-12 Wir haben die Arbeit äußerer Kräfte bereits auf ein thermodynamisches System statt auf einen einfachen Massenpunkt angewandt. Wir konnten die Arbeit äußerer Kräfte für die Änderung von kinetischer und potentieller Energie des Systems verantwortlich machen, die deshalb auch als äußere Energien bezeichnet werden. Der Zusammenhang ist korrekt, solange die Kräfte nicht auch Änderungen des inneren Zustands des Systems bewirken oder sich der innere Zustand des Systems selbst ändert . Dies ist bei thermodynamischen Systemen jedoch typischerweise der Fall und erfordert eine Verallgemeinerung des Energiesatzes der Mechanik. 4.1-13 Schon etwas komplexere mechanische Systeme können solche inneren Zustandsänderungen aufweisen. Ein Beispiel: Mechanisches System aus Rad, Wagenkasten und vorgespannter Feder. Start (Zustand 1) aus der Ruhe auf horizontalem Untergrund. Arbeitssatz: 4.1-14 Festlegung des Systems und Freischnitt Arbeiten äußerer Kräfte beim verlustlosen Rollen der Räder: Energien zu den verschiedenen Zeitpunkten: Kinetische Energie zum Zeitpunkt 2 durch Entspannen der Feder: Bem.: Diese kinetische Energie setzt sich zusammen aus der Rotationsenergie der Räder und der Translationsenergie von Rädern und Wagenkasten. 4.1-15 Wir werden im Abschnitt 4.2 sehen, dass äußere Kräfte auch den inneren Zustand eines Systems verändern können, nämlich schon dann, wenn die Abmessungen des Systems durch diese Kräfte verändert werden. Das wird im Abschnitt 4.2 mit der Volumenänderungsarbeit (vergl. 4.2-9) eingeführt. Umgekehrt kann die Änderung des inneren Zustands des Systems auch auf die Änderung äußerer Energien des Systems Einfluss nehmen. Dies geschieht zum Beispiel bei Fahrzeugen. Hier wird durch Verbrennung von Kraftstoff oder Umwandlung gespeicherter elektrischer Energie ein Teil der im System gespeicherten Energie in Bewegungsenergie und Energie der Lage umgewandelt. Die Einbeziehung aller möglicher Energieformen und -wandlungen in den Energieerhaltungssatz wird durch den 1. Hauptsatz der Thermodynamik geleistet. 4.1-16 4.2 Erster Hauptsatz der Thermodynamik „Die Gesamtenergie E eines Systems ändert sich durch Zu- und Abfuhr von Energie über die Systemgrenzen.“ Im Folgenden: Spezifizierung der verschiedenen Energieströme. Dabei werden wir uns auf die wichtigsten Energieformen beschränken.*) *) Vorzeichenregelung: zugeführte Energien werden positiv bewertet 4.2-1 4.2.1 Gesamtenergie oder Energieinhalt eines Systems Die Gesamtenergie E eines thermodynamischen Systems setzt sich zusammen aus den äußeren Energien Ea bestehend aus kinetischer Energie des Systems Ekin und potentieller Energie des Systems Epot und der im System gespeicherten Energie U, der inneren Energie Es lassen sich wieder molare und spezifische Größen formulieren: Gesamtenergie: Innere Energie: 4.2-2 Die innere Energie U Wie der Druck, das Volumen und die Temperatur ist auch die innere Energie eine Zustandsgröße. Es besteht deshalb z. B. der funktionale Zusammenhang Eine solche Beziehung heißt kalorische Zustandsgleichung. Die innere Energie ist eine Zustandsgröße. Über die thermische Zustandsgleichung sind Volumen, Druck und Temperatur voneinander abhängig, so dass die innere Energie auch wahlweise als Funktion der anderen Zustandsgrößen geschrieben werden kann. 4.2-3 Da die innere Energie eine Zustandsfunktion ist, besitzt sie ein vollständiges Differential. Falls die innere Energie als Funktion der Temperatur und des spezifischen Volumens gegeben ist lautet das vollständige Differential: oder: 4.2-4 Spezialfall: Die kalorische Zustandsgleichung des idealen Gases Beim idealen Gas beschreibt die innere Energie die thermische Energie des Systems auf Grund der Bewegung von Molekülen (Billardkugelmodell). Innere Energie Molare innere Energie . Für ein einatomiges, ideales Gas hatten wir gefunden: Es folgt für die molare innere Energie und für die spezifische innere Energie: Für ein ideales Gas ist daher die innere Energie nur eine Funktion der Temperatur. 4.2-5 Die äußeren Energien Ea Die kinetischen und potentiellen Energien beziehen sich auf die Bewegung des Systems als Ganzes relativ zu einem festen Bezugssystem (vergl. 4.1-5). Sie spielen bei geschlossenen Systemen, da diese meist ortsfest sind, oft keine Rolle. Zudem können vielfach alleine die Arbeiten äußerer Kräfte, für deren Änderung verantwortlich gemacht werden. Die Bilanz kann deshalb oft von der Energiebilanz für das System abgespalten werden (vergl. die Bemerkung auf Folien 4.1-11 und 4.1-12). Diese Möglichkeit besteht jedoch nicht immer, so dass eine genaue Betrachtung im Einzelfall notwendig ist. 4.2-6 4.2.2 Verschiedene Arbeitsformen Exemplarisch ohne Anspruch auf Vollständigkeit seien aufgezählt: - Arbeit äußerer Kräfte bei festen Systemgrenzen Wir können uns hier auf die Vorüberlegungen zu den mechanische Energieformen beziehen (vergl. 4.1-5). Alle Kräfte, die von außen auf das System einwirken, wollen wir als äußere Kräfte bezeichnen. Durch diese Kräfte ändern sich kinetische und potentielle Energien des Systems als Ganzes. Die Arbeit der Gewichtskraft ist für die Änderung der potentiellen Energie maßgeblich: 4.2-7 - elektrische Arbeit Zum Beispiel durch Zufuhr elektrischer Energie an Motor M aus der Umgebung Wel > 0 oder Abgabe an ein Leitungsnetz außerhalb des Systems erzeugt durch einen Generator G innerhalb des Systems Wel < 0. 4.2-8 - Wellenarbeit Übertragen durch eine über die Systemgrenze ragende Welle Eine Welle, angetrieben von einem außerhalb des Systems stehenden Motor M, wird Arbeit ins System einspeisen W > 0. Eine Welle, die einen Generator G außerhalb des Systems antreibt, entzieht dem System Arbeit W < 0. Durch die Welle eines Rührwerks wird von außen Arbeit in das System Welle übertragen W > 0. Bei den bisherigen Beispielen sind feste Systemgrenzen angenommen worden. Im Folgenden: Geschlossene Systemen mit bewegten Systemgrenzen 4.2-9 Volumenänderungsarbeit (Verschiebearbeit) und Nutzarbeit Betrachtet wird exemplarisch ein System aus Zylinder und Kolben. Die Kraft an der Kolbenstange leistet die Arbeit Bei quasistatischer, reversibler Zustandsänderung durchläuft das System eine Reihe von Gleichgewichtszuständen. Die träge Masse des Kolbens spielt dann keine Rolle. Eine Kräftebilanz am Kolben liefert deshalb für die Kraft: 4.2-10 Nutzarbeit und Volumenänderungsarbeit Die an die Kolbenstange abgeführte Arbeit, die Nutzarbeit, bei quasistatischer, reversibler Zustandsänderung ist daher: Der erste Term ist die Volumenänderungsarbeit des im Zylinder eingeschlossenen Gases: oder da m=const: Die Volumenänderungsarbeit des eingeschlossenen Gases wird bei Volumenvergrößerung von diesem an die Umgebung abgegeben: 4.2-11 Verschiebearbeit Der zweite Term ist die von der Umgebung aufgenommene Verschiebearbeit Sie entspricht der Volumenänderungsarbeit der Umgebung, wenn, wie in der Skizze angedeutet, die Umgebung als Bilanzsystems herangezogen wird. Die Verschiebearbeit ist also die Volumenänderungsarbeit gegen einen konstanten Druck. Der Begriff tritt bei vom Fluid durchströmten Systemen, also offenen Systemen, nochmals in Erscheinung (vgl. 4.2-14). Die Nutzarbeit ist nur ein Teil der vom System abgegebenen Arbeit. Ein Anteil der vom Gas abgegebenenVolumenänderungsarbeit wird als Verschiebearbeit an die Umgebung übergeben und kann nicht genutzt werden. 4.2-12 Volumenänderungsarbeit als reversible Arbeit Die gegebene Definition zur Volumenänderungsarbeit zeigt, dass sich die Volumenänderungsarbeit durch Umkehrung der Kolbenbewegung vollständig zurückgewinnen lässt. Solche Vorgänge werden als verlustlos oder reversibel bezeichnet. Die Volumenänderungsarbeit ist also eine reversible Arbeit. Die Umkehrbarkeit des Kompressionsprozesses für das System „Gas“ setzt voraus, dass keine Verwirbelung durch innere Reibung im Gas auftritt. Die Kolbenbewegung muss dazu sehr langsam, eigentlich unendlich langsam erfolgen. Es besteht zu jedem Zeitpunkt mechanisches Gleichgewicht. Bemerkung: Der Verluste durch Reibung zwischen Kolben und Wand spielt für das System „Gas“ keine Rolle. Der Kolben gehört ja gar nicht zum System! Erst bei der Betrachtung der Nutzarbeit am System „Kolben“ macht diese Reibung ihren Einfluss geltend und verringert die erzielbare Nutzarbeit. Der Terminus „reibungsfreier Kolben“ meint oft lax die Vernachlässigung aller Verluste. 4.2-13 Volumenänderungsarbeit pro Zeiteinheit beim Ein- und Ausschieben einer Masse Geschlossenes System mit mitbewegten Grenzen wird zu zwei Zeitpunkten 1 und 2 im Abstand dt (gedachte Kolben am Ein und Austritt) betrachtet. Volumenänderungsarbeit während des Zeitintervalls dt im Eintritt, Kraft F1 = p1 A , Wegänderung dx = c dt : Volumenänderungsarbeit pro Zeiteinheit im Eintritt: 4.2-14 Die im geschlossenen System enthaltene Masse bleibt konstant. Deshalb sind die Massenströme am Ein- und Austritt gleich und die Massenstromdichten ρ c gekoppelt: Volumenänderungsarbeit oder Verschiebearbeiten pro Zeiteinheit im Eintritt: und am Austritt: Summe der Verschiebearbeiten pro Zeiteinheit zwischen Ein- und Austritt: 4.2-15 Übergang vom geschlossenen System zum offenen Kontrollraum Die am geschlossenen System abgeleiteten Verschiebearbeiten pro Zeiteinheit können als Arbeitsströme gedeutet werden, die zu jedem Zeitpunkt einem System mit durchströmter Bilanzhülle (Kontrollraum), dem offenen System , zu- bzw. abgeführt werden. Diese Arbeitsströme sind an die Massenströme, welche die Kontrollgrenzen überschreiten, gekoppelt. Die spezifischeVerschiebearbeit ist durch gegeben. 4.2-16 Ergebnis: Die ein- und austretenden Massenströme führen mit: - Kinetische und potentielle Energien, - Innere Energien, - Verschiebearbeiten Die eintretenden Energieströme liefern an das System die Energie die austretenden Ströme entfernen den Energiestrom 4.2-17 Die Enthalpie H Wir definieren die Summe aus innerer Energie U und Verschiebearbeit pV als neue Größe: Die molaren und spezifischen Größen lauten: Wie die innere Energie ist auch die Enthalpie eine Zustandsgröße: Sie besitzt deshalb wie diese ein vollständiges Differential (vergl. 4.2-4): 4.2-18 Spezialfall: ideales Gas (vergl. 4.2-5) Aus folgt mit der thermischen Zustandsgleichung des idealen Gases und der inneren Energie sofort, dass auch die Enthalpie beim idealen Gas nur eine Funktion der Temperatur ist: Entsprechend gilt für die spezifischen Größen: 4.2-19 Totalenthalpie Als Summe aus Enthalpie und kinetischer und potentieller Energie wird auch die Totalenthalpie eingeführt: Für die molaren und spezifischen Größen gilt: Entsprechend wird die Energiebilanz am Kontrollvolumen noch kompakter darstellbar: 4.2-20 4.2.3 Wärmeströme Physikalische Deutung des Wärmestroms über Wände ins Bilanzsystem Wärmestrom J/s , 1 J = 1 Nm Wärmeleitung (Fouriersches Gesetz) , z. B. in der ebenen Wand Wärmeleitfähigkeit: λ [λ] = J/(msK) 4.2-21 Wärmestrom bei Konvektion Wärmeübertragung Wärmeübergangskoeffizient α [α] = J/(m2sK) Temperaturprofil T(r) wird durch die mittlere Temperatur Tm ersetzt, α wird empirisch für verschiedene Strömungen bestimmt. 4.2-22 Wärmetransport und Irreversibilität Die vorgenannten Prozesse der Wärmeübertragung haben, wie die Erfahrung lehrt, eine eindeutige, vorgegebene Richtung. Wärme fließt stets vom heißeren zum kälteren Körper. Zwischen dem thermodynamischen System und der Umgebung wird es zu einem Temperaturausgleich kommen. Die dargestellten Prozesse der Wärmeleitung und Konvektion sind also nicht umkehrbar oder irreversibel. 4.2-23 Reversibler Wärmetransport Dieser Begriff erscheint nach der vorstehenden Bemerkung sinnlos. Wir werden aber sehen, dass er für theoretische Konzepte eine wichtige Rolle spielt. Reversibler Wärmetransport erfordert eine verschwindende Temperaturdifferenz ΔT zwischen System und Umgebung. Der Wärmestrom tendiert mit ΔT → 0 selbst gegen Null. Damit geht aber ein unendlich langsamer Temperaturausgleich einher. Sind praktisch keine Temperaturunterschiede vorhanden, ist der Wärmefluss im Prinzip umkehrbar. System und Umgebung sind bei der reversiblen Wärmezufuhr zu jedem Zeitpunkt im thermischen Gleichgewicht. (Vergl. auch die Bemerkung zur reversiblen Arbeit Folie 4.2-11) Wir werden bei der späteren Quantifizierung von Irreversibilitäten darauf geführt, dass das Maß für die Irreversibilitäten proportional zu ΔT 2 ist und damit von höherer Ordnung gegen Null tendiert als der Wärmestrom (Abschnitt 5). 4.2-24 Erster Hauptsatz der Thermodynamik Damit können wir die Energiebilanz endgültig formulieren: „Die Gesamtenergie eines Systems ändert sich durch die mit den Massenströmen über die Systemgrenzen transportierte Totalenthalpien und durch Arbeits- und Wärmeströme über die Systemgrenzen.“ 4.2-25 4.3 Verschiedene Formen des 1. Hauptsatzes 4.3.1 Geschlossenes System ohne Änderung äußerer Energien Keine Massenflüsse über Systemgrenze, m = const, Keine Änderung von kinetischen und potentiellen Energien des Systems ⇒ Die Änderung der inneren Energie wird betrachtet: e = u. Abstraktion und Freischnitt: 4.3-1 Erster Hauptsatz: mit Volumenänderungsarbeit: (reversibel) Reibungsarbeit: (irreversibel) 4.3-2 Der während eines Zeitintervalls 1-2 zugeführte spezifische Wärmestrom wird als bezeichnet (analog für die Volumenänderungsarbeit und die Reibungsarbeit) Da die innere Energie eine Zustandsfunktion ist, braucht nur die Änderung der inneren Energie zwischen den Zeitpunkten betrachtet zu werden. 1. Hauptsatz für geschlossene Systeme in differentieller und integraler Form Die Änderung der inneren Energie eines geschlossenen Systems ist gleich der Summe aus Wärme, die über die Systemgrenze zugeführt wird, der Volumenänderungsarbeit des Systems und aller irreversibel zugeführten Arbeiten. 4.3-3 Im Allgemeinen können sich auch die äußeren Energien des Systems ändern und äußere Kräfte Arbeit leisten. Sind diese Energieformen zu berücksichtigen lautet der 1. Hauptsatz in differentieller Form und in integraler Form 4.3-4 Spezialfall: 1. Hauptsatz für geschlossene Systeme bei reversibler Prozessführung keine mechanischen Verluste und Wärmezufuhr reversibel (vergl. die Bemerkungen auf Seite 4.2-13 und 4.2-22) 4.3-5 Beispiel: Kolben-Zylindersystem im Schwerefeld der Erde Ein Kolben mit Masse mK schließt einen mit Gas, Masse mG, gefüllten Zylinder nach oben ab. Der Kolben werde ein kleines Stück dz langsam nach oben bewegt, so dass das Gas im Inneren stets im Gleichgewicht sei. Der Kolben gleite ferner reibungsfrei. Formulieren Sie die differenzielle Energiebilanz für diesen Prozess! Der 1. Hauptsatz für ein geschlossenes System mit Änderung äußerer Energien lautet: 4.3-6 Nebenstehend sind zwei mögliche Systemabgrenzungen skizziert. Für beide Systeme sollen die Bilanzen formuliert werden. Da beide Systeme bei dem als langsam angenommenen Vorgang stets im Gleichgewicht stehen und auch der Kolben reibungsfrei gleitet, kann die Reibarbeit δwR in beiden Fällen vernachlässigt werden. Die Systeme besitzt ebenfalls keine kinetische Energie. 4.3-7 Die Bilanz lautet unter diesen Voraussetzungen für beide Systeme: System 1: Bei Verschiebung der oberen Grenze gewinnt das Gas die potentielle Energie: Die Volumenänderungsarbeit ist: Die Arbeit der äußeren Kräfte verschwindet, da die Differenz der Druckkräfte der Gewichtskraft des Gases das Gleichgewicht hält (Hydrostatik). Die resultierende äußere Kraft also verschwindet: Die Bilanz für System 1 lautet also: 4.3-8 System 2: Bei Verschiebung der oberen Grenze gewinnen das Gas und der Kolben die potentielle Energie: Die Volumenänderungsarbeit ist Verschiebearbeit gegen die Umgebung: Die resultierende äußere Kraft leistet die Arbeit: Die Bilanz für System 2 lautet also: Wegen der hydrostatischen Aussage folgt wieder wie für System 1: 4.3-9 4.3.2 Stationärer Fließprozess in offenen Systemen Annahmen: 1. Stationär → Masse im System konstant: 2. Arbeit ist die dem System durch Wellen übertragene Arbeit: 4.3-10 Bilanz am stationären offenen System: Zugeführter Wärmestrom: Zugeführte Leistung: 4.3-11 Mit der Enthalpie folgt der 1. Hauptsatz für stationären Fließprozess Die Summe aus zugeführter Wärme und zugeführter technischer Arbeit ist gleich der Änderung der Enthalpie, der kinetischen und der potentiellen Energie des Mediums, das in einem stationären Fließprozess durch einen Kontrollraum strömt. 4.3-12 Vergleich mit 1. Hauptsatz für geschlossene Systeme Die Bilanz am offenen System lautet: Für das mitschwimmende Massenelement (grün), das bei 1 ein- und bei 2 austritt, liefert der 1. Hauptsatz für das geschlossene System mit Die Differenz der beiden Formulierungen ergibt für die technische Arbeit: 4.3-13 Die Differenz ergibt für die technische Arbeit: Mit der Produktregel der Differentiation lassen sich die ersten beiden Terme auf der rechten Seite zusammenfassen. 4.3-14 Die technische Arbeit besitzt demnach zwei Anteile reversibler Anteil irreversibler Anteil Bem.: Der reversible Anteil beinhaltet die kinetischen und potentiellen Energien der Massenströme. Die gespeicherte potentielle Energie in einem hochgelegen Reservoir wird zum Beispiel als technische Arbeit bei Wasserkraftanlagen in einer Turbine umgesetzt. 4.3-15 Spezialfall: 1. Hauptsatz für stationären Fließprozess bei reversibler Prozessführung keine mechanischen Verluste und Wärmezufuhr reversibel (vergl. die Bemerkungen auf Seite 4.2-13) 4.3-16 Spezialfall: Adiabater Strömungsprozess (q12 = 0) ohne technische Arbeit (wt12 = 0), Bei einem solchen Prozess bleibt die Totalenthalpie konstant. Das heißt, die Summe der austretenden Totalenthalpieströme ist gleich der Summe der eintretenden Totalenthalpieströme. 4.3-17 4.4 Die spezifischen Wärmekapazitäten 4.4.1 Änderung der inneren Energie auf Grund von Temperaturänderung Wegen des 1. Hauptsatz ist es zweckmäßig isochore Prozesse zu betrachten, da dann die Volumenänderungsarbeit verschwindet (vgl. 4.7-2): Bei reversibler Prozessführung ist dann die Änderung der inneren Energie allein durch die Wärmezufuhr bestimmt: Wir betrachten und definieren wegen (*): spezifische und molare Wärmekapazität bei konstantem Volumen 4.4-1 Bei konstantem Volumen gilt: Bemerkung: Wir haben die Änderung der inneren Energie mit der zugeführten Wärme gekoppelt, indem wir einen isochoren Prozess betrachtet haben: Für ideale Gase ist die Einschränkung auf einen isochoren Prozess aber nicht notwendig, da hier wegen gilt und damit immer: Der 1. Hauptsatz liefert für ideale Gase: 4.4-2 4.4.2 Änderung der Enthalpie auf Grund von Temperaturänderung Änderung der Enthalpie auf Grund von Temperaturänderungen bei konstantem Druck, isobare Prozesse (vgl. 4.7-3): Wir definieren wegen (*): spezifische und molare Wärmekapazität bei konstantem Druck Bei konstantem Druck gilt: 4.4-3 Eine Sonderrolle kommt wieder dem idealen Gas zu: Wir haben die Änderung der Enthalpie mit der zugeführten Wärme gekoppelt, indem wir einen isobaren Prozess betrachtet haben: Für ideale Gase ist die Einschränkung auf einen isobaren Prozess aber nicht notwendig, da hier wegen gilt und damit immer: Der 1. Hauptsatz liefert für ideale Gase: 4.4-4 4.4.3 Spezifische Wärmekapazitäten idealer Gase Bei idealen Gasen sind die innere Energie und die Enthalpie ausschließlich Funktionen der Temperatur. Daher müssen auch die molaren und spezifischen Wärmekapazitäten reine Temperaturfunktionen sein: Es gilt ferner: 4.4-5 Ableitung Ebenso Verhältnis der spezifischen Wärmen: κ ∗) Es ergibt sich: Das Billardkugelmodell des idealen Gases beschreibt im angegebenen Temperaturbereich den Wert für einatomige Gase richtig (vergl. 4.2-19): Verhältnis der spezifischen Wärmen κ spielt eine besondere Rolle. Wir werden sehen, dass für die idealen Gase κ gleich dem Isentropenxponenten k ist (vergl. 4.7-6) *) Das 4.4-6 Das Verhältnis der spezifischen oder der molaren Wärmen nimmt bei Umgebungstemperatur näherungsweise folgende Zahlenwerte an: Einatomige Gase: κ = 5/3 = 1,66 Zweiatomige Gase: κ = 7/5 = 1,4 4.4-7 Für mehratomige Gase zeigen Messungen, dass die spezifischen Wärmekapazitäten deutlich größer und deutlich temperaturabhängig sind: Für zweiatomige Gase bei Raumtemperatur liest man im vorstehenden Diagramm folgenden Wert ab: Zweiatomige Gase können bei diesen Temperaturen noch als starres Hantelmodell dargestellt werden. Da die innere Energie als die Summe der Energien der frei betrachteten Moleküle dargestellt werden kann, kommt bei zweiatomigen Gasen zu den drei Energieanteilen der Translation des Billardkugelmodell noch die Rotationsenergie um zwei Achsen hinzu. Nach dem Gleichverteilungssatz erhält im statistischen Mittel jeder Freiheitsgrad die gleiche innere Energie. Daher ist: Noch höhere Temperaturen regen Molekülschwingungen und bisher eingefrorene Freiheitsgrade an, so dass die Wärmekapazitäten mit der Temperatur weiter ansteigen. 4.4-8 Translatorische und rotatorische Freiheitsgrade Einatomige Gase (Beispiel Edelgase wie He, Ar etc) Freiheitsgrade der Translation: 3 Freiheitsgrade der Rotation: alle eingefroren*) Zweiatomige Gase (Beispiel Gase wie N2, O2 etc) Freiheitsgrade der Translation: 3 Freiheitsgrade der Rotation: 2 (einer eingefroren*)) Dreiatomige Gase mit gewinkelter Struktur (Beispiel Gase wie H2O, SO2 etc) Freiheitsgrade der Translation: 3 Freiheitsgrade der Rotation: 3 Aus den Messwerten lässt sich deshalb folgern, dass CO2 keine gewinkelte Struktur wie H2O oder SO2 hat! *) Die Tatsache, dass einige rotatorische Freiheitsgrade eingefroren sind, ist ein quantenmechanischer Effekt und lässt sich mit der klassischen Physik nicht erklären. Die Quantisierung des Drehimpulses erfordert bei kleinem Trägheitsmoment eine ausreichend hohe Temperatur, um die Rotation um die entsprechende Achse anzuregen. Alle klassischen Erklärungen widersprechen dem Gleichverteilungssatz, nachdem jeder Freiheitsgrad die gleiche Energie aufnimmt. 4.4-9 4.4.2 Spezifische Wärmekapazitäten idealer Flüssigkeiten Annahme: inkompressibel, d. h. konstantes Volumen: dv = 0 1. Hauptsatz liefert mit pdv = 0: Die innere Energie für ideale Flüssigkeiten ist also nur von der Temperatur abhängig. 4.4-10 Folgerung für die Enthalpie idealer Flüssigkeiten und cp Definition der Enthalpie: Vollständiges Differential: Vergleich: ⇒ Wärmekapazitäten cp und cv sind gleich für ideale Flüssigkeiten. Die Enthalpie für ideale Flüssigkeiten ist also von der Temperatur und vom Druck abhängig: 4.4-11