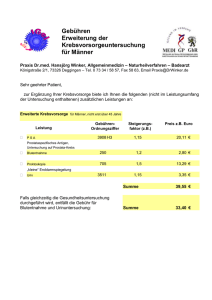
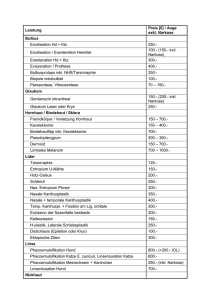
Endversion Master Arbeit - GV
Werbung

Stiftung Tierärztliche Hochschule Hannover Stressbelastung durch die von der GV-SOLAS empfohlenen Blutentnahmemethoden bei der Maus MASTER ARBEIT Zur Erlangung des Grades Master of Science des Studienganges Biologie der Tiere vorgelegt von Anja Schlichting Magdeburg Inhaltsverzeichnis 1. Abkürzungsverzeichnis 5 2. Einleitung 6 3. Literaturübersicht 8 3.1 Narkose 8 3.1.1 Ether 9 3.1.2 CO2 9 3.1.3 Sevofluran 10 3.1.4 Isofluran 10 3.2 Richtlinien für die Blutentnahme 3.2.1 Blutvolumen der Maus 11 3.2.2 Empfohlene Blutentnahmemenge 11 3.3 Blutentnahmemethoden 12 3.3.2 Punktion der Vena saphena 16 3.3.3 Punktion der Vena facialis 17 3.3.4 Punktion der Schwanzvene 19 3.3.5 Punktion des Venenwinkels 20 3.4 Stress 21 3.4.1 Stressnachweis im Blut anhand von Glucocorticoiden 21 3.4.2 Stressnachweis anhand des Verhaltens im Open Field 22 4. Material und Methoden 4.1 Versuchstiere 4.1.1 Haltung 4.2 Versuchsgruppen 24 24 24 25 4.2.1 Narkoseversuch 25 4.2.2 Blutentnahmeversuch 25 4.3 Versuchsablauf 11 26 4.3.1 Basalwertbestimmung von Corticosteron 26 4.3.2 Narkoseversuch 27 4.3.3 Blutentnahmeversuch 27 2 4.4 Narkose 4.4.1 Sevofluran 28 4.4.2 Isofluran 29 4.4.3 Ether 29 4.4.4 CO2 29 4.4.5 Sham 29 4.4.6 Kontrollen 29 4.5 Blutentnahmemethoden 30 4.5.1 retrobulbäre Blutentnahme 30 4.5.2 Blutentnahme aus der Schwanzvene 31 4.5.3 Blutentnahme aus der Vena saphena 32 4.5.4 Blutentnahme aus der Vena facialis 32 4.5.5 Blutentnahme aus dem Venenwinkel 33 4.6 Videoaufnahme 34 4.7 Open Field 34 4.8 Aufbereitung des Blutes 35 4.9 Bestimmung von Corticosteron mittels ELISA 35 4.10 Statistische Analysen 36 5. Ergebnisse 5.1 Narkose 37 37 5.1.1 Einleitung der Narkose 37 5.1.1.1 Zeit bis zur Ataxie 37 5.1.1.2 Zeit bis zum Erreichen einer operativen Tiefe 38 5.1.2 Verhalten direkt nach der Narkose 39 5.1.2.1 Zeit bis zum Erwachen aus der Narkose 39 5.1.2.2 Gesamtaktivität nach der Narkose 39 5.1.3 Blutanalyse 41 5.1.3.1 Hämatokrit 41 5.1.3.2 Corticosteron 42 5.1.4 Open Field 28 44 3 5.1.4.1 gelaufene Gesamtstrecke 44 5.1.4.2 maximal gelaufene Strecke 45 5.1.4.3 Zonenübertritte 46 5.1.4.4 Latenz des ersten Auftretens 46 5.1.4.5 gelaufene Geschwindigkeit 47 5.1.4.6 Aufenthaltsdauer in der Mitte des Open Fields 48 5.2 Blutentnahme 5.2.1 Dauer für die Blutentnahme 49 49 5.2.1.1 Dauer für die Durchführung der reinen Blutentnahme 49 5.2.1.2 Gesamtdauer für die Blutentnahme 51 5.2.1.3 Quantität des gewonnenen Blutes 52 5.2.2 Gesamtaktivität nach der Blutentnahme 53 5.2.3 Blutanalyse 55 5.2.4 Open Field 57 5.2.4.1 gelaufene Gesamtstrecke 57 5.2.4.2 maximal gelaufene Strecke 58 5.2.4.3 Zonenübertritte 59 5.2.4.4 Geschwindigkeit 60 5.2.4.5 Latenz des ersten Auftretens 61 5.2.4.6 Aufenthaltsdauer in der Mitte des Open Fields 62 6. Diskussion 63 6.1 Narkose 63 6.2 Blutentnahme 66 7. Zusammenfassung 72 8. Literaturverzeichnis 74 9. Danksagung 82 4 1. Abkürzungsverzeichnis ACTH Adenocorticotropes Hormon CO2 Kohlenstoffdioxid CRH Corticotropin-releasing Hormon EDTA Ethylendiamintetraacetat ELISA Enzyme Linked Immunoabsorbent Assay ER Endoplasmatische Retikulum FELASA Federation of Laboratory Animal Science Associations GV-SOLAS Gesellschaft für Versuchstierkunde - Society for Laboratory Animal Science k.A. keine Angaben KGW Körpergewicht MAC Minimale Alveoläre Anästhetikumkonzentration MW Mittelwert RPM Rounds per Minute s Sekunde SD Standardabweichung ZNS Zentralnervensystem 5 2. Einleitung Beim wissenschaftlichen Arbeiten mit Tieren wird häufig das Blut der Tiere benötigt, um Untersuchungen wie Antikörper- bzw. Hormonbestimmung und ähnliches durchzuführen. Bei kleinen Labornagern gibt es verschiedene Methoden der Blutentnahme, die je nach dem wissenschaftlichen Anliegen besser oder schlechter geeignet sind. Vor einer Entnahme muss deshalb überlegt werden, von welcher Qualität das Blut sein soll. Außerdem spielt die Menge der Blutprobe eine entscheidende Rolle. Dabei ist zu bedenken, ob es eine finale Blutentnahme sein soll, oder ob einmalig bzw. mehrmals Blut gewonnen werden soll. Die Häufigkeit der Blutentnahme muss an das Blutvolumen des Tieres und seine Regeneration angepasst sein. Ein weiterer wichtiger Faktor, der beachtet werden muss, ist der Stress, der bei der jeweiligen Blutentnahme für das Tier entsteht. Zum einen verändert eine erhöhte Stresshormonausschüttung die Versuchsergebnisse, zum anderen sollen für das Tier bei der Entnahme möglichst wenig Schmerzen, Leiden oder Schäden auftreten. Aus allen diesen Gründen wurden verschiedene Blutentnahmemethoden wie die Punktion der Schwanzvene, die Herzpunktion oder die Entnahme aus dem retrobulbären Venenplexus entwickelt. Diese Methoden sind etabliert und werden häufig bei Mäusen angewendet. In einer vorherigen Studie wurden zwei von der GV-SOLAS (1999) empfohlenen Methoden zur Blutentnahme, die retrobulbäre Blutentnahme und die Punktion der Vena facialis mit einer Lanzette, auf Stress für das Tier untersucht. Dabei wurden die Blutentnahmen sowohl mit Ether, CO2, als auch ohne Narkose durchgeführt. Es stellte sich anhand der Corticosteron Konzentration und dem Verhalten im Open Field heraus, dass die retrobulbäre Blutentnahme ohne Narkose bei der Maus scheinbar die geringste Stressantwort auslöst. Die Inhalationsnarkosen schienen den Stress zu erhöhen. Bei der Punktion der Vena facialis führte die CO2 Narkose zu mehr und die Ether Narkose zu weniger Stress (Schlichting et al., 2008). 6 Aus diesem Grund soll in dieser Arbeit zum einen untersucht werden, welchen Einfluss Ether-, CO 2 -, Sevofluran-, und Isofluran-Narkosen auf die Stressreaktion der Maus haben. Zum anderen werden alle von der GV-SOLAS (2009) empfohlenen Blutentnahmemethoden: die retrobulbäre Blutentnahme, die Punktion der Vena saphena, der Vena facialis sowie der Schwanzvene und die Blutentnahme aus dem Venenwinkel auf Stress untersucht. Ziel ist es eine Aussage der Stressreaktion der Mäuse sowohl auf eine Blutentnahme, als auch auf eine Narkose zu treffen. Dazu werden Corticosteron-Bestimmungen durchgeführt und das Verhalten direkt nach der Narkose bzw. Blutentnahme, sowie im Open Field beobachtet. 7 3. Literaturübersicht 3.1 Narkose Narkotika dienen dazu, bei operativen Eingriffen Schmerzen zu vermeiden. Sie schalten sowohl die Erregungsleitung als auch die Erregungsbildung des zentralen Nervensystems aus. Als Folge ergeben sich Analgesie, Bewusstlosigkeit und Muskelerschlaffung (Forth et al., 2005). Um dieses Stadium zu erreichen, werden die Narkotika injiziert oder inhaliert. Im Rahmen dieser Masterarbeit wird näher auf die Inhalationsnarkotika eingegangen. Bei Nagetieren erfolgt die Narkoseeinleitung am stressfreiesten in einer Ganzkörperkammer (Flecknell et al., 2009). Bei der Einleitung der Narkose gelangt das Narkotikum wie zum Beispiel Halothan, Methoxyfluran, Ether oder CO2 in den Respirationstrakt. Durch die Diffusion an der Alveolarmembran gelangt es schließlich in den Blutstrom der Lunge und wird über den Blutkreislauf in die Gewebe verteilt. Die Inhalationsnarkotika verfügen über eine ausreichende Penetrationsfähigkeit, so dass die Blut-Hirn-Schranke kein Hindernis darstellt. Der genaue Wirkmechanismus der jeweiligen Narkotika ist bislang noch nicht geklärt (Forth et al., 2005). Volatile Anästhetika unterscheiden sich in ihren physikochemischen Eigenschaften, wie dem Dampfdruck, dem Öl-Gas-Verteilungskoeffizienten und dem Blut-GasVe r t e i l u n g s k o e f fi z i e n t e n . D e r D a m p f d r u c k u n d d e r B l u t - G a s Verteilungskoeffizient bestimmen die Aufnahmefähigkeit durch die Lunge, während der Öl-Gas-Verteilungskoeffizient eine Voraussage über die anästhetische Potenz erlaubt. Als Maßeinheit für die Wirksamkeit eines Inhalationsnarkotikums wird die minimale alveoläre Anästhetikumkonzentration (MAC) verwendet, was einer Konzentration im Verteilungsgleichgewicht entspricht, bei der 50% der Patienten keine Abwehrreaktion auf einen definierten Schmerzreiz zeigen (Forth et al., 2005). Je niedriger dieser Wert ist, desto besser die anästhetische Wirkung des Inhalationsnarkotikums. 8 3.1.1 Ether Ether wird bei Labortieren, vor allem Ratten und Mäusen, häufig als Narkotikum eingesetzt. Die Narkose ist gut steuerbar und beeinflusst kaum die Atem- und Herzkreislauffunktion. Außerdem wirkt Ether analgetisch und ist muskelrelaxierend (Henschler und Rummel, 1987). Die Analgesie tritt schnell ein, da Ether eine Depression des ZNS bewirkt (Green, 1979). Allerdings soll Ether eine starke Reizung der Schleimhaut des Respirationstraktes bewirken, ist leicht brennbar und explosiv (Hedrich, 2004). Die Explosionsgefahr besteht schon ab einer Konzentration von 1,8% im Luftgemisch und 2,1% in Sauerstoff. Diese Konzentration ist jedoch auch für eine Anästhesie notwendig (Fish et al., 2008). Aus diesem Grund wird Ether im Laborgebrauch als Narkotikum nur noch selten verwendet. Im Vergleich zu O2-NO2-Halothan erzeugt Ether mehr Exzitationen und eine größere Urinproduktion bei Ratten (van Herck, 2001). Tabata (1998) beschreibt, dass eine Ether Anästhesie bei einigen Mäusestämmen, vor allem B6C3F1- und ICR-Stämmen, einen schnellen Anstieg des Plasma Glukose Levels bewirkt. 3.1.2 CO2 Kohlenstoffdioxid kombiniert mit Sauerstoff kann für kurzzeitige Narkosen bei kleinen Versuchstieren für kleine Eingriffe wie Blutentnahmen, Entnahmen von Gewebsproben oder Injektionen genutzt werden (Abel und Bartling, 1978). Es ist nicht brennbar und erst in hohen Konzentrationen giftig. Dadurch ist es für den Experimentator ungefährlich, kostengünstig und zeigt eine schnelle narkotische Wirkung bei Mäusen (Otto, 2004). Die genaue Wirkung von CO2 ist noch nicht geklärt. Einige Autoren sind der Meinung, dass die Narkose durch eine Hyp- oder Anoxie ausgelöst wird. Andere Autoren befürworten jedoch die Theorie, dass CO2 selbst eine narkotische Wirkung hat (Corbach, 2006). Allerdings wird der Einsatz von CO2 als Narkosegas kontrovers diskutiert. Einige Autoren konnten anhand von Studien mit CO2 Veränderungen im Verhalten und physiologische Antworten bei Tieren beobachten, die auf Schmerzen und Stress der Tiere hinweisen, wie Hyperventilation und Fluchtverhalten. Andere Autoren befürworten jedoch den Einsatz von CO2 9 sowohl als Narkose, als auch zum Euthanasieren (Conlee et al., 2005). In unseren vorherigen Studien fanden wir, dass Inhalationsnarkotika (Ether und CO2) bei der retrobulbären Blutentnahme zu mehr Stress führten, als eine Blutentnahme ohne Narkose (Schlichting et al., 2008). 3.1.3 Sevofluran Sevofluran ist ein halogenierter Ether, der nicht brennbar und explosiv ist. Es liegt als klare Flüssigkeit vor und benötigt zur Narkoseeinleitung einen s p e z i e l l e n Ve r d a m p f e r. A u f g r u n d e i n e s n i e d r i g e n B l u t - G a s Verteilungskoeffizienten von 0,69 und einem MAC von 2,5% (Maus) flutet Sevofluran bei der Narkoseeinleitung rasch an, was eine schnellere Bewusstlosigkeit als bei der Einleitung der Narkose mit Isofluran bewirkt (Forth et al., 2005). Wallin et al. (1975) konnten bei Mäusen während der Narkoseeinleitung mit Sevofluran keine Anzeichen von Schnaufen, übermäßigen Speichelfluss, Krämpfe oder andere unerwünschte Reaktionen erkennen. Außerdem sorgt Sevofluran für ein schnelles Erwachen nach der Narkose, obwohl es eine hohe Lipidlöslichkeit hat, wodurch es bei der Aufwachphase nur langsam pulmonal ausgeschieden wird (Forth et al., 2005; Flecknell, 2009). Ratten zeigten in den ersten 24 h nach der Narkose einen leichten Anstieg von anorganischen Fluorid-Ionen im ausgeschiedenen Urin (Wallin, 1975). Frink (1992) beobachtete bei Patienten nach Sevofluran Narkose eine kürzere Aufwachdauer als nach einer Isofluran Narkose. Die Narkosetiefe kann außerdem gut gesteuert werden. 3.1.4 Isofluran Das Inhalationsanästhetikum Isofluran ist eine farblose, nicht entflammbare und flüchtige Flüssigkeit (Dale und Brown, 1987) und wird zur Anästhesie wie Sevofluran auch mit einem speziell für Isofluran kalibrierten Verdampfer verwendet. Isofluran hat einen unangenehm stechenden Geruch, der stärker als Sevofluran die Atemwege reizt (Doi und Ikeda, 1993). Bei Kindern und Katzen wurde ein Hustenreiz beobachtet und es kam in einigen Fällen zu Bronchosekretion und Atemanhalten (Flecknell, 2009; Drummond et al., 1983). 10 Isofluran hat einen MAC-Wert von 1,41% (Maus) und einen Blut-GasVerteilungskoeffizient von 1,4, wodurch die Narkose sehr schnell eingeleitet wird und die Aufwachphase sehr kurz ist (Forth et al., 2005). Die Narkose ist außerdem sehr gut steuerbar. Der Hauptvorteil bei der Verwendung von Isofluran ist jedoch, dass es im Körper zu fast keiner Biotransformation kommt und es nahezu komplett wieder ausgeatmet wird. Dadurch wird die Leber kaum beeinflusst und es kommt zu keinen Interferenzen bei toxikologischen Studien (Flecknell, 2009). Aus diesem Grund wird Isofluran besonders gern in Studien mit Versuchstieren eingesetzt. 3.2 Richtlinien für die Blutentnahme In der Wissenschaft wird häufig Tieren Blut zu Versuchszwecken entnommen. Während bei großen Tieren die Blutgefäße relativ gut zu erreichen sind und sie auch ein großes Blutvolumen haben, stellt die Blutabnahme bei kleinen Labornagern ein Problem dar und ist mit größeren Belastungen für das Tier verbunden. Aus diesem Grund hat die Gesellschaft für Versuchstierkunde (GVSOLAS, 2009) Richtlinien veröffentlicht, die dem Experimentator Empfehlungen über Blutvolumina, Entnahmefrequenz und Lokalisationen der Blutentnahmen geben. 3.2.1 Blutvolumen der Maus Mäuse haben ein durchschnittliches Gesamtblutvolumen von 74 ml/kg Körpergewicht (KGW), dieses entspricht durchschnittlich 7,4% des KGW. Dabei ist zu beachten, dass das Blutvolumen in Abhängigkeit vom Stamm, Alter, Geschlecht, Ernährungs- und Gesundheitszustand variiert (Oakley und Warrack, 1940, Riches et al., 1973, Vacha, 1975, Sluiter et al., 1984, Diehl et al., 2001, GV-SOLAS, 2009). 3.2.2 Empfohlene Blutentnahmemenge Die Blutmenge, die einem Tier entnommen werden kann, ist stark von der Entnahmefrequenz abhängig. Es muss entschieden werden, ob einmalig, 11 täglich, wöchentlich oder final Blut entnommen wird. Daran muss die Menge angepasst werden. Bei einer einmaligen Blutentnahme zeigt der Verlust von 10% des Blutvolumens keine großen Nebenwirkungen. Bei einer Entnahme von mehr als 15% des Blutvolumens tritt häufiger ein Abfall des Blutdruckes oder eine Reduzierung des Hämoglobingehalts auf, was für das Tier lebensbedrohlich werden kann. Deshalb sollte dem Tier nach einer Blutentnahme eine Erholungsphase eingeräumt werden. Generell können bei einem Tier einmalig 10% des zirkulierenden Blutvolumens mit anschließender 4-wöchiger Erholungsphase entnommen werden. Bei täglicher Blutentnahme sollte das Entnahmevolumen nicht mehr als 1% des Gesamtblutvolumens der Tiere betragen (GV-SOLAS, 2009, Morton et al. 1993). 3.3 Blutentnahmemethoden Die Entscheidung, welche Blutentnahmemethode bei einem Versuch bevorzugt wird, hängt von vielen Faktoren ab. Zum einen ist die Blutqualität wichtig. Wird arterielles, venöses oder Mischblut benötigt? Soll das Blut für weitere Untersuchungen frei von Kontaminationen sein? Außerdem muss überlegt werden, welche Blutentnahmemethode für welche Tierart am besten geeignet ist. Während die Punktion der Ohrvene bei Kaninchen eine sehr gute Methode ist, ist diese bei Mäusen nicht anwendbar. Ein anderer Punkt, der überlegt werden muss, ist die Blutmenge und die Entnahmefrequenz. Es gibt einige Punktionspunkte bei der Maus, wie beispielsweise die Schwanzvene, an denen nur sehr geringe Blutmengen entnommen werden können. Andere Methoden wie die Punktion der Vena cava oder eine Herzpunktion sind zum Entbluten von Mäusen geeignet sind. In Tabelle 1 wurden drei verschiede Empfehlungen für die Blutentnahmen miteinander verglichen. Daraus wird ersichtlich, dass jede Institution andere Blutentnahmemethoden und Entnahmevolumina empfiehlt. Im Rahmen dieser Masterarbeit werden die Blutentnahmemethoden der Empfehlung der GV-SOLAS (2009) näher betrachtet. Es werden die Punktion der Vena facialis, des Venenwinkels, der Vena saphena, der Schwanzvene und 12 die retrobulbäre Blutentnahme untersucht. Diese Methoden werden in den folgenden Abschnitten näher erläutert. 13 14 Coccygeal Vene Venenwinkel Vena facialis Ohrvene Vena saphena Mandibulare Vene Retroorbital Amputation der Schwanzspitze kleinere - größere Blutmengen (100 µl) k.A. k.A. - k.A. k.A. k.A. -/+ - mittlere - größere Blutmengen (200 µl) kleinere - größere Blutmengen (100 µl) kleinere - mittlere Blutmengen (100 µl) k.A. k.A. - Volumen kleinere - mittlere Blutmengen (50 µl) 1-2 Tropfen Guidlines for Survival Bleeding of Mice and Rats (Office of Animal Care and Use) Narkose Laterale Schwanzvene - Blutentnahmemethode - + k.A - nicht empfohlen k.A - - Narkose k.A 50-200 µl 50-200 µl k.A 50-200 µl nicht empfohlen k.A 50-200 µl 50-200 µl Volumen k.A Removal of blood from laboratory mammals and birds (Laboratory Animals) k.A + - nicht empfohlen - k.A + - Narkose - k.A größere Blutmengen (170 µl) größere Blutmengen (170 µl) kleinere Blutmengen (20-40 µl) nicht empfohlen k.A größere Blutmengen (170 µl) Volumen kleinere - größere Blutmengen (170 µl) kleine Blutmengen bis zum Absetzalter (20-40 µl) Empfehlung zur Blutentnahme bei Versuchstieren (GV-SOLAS) Tab. 1 Vergleich der Empfehlungen der Blutentnahmemethoden und empfohlenen Blutvolumina für Mäuse. (k.A. = keine Angaben) 3.3.1 Retrobulbäre Blutentnahme Die retrobulbäre, früher auch retroorbitale Blutentnahme genannt, wurde schon 1913 von Pettit als einfache Methode zur Entnahme geringer Blutvolumina beschrieben. In den 1970er und 1980er Jahren wurde diese Methode in vielen europäischen und nordamerikanischen Instituten gewählt (van Herck, 1999). Es gibt zwei verschiedene Methoden, die retrobulbäre Blutentnahme durchzuführen. Zum einen wird eine Kapillare medial in den Augenwinkel eingeführt, leicht nach unten geneigt und in den retrobulbär Venenplexus geschoben. Durch eine rotierende Bewegung der Kapillare wird der Venenplexus leicht verletzt und Blut fließt in die Kapillare. Bei der anderen Methode verletzt die Kapillare auch den retrobulbären Venenplexus, wird aber im lateralen Augenwinkel eingeführt (van Herck, 1999) (Abb. 5). Laut der Gesellschaft für Versuchstierkunde (GV-SOLAS, 2009) ist diese retrobulbäre Blutentnahme bei Mäusen dazu geeignet, sowohl kleinere, als auch größere Blutvolumina zu entnehmen. Auch kann sie zum Entbluten genutzt werden. Obwohl die Methode häufig genutzt wird, ist diese Technik umstritten. Einerseits soll sie Schmerzen und Distress bei dem Tier verursachen, andererseits gibt es eine Abneigung unter den Experimentatoren am Auge zu manipulieren (van Herck et al., 2000). Jedoch werden bei sachgerechter Durchführung durch einen geübten Experimentator und bei korrektem Fixieren des Tieres die Schäden minimiert. Es wird nur Bindegewebe und peribulbäres Fett bei der Punktion des Venenplexus verletzt (GV-SOLAS, 1999). Bei einem Vergleich der Blutentnahmemethoden aus der Vena saphena, der Schwanzvene und dem retrobulbären Venenplexus bei Ratten konnte gezeigt werden, dass es keine Unterschiede im anschließenden Verhalten, betreffend des Groomings (Putzen), der Bewegung und Inaktivität gab. Jedoch war die Zeit, die für die Blutentnahme gebraucht wurde, sehr unterschiedlich. Die retrobulbäre Blutentnahme war gegenüber der Punktion der Vena saphena 7-mal und im Vergleich zur Punktion der Schwanzvene 15-mal schneller (van Herck et al., 2000). Da sowohl die Zeit, als auch die Fähigkeit des Experimentators entscheidend für die Belastung des Tieres ist, wird diese 15 Methode von der GV-SOLAS als tierschutzgerecht befunden (GV-SOLAS, 2009). 3.3.2 Punktion der Vena saphena Die Punktion der Vena saphena ist eine gute Methode, um bei Mäusen, Ratten, Hamster, Rennmäusen, Meerschweinchen und vielen weiteren Tieren Blut zu nehmen, und wird von der Gesellschaft für Versuchstierkunde (GV-SOLAS, 2009) empfohlen. Rusher und Birch (1975) beschrieben sie als schnelle Methode, um schnell und atraumatisch wiederholt Blut bei Ratten zu entnehmen. Bei der Punktion der Vena saphena wird die Maus in einem Falcon Tube fixiert, so dass das Bein, an dem die Blutentnahme durchgeführt werden soll, herausragt. Dieses Bein wird rasiert und durch einen leichten Druck auf das Fettgewebe zwischen Schwanz und Oberschenkel tritt die Vena saphena deutlich hervor. Sie verläuft, wie in Abbildung 1 dargestellt, auf der caudalen Oberfläche des Oberschenkels und kann so mit einer 25 Gauge-Kanüle punktiert werden. Das Blut wird mit einem EDTA beschichteten Gefäß oder einer Hämatokrit Kapillare aufgefangen werden. Durch die Nutzung eines Falcon Tube ist eine Narkose vermeidbar, wodurch zusätzlicher Stress durch die Narkose vermieden wird (Hem, 1998). Hoff (2000) beschreibt zusätzlich, dass man das Tier mit einer Wärmeplatte erhitzen sollte, damit die Gefäße sich weiten. Bei einem Vergleich dieser Form der Blutentnahme mit der Punktion der Schwanzvene stellte sich heraus, dass die Glukose Konzentration, welcher als Indikator für Stress gilt, bei der Punktion der Vena saphena signifikant langsamer anstieg als bei der Punktion der Schwanzvene (Aasland et al., 2010). Auch bei wiederholter Blutentnahme benötigt es keiner erneuten Punktion. Lediglich der Schorf muss entfernt werden, um eine wiederholte Blutentnahme durchzuführen. So wird Stress durch erneutes Punktieren vermieden (Hem et al., 1998; Aasland et al., 2010). 16 Abb. 1 Darstellung der Vena saphena (nach Cook, 1965) 3.3.3 Punktion der Vena facialis Eine weitere Möglichkeit Blut zu gewinnen, ist die Blutentnahme aus der Vena facialis. An einem Punkt, an dem die orbitale Vene, die submandibulare Vene und andere Venen zusammenfließen und die Jugularis-Vene bilden, können Blutproben gewonnen werden (Abb. 2). Bei dieser Methode wird keine Narkose oder Zwangsröhre benötigt, da die Tiere im Zwangsgriff fixiert werden. Dabei ist auf eine korrekte Stauung der Venen zu achten (GV-SOLAS, 2009). Um die Vena facialis zu punktieren, gibt es verschiedene Methoden, wie zum Beispiel die Punktion mit dem Skalpell. Hierbei besteht jedoch die Gefahr, dass es zu einem zu tiefen Einschnitt in das Gewebe kommt und andere Gefäße oder Arterien verletzt werden. Darüber hinaus handelt es sich juristisch um einen operativen Eingriff, der nur von einem bestimmten Personenkreis durchgeführt werden darf (Maisack et al., 2007). Weiter besteht auch die Gefahr, durch die Wange der Maus zu stechen, so dass Blut in die Mundhöhle läuft. Hierbei kann das Blut in die Atemwege des Tieres gelangen, woran es ersticken könnte. Bei einer Punktion mit einer 19-, 21-, oder 23 Gauge-Kanüle anstelle des Skalpells treten die gleichen Probleme auf. Bei beiden Methoden muss der 17 Experimentator sehr geübt sein, um solche Verletzungen des Tieres zu vermeiden. Außerdem kann dadurch, dass unterschiedlich tief in das Gewebe gestochen wird, die Menge des Blutes stark variieren. Aus diesen Gründen hat die Firma Mediapoint eine Lanzette entwickelt, die je nach Alter der Maus, von der Blut entnommen werden soll, eine variable Spitzengröße hat. So wird bei einem Alter der Mäuse von 2-6 Wochen eine Lanzette von 4,0 mm und ab einem Alter von 8 Wochen eine Lanzette mit 5,0 mm empfohlen. Durch die vorgegebene Länge soll durch einen geübten Experimentator die Tiefe des Einstiches in die Vene besser kontrolliert werden können, so dass Gewebeschäden vermieden werden. Außerdem soll mehrfach eine konstante Menge Blut von 0,2-0,5 ml entnommen werden können und die Maus soll weniger Schmerzen haben (Golde, 2005). Diese Lanzette wird auch von der Gesellschaft für Versuchstierkunde (GV-SOLAS, 2009) als geeignet empfunden. Eine frühere Untersuchung zeigte jedoch, dass diese Methode mit der „animal bleeding“-Lanzette im Vergleich zur retrobulbären Blutentnahme zu einem signifikant höheren Corticosteron Spiegel führte. Auch liefen die Tiere im Open Field signifikant weniger und mit einer langsameren Geschwindigkeit, was ein Anzeichen für Distress sein könnte (Schlichting et al., 2008). Jedoch zeigte eine andere Studie von Madetoja (2009), dass die Punktion der Vena facialis zu einem geringeren Corticosteron Anstieg führte als die Punktion der Schwanzvene und der Vena saphena. Wie die Punktion der Vena facialis hier durchgeführt wurde, wurde jedoch nicht erwähnt. Abb. 2 Darstellung der Vena facialis (nach Cook, 1965) 18 3.3.4 Punktion der Schwanzvene Bei Mäusen und Ratten lassen sich kleine bis große Blutvolumina durch die Punktion der kollateralen Schwanzvenen mit einer Kanüle entnehmen (GVSOLAS, 2009). Der Schwanz einer Ratte besitzt eine dorsale- und zwei laterale Venen und eine ventrale Arterie aus denen man Blut gewinnen kann (Brown, 2006) (Abb. 3). Vor allem das terminale Drittel des Schwanzes wird häufig für die Blutentnahme genutzt. In diesem Segment sind die Arterien und Venen am besten ausgeprägt und die Strukturen des muskulären Skelettsystems reduzieren sich Richtung der Spitze des Schwanzes (Staszyk et al., 2003). Dorsale Vene Haut Laterale Vene Sehnen Ventrale Arterie Abb. 3 Anordnung der Schwanzvenen Um diese Blutentnahme durchzuführen, muss das Tier fixiert werden. Das kann entweder durch einen Zwangsgriff oder eine Zwangsröhre geschehen (GVSOLAS, 2009; Nobunaga et al., 1966). Da die Gefäße vor allen bei Mäusen besonders klein sind, wird empfohlen die Tiere mittels Rotlicht, Wasserbad oder Wärmeplatte zu erwärmen, um eine Vasodilation der Gefäße zu erreichen (Brown, 2006; Conybeare et al., 1988). Dies kann jedoch Stress für das Tier bedeuten, zu Dehydrierung führen, den Stoffwechsel steigern und ist zeitaufwändig (Aasland et al., 2010). Um die Blutentnahme durchzuführen, wird eine der oben genannten Venen leicht gestaut und mit einer Kanüle oder Skalpell punktiert. Um eine wiederholte Blutentnahme durchzuführen, sollte möglichst am distalen Ende des Schwanzes mit der Punktion begonnen werden (Brown, 2006). Jedoch konnten Aasland et al. (2010) zeigen, dass bei dieser Methode im Vergleich zur Punktion der Vena saphena die Glukose Konzentration im Blut signifikant höher 19 war, was ein Anzeichen für mehr Stress durch die Blutentnahme bedeutet. Er begründet diesen Anstieg an Glukose im Blut dadurch, dass es für die Maus Stress bedeutet, wenn am Schwanz, welcher als Gleichgewichts Organ dient und auch für die Thermoregulation verantwortlich ist, manipuliert wird. Auch Müller (1999) konnte verglichen mit der retrobulbären Punktion und der Punktion des Venenwinkels eine signifikant erhöhte Corticosteron Konzentration nach der Schwanzvenen Punktion nachweisen. Dieser Anstieg wurde durch Aufenthalt des nicht narkotisierten Tieres in ein Wärmekabinett, der Fixation und den Punktionsschmerz erklärt. 3.3.5 Punktion des Venenwinkels Unter dem Venenwinkel versteht man den Zusammenfluss der Vena jugularis interna mit der Vena jugularis externa oder, falls nur eine dieser Venen ausgebildet ist, ihr Zusammentreffen mit der Vena subclavia ihrer Körperseite. Dieser befindet sich unterhalb des Schlüsselbeins (Nickel et al., 1996) (Abb. 4). Bei dieser Methode wird der Venenwinkel des sich auf den rückenliegenden Tieres mit einer Kanüle punktiert. Dies kann entweder unter Sichtkontrolle durch einen kleinen Hautschnitt über der Jugular Vene erfolgen oder blind, indem eine Kanüle direkt unter dem Schlüsselbein in dem vom Hals und Schulter gebildeten Winkel geschoben wird, welche die Vene punktiert (Phillips et al., 1973; Archer und Riley, 1981). Auf diese Weise lassen sich bei Mäusen, Ratten oder Meerschweinchen sicher und schnell große Blutvolumina entnehmen bzw. Substanzen intravenös applizieren (GV-SOLAS, 2009; Phillips et al., 1973). Phillips et al. (1973) beschrieben, dass eine geübte Person mit dieser Methode in einer Stunde bei 40 Ratten Blut nehmen kann. Sie beschrieben weiter, dass diese Methode mit einem speziell konstruiertem Zwangsbrett, in dem das Tier an allen vier Gliedmaßen mit Fußklammern, die mit Latex versehen sind, eingespannt werden kann, ohne Narkose durchzuführen ist. Jedoch kann dies zu Distress führen, weshalb sie eine leichte Ether Narkose empfehlen. Heute sollte diese Methode jedoch laut Empfehlung der GV-SOLAS (2009) nur noch unter Narkose durchgeführt werden. 20 Abb. 4 Darstellung des Venenwinkels (nach Cook, 1965) 3.4 Stress Stress wird definiert als nichtspezifische Reaktion des Körpers auf äußere Stimuli (Selye, 1976). Tiere befinden sich in einem dynamischen Gleichgewicht, einer so genannten Homöostase. Stressoren physiologischer und psychologischer Art bringen diese Homöostase aus dem Gleichgewicht, wodurch das Tier in den Zustand des Stresses gerät und sein Verhalten ändert. Auch physiologische Funktionen, wie die des Gastrointestinaltraktes oder die Immun- bzw. Hormonantwort verändern sich. Wie stark eine Stressantwort ist, hängt von der Intensität, Dauer und Frequenz des Stressors ab (Kannan, 2005). Stress führt weiterhin unumgänglich zu einer Freisetzung von ACTH (Adenocorticotropes Hormon) und von Nebennierenhormonen, wie Katecholaminen und Glukocorticoiden (Danzer, 1984). Der ACTH Ausschüttung folgt wiederum zeitverzögert eine Ausschüttung von Corticosteron (Cook et al., 1976; Kugler et al., 1988). 3.4.1 Stressnachweis im Blut anhand von Glucocorticoiden Bei Stress verändern sich im Blut zum Beispiel die Plasma Glukose Konzentration, die Adrenalin- oder Corticosteron Konzentrationen. Da in diesem Versuch die Corticosteronwerte nach Stresseinfluss untersucht wurden, wird hierauf näher eingegangen. Corticosteron wird in der Nebennierenrinde gebildet. Die Synthese erfolgt in zwei zellulären Kompartimenten, den Mitochondrien und dem Endoplasmatischen Retikulum (ER) aus Cholesterin. Im ersten Schritt der 21 Biosynthese wird aus Cholesterin Pregnenolon synthetisiert. Dieses wird anschließend in das agranuläre ER transportiert. Dort werden zum einen die Steroidhormone Testosteron und Östradiol gebildet und 11-Desoxycorticosteron aus Pregnenolon synthetisiert. Letzteres wird in die Mitochondrien transportiert, wo schließlich Corticosteron entsteht (Penzlin, 2004). Corticosteron stellt das letzte Glied der Hypothalamus-HypophysenNebennierenachse dar und unterliegt einer negativen Rückkopplungen der ACTH und CRH-Ausschüttung (Corticotropin-releasing Hormon) (Forth et al., 2005). Nach Einwirken eines Stressors steigt der Corticosteronspiegel in Abhängigkeit von der Stärke des Stressors an. Van Herck et al. (1991) beschrieben, dass die Corticosteron Konzentration nach einer Sham Anästhesie nach 3 min und nach einer Ether Anästhesie nach 15 min am höchsten war. Die Corticosteron Konzentration variiert stark zwischen den Mäusestämmen und unterliegt einem circadianen Rhythmus. So ist die Konzentration zwischen 4:00 und 12:00 Uhr mit einer Konzentration von weniger als 50 ng/ml am geringsten, während sie ihren Höhepunkt gegen 18:00 Uhr mit 200-300 ng/ml hat (Jilge und Kunz, 2004). Außerdem verändert sie sich bei Mäuseböcken je nach Dominanzstatus. Schuhr (1987) beschreibt, dass die Corticosteron Konzentration dominanter Männchen signifikant geringer ist, als die Konzentration bei subdominanten Männchen. 3.4.2 Stressnachweis anhand des Verhaltens im Open Field Ein Open Field ist ein abgegrenztes Feld definierter Größe, in das Tiere gesetzt werden, um ihr Verhalten zu beobachten. Einige Verhaltensparameter sind zum Beispiel Putzen (grooming), flach auf den Boden legen (stretching) oder Aufrichten (rearing). Außerdem kann man unterscheiden, ob ein Tier eher aktiv bzw. inaktiv ist, und ob es sich in der Mitte bzw. am Rand des Open Fields aufhält. Mit Hilfe dieser Verhaltensparameter kann man darauf schließen, ob ein Tier eher Erkundungs- oder Meideverhalten zeigt. Stress verändert das Verhalten, welches im Open Field beobachtet werden kann. In einem Open Field äußert sich Meideverhalten von Labortieren dadurch, dass wenn eine Maus in ein solches Feld gesetzt wird, sie ein 22 Verhalten, wie flaches Ausstrecken auf dem Boden (stretching) oder Kopfbewegungen, um die neue Umgebung zu erkunden, zeigt (Quartermain et al., 1996). Außerdem konnte Quartermain (1996) zeigen, dass länger andauernder Stress (1h), der durch 30 Fußschocks im 2 min Intervall, 1 h Bewegungseinschränkung, oder durch das Zusammensetzen mit einer aggressiven Maus provoziert wurde, das Erkundungs- und Bewegungsverhalten der Mäuse im anschließenden Open Field Versuch, welcher 30 min nach dem ausgesetzten Stress durchgeführt wurde, signifikant gegenüber ungestressten Tieren veränderte. Die gestressten Mäuse waren weniger aktiv als nicht gestresste. Katz et al. (1981) konnten zeigen, dass chronischer Stress zu einer Abnahme der Anfangsakitivität von Ratten im Open Field führte, akuter nicht traumatischen Stress, der durch Geräusche oder Licht ausgelöst wurde, die Anfangsaktivität jedoch erhöhte. Andererseits zeigten Mercier et al. (2003), dass Ratten, die 48 Stunden zuvor durch Fußschocks oder Schwimmen akut gestresst worden waren, im Open Field keine Veränderung des Verhaltens aufwiesen. Wie in der Literatur beschrieben, ist das Verhalten der Tiere in einer neuen Umgebung schwer zu interpretieren. Einige Autoren beschreiben, dass Tiere Erkundungsverhalten zeigen und aktiv sind, weil sie sich fürchten. Ein anderer Standpunkt ist, dass Tiere die Angst haben oder gestresst sind, nur wenig Erkundungsverhalten zeigen (Candland und Nagy, 1969; Roth und Katz, 1979). Aus diesem Grund erfolgte bei diesem Versuch zusätzlich zu den Verhaltensuntersuchungen eine Corticosteron Bestimmung. 23 4. Material und Methoden 4.1 Versuchstiere Für den Versuch wurden insgesamt 132 spezifiziert pathogen freie (FELASA, 2006) weibliche Mäuse des Inzuchtstammes BALB/cOlaHsd der Firma Harlan Winkelmann, Borchen, getestet. 60 Tiere wurden für einen Narkoseversuch und 72 Tiere für einen Blutentnahmeversuch eingesetzt. Alle Tiere wurden mit einem Alter von 6 Wochen geliefert und hatten ein Ankunftsgewicht von 16,20±1,58 g. Nach der Ankunft wurden die Tiere durch eine Ohrlochung markiert und randomisiert in Makrolon® Typ III Käfige (375 mm x 215 mm x 150 mm) á 5 Tiere gesetzt. 4.1.1 Haltung Alle Versuchstiere wurden in einem Scantainer® der Firma Scanbur AS Denmark gehalten, in welchen die Luft pro Stunde ca. 10- bis 16-mal ausgetauscht und durch einen Hepa Filter gereinigt wurde. Der Tierraum war klimatisiert, so dass eine konstante Temperatur von 22±2°C gegeben waren. Die Luftfeuchtigkeit im Tierraum betrug 50±10%. Die Beleuchtung des Raums erfolgte nach einem Tag/Nachtrhythmus von 6-18 Uhr. Im Scantainer wurde eine Lichtstärke von 35-70 Lux je nach Käfigetage gemessen. Die FaserNadelholz Einstreu Grad 5 der Firma Altromin GmbH und Co in den Käfigen wurde einmal wöchentlich ausgetauscht. Um die Umgebung anzureichern, wurde den Mäusen Nestbaumaterial (Nestlets, EBECO) zur Verfügung gestellt. Zusätzlich stand den Tieren pelletiertes Alleinfutter (Nr. 1324 der Firma Altromin) (Tab. 2) und Leitungswasser in kleinen Trinkflaschen (300 ml Fassungsvermögen) mit Nippeltränken ad libitum zur Verfügung. Die Adaptationszeit der Mäuse betrug 14 Tage. Während dieses Zeitraums wurden die Mäuse täglich zwischen 9-12 Uhr „gehändelt“. Dazu wurden sie jeweils für 60 Sekunden einzeln auf den Unterarm gesetzt. 24 Tab. 2: Inhaltsstoffe des RaSen/Mäuse FuSer (Altromin 1324). Inhaltsstoffe Zusatzstoffe/kg Rohprotein 19,0% Vitamin A als Vitamin A-Acetat 15000 IE Rohfett 4,0% Vitamin D3 als Cholecalciferol Rohfaser 6,0% Vitamin E als Alpha Tocopherol 75 mg Rohasche 7,0% Kupfer als Kupfersulfat Calcium 0,9% Phosphor 0,7% 600 IE 13 mg 4.2 Versuchsgruppen 4.2.1 Narkoseversuch Für den Narkoseversuch wurden die Tiere randomisiert auf 6 Gruppen á 10 Tiere verteilt. Es wurde darauf geachtet, dass pro Käfig und Tag nur ein Tier getestet wurde, um einen Anstieg des Corticosterons durch das wiederholte Öffnen des Käfigs zu verhindern. Pro Tag wurde eine Narkose durchgeführt. Als Narkose wurde Isofluran, Sevofluran, CO2 und Ether eingesetzt. Zusätzlich erfolgte eine Sham Narkose und eine Kontrollgruppe. Zu Versuchsbeginn waren die Mäuse 8 Wochen alt und hatten ein Gewicht von 18,62±1,70 g. 4.2.2 Blutentnahmeversuch Zur Untersuchung der verschiedenen Blutentnahmemethoden wurden die Tiere ebenfalls auf 6 Gruppen randomisiert verteilt. Jedoch erhöhte sich die Tierzahl pro Gruppe auf 12, da eine Histologie der Blutentnahmestellen für einen weiteren Versuch durchgeführt werden sollte. Auch bei diesem Versuch wurde aus dem oben genannten Grund pro Käfig und Tag nur ein Tier getestet. Durch die Erhöhung der Tierzahl wurden die Tiere auf 2 Scantainer in 2 Tierräumen verteilt. So wurden zusätzlich pro Tierraum 6 Tiere an einem Tag getestet. Für die Blutentnahme wurden Spezialisten eingeladen, die in ihrem Labor die Entnahme routinemäßig durchführen. Aus diesem Grund wurde pro Tag eine Blutentnahme durchgeführt. In der Tabelle 3 werden die durchführenden Personen und Blutentnahmemethoden aufgeführt. Für zwei Methoden, 25 retrobulbär mit dünner Kapillare und die Blutentnahme aus dem Venenwinkel, war es notwendig eine Ether Narkose durchzuführen. Die restlichen Methoden, retrobulbär mit dicker Kapillare, Punktion der Schwanzvene, Vena saphena und Vena facialis erfolgten ohne Narkose. Zu Versuchsbeginn waren die Mäuse 8 Wochen alt und hatten ein Gewicht von 19,26±1,21 g. Tab. 3 Blutentnahmemethoden und durchführende Personen. Blutentnahmemethode Narkose Durchführende/er Ort retrobulbär (dicke Kapillare) - Herr Prof. Hackbarth Hannover retrobulbär (dünne Kapillare) Ether Frau Wühl Mannheim Schwanzvene - Frau Wühl Mannheim Vena saphena - Frau Muench-Wuttke Dresden Vena facialis - Frau Kuschel Hamburg Frau Deutschmann Venenwinkel Ether Herr Dr. Strauch Freiburg 4.3 Versuchsablauf 4.3.1 Basalwertbestimmung von Corticosteron Bei allen Tieren wurde nach einer Adaptationszeit von 5 Tagen in einem Zeitraum zwischen 9-12 Uhr über 6 Tage 2 x 75 µl Blut entnommen, um einen basalen Corticosteron Wert zu bestimmen. Die Blutentnahme erfolgte retrobulbär am linken Auge mit einer 75 µl Na-heparinisierten Hämatokrit Kapillare (Hirschmann). Um bei dieser Blutentnahme möglichst konstante Werte zu bekommen, wurde pro Tag Blut von 2 Käfigen á 5 Mäusen entnommen. Um 5 Tieren eines Käfigs Blut zu entnehmen, wurden durchschnittlich 5 min benötigt. 26 4.3.2 Narkoseversuch Der Versuch wurde an 6 aufeinanderfolgenden Tagen in einem Zeitraum zwischen 09-12 Uhr durchgeführt. Wie oben erwähnt wurden 10 Tiere pro Tag getestet, wobei darauf geachtet wurde, dass pro Käfig nur ein Tier getestet wurde, um zusätzlichen Stress zu vermeiden. Es wurde ein Tier aus dem jeweiligen Käfig geholt und in einen Transportkäfig (Typ II, 265 mm x 190 mm x 180 mm) mit Einstreu gesetzt. Darin wurde es zum wenige Meter entfernten Versuchsraum gebracht. Sofort nach dem Eintreffen wurde das Tier in eine Narkosebox aus Plexiglas (150 mm x 130 mm x 280 mm) gesetzt und die entsprechende Narkose eingeleitet, welche als Stressor diente. Das Tier wurde aus der Narkosebox entnommen, wenn die Atmung deutlich schwächer wurde. Kontrolltiere und Tiere, die eine Sham Narkose erhielten, verblieben 78 s (Mittelwerte der Narkoseeinleitungszeiten) in der Narkosebox. Anschließend wurden die Tiere für 15 min in die Transportbox gesetzt, wobei die ersten 5 min nach der Narkose mit einer Videokamera aufgenommen wurden, um eine Verhaltensanalyse durchzuführen. Nach 15 min, in denen die Corticosteron Konzentration ansteigen sollte, erfolgte schließlich eine retrobulbäre Blutentnahme aus dem linken Auge, bei der 2 x 75 µl Blut mit einer Na-heparinisierten Hämatokrit Kapillare entnommen wurde. Diese diente zur Corticosteron Bestimmung. Anschließend kam die Maus nochmals für 5 min in ein Open Field, bevor sie in ihren Heimatkäfig zurückgebracht wurde. 4.3.3 Blutentnahmeversuch Der Versuch wurde an 6 aufeinanderfolgenden Tagen in einem Zeitraum von 9-12 Uhr durchgeführt. Pro Tag wurden 12 Tiere getestet. Da die Tiere auf 2 Tierräume verteilt waren, wurde pro Tierraum 6 Mäuse getestet. Auch bei diesem Versuch wurden pro Käfig und Tag nur ein Tier für den Versuch eingesetzt. Der Versuchsablauf verlief genauso wie der Ablauf des Narkoseversuchs. Das Tier wurde aus dem Käfig genommen und in einem Transportkäfig zum Versuchsraum gebracht. Dort wurde entweder sofort die Blutentnahme durchgeführt oder das Tier, wenn die Blutentnahme es vorsah, in 27 die Narkosebox gesetzt und eine Ether Narkose eingeleitet. Hier diente die Blutentnahme als Stressor. Anschließend blieben die Tiere, wie auch beim Narkoseversuch für 15 min im Transportkäfig, um einen Anstieg der Corticosteron Konzentration abzuwarten. Während dieser Zeit wurden die Tiere die ersten 10 min für eine spätere Verhaltensanalyse gefilmt. Nach Ablauf der Zeit wurden auch diesen Tieren 2 x 75 µl Blut retrobulbär aus dem linken Auge entnommen und sie kamen für 5 min ins Open Field, bevor sie in den Heimatkäfig zurück gesetzt wurden. 4.4 Narkose Bei allen Tieren wurden die unterschiedlichen Inhalationsnarkosen in der gleichen Narkosebox mit den Maßen 150 mm x 130 mm x 280 mm durchgeführt. Auch die Kontrolltiere und Tiere, die eine Sham Narkose erhielten wurden in diese Box gesetzt. In die Narkosebox wurde Zellstoff gelegt, dass nach jedem Tier gewechselt wurde. An dem Deckel, der mit einer Moosgummidichtung abgedichtet wurde, befand sich ein Anschluss für die Zuluft, über die das Narkosegas eingeleitet, und eine Abluft, über die das Narkosegas abgeleitet wurde. So wurde Sauerstoff über einen Flussmeter zum Verdampfer mit dem entsprechenden Narkosegas geleitet und gelangte weiter über eine Schlauchverbindung in die Narkosebox. Bei allen Narkotika wurden die Mäuse aus der Box genommen, wenn die Atmung deutlich schwächer wurde. 4.4.1 Sevofluran Die Einleitung der Narkose erfolgte über einen Sevofluran Verdampfer (Sevorane® ABBOTT Vapor 19.3). 8% Sevofluran (Sevorane® Abbott) wurde über ein Flussmeter mit 5 l/min reinen Sauerstoff eingeleitet. 28 4.4.2 Isofluran Bei dieser Inhalationsnarkose wurde eine Isofluran Verdampfer (Isoflurane®, Dräger, Vapor 19.3) verwendet. Hierbei wurden 4% Isofluran (Isofluran CP®, Cp-pharma®) mit einem Sauerstoffeinstrom von 5 l/min in die Narkosebox eingeleitet. 4.4.3 Ether Bei der Einleitung der Ether Narkose wurde eine Gas-Wasch-Flasche verwendet, die zwei Öffnungen besaß. An einer Öffnung wurde Sauerstoff angeschlossen, die andere Öffnung führte über einen Schlauch in die Narkosebox. So konnte der Ether (Diethylether pro narcosis), der in die GasWasch-Flasche auf Watte gegeben wurde, mit einer Flussrate von 5 l/min eingeleitet werden. Pro Tier wurden 8 ml Ether auf die Watte geträufelt. 4.4.4 CO2 Für die CO2 Narkose wurde ein spezieller Prellplattendeckel nach Corbach (2006) verwendet, der eine gutes Durchmischen von CO2 und Luft ermöglicht. Hierbei wurde CO2 direkt entsprechend der Käfiggröße mit 4,6 l/min eingeleitet. 4.4.5 Sham Bei der Sham Narkose wurden die Tiere ebenfalls wie die Tiere, bei denen eine Narkose erfolgte, in die Narkosebox gesetzt. Bei ihnen strömte ausschließlich Sauerstoff mit 5 l/min ein. Sie blieben in der Narkose Box für 78 s, was dem Mittelwert der Dauer für die Sevo- und Isofluran Narkose entspricht. 4.4.6 Kontrollen Die Kontrolltiere wurden auch in die Narkosebox gesetzt, jedoch ohne weiteren Lufteinstrom. Auch sie blieben wie die Mäuse, die eine Sham Narkose bekamen, für 78 s in der Box. 29 4.5 Blutentnahmemethoden Alle Blutentnahmen dienten als Stressor. Jede Blutentnahme wurde durch eine Person durchgeführt, die diese Methode routinemäßig anwendet. Um eine möglichst gleiche Ausgangssituation zu erreichen, war es Ziel, 75 µl Blut von jedem Tier zu nehmen. 4.5.1 retrobulbäre Blutentnahme Die retrobulbäre Blutentnahme mit der dicken Kapillare wurden ohne Narkose durchgeführt. Bei der Durchführung der Blutentnahme mit der dünnen Kapillare wurden die Tiere in Ether Narkose gelegt. Die Tiere wurden mit dem Zwangsgriff fixiert, was dazu führte, dass sich die Vena jugularis staute. Anschließend wurde entsprechend der Methode eine 75 µl Hämatokrit Kapillare (Hirschmann) (Außendurchmesser 1,5-1,6 mm) oder eine 20 µl Mikrokapillare (Blaubrand® intraEND) (Außendurchmesser 1,2 mm) in den medialen Augenwinkel des rechten Auges eingeführt und entlang des Augapfels mit einer rotierenden Bewegung vorsichtig vorgeschoben (Abb. 5). Durch die rotierende Bewegung verletzte die Kapillare einige Venengefäße, wodurch Blut aufgrund der Kapillarkräfte hineinströmte. Bei der dicken Hämatokrit Kapillare, die 75 µl fasste, wurde diese mit Blut gefüllt und anschließend aus dem Auge entfernt. Bei der retrobulbären Blutentnahme mit der dünnen Hämatokrit Kapillare blieb die Kapillare im Auge und das Blut tropfte in ein EDTA beschichtetes Gefäß. Anschließend wurde bei beiden Methoden der Blutstau gelöst, die Kapillare entfernt und die Blutung mit einem Tupfer gestoppt. Beide Blutentnahmen erfolgten am rechten Auge, an dem zuvor keine Blutentnahme durchgeführt wurde, um das Ergebnis einer anschließenden Histologie nicht zu verfälschen. Die Auswertung der Histologie ist jedoch nicht Gegenstand dieser Masterarbeit. 30 Abb. 5 SchemaWsche Darstellung der retrobulbären Blutentnahme. Die Kapillare (5) gleitet entlang des Bulbus (4) und gelangt zu dem Venengeflecht (7). (Weiss et al., 2003) 4.5.2 Blutentnahme aus der Schwanzvene Für die Blutentnahme aus der Schwanzvene wurden die Mäuse in ihren Transportkäfig für 10 min unter eine Rotlichtlampe (250 Watt, 230-250 Volt) mit einem Abstand von 20 cm zum Käfig gestellt, damit die Gefäße an der Schwanzvene sich weiteten. Nach Ablauf der Zeit kamen die Mäuse für die Blutentnahme in eine Zwangsröhre (Model 84). Gestochen wurde mit einer 23G Kanüle (BD Microlance) in der Mitte des Schwanzes in die erste laterale Schwanzvene (Abb. 6a). Dazu wurde die Kanüle flach für ca 7 mm in die Vene geführt. Die Kanüle wurde nach einem Anstechen der Vene entfernt und das Blut mit einer Hämatokrit Kapillare aufgefangen (Abb. 6b). Um diese vollständig zu füllen, wurde die Vene oberhalb der Einstichstelle leicht nachgestrichen. Nach erfolgter Blutentnahme wurde die Blutung mit einem Tupfer gestillt. a b Abb. 6 Blutentnahme aus der Schwanzvene. a) EinsWchstelle in der MiSe des Schwanzes in die 1. Laterale Schwanzvene. b) Auffangen des Blutes mit einer Hämatokrit Kapillare 31 4.5.3 Blutentnahme aus der Vena saphena Bei dieser Methode wurde die Maus in ein 50 ml Falcon Tube (BD Bioscience) gesetzt, so dass das linke Bein herausragt. Dieses Bein wurde oberhalb des Kniegelenks fixiert und mit einem elektrischen Rasierer (Braun) leicht rasiert, so dass die Vena saphena gut sichtbar wurde. Durch die Fixierung wurde leichter Druck auf das umliegende Fettgewebe ausgeübt, der die Vena saphena anstaute und die dann deutlich hervortrat. Anschließend wurde die Vena saphena mit einer 27G Kanüle (BD Microlance) angestochen (Abb. 7). Der sich bildende Bluttropfen wurde mit einer 75 µl Hämatokrit Kapillare aufgefangen. Anschließend wurde der Stau gelöst und das Tier in den Transportkäfig gesetzt. Abb. 7 EinsWchstelle in der Vena saphena 4.5.4 Blutentnahme aus der Vena facialis Die Blutentnahme erfolgte aus der Vena facialis der rechten Kopfseite. Das Tiere wurde mit dem Zwangsgriff fixiert, was zu einem Anstau der Vena facialis führte. Dann wurde mit einer Lanzette der Firma Roche Accu-Check (Abb. 8b) an der Hinterseite des Kiefers der Maus, etwas hinter dem „Punkt“ Richtung Ohr und Auge in einem Winkel von 90 Grad zur Oberfläche eingestochen (Abb. 8a). Eine zweite Person fing das Blut mit einer 75 μl Hämatokrit Kapillare auf. Anschließend wurde die Stauung gelöst und die Blutung mit einem Tupfer gestoppt. 32 a b 4 mm Abb. 8 a EinsWchstelle zur PunkWon der Vena facialis, b LanzeSe 4.5.5 Blutentnahme aus dem Venenwinkel Für dieses Blutentnahmemethode wurde die Maus mit Ether narkotisiert. Anschließend wurde sie auf den Rücken gelegt und die Beine caudal gestreckt. In dieser Position befindet sich der Venenwinkel, die Zusammenführung der Vena jugularis interna und Vena jugularis externa und Vena subclavia, unterhalb des Schlüsselbeins. Nun wurde mit einer 1 ml Spritze, der eine heparingespülte 27G Kanüle (B.Braun) aufgesetzt war im cranialen Halsbereich unter dem Schlüsselbein in Richtung gegenüberliegendes Knie gestochen und aspiriert, bis Blut in die Spritze lief (Abb. 9). Während dieser Prozedur wurde zur Narkoseerhaltung 0,5 ml Ether in einer 2 ml Spritze auf Watte gegeben und bei Bedarf der Maus vor der Nase gehalten. Abb. 9 PosiWon der Kanüle zur Blutentnahme aus dem Venenwinkel 33 4.6 Videoaufnahme Alle Mäuse wurden direkt nach der Narkose bzw. ersten Blutentnahme in ihren Transportkäfigen videoüberwacht. Zunächst wurde eine Zeit von 5 min veranschlagt. Jedoch stellte sich bei den Tieren im Narkoseversuch heraus, dass sich diese nach 5 min noch nicht normal verhielten. Aus diesem Grund wurden alle Tiere, denen Blut entnommen wurde, für 10 min beobachtet. Die Aufnahme erfolgte mit einer Camera von Canon (G10Hi) und wurde auf Hi8 Kassetten aufgenommen. Später wurde das Verhalten subjektiv analysiert. Die Parameter, die zeitlich erfasst wurden, sind in Tabelle 4 aufgelistet. Das Verhalten wurde vom inaktiven Tier bis zum Normalverhalten beobachtet. Tab. 4 Beobachtetes Verhalten während der Videoauswertung Verhalten dauerhaftes Liegen seltene Bewegung, nicht aktiv bewegen, aber langsam neugierig; zeigt Interesse an ihre Umwelt unkontrolliertes Taumeln Erkundungsverhalten, aber taumelig Aktiv; zeigt starkes Erkundungsverhalten Inaktiv Normalverhalten 4.7 Open Field Direkt nach der zweiten Blutentnahme wurden die Mäuse für 5 min in das Open Field gesetzt. Die Grundfläche des Open Fields betrug 60 cm x 60 cm. Das Verhalten wurde mit einer Kamera der Firma Ikegani (Linse: F1. 8/4-10 mm) gefilmt und mit einem Videorecorder (Panasonic TL 550) aufgezeichnet. Abschließend wurde das Verhalten mit EthoVision Version 3.1 ausgewertet. In dem Programm wurden manuell eine Randzone und Mittelzone (Abb. 10) eingeteilt, um unterscheiden zu können, wo sich die Tiere aufgehalten haben. Außerdem wurden die Zeit der Bewegung bzw. Inaktivität und die zurückgelegte Gesamtstrecke der Mäuse innerhalb des Open Field erfasst. Alle Tiere wurden in die Mitte der Open Fields gesetzt. 34 !"#$%&#'( )*+',%&#'( -.(/0( Abb. 10 Au`eilung des Open Fields 4.8 Aufbereitung des Blutes Für die Bestimmung der Corticosteron Konzentration im Blut wurden die zwei 75 µl Kapillaren der zweiten Blutentnahme, die 15 min nach der Narkose oder ersten Blutentnahme erfolgte, verwendet. Die mit Blut gefüllten Kapillaren wurden mit 12000 RPM für 4 min zentrifugiert (Zentrifuge: Biofuge® haemo, Heraeus®). Dadurch konnte zum einen der Hämatokrit-Wert bestimmt werden, zum anderen konnte Plasma gewonnen werden. Dieses wurde in 0,5 ml Eppendorf Gefäße (Landgraf Laborgeräte) umgefüllt und bei -18 ⁰C eingefroren. Bei dem Blutentnahmeversuch wurden als Stressor die oben genannten Blutentnahmen verwendet und nach 15 min jeweils 75 µl Blut in Hämatokrit Kapillaren aufgefangen. Um die Qualität der Blutentnahme zu bewerten wurden Luftblasen gezählt und das Blut wurde anschließend zentrifugiert. 4.9 Bestimmung von Corticosteron mittels ELISA Aus dem Plasma der zweiten Blutentnahme wurde schließlich die Corticosteron Konzentration mit Hilfe eines kompetitiven Corticosteron-ELISA´s der Firma IBL bestimmt. Dazu wurden die Proben zusammen mit Standards unterschiedlicher Corticosteronkonzentrationen (0, 5, 15, 30, 60, 120 und 240 35 nmol/L ) auf einer 96 Well Platte aufgetragen. Anschließend wurde auf jede Vertiefung Enzym Konjugat, das Meerrettichperoxidase enthielt, gegeben und für eine Stunde inkubiert. Dadurch konnte das Corticosteron an den in dem Well enthaltenen Antikörper binden. Danach ist nach mehreren Waschschritten die Substratlösung auf die Wells gegeben worden, die für eine Farbreaktion des Corticosterons sorgt. Nach weiteren 15 min Inkubationszeit wurde diese Reaktion mit einer Stopplösung beendet. Anschließend folgte das Auslesen des ELISAs mit einem Mikrotiterplatten-Lesegerät bei 450 nm. Da die Corticosteron Konzentration des Blutes über den Messbereich hinausreichte, wählte man eine entsprechende Verdünnung (1:5 bzw. 1:15). 4.10 Statistische Analysen Die Auswertung der Daten erfolgte mit Hilfe des Programms StatView Version 5.0 (SAS Institut, Inc., Cary, NC, USA, 1998). Sie sind auf Normalverteilung überprüft und mit einem ANOVA-Test und anschließendem Scheffé-Test mit einem Signifikanzlevel von 5% analysiert worden. Nicht normal verteilte Werte wurden mit dem Kruskal-Wallis Test und dem Mann-Whitney U Test statistisch erfasst. Im folgenden Ergebnisteil werden die Mittelwerte (MW) ± Standardabweichung (SD) angegeben und in den Graphiken dargestellt. 36 5. Ergebnisse 5.1 Narkose 5.1.1 Einleitung der Narkose Bei der Einleitung der jeweiligen Narkosen wurden zwei Zeiten ausgehend von einem Zeitpunkt Null, an dem das Tier in die Narkosebox gesetzt wurde, bestimmt. Die erste Zeit wurde genommen, als die Tiere begannen ataktisch zu werden, was ein Zeichen für die einsetzende Narkose war. Eine zweite Zeitmessung ergab sich durch das Entnehmen des Tieres aus der Narkosebox. Zu diesem Zeitpunkt war die Narkose tief genug, um kleine operative Eingriffe an dem Tier durchzuführen. Da sowohl bei der Sham Narkose, als auch bei den Kontrolltieren beide Stadien der Narkose nicht auftraten, wurden diese Gruppen bei der folgenden Statistik nicht berücksichtigt. 5.1.1.1 Zeit bis zur Ataxie Bei der Zeit bis zum Schwanken (Ataxie) der Tiere ergab sich ein signifikanter Wert von F3,36=18,82; p=<0,0001 zwischen den verwendeten Narkotika, Sevofluran, Isofluran, Ether und CO2. Die Ataxie der Tiere setzte am schnellsten bei der CO2 Narkose ein (27,30±4,22 s). Dann folgten die Gruppen, die eine Sevofluran- (32,10±6,35 s) sowie Isofluran- Narkose (33,40±4,60 s) erhielten. Die längste Zeit bis zur Ataxie und damit zum Einsetzen der Narkose benötigte die Ether Narkose mit 44,50±5,76 s. Somit ergab sich ein statistischer Unterschied zwischen den Einleitungszeiten der Narkosen bei Ether vs. CO2 (p<0,0001), Ether vs. Isofluran (p=0,0006) und Ether vs. Sevofluran (p=0,0001) (Abb. 11). 37 *** *** *** Zeit [s] 60 40 20 0 Sevofluran Isofluran CO2 Ether Abb. 11 Darstellung der Zeit bis zur Ataxie bei der Narkoseeinleitung. (MW±SD; n=10) (*** p<0,001; ** p<0,05; *p<0,1) 5.1.1.2 Zeit bis zum Erreichen einer operativen Tiefe Auch bei der zweiten Zeitmessung, bei der die Narkose tief genug war, um einen kleinen operativen Eingriff durchführen zu können, ergab sich zwischen den einzelnen Narkosegruppen ein signifikanter Unterschied (F3,36=33,775; p<0,0001). Dieser Unterschied war zwischen den Gruppen Sevofluran vs. CO2 (p<0,0001), Isofluran vs. CO2 (p<0,0001), Ether vs. CO2 (p<0,0001) und Sevofluran vs. Ether (p=0,0383) zu erkennen (Abb. 12). Die CO2 Narkose benötigte dabei die geringste Zeit für die Einleitung der Narkose (45,90±5,47 s), die Ether Narkose hingegen die längste Zeit (89,60±15,09 s). Die Einleitungszeiten der Isofluran- (79,90±4,89 s) und Sevofluran- Narkose (75,60±11,77 s) unterscheiden sich im Vergleich zur Ether und CO2 Narkose nicht sehr stark. *** *** ** Zeit [s] 150 *** 100 50 0 Sevofluran Isofluran CO2 Ether Abb. 12 Darstellung der Dauer der Einleitung der Narkosen bis zur operaWven Tiefe. (MW±SD; n=10) (*** p<0,001; ** p<0,05; *p<0,1) 38 5.1.2 Verhalten direkt nach der Narkose Nachdem die Tiere aus der Narkosebox entnommen und in ihren Transportkäfig gesetzt wurden, wurde das Verhalten beobachtet. Hierbei wurde zum einem die Zeit bestimmt, die das Tier brauchte, um aus der Narkose zu erwachen. Dieses Zeitintervall endete, wenn das Tier die erste Bewegung zeigte. Auch bei dieser Analyse wurden die Kontroll- und Sham- Tiere nicht mit einbezogen. 5.1.2.1 Zeit bis zum Erwachen aus der Narkose Bei dem Vergleich der Aufwachzeiten aus der jeweiligen Narkose ergab sich kein statistischer Unterschied zwischen den Gruppen (F3,36=2,197; p=0,1052). Alle Tiere benötigen unabhängig von der Narkose durchschnittlich 34,20±10,11 (s) zum Erwachen aus der Narkose (Tab. 5). Tab. 5 Vergleich der MW ± SD der Aufwachzeiten der jeweiligen Narkosen. Narkose Aufwachzeit (s) Sevofluran 31,00±7,72 Isofluran 39,90±9,67 CO2 29,20±7,63 Ether 36,70±15,42 5.1.2.2 Gesamtaktivität nach der Narkose Neben der Aufwachzeit wurde die Gesamtaktivität beurteilt. Dazu wurden die Zeiten des Auftretens verschiedener Aktivitäten auf die Gesamtzeit der Beobachtung (300 s) berechnet und mit Faktoren versehen. Daraus konnte die Gesamtaktivität ermittelt werden. Somit ergab sich ein Wert von 1-7, wobei 1 mit „nicht aktiv“ und 7 mit „sehr aktiv“ zu bewerten ist. Die einzelnen Verhaltensweisen mit Faktoren werden in Tabelle 6 dargestellt. Bei dieser Beobachtung wurden Kontrolltiere und Tiere, die eine Sham Narkose erhielten mit einbezogen. 39 Tab. 6 Darstellung der Verhaltensweisen mit dem entsprechenden Wert. Verhalten Wert dauerhaftes Liegen 1 seltene Bewegung, nicht aktiv 2 bewegen, aber langsam 3 neugierig; zeigt Interesse an ihre Umwelt 4 unkontrolliertes Taumeln 5 Erkundungsverhalten, aber taumelig 6 Aktiv; zeigt starkes Erkundungsverhalten 7 Bei dieser Beurteilung der Gesamtaktivität gab es zwischen den Gruppen zahlreiche signifikante Unterschiede (F5,54=152,596; p<0,0001). Das Verhalten der Kontrollgruppe wurde als Normalverhalten angesehen. Diese Tiere zeigten eine Aktivität von 7,0. Ausgehend von diesem Verhalten, wurde das Verhalten der anderen Gruppen beurteilt. Auch die Tiere, die eine Sham Narkose erhielten zeigten keine Veränderung im Verhalten und somit eine Gesamtaktivität von 7,0. Tiere, die eine CO2 Narkose erhielten, zeigten die geringste Aktivität mit 2,83±0,68. Die Aktivität der weiteren Gruppen war ungefähr gleich (Sevofluran: 6,18±0,13; Isofluran: 5,80±0,51; Ether: 5,62±0,44) (Abb. 13). Dementsprechend ergab sich, dass die Kontroll- und Sham- Gruppe signifikant aktiver waren gegenüber allen anderen Gruppen, die eine Narkose erhielten. Zusätzlich ergab sich ein statistischer Unterschied zwischen Sevofluran vs. CO2, Isofluran vs. CO 2 und Ether vs. CO 2 . Alle p-Werte werden zur Bewahrung der Gesamtaktivität Übersichtlichkeit in Tabelle 7 dargestellt. 6 4 2 0 Kontrolle Sham Sevofluran Isofluran CO2 Ether Abb. 13 Darstellung der GesamtakWvität ohne Signifikanzen. (MW±SD; n=10) 40 Tab. 7 Darstellung der MW ± SD der GesamtakWvität und die Signifikanzen zwischen den Gruppen. (*** p<0,001; ** p<0,05; *p<0,1) Mittelwert ± SD Kontrolle Kontrolle 7,00±0,0 Sham Sevofluran Isofluran CO2 Ether Sham 7,00±0,0 Sevofluran Isofluran CO2 Ether ** *** *** *** ** *** *** *** *** * 6,18±0,13 5,80±0,51 *** 2,83± 0,68 *** 5,62±0,44 5.1.3 Blutanalyse Um die Blutuntersuchung durchzuführen, wurde bei allen Mäusen vor Versuchsbeginn Blut retrobulbär entnommen, um den basalen Hämatokrit Wert und die Corticosteron Konzentration der ungestressten Tiere zu bestimmen. Eine zweite Blutentnahme erfolgte am Versuchstag 15 min nach der Narkose, bei der ebenfalls der Hämatokrit und die Corticosteron Konzentration bestimmt wurden. Nun konnten beide Werte nach der Narkose mit basalen Werten verglichen werden. 5.1.3.1 Hämatokrit Bei einem Vergleich des Hämatokrit Werts nach der Narkose mit dem basalen Wert war dieser nach der Sevofluran- (p=0,0174), Isofluran- (p=0,0773) und CO2 Narkose (p<0,0001) signifikant erhöht. Bei den Gruppen mit einer Ether Narkose, Sham Narkose und den Kontrolltieren ergaben sich keine signifikanten Unterschiede im Vergleich zu den basalen Werten (Tab. 8). 41 Tab. 8 Vergleich der MW ± SD der basalen Hämatokrit Werten mit denen nach der Narkose. Narkose vor Narkose (%) nach Narkose (%) Kontrolle 52,05±1,36 52,60±1,17 Sham 52,55±0,93 52,65±0,90 Sevofluran 52,00±0,88 53,10±1,13 Isofluran 51,40±1,93 52,70±1,03 Ether 52,15±1,47 51,95±1,12 CO2 51,05±0,90 55,00±1,20 5.1.3.2 Corticosteron Auch bei dem Vergleich der Corticosteron Werte vor und nach der Narkose ergaben sich statistische Unterschiede. So sind die Corticosteron Konzentrationen nach der Sevofluran (p<0,0001), Isofluran (p<0,0001), Sham (p=0,0013), CO2 (p<0,0001) und Ether Narkose (p<0,0001) signifikant höher als die zuvor gemessenen Basalwerte (Tab. 9) (Abb. 14). Jegliche Art von Behandlung führte zu einen Anstieg in der Corticosteron Konzentration. Lediglich bei den Kontrolltieren ergab sich kein statistischer Unterschied zwischen beiden Werten (Basal: 467,80±496,80 nmol/l; nach Behandlung 826,00±468,00 nmol/l). CORT [nmol / l] 3000 ** *** *** Sham Sevofluran Isofluran Basal *** Behandlung *** CO2 Ether 2000 1000 0 Kontrolle Abb. 14 Darstellung der CorWcosteron KonzentraWonen vor und nach einer Behandlung (MW±SD; n=10) (*** p<0,001; ** p<0,05; *p<0,1) 42 Tab. 9 Vergleich der MW ± SD der CorWcosteron KonzentraWonen vor und nach der Behandlung. Narkose vor Behandlung (nmol/l) nach Behandlung (nmol/l) Kontrolle 467,82±496,83 825,99±467,98 Sham 434,49±253,00 1207,9±406,29 Sevofluran 349,89±300,38 1877,1±292,89 Isofluran 345,77±319,47 2162,0±302,71 Ether 504,31±305,52 1948,6±291,91 CO2 434,04±390,47 1874,7±216,35 Um einen Vergleich der Corticosteron Konzentrationen zwischen den Gruppen zu erkennen, wurden Differenzen zwischen den Werten nach der jeweiligen Narkose und den Basalwerten gebildet. Hierbei ergab sich, dass der Corticosteron Wert nach einer Sevofluran Narkose (1527,21±397,86 nmol/l) signifikant höher war als bei Kontrolltieren (358,17±790,21 nmol/l). Auch die Konzentration von Corticosteron nach einer Isofluran Narkose (1816,20±386,79 nmol) war gegenüber einer Sham Narkose (773,46±535,21 nmol/l) signifikant erhöht. Eine CO2 Narkose (1440,70±337,16 nmol/l) und eine Ether Narkose (1444,33±405,01 nmol/l) zeigten ebenfalls einen statistischen Unterschied im Vergleich zu den Kontrolltieren (Abb. 15). ** ** *** *** CORT [nmol / l] 2500 * 2000 ** 1500 1000 500 0 Kontrolle Sham Sevofluran Isofluran CO2 Ether Abb. 15 Darstellung der CorWcosteron KonzentraWonen zwischen den Gruppen. (MW±SD; n=10) (*** p<0,001; ** p<0,05; *p<0,1) 43 5.1.4 Open Field Neben der Betrachtung der physiologischen Parameter nach der Narkose wurde das Verhalten in einem fünf-minütigen Open Field Test analysiert. Dabei wurde die gelaufene Gesamtstrecke, die Frequenz der Zonenübertritte, die Latenz des ersten Auftretens, die Geschwindigkeit und die Aufenthaltsdauer in den Kompartimenten des Open Fields betrachtet. 5.1.4.1 gelaufene Gesamtstrecke Bei der Auswertung der gelaufenen Gesamtstrecke ergab sich ein signifikanter Unterschied zwischen den unterschiedlichen Narkose Gruppen von F5,47=3,528; p=0,0086. Dabei legten Tiere, die eine Ether Narkose erhielten die größte Strecke mit 2805,18±1455,43 cm und Tiere, die eine Isofluran Narkose erhielten, die geringste Strecke mit 1556,12±598,53 cm zurück (Abb. 16). So ergab sich ein signifikanter Unterschied zwischen diesen beiden Gruppen von p=0,0581. Zwischen den anderen Gruppen ergab sich kein statistischer Distanz [cm / 5min] Unterschied (Tab. 10). 6000 * 4000 2000 0 Kontrolle Sham Sevofluran Isofluran CO2 Ether Abb. 16 Darstellung der Gesamtlaufstrecke der unterschiedlichen Gruppen. (MW±SD; n=10) (*** p<0,001; ** p<0,05; *p<0,1) 44 Tab. 10 Vergleich der MW ± SD der gelaufenen Gesamtstrecke im Open Field. Narkose Gesamtstrecke / 5 min (cm) Sevofluran 2033,49±445,23 Isofluran 1556,12±598,53 Sham 2503,42±227,16 Kontrolle 2322,15±498,11 CO2 1612,42±949,59 Ether 2805,18±1455,43 5.1.4.2 maximal gelaufene Strecke Die Analyse der maximal gelaufenen Strecke ohne Unterbrechung ergab einen signifikanten Unterschied zwischen den Gruppen von F5,47=3,458; p=0,0096. Dieser manifestierte sich vor allem zwischen den Gruppen, die eine Sevofluran und Ether Narkose erhielten. Nach einer Ether Narkose liefen die Tiere mit 35,83±27,75 cm signifikant (p=0,0963) mehr als Tiere nach einer Sevofluran Narkose mit 7,53±1,22 cm (Abb. 17). Weitere statistische Unterschiede waren nicht erkennbar. Kontroll- und Sham Tiere liefen mit 16,71±21,47 cm (Kontrolle) und 15,61±17,42 cm (Sham) die gleiche maximale Strecke. Auch die Tiere nach einer Isofluran Narkose, liefen mit 8,83±7,66 cm fast die gleiche Distanz wie die Tiere nach einer Sevofluran Narkose. Tiere nach einer CO2 Narkose liefen wiederum fast die gleiche Strecke (32,97±30,08 cm) wie Tiere nach einer Ether max. gelaufene Strecke [cm] Narkose. 80 * 60 40 20 0 Kontrolle Sham Sevofluran Isofluran CO2 Ether Abb. 17 Darstellung der maximal gelaufenen Strecke der unterschiedlichen Gruppen. (MW±SD; n=10) (*** p<0,001; ** p<0,05; *p<0,1) 45 5.1.4.3 Zonenübertritte Neben der zurückgelegten Gesamtstrecke wurden zur Untersuchung der Aktivität nach der Narkose die Zonenübertritte betrachtet. Dazu wurde das Open Field, wie in Abbildung 10 dargestellt, in eine Rand- und Mittelzone unterteilt. Auch bei dieser Betrachtung ergab sich zwischen allen Gruppen ein F-Wert von F5,47=2,868; p=0,0243. Zwischen den einzelnen Gruppen bestand auf Grund der hohen Standardabweichung kein signifikanter Unterschied. Die Reihenfolge von Zonenübertritten war somit: Sham (23.20±7,98) > Kontrolle (17.50±7.34) > Sevofluran (15.80±10.69) > Ether (12.00±7.02) > Isofluran (10.80±9.92) > CO2 (10.00±9,97) (Abb. 18). Frequenz / 5 min 40 30 20 10 0 Kontrolle Sham Sevofluran Isofluran CO2 Ether Abb. 18 Darstellung der ZonenübertriSe im Open Field pro 5 min. (MW±SD; n=10) 5.1.4.4 Latenz des ersten Auftretens Außerdem wurde die Latenz des ersten Auftretens im Open Field betrachtet. Das ist die Zeit, die das Tier benötigt, um von der Mitte, in die sie vom Experimentator gesetzt wurde, das erste Mal in die Randzone zu gelangen. Auch bei dieser Analyse ergab sich ein statistischer Wert zwischen den Gruppen von F5,47=3,324 und p=0,0119. Tiere, welche eine Sham Narkose bekamen, betraten mit 0,84±0,93 s signifikant schneller den Randbereich als Tiere, die eine CO2 Narkose (5,60±4,71 s) erhielten (p=0,0511) (Abb. 19). Zwischen den anderen Gruppen ergab sich kein signifikanter Unterschied (Tab. 11). 46 20 * Zeit [s] 15 10 5 0 Kontrolle Sham Sevofluran Isofluran CO2 Ether Abb. 19 Darstellung der Latenz des ersten Au`retens im Open Field. (MW±SD; n=10) ! (*** p<0,001; ** p<0,05; *p<0,1) Tab. 11 Vergleich der MW ± SD (s) der Latenz des ersten Au`retens. Narkose Latenz des ersten Auftretens Kontrolle 4,97±4,48 Sham 0,84±0,93 Sevofluran 2,86±2,04 Isofluran 3,00±2,63 CO2 5,60±4,71 Ether 1,69±1,98 5.1.4.5 gelaufene Geschwindigkeit Ein weiterer Parameter zur Betrachtung des Verhaltens im Open Field ist die Erfassung der gelaufenen Geschwindigkeit. Auch hier wurde ein signifikanter Unterschied zwischen den Gruppen ermittelt (F5,47=3,524; p=0,0087). Dieser statistische Wert ergab sich durch den Gruppenunterschied zwischen Tieren, die eine Isofluran und Ether Narkose erhielten. Nach einer Ether Narkose liefen die Tiere mit einer Geschwindigkeit von 9,36±4,85 cm/s und legten somit die schnellste Geschwindigkeit zurück. Tiere nach einer Isofluran Narkose liefen hingegen 5,19±2,00 cm/s und bewegten sich somit am langsamsten im Open Field. Dadurch ergab sich ein signifikanter Unterschied von p=0,059. Die anderen Gruppen reihten sich mit 5,38±3,17 cm/s (CO2) < 6,79±1,49 cm/s (Sevofluran) < 7,80±1,74 cm/s (Kontrolle) < 8,35±0,76 cm/s (Sham) in dieser Reihenfolge zwischen der maximalen und minimalen Geschwindigkeit ein (Abb. 20). 47 Geschwindigkeit [cm/s] 20 * 15 10 5 0 Kontrolle Sham Sevofluran Isofluran CO2 Ether Abb. 20 Darstellung der gelaufenen Geschwindigkeit im Open Field. (MW±SD; n=10) (*** p<0,001; ** p<0,05; *p<0,1) 5.1.4.6 Aufenthaltsdauer in der Mitte des Open Fields Bei der Betrachtung der Aufenthaltsdauer im mittleren Bereich des Open Fields während der gesamten 5 Minuten des Tests ergab sich kein signifikanter Unterschied zwischen den Gruppen. Alle Tiere aller Gruppen hielten sich durchschnittlich 25,77±17,99 s auf. Wodurch man schließen kann, dass sich die Tiere die meiste Zeit (274,24 s) am Rand aufhielten. Tiere nach der Ether Narkose zeigten bei dieser Betrachtung die geringste Aufenthaltsdauer in der Mitte des Open Fields (16,56±8,71 s). Die Sham Gruppe verbrachte wiederum die längste Zeit in der Mitte des Open Fields (34,56±16,16 s) (Tab. 12) Tab. 12 Aufenthaltsdauer in der MiSe im Open Field Test. Narkose Aufenthalt Mitte (s) Kontrolle 30,07±15,09 Sham 34,56±16,16 Sevofluran 27,70±17,95 Isofluran 24,04±24,62 CO2 21,65±19,04 Ether 16,56±8,71 48 5.2 Blutentnahme 5.2.1 Dauer für die Blutentnahme Zur Ermittlung der Dauer der Blutentnahme wurde zum einen die Gesamtdauer ermittelt. Das entspricht der Zeit, die der Experimentator für die genutzte Narkose bei der retrobulbären Blutentnahme mit der dünnen Kanüle oder Venenwinkel bzw. für die Fixation der Tiere bei den restlichen Blutentnahmen benötigte, plus die Dauer der eigentlichen Blutentnahme. Zum anderen wurde die Durchführungszeit der reinen Blutentnahme ermittelt. 5.2.1.1 Dauer für die Durchführung der reinen Blutentnahme Bei der Durchführung der Blutentnahme, ungeachtet davon wie lange der Experimentator benötigte das Tier zu narkotisieren oder zu fixieren, ergaben sich statistische Unterschiede zwischen den Gruppen (F 5,65 =29,597; p=<0,0001). Die Zeit für die Durchführung wurde gemessen von der ersten Punktion der jeweiligen Blutentnahmestelle bis zum Füllen der Hämatokrit Kapillare. Hierbei wurde die retrobulbäre Blutentnahme mit der dicken Kanüle mit 6,42±1,24 s am schnellsten durchgeführt. Diese Blutentnahme benötigte im Vergleich zur Blutentnahme aus der Schwanzvene mit 79,09±31,52 s, aus den Venenwinkel mit 40,58±16,98 s und aus der Vena saphena mit 40,67±13,82 s signifikant weniger Zeit (Abb. 21). Für die Blutentnahme aus der Schwanzvene wurde hingegen die längste Zeit benötigt. So ergaben sich bei dieser Methode im Vergleich zu allen anderen durchgeführten Blutentnahme signifikante Unterschiede (Tab. 13). Die Punktion der Vena facialis mit einer Durchführungszeit von 13,33±11,33 s war nach der retrobulbären Methode mit der dicken Kapillare die schnellste. Sie war im Vergleich zu Blutentnahme aus der Vena saphena (p=0,0104) und dem Venenwinkel (p=0,0108) signifikant schneller. Eine Ausnahme zum Füllen der Hämatokrit Kapillare wurde jedoch bei der Blutentnahme aus dem Venenwinkel gemacht. Wurde dort nach mehreren Einstichen der Kanüle in den Venenwinkel kein Blut gewonnen, wurde die Entnahme abgebrochen. So erreichte die Punktion des Venenwinkels eine reine Durchführungszeit von 40,58±16,98 s und war somit, obwohl die 49 Blutentnahme beim Nicht-Befüllen der Kapillare, was in 10 von 12 Kapillaren der Fall war, abgebrochen wurde, immer noch signifikant langsamer als die Punktion der Vena facialis (p=0,0108), die Punktion der Schwanzvene (p<0,0001) und die Punktion des retrobulbären Venengeflechts mit dicker (p=0,0005) und dünner Kapillare (p=0,0747). Ein weiterer statistischer Unterschied ergab sich zwischen der Punktion der Vena saphena (40,67±13,82 s) und der retrobulbären Blutentnahme mit der dünnen Kapillare (18,67±9,89 s). Dauer [s] 150 100 50 0 r.b. dick r.b. dünn Schwanzvene Vena saphena Vena facialis Venenwinkel Abb. 21 Darstellung der Dauer für die jeweiligen Blutentnahmen ohne Signifikanzen. (MW±SD; n=12) Tab. 13 Darstellung der MW ± SD der Blutentnahmezeiten in s und Darstellung der Signifikanzen. (*** p<0,001; ** p<0,05; *p<0,1) Mittelwert ± SD r.b (dick) r.b (dick) r.b (dünn) 6,43± Schwanz V. -vene saphena V. facialis Venenwinkel *** *** *** *** * * 79,09± *** *** 40,67± ** 1,24 r.b (dünn) 18,67± 9,89 Schwanzvene V. saphena V. facialis *** 31,52 13,82 13,33± ** 11,33 Venenwinkel 40,58± 16,98 50 5.2.1.2 Gesamtdauer für die Blutentnahme Die Gesamtdauer der Blutentnahme umfasst sowohl die Zeit für die jeweilige Blutentnahme, als auch die dafür benötigte Zeit, um das Tier zu fixieren bzw. in Narkose zu legen. Auch hierbei ergaben sich signifikante Unterschiede zwischen den unterschiedlichen Gruppen (F5,65=99,326; p<0,0001). Die retrobulbäre Blutentnahme ist mit dicker Kapillare mit 9,42±1,24 s inklusive der Fixation der Tiere auch bei dieser Betrachtung signifikant schneller als die Blutentnahme aus der Schwanzvene (117,82±26,71 s), der Vena saphena (63,17±16,12 s), dem Venenwinkel (136,75±21,64 s) und die retrobulbäre Blutentnahme mit der dünnen Kapillare (118,50±24,33 s) (Abb. 22). Die retrobulbäre Blutentnahme mit der dünnen Kapillare benötigte wie oben erwähnt 18,67±9,89 s für die reine Blutentnahme. Durch die Ether Narkose erhöht sich die Gesamtdauer der Blutentnahme auf 118,50±24,33 s. Somit war diese Methode signifikant langsamer als die Blutentnahme aus der Vena saphena (p<0,0001), Vena facialis (p<0,000)1 und die retrobulbäre Blutentnahme mit der dicken Kapillare (p<0,0001). Auch die Blutentnahme aus der Schwanzvene, bei der das Tier in einer Zwangsröhre gesetzt wurde, dauerte statistisch länger als die Blutentnahme aus der Vena saphena (p<0,0001), Vena facialis (p<0,0001) und die retrobulbäre Blutentnahme mit der dicken Kapillare (p<0,0001). Die Punktion der Vena facialis, bei der das Tier auch lediglich in den Zwangsgriff genommen werden musste, stellte sich nach der retrobulbären Blutentnahme Methode mit der dicken Kapillare mit 20,50±11,80 s als zweitschnellste Methode heraus. Somit war diese Methode auch signifikant schneller in der Durchführung als die Blutentnahme aus dem Venenwinkel (p<0,0001), bei der die Tiere in eine Ether Narkose gelegt wurden, und aus der Vena saphena (p=0,0001), bei der die Tiere in einen Falcon Tube gesetzt wurden. Bei der Betrachtung der Gesamtdauer benötigte die Punktion des Venenwinkels mit 136,75±21,64 s die längste Zeit, obwohl die Methode wie oben erwähnt abgebrochen wurde, wenn nach mehreren Versuchen kein Blut aspiriert wurde (10 von 12 Kapillaren waren nicht vollständig gefüllt) (Tab 14). 51 Gesamtdauer [s] 200 150 100 50 0 r.b. dick r.b. dünn Schwanzvene Vena saphena Vena facialis Venenwinkel Abb. 22 Darstellung der Gesamtdauer für die jeweiligen Blutentnahmen ohne Signifikanzen. (MW±SD; n=12) Tab. 14 Darstellung der MW ± SD der Gesamtdauer (in s) der Blutentnahmezeiten und Darstellung der Signifikanzen. (*** p<0,001; ** p<0,05; *p<0,1) Mittelwert ± SD r.b (dick) r.b (dick) 9,42± r.b (dünn) *** Schwanz V. -vene saphena *** V. facialis *** Venenwinkel *** 1,24 r.b (dünn) 118,50± *** *** *** *** 63,17± *** *** 20,50± *** 24,33 Schwanzvene 117,82± 26,71 V. saphena V. facialis 16,12 11,80 Venenwinkel 136,75± 21,64 5.2.1.3 Quantität des gewonnenen Blutes Neben der Betrachtung der Durchführungszeit der jeweiligen Blutentnahmen wurde zusätzlich subjektiv durch Erfassung der Füllstandes der Kapillaren und der enthaltenen Luftblasen die Quantität des Blutes erfasst. Das Blut, welches durch die Blutentnahme aus der Vena facialis und durch die Punktion des retrobulbären Venengeflechts, sowohl mit der dicken, als auch mit der dünnen Kapillare gewonnen wurde, zeigte keine Luftblasen und die Kapillaren waren stets voll gefüllt, so dass 75 µl Blut entnommen wurden. Bei 52 der Punktion der Vena saphena waren die Kapillaren nach der Blutentnahme auch stets gefüllt, jedoch waren bei drei Tieren Luftblasen enthalten, so dass hier ein leichter Verlust an Blut auftrat. Die Punktion der Schwanzvene war lediglich bei zwei Tieren erfolgreich, so dass die Kapillaren ohne Luftblasen voll gefüllt waren. Fünf Kapillaren waren nur zu einem Drittel bis zu drei Viertel gefüllt und sieben Kapillaren enthielten Luftblasen. Bei der Punktion des Venenwinkels erfolgte keine Zählung der Luftblasen. Jedoch waren auch bei dieser Methode die Kapillaren zu einem Viertel bis drei Viertel gefüllt. Zusätzlich konnte bei dieser Methode kein Hämatokrit-Wert bestimmt werden, da dieser dadurch, dass die Kanüle für die Punktion mit EDTA gespült wurde, nicht auswertbar war, so dass Hämatokrit Werte von 24 %, 31 % oder noch geringer (4,23 %) auftraten. 5.2.2 Gesamtaktivität nach der Blutentnahme Auch direkt nach der Blutentnahme wurde die Gesamtaktivität für 10 min betrachtet. Dazu wurden, wie oben beschrieben, die Zeiten des Auftretens verschiedener Aktivitäten (Tab. 6) auf die Gesamtzeit der Beobachtung (600 s) berechnet und mit Werten versehen. Daraus konnte die Gesamtaktivität ermittelt werden. Somit ergeben sich Werte von 1-7, wobei 1 „nicht aktiv“ und 7 „sehr aktiv“ bedeutet. In Tabelle 15 sind die signifikanten Unterschiede zwischen den Gruppen (F5,63=65,752; p=<0,0001) dargestellt. Tiere, denen Blut retrobulbär mit der dicken Kapillare entnommen wurde, zeigten hierbei mit 6,94±0,06 die höchste Aktivität. Sie waren signifikant aktiver als Tiere nach der Blutentnahme aus der Vena facialis (3,68±0,93), dem Venenwinkel (3,72±1,17) und nach der retrobulbären Blutentnahme mit der dünnen Kapillare (5,86±0,34). Die geringste Aktivität zeigten die Tiere nach der Punktion der Vena facialis mit 3,68±0,93. Diese Tiere wiesen eine statistisch geringere Aktivität auf als Tiere nach der Punktion der Vena saphena (6,77±0,29), Punktion der Schwanzvene (6,87±0,38) und der retrobulbären Blutentnahme, sowohl mit dicker (6,94±0,06), als auch mit dünner (5,86±0,34) Kapillare. Tiere, denen Blut aus dem Venenwinkel entnommen wurde, zeigten ebenfalls eine geringe Aktivität von 3,72±1,17. Diese Aktivität unterschied sich signifikant von der Aktivität nach der 53 Blutentnahme aus der Vena saphena (p<0,0001) und der Schwanzvene (p<0,0001) sowie nach der Punktion des retrobulbären Venengeflechts mit dicker (p<0,0001) und dünner (p=0,0289) Kapillare. Ebenfalls waren Tiere nach der retrobulbären Punktion mit dünner Kapillare signifikant weniger aktiv, als Tiere bei denen die Schwanzvene (p=0,0289) bzw. die Vena saphena (p=0,0585) punktiert wurde (Abb. 23). Gesamtaktivität 8 6 4 2 0 r.b. dick r.b. dünn Schwanzvene Vena saphena Vena facialis Venenwinkel Abb. 23 Darstellung der Gesamtdauer für die jeweiligen Blutentnahmen ohne Signifikanzen. (MW±SD; n=12) Tab. 15 Darstellung der MW ± SD der GesamtakWvitäten in s nach der Blutentnahme und Darstellung der Signifikanzen. (*** p<0,001; ** p<0,05; *p<0,1) Mittelwert ± SD r.b (dick) r.b (dick) 6,94± r.b (dünn) Schwanz V. -vene saphena ** V. facialis Venenwinkel *** *** *** *** *** *** *** *** 0,06 r.b (dünn) 5,86± ** * 0,34 Schwanzvene V. saphena V. facialis 3,68± 0,93 6,77± 0,29 6,87± 0,38 Venenwinkel 3,72± 1,17 54 5.2.3 Blutanalyse Für die Ermittlung des physiologischen Stresses wurde 15 min nach der jeweiligen Blutentnahme die Corticosteron Konzentration durch eine zweite Blutentnahme bestimmt und mit den Konzentrationen der basalen Blutentnahme verglichen. Dabei ergab sich, dass sich die Corticosteron Werte aller Blutentnahmen signifikant von den basalen Corticosteron Werten unterschieden. Bei der retrobulbären Blutentnahme mit der dicken und dünnen Kapillare waren die Corticosteron Werte nach der Blutentnahme (dick: 1169,64±395,90 nmol/l; dünn: 1730,55±666,01 nmol/l) signifikant höher als die basalen Werte (dick: 282,02±210,78 nmol/l; dünn: 87,01±75,10 nmol/l). Auch die Corticosteron Werte der Punktion der Schwanzvene (2412,47±1873,39 nmol/l), der Vena facialis (2578,81±2198,99 nmol/l), der Vena saphena (1805,06±820,21 nmol/l), des Venenwinkels (236,75±259,71 nmol/l) unterschieden sich signifikant von ihren basalen Werten (Abb. 24, Tab. 16). Cort basal Cort nach Blutentnahme CORT [nmol / l] 8000 *** *** ** *** ** ** r.b. dick r.b. dünn Schwanzvene V. saphena V. facialis Venenwinkel 6000 4000 2000 0 Abb. 24 Vergleich der basalen CorWcosteron Werte mir denen nach der Blutentnahme. (MW±SD; n=12) (*** p<0,001; ** p<0,05; *p<0,1) 55 Tab. 16 Vergleich der basalen CorWcosteron Werten mit den CorWcosteron Werten nach der Blutentnahme. . (MW±SD) Blutentnahmemethoden basale Corticosteron Werte ± SD (nmol/l) Corticosteron Werte nach Blutentnahme ± SD (nmol/l) retrobulbär (dick) 282,02±210,78 1169,64±395,90 retrobulbär (dünn) 87,01±75,10 1730,55±666,01 192,307±188,12 2578,81±2198,99 Vena saphena 116,65±97,33 1805,06±820,21 Schwanzvene 203,60±168,39 2412,47±1873,39 Venenwinkel 236,75±259,71 3243,61±1958,13 Vena facialis Neben dem Vergleich der basalen Corticosteron Werte mit denen nach der Blutentnahme, wurden die Corticosteron Werte unabhängig von ihrem Basalwert miteinander vergleichen. Dazu wurde die Differenz zwischen den Corticosteron Werten nach der Blutentnahme und den basalen Corticosteron Werten berechnet. Dort ergab sich ein signifikanter Gruppenunterschied von F5,63=2,523, p=0,0382. Jedoch lässt sich dieser Gruppenunterschied, der zwischen allen Gruppen entstand durch die großen Standardabweichungen (Tab. 16) nicht individuell auf die jeweiligen Gruppen übertragen. Die retrobulbäre Blutentnahme mit der dicken Kapillare löste den geringsten Corticosteron Anstieg mit 887,62±481,07 nmol/l aus, die Punktion des Venenwinkels führte hingegen zu den größten Corticosteron Anstieg (3006,86±2101,61 nmol/l). Es ergab sich ein Corticosteron Anstieg der Größe nach: retrobulbär (dick) (887,61±481,07 nmol/l) < retrobulbär (dünn) (1643,53±675,49 nmol/l) < Vena saphena (1688,41±811,86 nmol/l) < Schwanzvene (2208,87±1853,51 nmol/l) < Vena facialis (2386,50±2260,98 nmol/l) < Venenwinkel (3006,86±2101,61 nmol/l) (Abb. 25). 56 CORT [nmol / l] 8000 6000 4000 2000 0 -2000 r.b. dick r.b. dünn Schwanzvene Vena saphena Vena facialis Venenwinkel Abb. 25 Darstellung der Gruppenunterschiede der CorWcosteron AnsWegs nach der Blutentnahme. (MW±SD; n=12) 5.2.4 Open Field Auch 15 min nach der Blutentnahme wurden die Tiere wie nach der Narkose für fünf Minuten in ein Open Field gesetzt, um das Verhalten zu beobachten. 5.2.4.1 gelaufene Gesamtstrecke Bei dem Vergleich der gelaufenen Gesamtstrecke pro fünf Minuten im Open Field ergaben sich statistische Unterschiede zwischen den Gruppen (F5,65=8,336; p<0,0001). Die größte Distanz im Open Field legten Tiere nach der Punktion der Schwanzvene mit 2183,27±648,65 cm zurück. Tiere, bei denen Blut aus dem Venenwinkel genommen wurde, legten wiederum die geringste Strecke mit 839,54±371,71 cm im Open Field zurück. Sie liefen in den fünf Minuten, in denen der Open Field Test durchgeführt wurde, signifikant weniger als Tiere nach der retrobulbären Blutentnahme mit der dicken (1807,78±861,96 cm) und dünnen Kapillare (1699,01±498,42 cm), Tiere nach der Punktion der Schwanzvene (2183,27±648,65 cm) und Tiere nach der Punktion der Vena saphena mit 2110,21±443,21 cm. Nach der Punktion der Vena facialis legten die Tiere eine Gesamtstrecke von 1225,54±697,78 cm im Open Field zurück und unterschieden sich statistisch von Tieren nach Punktion der Schwanzvene (p=0,0191) und nach Punktion der Vena saphena (p=0,0394) (Abb. 26). 57 ** Distanz [cm / 5min] ** ** * 4000 *** *** 3000 2000 1000 0 r.b. dick r.b. dünn Schwanzvene Vena saphena Vena facialis Venenwinkel Abb. 26 Darstellung der gelaufenen Gesamtstrecke im Open Field pro 5 Minuten. (MW±SD; n=12) (*** p<0,001; ** p<0,05; *p<0,1) 5.2.4.2 maximal gelaufene Strecke Auch bei der Betrachtung der maximal gelaufenen Strecke im Open Field ergaben sich signifikante Unterschiede zwischen den Gruppen (F5,65=8,507, p<0,0001). Die Mäuse mit einer Blutentnahme aus dem Venenwinkel liefen, wie oben erwähnt, die kürzeste Gesamtstrecke im Open Field. Auch bei der maximal gelaufenen Strecke legten diese Tiere die kürzeste Distanz zurück (4,62±1,49 cm). Damit legten sie eine statistisch kürzere maximale Strecke zurück als Tiere nach der retrobulbären Blutentnahme mit der dünnen Kapillare (6,76±1,12 cm), Tiere nach der Punktion der Schwanzvene (8,19±1,55 cm) und Tiere nach der Punktion der Vena saphena (8,13±1,45 cm) (Abb. 27). Die größte maximale Strecke liefen Tiere nach Punktion der Schwanzvene mit 8,19±1,55 cm. Sie liefen somit signifikant mehr als Tiere nach Punktion der Vena facialis mit 5,73±1,82 cm und Tiere nach Punktion des Venenwinkels. Ein weiterer statistischer Unterschied ergab sich zwischen den Gruppen nach der Blutentnahme aus der Vena saphena und Vena facialis. So liefen die Tiere nach der Punktion der Vena saphena (8,13±1,45 cm) signifikant mehr als die Tiere nach der Punktion der Vena facialis mit 5,73±1,82 cm (Tab 17). 58 max. gelaufene Strecke [cm] ** * 15 ** *** *** 10 5 0 r.b. dick r.b. dünn Schwanzvene Vena saphena Vena facialis Venenwinkel Abb. 27 Darstellung der maximal gelaufenen Strecke im Open Field. (MW±SD; n=12) (*** p<0,001; ** p<0,05; *p<0,1) Tab. 17 Vergleich der gelaufenen maximalen Strecke ± SD im Open Field. (MW±SD) Blutentnahmemethode gelaufene maximale Strecke ± SD (cm) retrobulbär (dicke Kapillare) 6,61±2,04 retrobulbär (dünne Kapillare) 6,76±1,12 Schwanzvene 8,19±1,55 Vena saphena 8,13±1,45 Vena facialis 5,73±1,82 Venenwinkel 4,62±1,49 5.2.4.3 Zonenübertritte Wie schon im Material und Methoden Teil beschrieben wurde das Open Field in einen Rand- und Mittelbereich eingeteilt, um Zonenübertritte zu erfassen. Hierbei ergaben sich signifikante Unterschiede zwischen den Gruppen (F5,65=3,792; p=0,0045). Auch hier zeigten Tiere nach der Blutentnahme aus der Schwanzvene die meisten Zonenübergänge (22,42±11,16). Die wenigsten Übertritte zeigten Tiere nach der Punktion der Venenwinkels (7,64±3,98), was auch mit der gelaufenen Gesamtstrecke und der maximal gelaufenen Strecke korrelierte. Somit führte dieser Unterschied zwischen den meisten Zonenübertritten und den geringsten Zonenübertritten zu einem statistischen Unterschied zwischen den Gruppen nach der Schwanzvenen- und Venenwinkel Punktion (p=0,28). Ein weiterer signifikanter Unterschied wurde zwischen der Blutentnahme aus dem Venenwinkel und der retrobulbären Blutentnahme mit 59 der dicken Kapillare (20,41±14,21) gefunden (p=0,0872). So ergab sich eine Reihenfolge der Zonenübertritte von: Venenwinkel (7,64±3,98) < retrobulbär (dünn) (12,00±8,63) < Vena facialis (13,67±9,73) = Vena saphena (13,67±6,17) < retrobulbär (dick) (20,42±14,20) < Schwanzvene (22,42±11,16) (Abb. 28). Frequenz / 5 min 50 ** 40 ** 30 20 10 0 r.b. dick r.b. dünn Schwanzvene Vena saphena Vena facialis Venenwinkel Abb. 28 Darstellung der ZonenübertriSe im Open Field pro 5 min. (MW±SD; n=12) (*** p<0,001; ** p<0,05; *p<0,1) 5.2.4.4 Geschwindigkeit Eine weiterer Parameter, der im Open Field erfasst wurde, war die Geschwindigkeit, mit der sich die Tiere bewegten. Es ergaben sich dabei signifikante Unterschiede zwischen den Gruppe (F5,65=8,334; p<0,0001). Hierbei liefen Tiere, denen Blut aus dem Venenwinkel genommen wurde, am langsamsten mit 2,80±1,24 cm/s und bewegten sich somit statistisch langsamer als Tiere nach der Punktion der Vena saphena (7,04±1,48 cm/s), Tiere nach Punktion der Schwanzvene (7,28±2,16 cm/s) und Tiere, denen retrobulbär Blut sowohl mit der dicken (6,03±2,88 cm/s), als auch mit der dünnen Kapillare (5,67±1,66 cm/s) genommen wurde (Abb. 29). Neben den Tieren nach Venenwinkel Punktion bewegten sich auch die Tiere nach der Punktion der Vena facialis mit 4,09±2,33 cm/s sehr langsam. So wurde ein statistischer Unterschied im Vergleich zur Punktion der Vena facialis und der Schwanzvene errechnet, nach der die Tiere sich mit der größten Geschwindigkeit mit 7,28±2,16 cm/s bewegten. 60 Geschwindigkeit [cm/s] ** ** 15 ** * *** 10 *** 5 0 r.b. dick r.b. dünn Schwanzvene Vena saphena Vena facialis Venenwinkel Abb. 29 Darstellung der gelaufenen Geschwindigkeit im Open Field. (MW±SD; n=12) (*** p<0,001; ** p<0,05; *p<0,1) 5.2.4.5 Latenz des ersten Auftretens Auch bei der Betrachtung der Zeit, die die Tiere benötigten, um das erste Mal von der Mitte der Open Fields in den Randbereich zu gelangen, ergaben sich signifikante Unterschiede zwischen den Gruppen (F5,65=4,700; p=0,0010). Dieser Unterschied rührt vor allem daher, dass Tiere, denen Blut aus dem Venenwinkel entnommen wurde, 20,13±24,36 s benötigten, um von der Mitte zum Rand zu gelangen. Dadurch hatten diese Tiere, wie in Abbildung 30 dargestellt, eine signifikant längere Latenzzeit als alle anderen Tiere, die ca 2-5 s benötigten, um die Mitte zu verlassen. Somit ergab sich eine Reihenfolge von: Venenwinkel (20,13±24,36 s) > Vena facialis (5,37±5,31 s) retrobulbär (dick) > (4,98±4,15 s) > Vena saphena (4,42±3,75 s) > Schwanzvene (3,67±2,54 s) > Latency of first occurrence [s] retrobulbär (dünn) (2,50±2,06 s). ** 80 ** ** ** ** 60 40 20 0 r.b. dick r.b. dünn Schwanzvene Vena saphena Vena facialis Venenwinkel Abb. 30 Darstellung der Latenz des ersten Au`retens im Open Field. (MW±SD; n=12) (*** p<0,001; ** p<0,05; *p<0,1) 61 5.2.4.6 Aufenthaltsdauer in der Mitte des Open Fields Wie schon die Betrachtung der Aufenthaltsdauer im fünf-minütigen Open Field Test nach der Narkose ergab auch diese Beobachtung der Aufenthaltsdauer nach der Blutentnahme keinen signifikanten Gruppenunterschied. Am längsten befanden sich die Tiere nach der Punktion des Venenwinkels mit 58,20±71,86 s in der Mitte. Die kürzeste Verweildauer zeigten die Tiere nach der retrobulbären Blutentnahme mit der dünnen Kapillare (21,43±20,79 s) (Tab. 18). Wie die Tiere nach der Narkose hielten sich die Tiere nach der Blutentnahme die längste Zeit (259,83 s) während des Open Field Tests im Randbereich auf. Tab. 18. Aufenthaltsdauer in der MiSe im Open Field Test. (MW±SD) Blutentnahmemethode Aufenthaltsdauer Mitte (s) retrobulbär (dicke Kapillare) 40,12±27,88 retrobulbär (dünne Kapillare) 21,43±20,79 Schwanzvene 45,85±22,35 Vena saphena 25,27±15,87 Vena facialis 51,63±44,51 Venenwinkel 58,20±71,86 62 6. Diskussion Diese Masterarbeit ist eine Fortführung meiner Bachelorarbeit, bei der zwei unterschiedliche Blutentnahmen, retrobulbär mit dicker Kapillare und die Punktion der Vena facialis mit einer animal bleeding Lanzette, sowohl mit Ether-, CO2, als auch ohne Narkose durchgeführt wurden. Es stellte sich anhand der Corticosteron Konzentration und des Verhaltens im Open Field heraus, dass die retrobulbäre Blutentnahme ohne Narkose bei der Maus offensichtlich die geringste Stressantwort auslöste. Die Inhalationsnarkosen schienen den Stress zu erhöhen. Bei der Punktion der Vena facialis führte die CO2 Narkose zu mehr und die Ether Narkose zu weniger Stress (Schlichting et al., 2008). Aus diesem Grund sollte in dieser meiner Masterarbeit zum einen untersucht werden, welchen Einfluss Ether-, CO2-, Sevofluran-, und Isofluran-Narkosen auf die Stressreaktion der Maus haben. Zum anderen wurden alle von der GV-SOLAS (2009) empfohlenen Blutentnahmemethoden: die retrobulbäre Blutentnahme mit dicker und dünner Kapillare, die Punktion der Vena saphena, der Vena facialis sowie der Schwanzvene und die Blutentnahme aus dem Venenwinkel auf das Hervorrufen von Stress untersucht. Ziel war es, eine Aussage über die Stressreaktion der Mäuse sowohl auf eine Blutentnahme, als auch auf eine Narkose zu treffen. Dazu wurden Corticosteron Bestimmungen durchgeführt und das Verhalten direkt nach der Narkose bzw. Blutentnahme sowie im Open Field beobachtet. 6.1 Narkose Ziel dieses Narkoseversuchs war es zu untersuchen, welchen Einfluss vier verschiedene, häufig verwendete, volatile Anästhetika (Ether, CO2, Sevofluran und Isofluran) auf Mäuse haben. Zunächst wurden die Einleitungs- und Aufwachzeiten der Narkotika betrachtet. Hierbei zeigte sich, dass Tiere, die eine CO2 Narkose erhielten, am schnellsten ataktisch wurden (27,30±4,22 s), was ein Zeichen für die einsetzende Narkose war und auch am schnellsten in Narkose verfielen (45,90±5,47 s). Bei der Verwendung von Ether benötigten die 63 Tiere hingegen am längsten (Ataxie: 44,5±5,76 s; Narkose: 89,60±15,09 s). Auch die Zeit bis zum Aufwachen aus der Narkose war bei der Ether Narkose länger (36,7±15,42 s) als nach der CO2 Narkose (29,2±7,63 s). Dieses Ergebnis stimmt nicht mit den Resultaten eines Narkoseversuchs von Fowler et al. (1980) überein. In ihren Versuch an Wistar Ratten dauerten die Einleitung und das Aufwachen bei der CO2 Narkose länger als bei einer Ether Narkose. Jedoch wurde in seinem Versuch ein CO2 : O2 Gemisch verwendet und der Einstrom betrug 1 l/min. In dem hier vorliegenden Versuch wurde ein spezieller Deckel verwendet, in welchem das CO2 durch eine Prellplatte mit einem Einstrom von 4,6 l/min verwirbelt wurde, wodurch die Narkoseeinleitung nachgewiesen besonders schonend ist (Corbach, 2006). Vermutlich reduziert sich daher die Einleitungszeit mit CO2 in diesem Versuch im Vergleich zu jenem von Fowler et al. (1980). Auch bei einer Studie von Kohler et al. (1999) zeigte sich, dass CO2 bei Mäusen zu einer sehr schnellen Einleitung und einer schnellen Aufwachzeit führt. Flecknell (2009) erklärte die schnelle Aufwachzeit durch die hohe Atemfrequenz, bei der das CO2 schnell wieder ausgeatmet wird. Die Betrachtung der Einleitungs- bzw. Aufwachzeiten der Sevofluran und Isofluran Narkose zeigte, dass es bei den Zeiten fast keine Unterschiede gab. Bei Sevofluran benötigten die Tiere 79,9±4,89 s bis zum Erreichen einer operativen Tiefe und bei Isofluran 75,6±11,77 s. Auch die Aufwachzeiten waren fast gleich (Sevofluran: 31,0±7,72 s; Isofluran: 39,9±9,67 s). Das bestätigt, dass beide Narkotika im Körper sehr schnell anfluten und auch wieder schnell ausgeatmet werden. Jedoch widerspricht dieses Ergebnis Studien von Hikasa et al. (1996) und Flecknell (2009), die herausfanden, dass Sevofluran eine geringere Einleitungszeit benötigt als Isofluran. Neben den Einleitung- und Aufwachzeiten wurde das Verhalten direkt nach der Narkose, die Corticosteron Konzentration und das Verhalten im Open Field zur Beurteilung des auftretenden Stresses durch die Narkose betrachtet. Hier konnte gezeigt werden, dass alle Tiere, die eine Narkose erhielten, insgesamt signifikant weniger aktiv waren, als Tiere ohne bzw. mit einer Sham Narkose. Auch bei der Auswertung der Corticosteron Konzentration ergaben sich signifikante Unterschiede zwischen den Werten nach der Narkose, verglichen mit den basalen Corticosteron Werten. Alle Corticosteron Konzentrationen 64 waren nach der Narkose unabhängig davon, ob eine Sham-, CO2-, Sevofluran-, Isofluran- oder Ether- Narkose durchgeführt wurde, im Vergleich zu den basalen Werten stark erhöht. Zwischen den Narkosegruppen ergaben sich keine Unterschiede nach der Narkose (CO2: 1874,7±26,4 nmol/l, Ether: 1948,6±291,9 nmol/l, Sevofluran: 1877,1±292,9 nmol/l, Isofluran: 2162,0 ±302,7 nmol/l). Diese Ergebnisse zeigen, dass jegliche Art von volatilen Narkotika, sogar der Lufteinstrom allein, in einer Narkosebox zu Stress bei Tieren führen kann. Bestätigt wird dieses Ergebnis durch zahlreiche Literaturquellen, die erwähnen, dass Ether beispielsweise dadurch Stress induziert, dass es zu einer Reizung der Atemwege führt oder dass es zu einer vermehrten Schleimproduktion kommt (Otto, 2004; Fish, 2008). Conlee et al. (2005) berichteten in einem Review von zahlreichen Autoren, die beschreiben, dass CO2 bei Tieren, gemessen an physiologischen Parametern wie Herzschlagrate, Atemfrequenz und Blutdruck, zu Schmerzen und Distress führt. Bei einem Vergleich der durch Sevofluran und Isofluran entstehenden Atemwegsreizung zeigte sich, dass Isofluran im Vergleich zu Sevofluran zu mehr Reizungen führte (Doi und Ikeda, 1993). Obwohl Sevofluran weniger Reizungen der Atemwege verursachte, traten dennoch welche auf. So führt jedes Narkotikum zu einer Veränderung im Körper des Tieres, was Stress auslösen kann. Im Open Field Test zeigten die Tiere jedoch unabhängig davon, welches Anästhetikum verwendet wurde, keine auf die Narkose zurückführbare Veränderung. Lediglich Tiere, die eine Ether Narkose erhalten hatten, liefen eine längere Gesamtstrecke als Tiere, die eine Isofluran Narkose erhalten hatten. Weiterhin zeigten Tiere nach einer CO2 Narkose eine längere Latenzzeit als Tiere, die eine Sham Narkose erhielten. Quatermain et al. (1996) berichteten, dass Stress zu einer Reduktion der Bewegung führt. Jedoch hatten fast alle Tiere unabhängig davon, ob sie eine Narkose bekamen oder nicht, eine annähernd gleiche Bewegungsaktivität. Das lässt sich schließen, dass der Stress, der durch eine Narkose ausgelöst wird, nur von kurzzeitiger Dauer ist und keinen entscheidenden Einfluss auf das Verhalten im Open Field 15 min nach der Narkose zu haben scheint. Die Bewegung direkt nach der Narkose ist jedoch stark reduziert, im Vergleich zu Tieren, die keine Narkose erhielten. Zusätzlich stieg die Corticosteron 65 Konzentration nach der Narkose signifikant an. Somit scheinen also die in dieser Studie verwendeten volatilen Anästhetika bei den Tieren kurzfristig Stress auszulösen. Daher sollte überlegt werden, ob bei kurzen experimentellen Eingriffen, wie zum Beispiel einer Blutentnahme, auf eine Narkose verzichtet werden sollte, da diese genau wie die kurze Behandlung auch zu temporärem Stress führen kann. 6.2 Blutentnahme Ein weiteres Ziel dieser Arbeit war es verschiedene Blutentnahmemethoden vergleichend zu untersuchen. Bei der Arbeit in der Versuchstierkunde wird häufig Blut von Labortieren benötigt, um beispielsweise eine Blutgasanalyse oder eine Hormonbestimmung durchzuführen. Aus diesem Grund soll eine Methode gefunden werden, die für die Tiere besonders schonend ist und ihnen den geringsten Stress bereitet. Die GV-SOLAS hat in ihrer Empfehlung einige Methoden zur Blutentnahme bei Mäusen, wie die retrobulbäre Blutentnahme, die Blutentnahme aus dem Venenwinkel, der Vena facialis, der Vena saphena und der Schwanzvene empfohlen. Aus einer früheren Studie (Schlichting et al., 2008) wurde ersichtlich, dass bei einem Vergleich der retrobulbären Blutentnahme mit der Punktion der Vena facialis mit einer animal bleeding Lanzette die retrobulbäre Blutentnahme sowohl bei der Bestimmung der Corticosteron Konzentration, als auch im Verhalten im Open Field Test für das Tier stressärmer ist. In der vorliegenden Studie wurden daher alle von der GVSOLAS empfohlenen Blutentnahmemethoden auf Stress untersucht. Zunächst wurden die Durchführungszeiten der verschiedenen Blutentnahmen analysiert. Dabei ist zu beachten, dass zwei Entnahmemethoden, die retrobulbäre Blutentnahme mit der dünnen Kanüle und die Punktion des Venenwinkels, eine Narkose benötigten. Für die Punktion der Schwanzvene musste die Maus in eine Zwangsröhre verbracht werden. Aus diesem Grund benötigten diese Methoden (retrobulbär dünn: 118,5±24,33 s; Schwanzvene: 117,82±26,71 s; Venenwinkel: 136,75±21,64 s) im Vergleich zu den anderen Methoden mehr Zeit. Bei der Punktion der Vena facialis und der retrobulbären Blutentnahme mit der dicken Kapillare wurden die Tiere lediglich in den 66 Zwangsgriff genommen, um ihnen Blut zu entnehmen. Diese Prozeduren dauerten nur wenige Sekunden (retrobulbär dick: 9,42±1,24 s; Vena facialis: 20,5±11,8 s) und waren somit signifikant schneller als die zuvor erwähnten Methoden. Eine mittlere Position von der Betrachtung der Zeit erreichte die Punktion der Vena saphena (63,17±16,12 s). Dieses Ergebnis in der Durchführungszeit bestätigt das Ergebnis von van Herck et al. (2001). Bei einem Vergleich der Behandlungszeiten dreier Blutentnahme Techniken stellten auch sie fest, dass die retrobulbäre Blutentnahme Methode die schnellste und die Punktion der Schwanzvene die langsamste Methode war. Die Punktion der Vena saphena nahm auch bei dieser Studie zeitlich gesehen die mittlere Position ein. Obwohl bei der Punktion der Vena saphena die Tiere ebenfalls in ein Gefäß, hier ein Falcon Tube, gesetzt wurden und noch das Bein rasiert werden musste, benötigte diese Methode signifikant weniger Zeit als die Punktion der Schwanzvene, bei der das Tier ebenfalls in ein Gefäß (Zwangsröhre) gesetzt wurde. Jedoch musste bei der Punktion der Schwanzvene häufiger nachgestochen werden, da die einmalige Punktion oft nicht ausreichte, um eine Hämatokrit Kapillare zu füllen, wodurch diese Methode mehr Zeit in Anspruch genommen hat. Diese mehrfach Punktionen traten bei allen Methoden auf außer bei der retrobulbären Blutentnahme, sowohl mit dicker, als auch mit dünner Kapillare. Eine weitere Variation der unterschiedlichen Entnahmezeiten kam durch das individuelle Arbeitstempo der Personen, die die Punktionen durchführten, zustande. Jedoch ließ sich diese Variation nicht verhindern, da jede Blutentnahme durch eine geübte Person durchgeführt werden sollte und niemand alle Blutentnahmemethoden perfekt beherrscht. Um den Stress der verschiedenen Entnahmemethoden abzuschätzen, wurde das Verhalten direkt nach der Blutentnahme, die Corticosteron Konzentration und das Verhalten im Open Field beurteilt. Das Verhalten direkt nach der Blutentnahme ergab, dass die Tiere nach der retrobulbären Blutentnahme mit der dicken Kanüle und nach der Punktion der Vena saphena bzw. Schwanzvene fast genauso aktiv waren, wie die Kontrolltiere des Narkoseversuchs, was für Normalverhalten spricht. Diese Tiere schienen direkt nach der Blutentnahme keine Veränderung im Verhalten 67 zu zeigen. Tiere hingegen, bei denen der Venenwinkel bzw. die Vena facialis punktiert wurde, schienen sich weniger zu bewegen und waren insgesamt direkt nach der Blutentnahme wenig aktiv. Die Aktivität scheint nicht mit der Dauer der Blutentnahme zu korrelieren. Man könnte zwar der Meinung sein, je länger eine Blutentnahme dauert, desto mehr Stress müssten die Tiere haben. Dies trifft jedoch nicht zu, da die Blutentnahme aus der Vena facialis eine recht kurze Durchführungszeit hatte, die Tiere dennoch nicht sehr aktiv waren. Als weiterer Parameter zur Beurteilung des durch die Blutentnahme Techniken verursachten Stresses war die Corticosteron Konzentration. Stress hat einen Einfluss auf die Bildung des Corticosterons (Harvey et al., 1980). Außerdem hat Corticosteron im Gegensatz zu Adrenalin und Noradrenalin, welche auch bei Stress im Körper anfluten, einen langsameren Anstieg und erreicht seinen Peak erst nach 15 min (Gartner er al., 1980, Wong et al. 1983, van Herck et al., 1991), wodurch es sich gut als Stressparameter eignet. Bei dieser Betrachtung ergab sich, dass alle Corticosteron Werte nach der Blutentnahme, unabhängig mit welcher Technik durchgeführt, signifikant im Vergleich zu den basalen Werten anstiegen. Somit kann davon ausgegangen werden, dass jegliche Form der Blutentnahme Stress bei der Maus auslöst. Zwischen den Blutentnahme Gruppen ergab sich zwar kein signifikanter Unterschied, tendenziell hatten Tiere nach der Punktion der Schwanzvene, der Vena facialis und des Venenwinkels aber eine höhere Corticosteron Konzentration als die anderen Gruppen. Jedoch lässt sich dieser Unterschied statistisch nicht nachweisen, da einige Werte dieser beiden Gruppen trotz einer hohen Verdünnung über den Messbereich hinausgingen. Da die Standardkurve leicht abknickte, wurden diese hohen Werte bei der Betrachtung der Corticosteron Konzentration nicht mit einbezogen. Um eine genaue Aussage zu treffen, müsste diese Analyse wiederholt werden. Auch im Open Field Test spiegelt sich die Aktivität direkt nach der Blutentnahme wider. Tiere, denen Blut aus dem Venenwinkel und der Vena facialis entnommen wurde, zeigten auch hier ein verändertes Verhalten. So liefen Tiere nach der Punktion des Venenwinkels mit 839,54±371,71 cm die geringste Gesamtstrecke, gefolgt von der Punktion der Vena facialis mit 1225,54±697,78 cm. Tiere nach der Punktion der Schwanzvene legten im Gegensatz dazu die 68 längste Strecke zurück. Dieses Verhalten zeigte sich auch in der gelaufenen Geschwindigkeit. Auch hier liefen die Tiere, denen die Schwanzvene punktiert wurde mit der höchsten Geschwindigkeit mit 7,28±2,16 cm/s und Tiere nach der Punktion des Venenwinkels mit 2,80±1,24 cm/s bzw. der Vena facialis mit 4,09±2,33 cm/s mit eine geringeren Geschwindigkeit. Bei der Betrachtung der Latenzzeit hielten sich die Tiere, denen Blut aus dem Venenwinkel entnommen wurde, statistisch signifikant im Vergleich zu allen anderen Gruppen am längsten in der Mitte auf, bevor sie sich das erste Mal in den Randbereich begaben. Das Verhalten im Open Field ist schwierig zu analysieren. Viele Autoren sind der Meinung, dass Stress im Open Field Test zu einer Reduktion der Bewegungsaktivität führt. Andere Autoren beschreiben, dass vorhergehende Manipulationen des Verhaltens wie Schocks und Angst Konditionierung im Open Field zu einem Anstieg der Aktivität führt (Roth und Katz, 1979). Wenn man wie Quartermain et al. (1996) davon ausgeht, dass Stress zu einer Reduktion der Bewegungsaktivität führt, so zeigten die Tiere nach der Punktion der Vena facialis und nach Punktion des Venenwinkels in dieser Untersuchung ein hohes Maß an Stress. Das manifestiert sich neben dem Open Field Versuch auch in der Aktivität direkt nach der Blutentnahme, welche stark reduziert war. Außerdem war die Corticosteron Konzentration bei diesen Gruppen tendenziell erhöht. Vermutlich liegt diese Reaktion an der Methode selbst. Sowohl bei der Vena facialis, als auch bei der Punktion des Venenwinkels stechen die durchführenden Personen blind. So kann es passieren, dass bei der Blutentnahme aus der Vena facialis der Experimentator in die Massetermuskulatur stechen könnte oder Nerven, die auf der Muskulatur verlaufen, verletzen könnte. Bei der Punktion des Venenwinkels könnten auch andere Gefäße verletzt werden oder gar Lunge oder Herz getroffen werden. Müller (1999) und Meyer-Eilers (2000) fanden bei einer histologischen Untersuchung des Venenwinkels nach mehrfacher Punktion Veränderungen in der Muskulatur (fibrotische Zubildungen, Degenerationen, granulomatöse Entzündungen, Infiltration mit Lymphozyten), im Bindegewebe (Fibrose, granulomatöse Entzündungen) und am Nervengewebe (Degeneration, Infiltration mit Lymphozyten). Dadurch können bei den Tieren starke Schmerzen 69 entstehen, die Rückzugsverhalten und/oder eine verlangsamte Bewegung auslösen (Weiß, 2008; van Zutphen et al., 1995). Wenn man im Gegensatz dazu davon ausgeht, dass Stress zu einer Bewegungssteigerung führt (Katz et al., 1981), könnten auch die Tiere nach der Punktion der Schwanzvene gestresst sein. Sie zeigten wie die Tiere nach der retrobulbären Blutentnahme (dick und dünn) und Tiere nach der Punktion der Vena saphena eine starke Aktivität direkt nach der Blutentnahme. Diese Aktivität hielt jedoch nach der Schwanzvenen Punktion bis zum Open Field Test an, wo sie die längste Gesamtstrecke mit der höchsten Geschwindigkeit zurücklegten. Auch die Corticosteron Konzentration war wie bei der Venenwinkel und Vena facialis Punktion erhöht. Das konnten auch Aasland et al. (2010) zeigen. Sie stellten fest, dass nach der Punktion der Schwanzvene im Vergleich zur Punktion der Vena saphena die Glukose Konzentration im Blut signifikant höher war, was ein Anzeichen für Stress durch die Blutentnahme ist. Dies könnte zum einen daran liegen, dass durch die Blutentnahme am Schwanz Hämatome entstehen (Müller, 1999). Zum anderen wurde das Tier für die Blutentnahme erwärmt, was den Stoffwechsel beeinflusst, wodurch Stress entstehen könnte. Ein weiterer Grund könnte sein, dass die Durchführung der Blutentnahme mit 117,82±26,71 s sehr lang war. Zwar waren auch die Durchfühungszeiten der Punktion des Venenwinkels und die retrobulbäre Blutentnahme mit der dünnen Kapillare sehr lang, jedoch lagen die Tiere bei diesen Methoden in Narkose, bei der Punktion des Schwanzvene wurden sie jedoch in eine Zwangsröhre gesteckt. Zusätzlich wurden die Tiere 10 min vor der Blutentnahme mit einer Rotlichtlampe erwärmt. Die Blutentnahmen aus der Vena saphena und die retrobulbäre Blutentnahme mit dicker bzw. dünner Kapillare scheinen hingegen nicht so starken Stress auszulösen. Die Tiere hatten eine hohe Aktivität direkt nach der Blutentnahme und befanden sich in der Aktivität im Open Field zwischen den beiden Extremen. Auch die Corticosteron Konzentrationen waren niedriger als bei der Punktion der Schwanzvene, der Vena facialis und des Venenwinkels. Bei der Punktion der Vena saphena kann der Experimentator die Vene sehr gut sehen, wodurch eine Verletzung des umliegenden Gewebes gemindert wird. Außerdem wird das Tier weder mit der Hand noch mit der Zwangsröhre fixiert, sondern in 70 ein Falcon Tube gesetzt, wo sich das Tier relativ frei bewegen kann. Dadurch könnte der Stress vermindert sein. Bei der retrobulbären Blutentnahme war die Druchführungszeit extrem kurz bei der dicken Kapillare bzw. das Tier lag bei der dünnen Kapillare in Narkose, wodurch Stress vermieden werden kann. Jedoch weisen Untersuchungen von Meyer-Eilers (2000) histologische Veränderungen an der HARDERschen Drüse und retinale Degenerationen auf. Um eine genauere Betrachtung des durch den einzelnen Blutentnahme Techniken entstehenden Stress zu machen, müsste eine erneute Untersuchung der Corticosteron Konzentrationen erfolgen, da eine bloße Aussage auf Grund von Verhaltensparametern sehr ungenau zu sein scheint. Des Weiteren könnte eine histologische Untersuchung eine Aussage über die Qualität der jeweiligen Blutentnahme Techniken bringen. Diese Studie erfolgt zur Zeit parallel zu dieser Arbeit. Aus der hier vorliegenden Untersuchung lässt sie jedoch schließen, dass jegliche Art von Blutentnahme bei der Maus gemessen an Verhalten und physiologischen Parametern zu Stress zu führen scheint. Des Weiteren lässt sich vermuten, dass durch die Punktion der Vena facialis und des Venenwinkels im Vergleich zu den anderen Methoden die Maus mehr Schmerzen und Stress erleidet. Die Blutentnahme aus der Schwanzvene hat eine lange Durchführungszeit und durch das Erwärmen des Tieres kommt es bei dem Tier ebenfalls zu Stress. Als Blutentnahmemethoden, die den offensichtlich geringsten Stress verursachen, sind die retrobulbäre Blutentnahme mit dicker und dünner Kapillare und die Blutentnahme aus der Vena saphena anzusehen. 71 7. Zusammenfassung Anja Schlichting Stressbelastung durch die von der GV-SOLAS empfohlenen Blutentnahmemethoden bei der Maus Im Rahmen von Tierversuchen gibt es viele Methoden zur Blutentnahme bei Mäusen. Aber nur wenige Studien liegen vor, welche Auswirkungen diese verschiedenen Techniken auf die Maus haben. Zusätzlich wird häufig diskutiert, ob der Einsatz einer volatilen Anästhesie den Stress, der durch die Blutentnahme entsteht, minimiert. Aus diesem Grund wurde in dieser Studie einerseits die Stressbelastung durch verschiedene volatile Narkotika wie Sevofluran, Isofluran, CO2 und Ether untersucht. Andrerseits wurden die von der GV-SOLAS empfohlenen Blutentnahme Techniken (retrobulbär mit dicker und dünner Kapillare, Venenwinkel, Vena saphena, Vena facialis, Schwanzvene) durch erfahrenes Personal durchgeführt, um eine Aussage zu dem dadurch entstehenden Stress für das Tier machen zu können. Dazu wurden insgesamt 132 weibliche Mäuse des Inzuchtstammes BALB/ cOlaHsd getestet, wobei 60 Mäuse (10 pro Gruppe) für den Narkoseversuch und 72 Mäuse (12 pro Gruppe) für den Blutentnahmeversuch eingeteilt wurden. Bei jedem Tier wurde entsprechend der Gruppe Blut genommen bzw. eine Narkose eingeleitet und direkt danach das Verhalten nach der Blutentnahme bzw. nach der Narkose beobachtet. Außerdem wurde die Zeit gemessen, die für die Einleitung der jeweiligen Narkose bzw. für die Durchführung der Blutentnahmen benötigt wurde. Nach 15 min erfolgte nochmals bei allen Tieren retrobulbär eine Blutentnahme, aus welcher die Corticosteron Konzentration als Stressindikator bestimmt wurde. Anschließend wurde das Verhalten im Open Field beobachtet. Bei der Narkose Untersuchung zeigte sich, dass die Einleitungszeit für die CO2 Narkose am kürzesten und für die Ether Narkose am längsten war. Bei der Betrachtung des Verhaltens direkt nach der Narkose zeigte sich, dass alle Tiere, die eine Narkose erhielten, insgesamt signifikant weniger aktiv waren, als Tiere ohne bzw. mit einer Sham Narkose. Auch bei der Betrachtung der Corticosteron Konzentration ergaben sich signifikante Unterschiede zwischen den Werten nach der Narkose im Vergleich zu den basalen Corticosteron 72 Werten. Alle Corticosteron Konzentrationen waren nach der Narkose unabhängig ob Sham, CO2, Sevofluran, Isofluran oder Ether im Vergleich zu den basalen Werten erhöht. Zwischen den Narkosegruppen ergaben sich keine signifikanten Unterschiede. Im Open Field Test zeigten die Tiere jedoch unabhängig davon, welches Anästhetikum verwendet wurde, keine auf die Narkose zurückführbare Veränderung. Somit scheinen also alle in dieser Studie verwendeten volatilen Anästhetika bei den Tieren nur kurzfristig Stress auszulösen. Bei der Untersuchung der Blutentnahme wurden zwei Techniken, die Punktion des Venenwinkels und die retrobulbäre Blutentnahme mit dünner Kapillare, unter einer Ether Narkose durchgeführt. Aus diesem Grund benötigten diese Methoden zusammen mit der Punktion der Schwanzvene, bei der das Tier in eine Zwangsröhre gesetzt wurde im Vergleich zu den anderen Methoden sehr viel Zeit. Bei der Betrachtung des Verhaltens direkt nach der Narkose zeigte sich, dass Tiere, denen Blut aus dem Venenwinkel bzw. aus der Vena facialis entnommen wurde, sich weniger zu bewegen schienen und insgesamt, direkt nach der Blutentnahme, sehr wenig aktiv waren. Alle anderen Gruppen zeigten eine starke Aktivität. An Hand der Corticosteron Konzentration ist deutlich, dass alle Blutentnahmemethoden zu einem Anstieg des Plasma-Corticosterons führte. Zwischen den Gruppen waren die Corticosteron Konzentrationen nach der Punktion des Venenwinkels, der Schwanzvene und der Vena facialis tendenziell erhöht. Dieses Ergebnis spiegelte sich auch im Open Field Test wider, bei dem die Tiere nach der Punktion des Venenwinkels und der Vena facialis sich extrem langsam bewegten, Tiere, denen die Schwanzvene punktiert wurde, zeigten wiederum im Vergleich zur retrobulbären Blutentnahme und zur Punktion der Vena saphena ein hyperaktives Verhalten. Somit lässt sich vermuten, dass durch die Punktion der Vena facialis und des Venenwinkels die Maus mehr Schmerzen und Stress hat. Die Blutentnahme aus der Schwanzvene hat eine lange Durchführungszeit und durch das Erwärmen des Tieres könnte es bei dem Tier ebenfalls zum Stress kommen. Als Blutentnahmemethoden, die den vermeintlich geringsten Stress verursachen sind daher die retrobulbäre Blutentnahme mit dicker und dünner Kapillare und die Blutentnahme aus der Vena saphena anzusehen. 73 8. Literaturverzeichnis 1! ! ! 2! ! Aasland K.E., E. Skjerve und A.J. Smith (2010): Quality of blood samples from the saphenous vein compared with the tail vein during multiple blood sampling of mice. Lab Anim 44(1):25-29. ! Abel H. und H. Bartling (1978): Narkose mit Kohlendioxyd für kurz dauernde Eingriffe bei kleinen Versuchstieren. Zeitschrift für Versuchstierkunde 20:132-136. 3! ! ! Archer R.K. und J. Riley (1981): Standardized method for bleeding rats. Lab Anim 15(1):25-28. 4! ! ! Brown C. (2006): Blood collection from the tail of a rat. Lab Anim (NY) 35(8):24-25. 5! ! ! Candland D.K. und Z.M. Nagy (1969): The open field: some comparative data. Ann N Y Acad Sci 159(3):831-851. 6! ! Conlee K.M., M.L. Stephens, A.N. Rowan und L.A. King (2005): Carbon dioxide for euthanasia: concerns regarding pain and distress, with special reference to mice and rats. Lab Anim 39(2):137-161. ! 7! ! ! 8! Conybeare G, G.B. Leslie, K. Angles, R.J. Barrett, J.S. Luke und D.R. Gask (1988): An improved simple technique for the collection of blood samples from rats and mice. Lab Anim 22(2):177-182. ! Cook D.M., J.W. Kendall, J.P. Allen und L.G. Lagerquist (1976): Nyctohemeral variation and suppressibility of plasma ACTH in various stages of Cushing's disease. Clin Endocrinol (Oxf) 5(4):303-312. 9! ! ! Cook M.J. (1965): The Anatomy of the Laboratory Mouse Academic Press. 10! ! Corbach S. (2006): Untersuchung der CO2-Euthanasie bei Labormäusen auf Tierschutzgerechtigkeit. Dissertation; Tierärztliche Hochschule, Hannover, Institut für Tierschutz und Verhalten. ! 74 11! ! ! Dale O. und B.R. Jr. Brown (1987): Clinical pharmacokinetics of the inhalational anaesthetics. Clin Pharmacokinet 12(3):145-167. 12! ! ! Danzer A. (1984): Verhalten. Stuttgart: Carl Ernst Poeschel Verlag. 13! Diehl, K. H., R. Hull, D. Morton, R. Pfister, Y.Rabemampianina, D. Smith, J. M. Vidal und C. van de Vorstenbosch (2001): A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol 21(1): 15-23. ! ! 14! ! ! 15! ! ! 16! Doi M und K. Ikeda (1993): Airway irritation produced by volatile anaesthetics during brief inhalation: comparison of halothane, enflurane, isoflurane and sevoflurane. Can J Anaesth 40(2):122-126. Drummond J.C., M.M. Todd und H.M. Shapiro (1983): Minimal alveolar concentrations for halothane, enflurane, and isoflurane in the cat. J Am Vet Med Assoc 182(10):1099-1101. ! Fish E.N., M.J. Brown, P.J. Danneman und A.Z. Karas AZ (2008): Anesthesia and Analgesia in Laboratory Animals: American College of Laboratory Animal Medicine Series. 17! ! ! Flecknell P. (2009): Laboratory Animal Anaesthesia: Elsevier-Verlag. 18! ! ! Forth W., D. Henshler und W. Rummel, (2005): Allgemeine und spezielle Pharmakologie und Toxikologie: Elsevier, Urban & Fischer. 19! ! Fowler J.S., J.S. Brown und E.W. Flower (1980): Comparison between ether and carbon dioxide anaesthesia for removal of small blood samples from rats. Lab Anim 14(3):275-278. ! 20! ! 21! ! ! Frink E.J.J., T.P. Malan, M. Atlas, L.M. Dominguez, J.A. DiNardo und B.R. Jr. Brown, (1992): Clinical comparison of sevoflurane and isoflurane in healthy patients. Anesth Analg 74(2):241-245. Gartner, K., D. Buttner, K. Dohler, R. Friedel, J. Lindena und I. Trautschold, (1980): Stress response of rats to handling and experimental procedures. Lab Anim 14(3): 267-274. 75 22! ! ! Golde W.T., P. Gollobin und L.L. Rodriguez (2005): A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY) 34(9):39-43. 23! ! ! Green C.J. (1979): Animal anaesthesia Laboratory Handbooks 24! ! GV-SOLAS (1999): Empfehlung zur Blutentnahme bei Versuchstieren, insbesondere kleinen Versuchstieren. 25! ! GV-SOLAS (2008): Stellungnahme zur retrobulbären Blutentnahme. 26! ! GV-SOLAS (2009): Empfehlung zur Blutentnahme bei Versuchstieren, insbesondere kleinen Versuchstieren. 27! ! ! Harvey S., B.J. Merry und J.G. Phillips (1980): Influence of stress on the secretion of corticosterone in the duck (Anas platyrhynchos). J Endocrinol 87(1):161-171. 28! ! ! Hedrich H.J. (2004): The Laboratory Mouse: Elsevier, Acad. Press. 29! ! ! Hem A., A.J. Smith und P. Solberg (1998): Saphenous vein puncture for blood sampling of the mouse, rat, hamster, gerbil, guinea pig, ferret and mink. Lab Anim 32(4):364-368. 30! ! ! Henschler D. und W. Rummel (1987): Pharmakologie und Toxikologie: Wissenschaftsverlag. 31! ! Hikasa Y., H. Kawanabe, K. Takase und S. Ogasawara (1996): Comparisons of sevoflurane, isoflurane, and halothane anesthesia in spontaneously breathing cats. Vet Surg 25(3):234-243. 32! ! ! Maisack, C., A. Hirt und J. Moritz (2007): Tierschutzgesetz. 2. Auflage Franz Vahlen München. 33! ! ! Hoff J., LVT und RLATG (2000): Methods of Blood Collection in the Mouse. Lab Anim 29(10):47-53. 76 34! ! ! Jilge B. und E. Kunz (2004): Circadian Rhythms of the Mouse. In: The Laboraty Mouse(H. Hedrich, G. B., ed), pp 311-327: ELSEVIER, Academic Press. 35! ! ! Kannan Y. (2005): Neuroendocrine-Immune Network in Stress. In: The Laboratory Mouse(H. Hedrich, G. B., ed), pp 301-309: ELSEVIER Academic Press. 36! ! Katz R.J., K.A. Roth und B.J. Carroll (1981): Acute and chronic stress effects on open field activity in the rat: implications for a model of depression. Neurosci Biobehav Rev 5(2):247-251. ! 37! ! ! 38! ! ! 39! ! 40! ! ! 41! ! ! 42! ! ! Kohler I., R. Meier, A. Busato, G. Neiger-Aeschbacher und U. Schatzmann (1999): Is carbon dioxide (CO2) a useful short acting anaesthetic for small laboratory animals? Lab Anim 33(2):155-161. Kugler J., K.W. Lange und K.T. Kalveram (1988): Influence of bleeding order on plasma corticosterone concentration in the mouse. Exp Clin Endocrinol 91(2):241-243. Madetoja J., M. Madetoja, J. Mäkinen, E. Riuttala und J. Jokinen (2009): Blood Sampling from the Tail Vein, in Comparison with Two Other Techniques, Causes Less Stress to Mice. Scand J Lab Anim Sci 36(2):215-221. Mercier S., F. Canini, A. Buguet, R. Cespuglio, S. Martin und L. Bourdon (2003): Behavioural changes after an acute stress: stressor and test types influences. Behav Brain Res 139(1-2):167-175. Meyer-Eilers S. (2000): Vergleichende histologische Untersuchung nach wiederholter Blutentnahme aus dem retroorbitalen Venenplexus oder aus dem jugularen Venenwinkel bei Mäusen und Ratten. Dissertation, Universität München. Morton D., D. Abbot, R. Barclay, B. Close, R. Ewbank, D. Gask und M. Heath, S. Mattic, T. Poole, J. Seamer, J. Southee, A. Thompson, B. Trussel, C. West und M. Jenning (1993): Removal of blood from laboratory mammals and birds. Laboratory Animals 27:1-22. 77 43! ! Müller B. (1999): Blutentnahme aus dem retroorbitalen Venenplexus, den Schwanzvenen und dem jugularen Venenwinkel bei Ratte und Maus - vergleichende hämatologisch/biochemischie und klinische Untersuchungen. Dissertation, Universität Gießen. 44! ! ! Nickel R., A. Schumacher und E. Seiferle (1984): Lehrbuch der Anatomie der Haustiere. 3.Auflage. Paul Parey, Berlin,Hamburg. 45! ! ! Nobunaga T., K. Nakamura und T. Imamichi (1966): A method for intravenous injection and collection of blood from rats and mice without restraint and anesthesia. Lab Anim Care 16(1):40-49. 46! ! ! Oakley, C. L. und G. H. Warrack (1940): The blood volume of the mouse. The Journal of Pathology and Bacteriology 50(2): 372–377. 47! ! ! Office of Animal Care and Use (2010): Guidelines for Survival Bleeding of Mice and Rats. http://oacu.od.nih.gov/ARAC/. 48! ! ! Otto K. (2004): Anaesthesia, Analgesia and Euthanasia. In: The Laboratory Mouse(H. Hedrich, G. B., ed), pp 555-571: ELSEVIER Academic Press. 49! ! ! Penzlin H. (2004): Lehrbuch der Tierphysiologie. 7. Auflage. Spektrum Verlag. 50! ! ! Pettit A. (1913): Procédé simple pour préveler du sang chez les petit rongeurs. Compt Soc Exp Biol Med 74:11-12. 51! ! ! Phillips W.A., W.W. Stafford und J.J. Stuut (1973): Juglar vein technique for serial blood sampling and intravenous injection in the rat. Proc Soc Exp Biol Med 143(3):733-735. 52! ! ! Quartermain D., E.A. Stone und G. Charbonneau (1996): Acute stress disrupts risk assessment behavior in mice. Physiol Behav 59(3-5):937-940. 78 53! ! Rehbinder C., P. Baneux, D. Forbes, H. van Herck, W. Nicklas, Z. Rugaya und G. Winkler (1996): FELASA recommendations for the health monitoring of mouse, rat, hamster, gerbil, guinea pig and rabbit experimental units. Report of the Federation of European Laboratory Animal Science Associations (FELASA) Working Group on Animal Health accepted by the FELASA Board of Management. Lab Anim 30(3):193-208. 54! ! ! Riches, A. C., J. G. Sharp, D. B. Thomas und S.V. Smith (1973): Blood volume determination in the mouse. J Physiol 228(2): 279-284. 55! ! ! Roth K.A. und R.J. Katz (1979): Stress, behavioral arousal, and open field activity--a reexamination of emotionality in the rat. Neurosci Biobehav Rev 3(4):247-263. 56! ! ! Rusher D.L. und R.W. Birch (1975): A new method for rapid collection of blood from rats. Physiol Behav 14(3):377-378. 57! ! Schlichting A., P.-P. Tsai, H.D. Stelzer und H. Hackbarth (2008): Vergleich der retrobulbären Blutentnahme mit der Punktion der V. facialis im Hinblick auf Tierschutzgerechtigkeit. GV-Solas Tagung Dresden. ! ! 58! ! Schuhr B. (1987): Social structure and plasma corticosterone level in female albino mice. Physiol Behav 40(6):689-693. 59! ! Selye H. (1976): Forty years of stress research: principal remaining problems and misconceptions. Can Med Assoc J 115(1):53-56. ! 60! ! ! 61! ! 62! ! ! Staszyk C., W. Bohnet, H. Gasse und H. Hackbarth (2003): Blood vessels of the rat tail: a histological re-examination with respect to blood vessel puncture methods. Lab Anim 37(2):121-125. Sluiter, W., L. W. Oomens, A. Brand und R. van Furth (1984): Determination of blood volume in the mouse with 51chromium-labelled erythrocytes. J Immunol Methods 73(1): 221-225. Tabata H., T. Kitamura und N. Nagamatsu (1998): Comparison of effects of restraint, cage transportation, anaesthesia and repeated bleeding on plasma glucose levels between mice and rats. Lab Anim 32(2):143-148. 79 63! ! ! Vacha, J. (1975): Blood volume in inbred strain BALB/c, CBA/J and C57BL/10 mice determined by means of 59Fe-labelled red cells and 59Fe bound to transferrin. Physiol Bohemoslov 24(5): 413-419. 64! ! Van Herck H. (1999): Orbital Puncture: a non-terminal blood samling technique in rats. Dissertation, Universität Utrecht. 65! Van Herck H., V. Baumans, C.J. Brandt, H.A. Boere, A.P. Hesp, H.A. van Lith, M. Schurink und A.C. Beynen (2001): Blood sampling from the retro-orbital plexus, the saphenous vein and the tail vein in rats: comparative effects on selected behavioural and blood variables. Lab Anim 35(2):131-139. ! ! 66! ! ! 67! ! Van Herck H., V. Baumans, S.F. de Boer, J. van der Gugten, A.B. van Woerkom und A.C. Beynen (1991): Endocrine stress response in rats subjected to singular orbital puncture while under diethyl-ether anaesthesia. Lab Anim 25(4):325-329. ! Van Herck H., V. Baumans, H.A. van Lith und A.C. Beynen (2000): Is orbital puncture justiflable for collection of non-terminal blood samples from rats? Dissertation, Central Laboratory Animal Institute. 68! ! ! Van Zutphen L.F.M., V. Baumans und A. C. Beynen (1995): Grundlagen der Versuchstierkunde. Enke-Verlag 69! ! ! Wallin R.F., B.M. Regan, M.D. Napoli und I.J. Stern (1975): Sevoflurane: a new inhalational anesthetic agent. Anesth Analg 54(6):758-766. 70! ! ! Weiß J, J. Maeß und K. Nebendahl (2008): Haus- und Versuchstierpflege. 2. Auflage. Enke Verlag. 71! Wong, C.-C., K.-D. Döhler, J. A. Michael, H. Geerlings, R.-D. Hesch, A. von zur Mühlen (1983): Influence of age, strain and season on diurnal periodicity of thyroid stimulating hormone, thyroxine, triiodothyronine and parathyroid hormone in the serum of male laboratory rats. Acta Endocrinologica 102(3): 377-385. ! ! 80 Hiermit bestätige ich, dass ich die vorliegende Arbeit mit dem Titel: Stressbelastung durch die von der GV-SOLAS empfohlenen Blutentnahmemethoden bei der Maus selbstständig verfasst und nur unter Verwendung der angegebenen Hilfsmittel angefertigt habe. Hannover, September 2010 81 9. Danksagung Bedanken möchte ich mich bei Herrn Prof. Dr. Hackbarth für die Bereitstellung und Betreuung des Themas meiner Master Arbeit. Auch Frau Tsai, PhD gebührt großer Dank für die Betreuung dieser Arbeit und die statistische Auswertung. Herrn Helge D. Stelzer möchte ich für die Hilfe bei der Organisation und Durchführung der Versuche herzlich danken. Für die Durchführung der Sevofluran und Isofluran Narkose bedanke ich mich ebenfalls bei Herrn Dr. Haberstroh. Weiterhin bedanke ich mich bei Frau Wühl, Frau Muench-Wuttke, Frau Kuschel, Frau Deutschmann und Herrn Dr. Strauch für die Durchführung der verschiedenen Blutentnahmen. Auch dem Institut für Pharmakologie, insbesondere Herrn Prof. Dr. Bäumer, möchte ich danken, dass es mir ermöglicht wurde meinen ELISA durchzuführen. Meiner Familie und meinem Freund Ansgar möchte ich für die Unterstützung und das Verständnis während der Durchführung dieser Arbeit danken. Besonders Ansgar hat mich dabei immer wieder motiviert. Danke 82