Organische Chemie 1 – Teil 2 - Goethe
Werbung

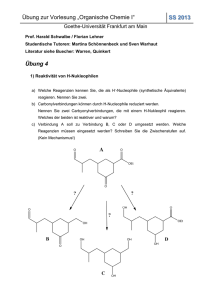
23.06.2015 Inhalte der 4. Vorlesung: 2.1.4 O-Nukleophile 2.1.5 S-Nukleophile 2.1.5.1 Thioalkohole / 2.1.5.2 Natriumhydrogensulfit 2.1.6 N-Nukleophile 2.1.6.1 Primäre Amine/ 2.1.6.2 Sekundäre Amine Organische Chemie 1 – Teil 2 4. Vorlesung Freitag 19.06.2015 Harald Schwalbe Institut für Organische Chemie und Chemische Biologie Goethe Universität Frankfurt Büro: N160 / 3. OG /Raum Nr. 313 Ext. +49 (0)69 / 798-29737 23. Juni 2015 Synthese eines Ketals O TsOH + ROH RO OR Toluol + H2O (Wasserabscheider verschiebt das Gleichgewicht auf die Produktseite) TsOH = para-Toluolsulfonsäure O HO S O Abbildung 49: Synthese eines Ketals mit p-Toluolsulfonsäure als Katalysator 23. Juni 2015 hblhgvfkgcgkh Organische Chemie 1 - Teil 2 - 4.Vorlesung 1 23.06.2015 Acetale als Schutzgruppen O O + OH O TsOH + H2O HO Cyclohexanon Ethylenglykol Abbildung 50: Acetalbildung ist entropisch begünstigt 23. Juni 2015 Organische Chemie 1 - Teil 2 - 4.Vorlesung Acetale als Schutzgruppen + H H - + O O O OH HO O OH + OH HO + H+ OH H2O O H O + O O -H2O O -H+ Abbildung 51: Mechanismus zur Bildung eines Acetals aus Cyclohexanon und Ethylenglykol 23. Juni 2015 hblhgvfkgcgkh Organische Chemie 1 - Teil 2 - 4.Vorlesung 2 23.06.2015 Alkohol Schutzgruppe Tetrahydropyranylethern R THP-Ether Tetrahydropyranylether OH + O RO * O rac Dihydropyran Abbildung 52: Bildung von Tetrahydropyranylethern als Schutzgruppe von Alkoholen 23. Juni 2015 Organische Chemie 1 - Teil 2 - 4.Vorlesung Selektive Reduzierung mit Hilfe von Schutzgruppen a. b. CHO b. O + HOC2H4OH, H * C O O O C H LiAlH4 H COOCH3 CH2OH COOCH3 a. + H /H2O NaBH4 CH2OH COOCH3 CHO CH2OH Abbildung 53: Reaktionswege zur selektiven Reduzierung einer Verbindung mit zwei funktionellen Gruppen. a.) Mit Natriumborhydrid ohne Einführung einer Schutzgruppe b.) Nach der Einführung einer acetalischen Schutzgruppe Behandlung mit Lithiumaluminiumhydrid und anschließender Entschützung. 23. Juni 2015 hblhgvfkgcgkh Organische Chemie 1 - Teil 2 - 4.Vorlesung 3 23.06.2015 Thioalkohol als Schutzgruppe - Dithioacetal O + R BF3·Et2O HS SH (Bortrifluoridetherat) S S H R H Abbildung 54 Reaktion eines Aldehyden mit Propan-1,3-dithiol zu einem Dithioacetal. O O O O H5IO6 (=HIO4+2H2O) 0°C, THF abs. oder Et2O abs. S S O Abbildung 55 Selektive Spaltung einer Dithioacetalgruppe mit Periodatsäure 23. Juni 2015 Organische Chemie 1 - Teil 2 - 4.Vorlesung Folgereaktionen von Thioacetalen S R´ Raney-Nickel Reduktion: R CH R S R´ S Deprotonierung: R S Bu-Li C H R´X R C S S S R´ R´ C R CH 3 O S R Abbildung 56 Verwendung von Thioacetalen in verschiedenen Synthesen. Bei der Reduktion wird eine Carbonylgruppe über ein Thioacetal als Zwischenprodukt zum Alkyl reduziert. Die Reaktion über die Deprotonierung des Thioacetals entspricht der Umpolung einer Carbonylgruppe. 23. Juni 2015 hblhgvfkgcgkh Organische Chemie 1 - Teil 2 - 4.Vorlesung 4 23.06.2015 Natriumhydrogensulfit – Ein kristallisierbares Produkt verdünnte Säure O + Na HSO3 HO SO 3 Produkt kristallisierbar Na Schütteln im Eisbad O Na O O S O HO S O O O Na H Abbildung 57 Bei der Reaktion einer Carbonylverbindung mit Hydrogensulfit entsteht ein kristallisierbares Produkt 23. Juni 2015 Organische Chemie 1 - Teil 2 - 4.Vorlesung Natriumhydrogensulfit unterbindet die Bildung von HCN NaHSO 3 NaCN O O NaHSO 3 Na HO SO 3 HO O ~H + O O S CN Na OH O Na + HSO 3 NC einziges H + Na HO Na2 SO 3 + CN O H CN O S O O 2 Na Abbildung 58 Es ist der Mechanismus der Reaktion von Aceton mit Natriumhydrogensulfit und Natriumcyanid zu Cyanhydrin gezeigt. 23. Juni 2015 hblhgvfkgcgkh Organische Chemie 1 - Teil 2 - 4.Vorlesung 5 23.06.2015 Industrielle Verwendung von Natriumhydrogensulfit O NaHSO 3 H H HO Ethanol SO 3 Na Abbildung 59 Die Umsetzung von Natriumhydrogensulfit mit Formaldehyd liefert ein kristallines Produkt. O O S HO H2N O Na SO3 O S H2N NH2 N H SO3 Na Abbildung 60 Reaktion von Dapson mit Bisulfit 23. Juni 2015 Organische Chemie 1 - Teil 2 - 4.Vorlesung Synthese eines Imins C O + R NH 2 OH H+ -H 2 O C C N R NHR Halbaminal oder Hemiaminal O H+ O HO Imin H+ R N H R H H 2O R N R N H N H H H R C N R - H+ N H - H 2O Abbildung 61 Allgemeine säurekatalysierte Reaktion einer Carbonylverbindung mit einem primären Amin über das Zwischenprodukt des Halbaminals (vgl. Halbacetal) zum Produkt Imin mit Mechanismus 23. Juni 2015 hblhgvfkgcgkh Organische Chemie 1 - Teil 2 - 4.Vorlesung 6 23.06.2015 Vergleich von Acetal- und Imin-Bildung Abbildung 62 Gegenüberstellung der Mechanismen zur Acetal- (links) und zur Iminbildung. 23. Juni 2015 Organische Chemie 1 - Teil 2 - 4.Vorlesung Reaktion von Aminen mit Aldehyd und Keton CHO + H C NH2 N + H2O Abbildung 63 Durch Konjugation wird das gebildete Imin stabilisiert. H 2N OH N OH Hydroxylamin H2N Oxim NH 2 + N NH 2 Hydrazin H2 N H N 23. Juni 2015 hblhgvfkgcgkh N Hydrazon NO 2 O2N N 2,4-Dinitrophenylhydrazin (Derivat des Hydrazin, welches früher in der Analytik verwendet wurde, da sich die Hydrazone gut kristallisieren lassen Abbildung 64 Beispiele weiterer N-Nukleophile und ihrer Produkte aus der Reaktion mit Carbonylverbindungen Organische Chemie 1 - Teil 2 - 4.Vorlesung . 7 23.06.2015 Enol, Enamin und Imin OH NH2 Enol Enamin Abbildung 65 Struktur eines Enols und eines Enamins H N N Enamin Imin Abbildung 66 Imin-Enamin-Tautomerie 23. Juni 2015 Organische Chemie 1 - Teil 2 - 4.Vorlesung Enaminsynthese OH O HO NHR 2 + R 2 NH + H+ ~H + NR 2 NR 2 H2O NR 2 H - H+ Enamin -H 2 O Immonium-Ion Abbildung 67 Mechanismus der säurekatalysierten Enaminsynthese 23. Juni 2015 hblhgvfkgcgkh Organische Chemie 1 - Teil 2 - 4.Vorlesung 8