2.3 Flüssige Kristalle 3. Thermodynamik
Werbung

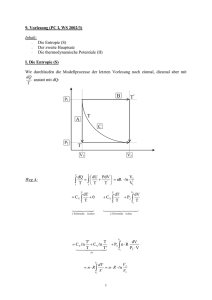
12 Flüssigkeit sofort verschwinden, bei nicht-Newtonschen Flüssigkeiten erhält man exponentielle Abklingkurven, deren Zeitkonstanten u.a. die Länge von Aggregaten in der Lösung zu ermitteln ermöglicht. 2.3 Flüssige Kristalle Bestimmte Substanzen bilden oberhalb vom Schmelzpunkt zunächst trübe Flüssigkeiten aus, die erst bei deutlich höheren Temperaturen klar werden (Klärpunkt). Die trüben Flüssigkeiten sind Flüssigkristalle, in welchen die Moleküle eine gewisse Ordnung ausweisen. Es sind zumeist Moleküle mit einem stäbchenförmigen, starren Mittelteil (z. B. Biphenyle), die an einem oder beiden Enden flexible Gruppen tragen (z.B. aliphatische Ketten). Aus der festen Phase kommend gelangt man bei steigender Temperatur zunächst zu vergleichsweise hochgeordneten smektischenPhasen, die Schichten parallel angeordneter solcher Moleküle enthalten. Cholesterische Phasen entstehen aus Schichten, die Moleküle mit einer Vorzugsrichtung aufweisen, wobei sich diese Vorzugsrichtung mit jeder Schicht um einen bestimmten Winkel verschiebt. Nach einer von diesen Winkel abhängigen Zahl von Schichten liegt wieder die Vorzugsrichtung der untersten Schicht vor (Ganghöhe). Die geringste Ordnung liegt bei nematischen Phasen vor, in denen die länglichen Moleküle zwar eine Vorzugsrichtung aber keine Ordnung senkrecht zu dieser Vorzugsrichtung zeigen. Man kann sich vorstellen, dass in solchen Systemen verschiedene Viskositäten in den drei Raumrichtungen auftreten, die nur mit speziellen Messgeräten gemessen werden können, aber für bestimmte Anwendungen bekannt sein sollten. smektisch cholesterisch nematisch (Abb. aus Wikipedia) Wenn die Moleküle eine gewisse Polarität oder Polarisierbarkeit aufweisen, lassen sich die flüssigen Kristalle im elektrischen Feld ausrichten. So wird bei angelegtem Feld aus einem cholesterischen ein nematischer Flüssigkristall (SCHADT-HELFRICH-Effekt), der dadurch für (linear polarisiertes) Licht durchlässig wird – dieser Effekt ist die Basis für moderne, preiswerte Anzeigegeräte aller Art (Displays). 3. Thermodynamik 3.1 Entropie in der Nähe des absoluten Nullpunkts (3. Hauptsatz) Man erinnere sich an die Definition der Entropie ds = dqrev/T (mit Hilfe des Carnot-Prozesses im Teil I), wobei dqrev in praktischen Fällen durch (cp/T) dT oder (cv/T) dT des untersuchten Stoffes gegeben ist. NERNST fand Anfang des 20. Jahrhunderts, dass die Differenzen der molaren Wärmekapaziäten (Cp oder Cv) zwischen Edukten und Produkten einer Reaktion mit fallender Temperatur immer 13 kleiner wurden. Entsprechend geringer wurden die zugehörigen Reaktionsentropien ∆RS. Er folgerte daraus (insbesondere für die Reaktionen reiner kristalliner Festkörper), dass lim ∆S = 0 (3-1), T →0 dass also die Reaktionsentropie bei Annäherung an den absoluten Nullpunkt gegen Null strebt. Diese Folgerung ist als NERNSTsches Wärmetheorem bekannt. PLANCK überarbeitete dieses und konnte formulieren lim S = 0 (3-2), T →0 also dass die Entropie selbst beim absoluten Nullpunkt (für ideale Festkörper) verschwindet. Dies wird als 3. Hauptsatz der Thermodynamik bezeichnet.3 Dieser Hauptsatz ist problematischer als die ersten beiden. Streng genommen kann die Entropie nur bei ideal kristallisierten Festkörpern verschwinden, bei welchen jedes Atom seinen festen Platz hat. Zahlreiche Stoffe kristallisieren aber nicht ideal (wechselnde Molekülorientierung, Glaszustand) und in der statistischen Thermodynamik verschwindet die Entropie bei kristallisierten Mischelementen wegen unterschiedlicher Anordnungen der Isotope nicht. Der Hauptsatz ermöglicht jedoch die Ermittlung absoluter Entropien nach T T Cp C S (T ) = S (T = 0) + ∫ dT ( bzw. S (T ) = S (T = 0) + ∫ v dT ) (3-3), T T 0 0 weil wir mit dem 3. Hauptsatz S(T=0) = 0 setzen können. Dazu sind – wie im Teil I gesagt – ggf. Phasenumwandlungsentropien und unterschiedliche Werte der Molwärmen (spezifischen Wärmen) Cp und Cv in den verschiedenen Aggregatzuständen zu berücksichtigen. Da Cp und Cv auch innerhalb von Phasenbereichen nicht konstant sind, gelten obige Beziehungen entweder nur für einen eingeschränkten Temperaturbereich oder es muss bei der Integration die Temperaturabhängigkeit der Molwärmen berücksichtigt werden. Bei hinreichend tiefen Temperaturen folgt die Molwärme Cv von perfekten Kristallen (nach einer Theorie von DEBYE) dem folgenden Grenzgesetz (T3-Gesetz) 3 12 π 4 T lim Cv = ⋅ ⋅R. (3-4). T →0 5 Θ Θ heißt charakteristische Temperatur oder DEBYE-Temperatur und hat z. B. für Silber 225 K, für Eisen den Wert 462 K, und für Diamant 1800 K. Damit lassen sich innere Energie U, Entropie S und in der Folge die Freie Energie F bei tiefen Temperaturen berechnen: T T U = ∫ C v dT ; 0 3.2 3 S=∫ 0 Cv dT ; T T F = − ∫ SdT (3-5) 0 Gleichgewichtsbedingungen und maximale Arbeit NERNST erhielt 1920 den Nobelpreis für Chemie in Anerkennung seiner „Arbeiten in der Thermochemie“; PLANCK war bereits 1918/19 für seine Quantentheorie mit dem NP für Physik ausgezeichnet worden. 14 3.2.1 Gleichgewichtskonstanten Während ein Prozess (oder eine Reaktion) abläuft, vermindert sich die zur Verfügung stehende Freie Enthalpie ∆G (Triebkraft) ∂g ∂g dn ∆G = = ∑ ⋅ i = ∑ν i µi dξ i ∂ni p ,T . n i ∂ξ p ,T j (3-6) ständig, bis der Gleichgewichtszustand erreicht ist (∆G = 0, bekannt aus Teil I). Dann hat die Freie Enthalpie bezüglich der Umsatzvariablen (Reaktionslaufzahl) ξ einen Minimalwert erreicht. Infolgedessen ist dort (∂g ∂ξ ) p ,T = 0 und daher auch die Freie Enthalpie ∆G = 0. Die Mengenanteile der Komponenten nehmen dabei feste Gleichgewichtswerte xG,i an. Die entsprechende, in Mengenanteilen geschriebene Gleichgewichtskonstante ist K x ( p, T ) = ∏ (xG,i ) i ν (3-7). Sie ist dimensionslos und hängt von p und T ab. Nur noch von T hängt hingegen die in Gleichgewichtspartialdrücken geschriebene Gleichgewichtskonstante Kp ab: νi νi ∑ν i pG,i p p K p (T ) = ∏ xG, i Θ = ∏ Θ =K x Θ (3-8), p p p die - wie aus Teil I bekannt - mit ∆ R G Θ direkt verknüpft ist (vgl. 5-19, Teil I): ∆ R G Θ = ∑ν i µiΘ (T ) = − RT ln K x − RT ∑ν i ln p Θ p i i (3-9). νi p Θ Θ = − RT ln ∏ xG,i Θ = − RT ln K p (T ) = ∆ R H − T∆ R S p Entsprechend ist auch die in Gleichgewichtskonzentrationen cG,i = pG, i RT (in der Gasphase) ausgedrückte Konstante Kc nur von der Temperatur abhängig und kann dimensionslos definiert werden: ν i pΘ cG,i K c (T ) = ∏ Θ = K p Θ c RT c ∑ν i ∑ p = Kx Θ c RT νi (3-10) Achtung: p⊝ und c⊝ sind hier nicht thermodynamische Standardbedingungen sondern dienen der Korrektur der Dimensionen (also jeweils 1 · Dimension). 3.2.2 Systeme im Gleichgewicht Ein System ist im Gleichgewicht, wenn keine irreversiblen Prozesse mehr ablaufen. Schon im Teil I hat es sich für die Betrachtung nicht isolierter Systeme als zweckmäßig erwiesen, zwischen einem inneren System (Index i) und einem äußeren System (Index a) zu unterscheiden, die zusammen ein Gesamtsystem (ohne Index) bilden. 15 In einem isolierten System ist du = dq – pdv = 0, ferner der Wärmeaustausch mit der Umgebung dq = 0 und deshalb auch pdv = 0, d.h. konstantes Volumen. Darüber hinaus ist dq/T = dsa = 0. Andererseits ist für einen Prozess, also wenn das System noch nicht im Gleichgewicht ist, ds = dq/T + dsi = 0 + dsi ≥ 0 und deshalb dsi ≥ 0. Damit wird der erste Hauptsatz zu du = 0 = Tds – Tdsi – pdv ≤ Tds – pdv, (3-11) (für isolierte Systeme) wobei sich das Gleichheitszeichen auf den thermodynamischen Gleichgewichtszustand bezieht. Im Gleichgewicht laufen keine irreversiblen Prozesse mehr ab, d.h. dsi = 0 und auch ds = 0. Da dsi generell nur positiv sein kann, bedeutet dies, dass im Gleichgewicht die Entropie s einen Maximalwert und die innere Energie u ein Minimum hat. Letzteres gilt auch für die Enthalpie wegen dh = Tds – Tdsi + vdp. Natürlich vorkommende Prozesse im isolierten System werden also immer von einer Entropie-Erhöhung und einer Energie- bzw. Enthalpie-Erniedrigung begleitet. Wie oben gezeigt, treten hier u und h als Funktionen von s und v bzw. s und p auf, was für Anwendungen auf adiabatische Prozesse praktisch ist, weil dann (im Gleichgewicht) ds = 04 . Für isotherme Prozesse (geschlossenes System) ist es hingegen zweckmäßiger, die Größen Freie Energie f (HELMHOLTZ-Energie) und Freie Enthalpie g zu gebrauchen: f = u – Ts; g = h – Ts; df = Tds – Tdsi – pdv – Tds – sdT = – sdT – pdv – Tdsi dg = Tds – Tdsi + vdp – Tds –sdT = – sdT + vdp – Tdsi (3-12) Damit erhält man Gleichgewichtsbedingungen für isotherme, isochore und isobare Systeme, in denen die Freie Enthalpie g bzw. die Freie Energie f ein Minimum annimmt. Sinnvoll ist die Verwendung von g für Festkörper oder Flüssigkeiten bei isothermen und isobaren Prozessen, die Verwendung von f für Gase (in geschlossenem Gefäß) bei isothermen und isochoren Prozessen. 3.2.3 Maximale Nutzarbeit Bei isothermen Prozessen ist df = – pdv – Tdsi = da – Tdsi ≤ da. Im Fall des reversiblen isothermen Prozesses ist dsi = 0 und df = darev. Die Größe ∆f = – arev bezeichnet daher den Maximalwert der Arbeit, die ein System überhaupt abgeben kann (Maximale Nutzarbeit, engl. „work function“, „maximum work function“). Diese maximale Nutzarbeit kann größer sein als du, wenn ds positiv ist wie bei chemischen Reaktionen, die unter Volumenvergrößerung ablaufen. Ein Beispiel ist die Verbrennung von Isooctan (2,2,4-Trimethylpentan) C8H18(gas) + 12,5 O2 → 8 CO2 + 9 H2O (gas). Bei 298 K und 1 bar ist ∆U = –5108 kJ/mol und ∆S = 0,422 kJ/(mol K), so dass ∆F(298 K) = (–5109 – 298·0,422 = –5235) kJ/mol. ∆F gibt den Maximalwert der zu erhaltenden Nutzarbeit an. Tatsächlich aber ist bei der Verbrennung von Isooctan in einer Kalorimeterbombe die Nutzarbeit Null (Volumen konstant). In einem gängigen Verbrennungsmotor erhält man etwa 1000 kJ/mol und in einer Brennstoffzelle ca. 3000 kJ/mol. Der Gesamtbetrag der Erniedrigung der Freien Energie ist jedoch nicht 4 Man mache sich klar, dass z.B. beim Carnot-Kreisprozess die adiabatischen Teilschritte bei konstanter Entropie ablaufen. 16 in praktischer Weise aus der Benzinverbrennung zu erhalten, da hierbei 1. alle Reibungsverluste in Getrieben usw. ausgeschaltet werden müssten und 2. die Verbrennung unendlich langsam zu erfolgen hätte (reversibler Prozess). 3.2.4 Zusammenhang zwischen thermodynamischen Potenzialen Die zum Teil bereits mehrfach verwendeten und für reversible Prozesse geltenden (wegen dsi = 0) Beziehungen (3-13) bis 3-16) du = Tds – pdv = (∂u/∂s)v ds + (∂u/∂v)s dv dh = Tds + vdp = (∂h/∂s)v ds + (∂h/∂p)s dp df = –sdT– pdv = (∂f/∂T)v dT + (∂f/∂v)T dv dg = –sdT + vdp = (∂g/∂T)p dT + (∂g/∂p)T dp (3-13) (3-14) (3-15) (3-16) kann man sich entweder jeweils klarmachen oder ihre Aufstellung mit Hilfe eines Merkschemas vornehmen: + – s u v h f p g T Hierzu ein Merkvers: schöne und vornehme frauen Tragen große prächtige hüte Das Prinzip des Merkschemas ist, dass die Energiegrößen jeweils zwischen den Variablen stehen (mit Vorzeichen), von denen sie abhängen, und die dann noch mit den diagonal dazu stehenden Größen zu multiplizieren sind, z.B. du = + Tds –pdv (wie 3-13). Alle thermodynamischen Potenziale sind Zustandsfunktionen, so dass die gemischten 2. Ableitungen gleich sind (MAXWELLsche Beziehungen): ∂T ∂p Für u nach (3-13): = − , ∂v s ∂s v ∂T ∂v für h nach (3-14): = , ∂p s ∂s p ∂s ∂p für f nach (3-15): = , ∂v T ∂T v ∂s ∂v für g nach (3-16): = − . ∂T p ∂p T Für solche Beziehungen gibt es zahlreiche Anwendungen, etwa die Beschreibung des JOULETHOMSON-Effekts bzw. -Koeffizienten (s. oben und Lehrbücher). Entsprechend ergeben sich die in den Ecken des Merkschemas stehenden Größen als partielle Ableitung des jeweils schräg gegenüberstehenden thermodynamischen Potenzials nach der diagonal gegenüberstehenden Größe: ∂u ∂h ∂f ∂g T = = ; s = − = − ∂s v ∂s p ∂T v ∂T p vgl. 3-13 bis 3-16 (s. auch 3-44, 3-45 in Teil I). ∂h ∂g ∂u ∂f p = − = − ; v = = ∂v s ∂v T ∂p s ∂p T 17 3.3 Mischphasen 3.3.1 Partielle molare Größen Die Erfahrung zeigt, dass extensive Zustandsgrößen nicht immer additiv sind. Z.B. machen ca. 20-%-ige Schnäpse immer einen öligen Eindruck. Hier liegt ein Dichtemaximum für Mischungen aus Ethanol und Wasser vor. Deren Mischungen weisen in diesem Zusammensetzungsbereich immer ein Volumen auf, das kleiner ist als die Summe der Einzelvolumina. Es ist daher zweckmäßig, partielle molare Größen zu definieren, etwa ∂v Vi = (3-17) ∂ n i p ,T , n j Partielle Volumina können sogar negativ (MgSO4 in Wasser) oder Null (Eier im Eierkarton) sein. Hält man die Zusammensetzung konstant, so folgt wegen der Extensivität von v aus dv = Σ Vi dn i (3-18), v = Σ Vi n i (3-19). dass Bildet man das Differential, so ergibt sich jedoch dv = ΣVi dni + Σni dVi. Das kann nur richtig sein, wenn Σ n i dVi = 0 (3-20) (vgl. GIBBS-DUHEM-Gleichung, Anhang 2). Hieraus folgt, dass die partiellen Volumina nicht alle unabhängig voneinander sind: Im binären System (Zweistoff-System) ist n 1 dV1 = –n 2 dV2 (3-21). Zur experimentellen Bestimmung von Partialvolumina kann allgemein die Definitionsgleichung (3-17) dienen. Für binäre Mischungen existiert eine genauere Methode, die von dem mittleren Molvolumen V = v = x1V1 + x 2V 2 = (1 − x 2 )V1 + x 2V 2 n1 + n 2 (3-22) ausgeht, woraus folgt, dass ∂v ∂V = V + (n1 + n 2 ) V1 = ∂n1 n2 ∂n1 n2 (3-23). Da ∂V dV = ∂ n 1 dx 2 ∂x 2 dV = ∂n1 n2 dx 2 erhält man aus (3-23) n2 − (n + n ) 2 1 2 (3-24), 18 dV dx 2 das ist die Gleichung einer Geraden. V1 = V − x 2 (3-25), Bestimmt man also das mittlere Molvolumen als Funktion von x2, so erhält man die Partialmolvolumina als Achsenabschnitte einer Tangente an die Kurve (s. Skizze). 3.3.2 Mischungsentropie Das chemische Potenzial eines reinen (Index 0) idealen Gases ist gegeben durch p (3-26), pΘ wobei sich µiσ hier auf einen Normaldruck bzw. Standarddruck (1 bar oder 1 atm) bezieht (zum ln-Term vergl.Teil I, Gl. (5-12)). In einer Mischung von idealen Gasen sind die Mengenanteile xi der Komponenten mit dem Partialdrücken pi und dem Gesamtdruck p durch pi = xi p ((2-5) in Teil I) verknüpft, und das chemische Potenzial der Komponente i in der Mischung ist µ 0i = µiΘ (T ) + RT ln µ i ( p, T , x i ) = µ iΘ (T ) + RT ln pi = µ 0i ( p, T ) + RT ln x i pΘ (3-27) Für xi = 1 ergibt sich das chemische Potenzial des reinen Stoffs. Bei sich nicht ideal verhaltenden Gasen führt man die Aktivität ai ein (vgl. Teil I, Kap. 5.2). Sie bezeichnet einen um die Abweichung von der Idealität korrigierten Stoffmengenanteil: ai = ϕi · xi (ϕi : Aktivitäts- oder Fugazitätskoeffizient5). Damit wird µ i = µ 0i + RT ln ai (3-28) (Erinnerung: So definiert ist die Aktivität dimensionslos und ohne Trick zu logarithmieren.) Entfernt man in einem System mit zunächst getrennten Gasen A und B die Trennwand, so tritt spontane Durchmischung ein, verbunden mit einer Erhöhung der Entropie und einer Erniedrigung der Freien Enthalpie. Es gilt im System mit getrennten Gasen g0 = nA µ 0A + nBµ 0B und nach der Durchmischung gm = nA µ A + nBµ B. Entsprechend ist die Freie Mischungsenthalpie ∆g m = g m − g 0 = n A ( µ A − µ 0 A ) + n B ( µ B − µ 0 B ) = n A RT ln x A + n B RT ln x B = (n A + n B ) RT ( x A ln x A + x B ln x B ) (3-29) Wegen 0 ≤ xi ≤ 1 ist ∆gm < 0. Allgemein lässt sich der Effekt der Mischung von idealen Gasen auf den Zahlenwert der Freien Enthalpie wie folgt ausdrücken 5 In diesem Text wird unterschieden fi: Aktivitätskoeffizient bei kondensierten Mischungen, ϕi: Fugazitäts- oder Aktivitätskoeffizient bei Gasen (Dämpfen); γi: Ionenaktivitätskoeffizient; Aktivitäten immer a1. 19 ∆g m = (∑ ni )RT ∑ xi ln xi (3-30) Daraus folgt für die Mischungsentropie ∂∆g m (3-31) ∆sm = − = − (∑ ni )R ∑ xi ln xi > 0 ∂T p , ni Für binäre Mischungen (idealer Gase) durchlaufen ∆gm ein Minimum und T∆sm ein Maximum als Funktion von x, jeweils bei xi = 0,5. ihre Summe ist jeweils = 0. Deshalb verschwindet die Mischungsenthalpie ∆hm für ideale Mischungen: ∆hm = ∆gm + T∆sm = 0 (3-32), im realen Fall erhält man jedoch ∆gm = (Σni) RT Σxi ln ai = (Σni) RT Σxi ln ϕixi (3-33). Die Differenzen zwischen diesen Größen und denen für die idealen Systeme werden als Exzess-(Zusatz-, Überschuss-)Größen bezeichnet; z.B. ist die Freie Exzess-Enthalpie ∆gE = ∆gm – id∆gm = (Σni) RT Σxi ln ϕi (3-34). Die Exzess-Enthalpie ist identisch mit der experimentell bestimmbaren Mischungsenthalpie (Mischungs- bzw. ggf. Lösungswärme) ∂∆g E ∆hE = ∆g E + T∆sE = ∆g E − T ∂T p , ni ∂ ln ϕ i = − (∑ ni )RT 2 ∑ xi ∂T p , ni (3-35). = ∆g m + T∆sm = ∆hm 3.4 Grenzflächen In belebten Natur und in der modernen synthetischen Chemie sowohl im Forschungslabor als auch in der technischen Umsetzung laufen die meisten Reaktionen an Grenzflächen ab (Membranen, Katalysatoren). Kenntnisse über die Thermodynamik von Adsorption und Desorption, Benetzung, Schichtbildung, Keimbildung, usw. sind deshalb in Verbindung mit der zugehörigen Kinetik und Analytik unverzichtbares Rüstzeug eines Chemikers. An der Grenzfläche zwischen zwei Phasen unterliegen die Moleküle einseitigen Anziehungskräften und haben daher eine andere Energie als die Moleküle innerhalb der Phase. Bei makroskopischen Körpern ist die Zahl der Grenzflächenmoleküle klein gegenüber der Gesamtzahl der Moleküle des Körpers und man kann die Energieunterschiede meist vernachlässigen. Oberfläche O und Volumen stehen jedoch nicht in einem festen Verhältnis. Wird bei konstanter Gesamtmasse der Körper immer mehr zerkleinert, so vergrößert sich die Oberfläche gewaltig. Beispiel: Ein kubischer Kristall mit 1 cm Kantenlänge bestehe aus Atomen von 0,2 nm 20 Durchmesser; entlang einer Kante befinden sich 5·107 Atome, insgesamt sind 125·1021 Atome im System. An der Oberfläche befinden sich dann 6·(5·107)2 = 1,5·1016 Atome entsprechend 1,2·10-5 % der Gesamtzahl. Zerkleinert man den Kristall in Würfelchen von 0,1 µm = 10-5 cm Kantenlänge, so ist die Zahl der Atome an der Oberfläche aller 1015 Kristallite nunmehr 6·5002 1015 = 1,5·1021 entsprechend 1,2 %. 3.4.1 Thermodynamische Größen der Grenzflächenchemie 3.4.1.1 Einkomponentensysteme (Oberflächenspannung und Keimbildung) Das Zerkleinern eines solchen Kristalls erfordert die Zufuhr von mechanischer Arbeit. Allgemein wird die Energie eines Systems erhöht, wenn die Oberfläche um den Betrag dO vergrößert wird, so dass man schreiben muss dg = vdp − sdT + γdO dh = Tds + vdp + γ dO du = Tds – pdv + γ dO df = –sdT – pdv + γ dO (3-36) Die Größe ∂g ∂u ∂h ∂f = = = ∂O p ,T ∂O s ,v ∂O s , p ∂O T ,v γ = (3-37) heißt Oberflächenspannung oder Oberflächenarbeit und ist immer positiv. Sie wird in J/cm2 oder mN/m (Milli-Newton pro Meter)angegeben. K dx l Dass die Oberflächenarbeit ein reversibler Arbeitsbetrag ist, ergibt sich aus dem Bügelversuch. Um eine Flüssigkeitslamelle im Gleichgewicht zu halten, muss eine Kraft K aufgewendet werden. Zur Verschiebung des Bügels um eine Strecke dx muss die reversible Arbeit da = Kdx = γdO = γ·2·ldx (3-38) aufgewendet werden, d.h. γ = K / (2 l). (3-39) Für die nachfolgende Betrachtung, bei der p und v konstant gehalten werden, ist es zweckmäßig, die Freie Energie f = u – Ts (auch Helmholtzenergie genannt) zu verwenden. Gleichzeitige Änderung von Volumen und Oberfläche Wird ein Dampf kondensiert (Tröpfchenbildung) bzw. in ein Gefäß mit gekrümmten Grenzflächen (Kapillarsystem) einkondensiert, so treten Oberflächen und Volumenänderungen gleichzeitig auf. Hierzu das skizzierte Gedankenexperiment: Zufuhr der Arbeit da durch Bewegung des Kolbens im linken Zylinder nach rechts bewirkt eine reversible Änderung der Oberfläche und der beiden Volumina vg und vfl, dann ist da= – pfldvfl – pgdvg + γdO (3-40). Aus dem ersten Hauptsatz du = dq + da und der Definition der Freien Energie f erhält man 21 df = – sdT – pfldvfl – pgdvg + γdO (3-41). (und entsprechende Beziehungen für dh und dg). Im Gleichgewicht fl ⇌ g hat die Freie Energie ein Minimum und bei konstanter Temperatur ist df = 0 = – pfldvfl – pgdvg + γdO (3-42). Bei konstantem Gesamtvolumen ist dvg = – dvfl und daher (pfl –pg)dvfl = γdO (3-43). Bei Flüssigkeiten mit ebenen Oberflächen, die sich in zylindrischen Gefäßen befinden, bewirkt eine Ausdehnung dvfl der flüssigen Phase auf Kosten der Gasphase keine Veränderung der Oberfläche O; d.h. dO = 0 und daher ist auch pfl = pg. Ist jedoch die Flüssigkeit ein kugelförmiges Tröpfchen vom Radius r, so gilt dvfl = 4πr2dr und dO = 8πrdr, so dass pfl − pg = γ dO 2γ = r dvfl (3-44), d.h. der Druck im Tropfen ist größer als in der Gasphase und der kleine Tropfen ist nur existent, weil die Oberflächenspannung wie eine Membran um den Tropfen wirkt. Für den Stoffaustausch zwischen den Phasen (Verdampfung bzw. Kondensation) gilt im Gleichgewicht µfl = µg und dµfl = dµg . Wegen dµ = − SdT + Vdp (3-45) ist bei konstanter Temperatur Vfl dpfl = Vg dpg (3-46) und aus (3-44)) folgt Vg 1 d( pfl − pg ) = − 1dpg = 2γd (3-47) r Vfl Da Vg >> Vfl, kann Vg bei Gültigkeit des idealen Gasgesetzes ersetzt werden: RT 1 Vg 2γd = dp g = dp g Vfl pg r Vfl (3-48). Integration von p0 (Dampfdruck bei ebener Oberfläche, d.h. 1/r → 0) bis p ergibt 2γ RT p = ln r Vfl p0 bzw. ln p 2γ Vfl = ⋅ p0 r RT (3-49) 22 d.h. der Dampfdruck p eines kleinen Tröpfchens ist größer als der über einer ebenen Flüssigkeitsoberfläche und sehr kleine Tröpfchen sind unstabil (s. u.). Ähnliches gilt für die Kristallisation/Löslichkeit kleiner Festkörperteilchen. Keimbildung Die Bildung einer neuen Phase, z.B. beim Kristallisieren von Festkörpern aus Flüssigkeiten, Kondensieren von Flüssigkeiten aus Dämpfen usw., verläuft über kleine Molekülaggregate („Keime“). Erfahrungsgemäß findet Keimbildung nur statt, wenn eine gewisse Übersättigung vorliegt. Sehr reines Wasser kann z.B. ohne weiteres auf –40 °C unterkühlt werden, bevor spontane Kristallisation einsetzt. Die Ursache für dieses Verhalten ist die geringe Stabilität der kleinen Molekülaggregate. Die Aggregation von Molekülen eines übersättigten Dampfes D zu einem Keim K (Flüssigkeitströpfchen) D ⇌ K ist mit einer Änderung der Freien Enthalpie verbunden, die sich bei konstanter Temperatur durch dg = v dpD + (vK dpK ) + γdO (3-50) ausdrücken lässt, wobei vD und vK die Volumina von Dampf und Keim bezeichnen und vK gegenüber v vernachlässigt werden kann. Entsprechend sind pD und pK die (im allgemeinen verschiedenen) Drücke im Dampf und im Keim. O ist die Oberfläche des Keims und γ die Oberflächenspannung. Wenn sich der Dampf ideal verhält, und wenn der Keim die Form eines kugelförmigen Tröpfchens vom Radius r hat, gilt für die Kondensation von n Mol Dampf p ∆g = − n RT ln D + 4 πr 2γ (3-51), pK wobei der zweite Term in (3-81) wegen vK << vD vernachlässigt wurde. Drückt man n durch das Molvolumen VK der Keimphase aus, so wird 4 πr 3 p ∆g = − RT ln D + 4 πr 2γ (3-52) 3 VK pK =n Im Fall der Übersättigung ist pD > pk und ∆g(r) durchläuft ein Maximum, das zu einem kritischen Tröpfchenradius rc gehört, und zwar erhält man aus (3-63) für d∆g = 0 die Beziehung rc = mit 2γ VK RT ln( pD / pK ) (3-53) 4 2 π rc γ 3 (3-54). ∆g max = Das Maximum in der Kurve ∆g = f(r) folgt auch, wenn man die Gibbs-Helmholtz-Gleichung ∆g = ∆h – T ∆s + γ∆O (mit Berücksichtigung der Oberflächenänderung) ansetzt. ∆O ist zu Beginn der Kondensation so groß, dass ∆g positiv ist; wird dann bei wachsendem r kleiner und verschwindet schließlich bei sehr großen r entsprechend einer (praktisch) ebenen Grenzfläche. Die Kurve schwenkt dann in einen negativen konstanten ∆g-Wert für die Kondensation ein. 23 Beispielsweise wird für Wasserdampf von 0 °C und pD/pK = 4 mit Hilfe von (3-53) ein kritischer Wert rc = 0.83 nm berechnet, der einem Keim von 90 Wassermolekülen entspricht. Für r < 3rc/2 ergibt sich aus (3-54) mit (3-53) dass ∆g > 0. Keime dieser Größe sind daher nicht stabil und können unter Erniedrigung der Freien Enthalpie wieder zerfallen; an größeren Keimen, für die < 0 ist (d.h. r > r0 = 3rc/2), verläuft die Kondensation dagegen spontan, bis ein Gleichgewichtszustand erreicht ist. Setzt man (3-53) in (3-54) ein 16π γ 3 V 2 ∆g max = (3-55), 3 [ RT ln( pD / pK )]2 so ergibt sich, dass ∆gmax durch Erhöhung der Übersättigung pD/pK herabgesetzt werden kann. Damit erhöht sich auch die Geschwindigkeit der Keimbildung, die insbesondere von der thermischen Wahrscheinlichkeit der kritischen Keime abhängt (und mit der statistischen Theorie6 von Becker und Döring berechnet werden kann; Ann. Phys. 24 (1935) 719; s. auch Bradley, Quart.Rev. 5 (1951) 315). 3.4.1.2 Mehrkomponentensysteme (GIBBS-Adsorptionsisotherme) Bei jedem Zweiphasensystem kann man drei Bereiche unterscheiden: zwei homogene Phasen α und β und eine Zwischenphase, in der die Eigenschaften der einen Phase kontinuierlich in die der anderen übergehen. Um die Eigenschaften der Zwischenphase genau zu beschreiben, müsste ihre Zusammensetzung bekannt sein. Im Allgemeinen hängen die Konzentrationen der Komponenten in der Zwischenphase empfindlich von der Lage der Begrenzungen der Zwischenphase gegenüber den beiden homogenen Phasen ab. Da es unmöglich ist, diese Begrenzungen mit der erforderlichen Genauigkeit (Bruchteile von nm) festzulegen, geht man in der Thermodynamik von einem phänomenologischen Modell aus, nach dem eine streng 2-dimensionale Fläche das gesamte Volumen in zwei Anteile unterteilt: v = vα + vβ (3-58) Für jede Komponente i definiert man Mengen nαi = cαi vα ; nβi = cβi vβ (3-59) durch die Konzentrationen cαi und cβi im Inneren der homogenen Phasen α und ß. Damit das Modellsystem mit dem realen übereinstimmt, muss die Gesamtmenge der Komponente i durch ni = nαi + nβi + nOi (3-60) gegeben sein, wobei nOi eine Überschussgröße bezeichnet, die der Fläche O zugeordnet ist. Je nachdem, ob in der Zwischenphase eine Anreicherung oder Verarmung der betreffenden Komponente stattfindet, ist nOi positiv oder negativ (seltener = 0). Davon abgeleitet ist die Oberflächenkonzentration (auch„Adsorption“ genannt) Γ i = nOi / O (in mol/cm2) (3-61) die ebenfalls eine Überschussgröße bezeichnet. Analog definiert man Oberflächenenergie, -entropie, usw. durch 6 Siehe Anhang 2 24 uO = u − uα − u β ; uβ = U β vβ usw. sO = s − sα − s β usw.; daher folgt für dp = 0 dgO = − sO dT + γdO + ∑ µi dnOi (Im Gleichgewicht ist µ Oi = µ αi = µ βi = µ i). Bei konstanter Temperatur ist dg O = γ dO + ∑ µ i dnOi und g O = γO + ∑ µi nOi Differentialbildung führt zu dgO = γ dO + O dγ + ∑ µ i dnOi + ∑ nOi dµ i bzw. (analog zur GIBBS-DUHEM-Gleichung7) O dγ + ∑ nOi dµi = 0 = O dγ + ∑ O Γ i dµi Dividiert man durch O, so wird dγ = − ∑ Γ i dµ i GIBBSsche Adsorptionsgleichung (3-62) (3-63) (3-64) (3-65) (3-66) (3-67) (3-67) (3-69) bzw. für zwei Komponenten dγ = − Γ 1 dµ1 − Γ 2 dµ 2 (3-70). Wegen der Gibbs-Duhem-Gleichung ∑ ni dµ i = 0 (3-71) können µ 1 und µ 2 nicht unabhängig voneinander variiert werden ( dµ1n1 = −dµ2 n2 ). Man schreibt daher dµ1 = −dµ2 n2 / n1 ≈ −dµ2 c2 / c1 (3-72), so dass nach (3-70) c dγ = − Γ 2 − Γ 1 2 dµ 2 c1 (3-73) Der Ausdruck Γ 2,1 = Γ 2 − Γ 1 ∂γ c2 = − c1 ∂µ 2 T (3-74) bezeichnet daher eine relative Oberflächenkonzentration. Für ideale Lösungen gilt µ 2 = µ 2o + RT ln c2 / c Θ (3-75) und man kann relative Oberflächenkonzentrationen aus der Konzentrationsabhängigkeit der Oberflächenspannung bestimmen nach Γ 2,1 = − 7 Siehe Anhang 3 1 RT ∂γ o ∂ ln c / c 2 T (3-76). 25 Es folgt unmittelbar, dass Substanzen, die die Oberflächenspannung herabsetzen (oberflächenaktive Substanzen) in der Grenzschicht angereichert sind (Γ2,1 > 0). In praktischen Fällen ist die Komponente 1 das Lösemittel und die Komponente 2 ein gelöster Stoff, z.B. ein Spülmittel (Tensid) in Wasser. Die Phasengrenzfläche zwischen Lösung und Luft ist in guter Näherung so zu definieren, dass sich für Wasser keine Überschusskonzentration ergibt. Dann ist Γ1 = 0 und Γ2,1 = Γ2. Gl. (3-69) ist eine rein thermodynamische Beziehung und gilt daher streng. Dennoch ist eine Überprüfung reizvoll, und die dazu angestellten Experimente haben wesentlich zum Verständnis der Anreicherung von oberflächenaktiven Substanzen in Grenzschichten beigetragen. Drei brauchbare Methoden: – Abscheren von Grenzschichten mit Mikrotomen und Analyse – Ellipsometrie (Änderung des Polarisationszustands von Licht bei Refexion oder Transmission) – Verwendung von Substanzen, die mit Atomen wie 14C, 35S usw. markiert sind, deren weiche β-Strahlung eine Reichweite von der Größenordnung der Grenzschichtdicke hat, z.B. 3.4.2 Adhäsion und Kohäsion von Flüssigkeiten, Spreitprozesse Ein quantitatives Maß für die Adhäsion einer Flüssigkeit B an einer Flüssigkeit A ist die Oberflächenarbeit ∆aBA, die verrichtet werden muss, um die Flüssigkeiten von einander zu trennen. Dabei entstehen zwei neue, gleich große Oberflächen ∆O der Flüssigkeiten gegen Luft: ∆a BA = (γ A + γ B − γ BA ) ∆O (3-77) (∆aBA ist die Adhäsionsarbeit, γ jeweils gegen Luft gemessen) Ist B = A, so erhält man wegen γ AA = 0 die Kohäsionsarbeit: ∆a AA = 2γ A ∆O (3-78), die bei der Trennung eines Flüssigkeitsvolumens in zwei Teile aufzubringen ist. Beim Spreiten von B auf A findet eine spontane Ausbreitung eines zunächst aufgebrachten dicken Tropfens statt. Bei konstanten Werten von Druck und Temperatur gilt für die mit dem Spreiten verbundene Änderung der Freien Enthalpie des Gesamtsystems dg = γ A dOA + γ B dOB + γ BA dOBA (3-79). Da sich die Oberfläche von B gegenüber Luft und gegenüber A auf Kosten der Oberfläche von A (gegenüber Luft) vergrößert, gilt dOB = dOBA = −dOA = dO und (3-80) 26 − ∆g = (γ A − γ B − γ BA ) ∆O = SBA ∆O (s. A. W. Adamson, Physical Chemistry of Surfaces, Kap. IV). (3-81) Der Spreitungskoeffizient SBA ist daher positiv, wenn Spreiten spontan erfolgt. In diesem Fall ist die Adhäsion von B und A größer als die Kohäsion von B: SBA = (∆aBA – ∆aBB)/∆O (3-82) Die Spreitung unterscheidet sich prinzipiell von der Anreicherung einer oberflächenaktiven Substanz in der Grenzfläche (siehe oben), weil sich B in der unteren Phase A nicht löst oder nur in einer sehr kleinen aber konstanten Konzentration vorliegt. Wenn sich B und A etwas ineinander lösen, ist im allgemeinen SB(A)A(B) ≠ SBA. So findet man, dass Benzol auf Wasser zunächst spreitet, weil SBA > 0; anschließend zieht sich das aufgetropfte Benzol zu einer Linse an der Wasseroberfläche zusammen, weil SB(A)A(B) < 0. 3.4.2.1 Monoschichten Die Spreitung tritt bei schwer löslichen Substanzen auf, die einen dünnen Film auf der Oberfläche einer Flüssigkeit (oder einer anderen Unterphase) bilden. Die Oberflächenkonzentration ist hier unmittelbar durch die auf die Flächeneinheit aufgegebene Substanzmenge definiert und daher nicht besonders interessant. Wichtiger ist die Herabsetzung der Oberflächenspannung durch die bedeckende Schicht, die bei Destillationsvorgängen, bei der Flotation und bei Waschprozessen (Verhinderung der Schaumbildung!) eine praktische Rolle spielt. Auch die Bildung eines Flüssigkeitsfilms auf Schleimhäuten gehört hierher. Typischer Vertreter dieser Substanzklassen sind die höheren Fettsäuren und -alkohole, die sich über eine beliebig große Wasseroberfläche spontan ausbreiten („Spreiten“, s.o.), aber auch durch bewegliche Barrieren zusammengeschoben werden können. Es hat sich gezeigt, dass sich die Oberflächenspannung solcher Schichten drastisch ändert, wenn der Substanz weniger als etwa 0.2 nm2/Molekül zur Verfügung steht („POCKELS-Punkt8“). Dieser Wert wird als Platzbedarf eines Moleküls in einem monomolekularen Film gedeutet. Da der Platzbedarf unabhängig von der Kettenlänge ist (zwischen C16 und C26 geprüft), ergibt sich, dass die Fettsäuremoleküle am POCKELS-Punkt senkrecht zur Oberfläche angeordnet sein müssen. Die beim Spreiten auftretenden Kräfte lassen sich in einem LANGMUIR-Trog messen: der Trog wird zunächst bis zum Rand mit reinem Lösungsmittel (meist Wasser) gefüllt. Zwischen Barriere und Schwimmer wird ein Tropfen einer Lösung aufgetragen, die den Schichtbildner enthält (z.B. Stearinsäure in Benzol). Nach dem Verdunsten des Lösemittels kann man die Eigenschaften der Schicht durch Verschieben der Barriere und Messen der dabei am Schwimmer auftretenden Kräfte untersuchen. Als Oberflächendruck bezeichnet man die Größe π = γ0 −γ (3-83), wobei γ0 und γ die Oberflächenspannung von reiner Unterphase und von der Unterphase mit gespreiteter Schicht bezeichnen. Die Verschiebung 8 Nach AGNES POCKELS, 1862-1935, Braunschweig 27 des Schwimmers erfordert einen Arbeitsbetrag ( da = −π ⋅ l ⋅ dx = −π ⋅ dO ). Trägt man π gegen O bei verschiedenen Temperaturen auf, so erhält man Isothermen, die für verschiedene Substanzen sehr unterschiedlich sein können. Wenn die Wechselwirkung zwischen den Molekülen gering ist (oder die Verdünnung hinreichend hoch), verhält sich die Substanz wie ein zweidimensionales Gas: RT πO = nO RT = mO (3-84) bzw. M π = Γ RT (3-85) Bei zunehmender Oberflächenkonzentration verhalten sich die Substanzen wie ein zweidimensionales VAN-DER-WAALS-Gas. Die Analogien werden nachfolgend verdeutlicht: ideales Gas n RT p= v [Hyperbel p= f(v)] RT M Aus kinetischer Gastheorie: pv = nRT = m 2 ↓ 1 2 ↓ 1 L m w2 3 L: Loschmidtzahl 2 ( RT = ) pV = L ⋅ ε kin 3 (εkin) = kinetische Energie = Translationsenergie εt pv = gespreitete Moleküle (ideal) n ⋅ RT π= O = Γ ⋅ RT [Hyperbel π = f(O)] O RT π ⋅ O = nO ⋅ RT = mO M 3 3 2 2 3 Freiheitsgrade ε t = RT / L = kT 1 N O m w2 2 NO = Teilchenzahl / Fläche für 1 Teilchen: 1 kT = π ⋅ σ = m w 2 = ε kin = ε t 2 σ : Fläche, die ein Molekül beansprucht π= εt = kT 2 Freiheitsgrade reales Gas: a p + 2 (V − b) = RT V gespreitete Schicht (real): α π + 2 (σ − β ) = k ⋅ T FM „VAN-DER-WAALS-Gleichung“ FM: Flächenbedarf eines Moleküls (bzw. seiner Kopfgruppe) 28 (schwer zu messen, Barriere sehr langsam bewegen!) I = gasanalog, II = Koexistenz gasanalog / flüssiganalog (Filmbildung), III = flüssig-ausgedehnt, IV = Koexistenz flüssigausgedehnt / flüssig-kondensiert (Folie) V = flüssig-kondensiert, VI = fest-kondensiert, VII = kollabierte Phase Monoschichten behindern die Verdampfung der Flüssigkeit, die sie bedecken. Sie setzen dem Übertritt der Flüssigkeitsmoleküle in die Gasphase einen vom Oberflächendruck π abhängigen Widerstand entgegen. Bei Vergrößerung des Oberflächendrucks geht der Widerstand gegen einen konstanten Grenzwert, der der dicht gepackten fest-kondensierten Phase entspricht und deshalb die Ermittlung des Platzbedarfs der Kopfgruppe bzw. des Molekülquerschnitts ermöglicht. Von besonderem Interesse sind reaktionskinetische Studien an Monoschichten, da hier die Möglichkeit besteht, Moleküle in bestimmter Orientierung zueinander reagieren zu lassen. 3.4.3 Benetzung Wenn sich ein Flüssigkeitstropfen L in der Atmosphäre eines Gases G auf der festen Unterlage S befindet, dann treten die drei Grenzflächenspannungen γGS, γGL, und γLS auf, und es bildet sich ein für die Benetzung der Oberfläche charakteristischer Randwinkel θ aus. Im Gleichgewicht ist 28 29 γ GS = γ LS + γ GL ⋅ cos θ (YOUNG-Gleichung) (3-86). γGS und γLS sind nicht unabhängig voneinander meßbar; ihre Differenz ist die Haftspannung γH= γGS – γLS, die positive und negative Werte annehmen kann. Für θ < 90° ist γH > 0. Dagegen ist γH < 0, wenn 90° < θ < 180 °. Im ersteren Fall spricht man davon, dass die Flüssigkeit den Festkörper benetzt (z.B. Wasser an Glas), im letzteren, dass sie ihn nicht benetzt (z.B. Wasser auf Paraffin oder Quecksilber auf Glas). Proportional zur Haftspannung ist die Steighöhe h von Flüssigkeiten in Kapillaren Ist r der Radius der Kapillare, so kann man näherungsweise9 die Oberfläche des Flüssigkeitsspiegels in der Kapillare als Teil einer Kugeloberfläche mit demselben Radius auffassen. Im Gleichgewicht halten sich der hydrostatische Druck ρgh der Flüssigkeitssäule und der durch 2γ (3-44) gegebene Kapillardruck pfl − pg = die Waage: r 2γ H 2γ cos θ h= = GL (3-87) ρ gr ρ gr (ρ ist die Dichte der Flüssigkeit und g die Erdbeschleunigung). Bei benetzenden Flüssigkeiten (θ ≈ 0) ist die Bestimmung der Steighöhe eine bequeme Methode zur Messung von Oberflächenspannungen γGL. Komplizierte Apparaturen ermöglichen die Bestimmung des Kontaktwinkels θ. Temperaturabhängigkeit der Oberflächenspannung γ Als Funktion der Temperatur muss die Oberflächenspannung beim kritischen Punkt verschwinden. Empirisch gilt im linearen Teil untenstehender Skizze bis zu Temperaturen, die nur wenig unter der kritischen Temperatur Tk liegen, die EÖTVÖS-Regel 2 γVfl 3 = k E (Tk − 6K - T ) (3-88), wobei kE als EÖTVÖS-Konstante bezeichnet wird. Etwa 6 K unterhalb von Tk geht der lineare Abfall der Kurve in einen gekrümmten über (s. Abb.. Nach dem Theorem der übereinstimmenden Zustände (s. Kap. 1.1.2) sollte kE eine universelle Konstante vom Betrag ca. 230 nJ·K–1 mol–2/3 sein. Praktisch findet man jedoch nur bei einigen unpolaren Substanzen übereinstimmende kE-Werte, die sich sonst als sehr individuell erweisen (s. Tabelle). 9 Siehe Anhang 1 29 30 -6 3 γ/ mJ/m2 Vfl /10 m /mol Substanz T /°C He –270.7 0.308 32.792 77.9 N2 –200 9.85 17.34 152.4 H2O 20 72.75 18.016 101.7 CCl4 20 26.95 96.499 254.8 ← C2H5OH 20 22.75 58.368 129.4 CH3COCH3 20 23.70 73.528 220.3 ← C6H6 20 28.85 88.909 265 ← Hg 25 483.5 14.808 204 ← Na 110 205.7 24.496 Ag 1100 907 11.763 d γV 2 3 fl nJ = kE / − 2 dT Kmol 3 42.5 160 4. Kinetik 4.1 Bimolekulare Reaktionen Gasphase Ganz allgemein lässt sich die Geschwindigkeit einer Reaktion mit Hilfe der im Teil I bereits definierten Reaktionslaufzahl10 ξ (dξ = dni/νi) als Umsatzgeschwindigkeit ω ω = dξ / dt (4-1) formulieren. Die Reaktionsgeschwindigkeit r ist dann r = ω / v = (1/νi)(dci /dt); (4-2), wobei die νi stöchiometrische Koeffizienten der Reaktionsgleichung (mit Vorzeichen) angeben. r wird für bimolekulare Reaktionen meist in mol dm3 s-1 oder in (bar s)-1 angegeben, oft auch einfach reziproken Teilchendichten: cm3 s-1. Falls sich das Volumen bei der Reaktion nicht ändert, sind Umsatzgeschwindigkeit und Reaktionsgeschwindigkeit proportional zueinander. Einfachster Typ einer bimolekularen chemischen Elementarreaktion ist A + B → P (P: allgemein Produkte). Nach diesem Schema laufen viele Atom- und Radikalreaktionen in der Gasphase ab, wie z.B. Na + Cl2 → NaCl + Cl. Die Wahrscheinlichkeit der Bildung von Pro- 10 dξ = 1 mol bedeutet, dass ein Formelumsatz durchlaufen wurde 30