Skript
Werbung

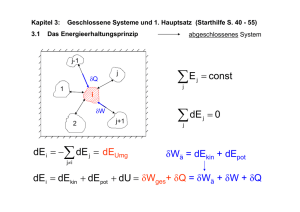
9. Vorlesung (PC I, WS 2002/3) Inhalt: - Die Entropie (S) Der zweite Hauptsatz Die thermodynamische Potentiale (II) I. Die Entropie (S) Wir durchlaufen die Modellprozesse der letzten Vorlesung noch einmal, diesmal aber mit dQ anstatt mit dQ: T B P1 T'' T A C P2 T' V1 dQ V dU PdV 1 T 1 T T nR n V12 2 Weg A: V2 2 T' T V2 dT CV 0 T T dT CV T T' dV T V1 1.Teilstrecke isochor 2.Teilstrecke isobar P2 V 2 T' T dV C V n C V n P2 n R T T' P2 V V1 0 V2 V dV n R n 2 V V1 V1 n R 1 Weg B: (1.Teilstrecke isobar; 2.Teilstrecke isochor) nR n 2 Weg C: (isothermer Weg) = 1 V2 V1 dQ dU PdV T T T 1 2 2 V 2 2 P 1 T dV dV n R dV nR T T1 V V 1 V1 nR n Es zeigt sich also: Das Integral unabhängig. Es V2 V1 dQ ist im Gegensatz zu T dQ vom Integrationsweg dQ eignet sich also zur Definition einer Zustandsgröße. Nach dem T griechischen Wort „entrépein“ und „tropé“ (umkehren und Umkehrung) wird diese erstmalig von Clausius definierte Größe Entropie S genannt. Ihre Änderung beim Übergang von 2 dQ Zustand 1 in Zustand 2 wird mit S1, 2 rev angegeben. T 1 II. Der zweite Hauptsatz Überprüfen wir einmal, in wieweit unsere neue definierte Größe S in verschiedenen Prozessen unseren Anforderungen gerecht wird: a) Irreversible Ausdehnung eines idealen Gases In einem isolierten Behälter V1 befindet sich ein Gas mit dem Druck P2; im zweiten Behälter mit dem gleichen Volumen V1’ ist Vakuum. Die Wand zwischen beiden Kompartiments wird geöffnet, das Gas dringt unkontrolliert in den zweiten Raum ein. Zustand 1: Öffnung verschlossen, Gas nur auf der linken Seite V1,P1,T Zustand 2: Öffnung, Gas gleichmäßig auf beiden Seiten V2 = 2V2, P2,T Gas V1 V2=2V1 Das Gas strömt, bis ein Druckausgleich vorhanden ist. Da die Stoffmenge des Gases konstant bleibt und keine Energie das System verlassen kann, ist der Prozeß adiabatisch, d.h. dQ=0 2 2 dQ dQ 0 . Obwohl ein irreversibler Prozeß abgelaufen ist, hat sich die Größe nicht T T 1 1 geändert. Ohne zusätzliche Definition ist sie offenbar noch nicht als Zustandsgröße geeignet. 2 b) Reversible Ausdehnung eines idealen Gases (zum selben Endzustand): Kann das System den gleichen Zustand wie im ersten Experiment erreichen, aber über eine andere Prozeßführung? Wir ändern das System so ab, daß das Volumen V1 seitlich mit einem Kolben begrenzt ist, gegen den das Gas drückt und der wiederum an einer Mechanik hängt. Das Gefäß wird (z.B. mit einem Wasserbad) auf konstanter Temperatur gehalten: Gas P1, V1, T -----> P2, V2 , T Auf diese Weise kann der Kolben in jedem Moment der Expansion angehalten werden, d.h. die Schritte der Expansion unendlich klein gewählt werden. Wird die Arbeit, die das Gas beim Ausdehnen am Kolben verrichtet, z.B. durch eine Feder gespeichert, kann sie auch wieder zum Komprimieren des Gases eingesetzt werden: dadurch wird der Prozeß erstens reversibel, und zweitens verläßt keine Energie das System Behälter – Kolben – Wärmebad, gehorcht damit also dem ersten Hauptsatz: 2 CV dT 2 dQ 1 T 1 T 1 p dV 2 Da der Prozess isotherm geführt wird, ist dT=0 und daher der erste Summand gleich Null. n R T Über P , d.h. die Zustandsgleichung des idealen Gases, ergibt sich V 2 2 V2 dQ n R T 0 1 T 1 V dV n R T n V1 In beiden Experimenten ist Übergang von P1, V1, T P2, V2, T erfolgt, das Ergebnis für die 2 dQ Größe ist allerdings verschieden: T 1 2 in a): dQ 0 T a) ist irreversibler Prozeß 2 V dQ n R T n 2 T V1 b) ist reversibler Prozeß 1 in b): 1 2 dQ reicht offenbar noch nicht aus, um eine eindeutige Definition der T 1 Entropie zu gewährleisten. Der Prozeßweg, auf dem die Entropieänderung berechnet wird, muß ein reversibler Weg sein. Damit ergibt sich als tragfähige Definition der Entropie: Die Definition S1, 2 3 2 S1, 2 1 dQreversibel T 2 dQ 0 T 1 herauskommt, so kann die zugehörige Entropieänderung nur über einen reversiblen Weg berechnet werden. Es muß also ein reversibler Weg zum gleichen Endzustand gesucht werden. Im Beispiel b) ergab sich 2 dQ rev S 0 T 1 Wenn auch bei einem speziellen Prozeßweg (wie in Beispiel a)) das Ergebnis In Verallgemeinerung dieses Befundes können wir jetzt den 2. Hauptsatz der Thermodynamik formulieren: Generell gilt für isoliertes System (dQ=0) S dQ rev dQ 0 T T S 0 reversible r Vorgang S 0 irreversib ler Vorgang S 0 unmöglicher Vorgang für nicht isoliertes System: dQ reversible r Vorgang T dQ S irreversib ler Vorgang T dQ S unmöglicher Vorgang T S dQ T oder dQ T dS bzw . dS Speziell gilt dQ=T*dS für einen reversiblen Vorgang. III. Die thermodynamischen Potentiale (II): Um ersten und zweiten Hauptsatz miteinander zu kombinieren, wurden zwei weitere Potentiale eingeführt, einerseits die Gibbs’sche Energie G, andererseits die Helmholtz – Energie A bzw. F. Diese Potentiale beachten bei der energetischen Betrachtung eines Prozesses auch die Änderung der Entropie. 4 Bedeutung der Gibbs‘schen Energie G: G H TS U PV TS dG dU PdV VdP TdS SdT 1. Hauptsatz dG dQ VdP TdS SdT 2. Hauptsatz dG TdS VdP TdS SdT VdP SdT VdP SdT dG VdP SdT spon tan reversibel , bzw. Gleichgewicht bei T , P cons tan t : 0 spon tan er Pr ozeß 0 Gleichgewicht , bzw. reversible r Pr ozeß dG T , P Bedeutung der Helmholtzenergie A bzw. F: A U TS dA dU TdS SdT dQ PdV TdS SdT TdS PdV TdS SdT PdV SdT dQTdS bei V , T const . 0 (dA)V ,T 0 spon tan reversibel , Gleichgewicht Es zeigt sich, daß G also nur für die Beschreibung eines Systems herangezogen werden kann, d.h. konstant ist, wenn Temperatur und Druck konstant bleiben. A dagegen ist nur konstant bei Experimenten, bei denen Volumen und Temperatur gleichbleiben. Zeigen die beiden anderen Potentiale U und H ähnliches Verhalten? dieselbe Betrachtung für innere Energie: dQ dU PdV dU dQ PdV TdS PdV 0 spon tan er Pr ozeß (dU ) S ,V 0 reversible r Pr ozeß, Gleichgewicht V , S const . 5 für Enthalpie: dH dU PdV VdP dQ PdV PdV VdP dQ VdP TdS VdP 0 spon tan er Pr ozeß (dH ) S , P 0 Gleichgewicht , reversible r Pr ozeß S , P const . Somit existieren für jedes der vier Potentiale zwei besondere Variable, die sogenannten natürlichen oder charakteristischen Variablen. Wenn die natürlichen Variablen konstant gehalten werden, dann gibt dass Minimum des jeweiligen Potentials den Gleichgewichtszustand an, bzw. ein Prozeß, bei dem Das Potential verringert wird, ist ein spontaner Prozeß. Umgekehrt muß ich je nach Experiment, das ich durchführe, für eine energetische „Momentaufnahme“ das passende Potential zur Beschreibung wählen; z.B. ist in einem Reagenzglas P durch den Luftdruck und T durch die Raumtemperatur konstant, also wählt man zur Beschreibung G. In einer Batterie bleibt das Volumen gleich, die Temperatur wird durch die Umgebung konstant gehalten; man wählt A zur Beschreibung. Thermodynamisches Potential U H=U+PV A=U-TS G=H-TS Natürliche Variablen S, V S, P T, V T, P Von einer anderen Seite betrachtet: Wenn ein thermodynamisches Potential für ein System als Funktion seiner natürlichen Variablen bekannt ist, dann können alle thermodynamischen Eigenschaften des Systems berechnet werden. 6