Folien_zur_Vorlesung_Energiesysteme Kapitel_3
Werbung

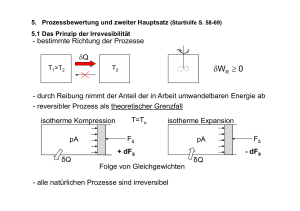
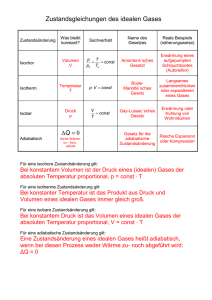
Kapitel 3: 3.1 Geschlossene Systeme und 1. Hauptsatz (Starthilfe S. 40 - 55) Das Energieerhaltungsprinzip abgeschlossenes System j-1 δQ j ∑E j = const j 1 i δW 2 j+1 dEi = −∑ dE j = dEUmg j≠i ∑ dE j =0 j δWä = dEkin + dEpot dE i = dEkin + dE pot + dU = δWges+ δQ = δWä + δW + δQ 3.2 Arbeit und innere Energie Voraussetzung: • adiabate Systeme (δQ = 0) − dEUmg = δW = dE System • Schwerkraft als einzige äußere Kraft • Beschränkung auf mechanische Arbeit 3.2.1 Mechanische Arbeit Scherkräfte Ö Wirkung einer Kraft Normalkräfte G G = ∫ F ( s ) ⋅ ds 2 Wmech,12 1 äußere Arbeit δWä Wirkung auf das thermodynamische System Systemarbeit δW Mechanische Arbeit und thermodynamisches System → keine Änderung des inneren Systemzustandes (Änderung der äußeren Koordinaten) → Änderung des inneren Systemzustandes (dp, dT) δWmech = δWSystem δWmech = δWä p, T ds p, T ds F F −dEUmg G G = Fds = Fds = δWmech 3.2.2 Äußere Arbeit −dEUmg = δWmech = dESystem = d (Ekin + Epot + U) δWä = dEkin + dEpot M 2 = dv + Mgdz 2 δWä 1 2 δw ä = = dv + gdz M 2 w ä,12 ( ) 1 2 2 = v 2 − v1 + g ( z2 − z1 ) 2 (Vernachlässigung der Rotation in dEkin) spezifische Arbeit 3.2.3 Systemarbeit - Volumenänderungsarbeit quasistatische und nichtstatische Zustandsänderung • quasistatische Zustandsänderung (→ Folge von Gleichgewichten) • mechanisches Gleichgewicht F + pUAK = pSGAK = pAK • nichtstatische Zustandsänderung pSG ≠ p (Nichtgleichgewicht) Ö Diskussion des Druckausgleichs (mechanisches Gleichgewicht) im System Volumenänderungsarbeit - Berechnungsgleichung δWV = δWmech = ± Fds = −pSGdV( System) Vorzeichenvereinbarung: • Zufuhr (Kompession) • Abgabe (Expansion) δW > 0 δW < 0 quasistatische Zustandsänderung: p SG = p System = p(V ) δWV quasistatisch = δWV = −p ( V ) d V Volumenänderungsarbeit - Integration • spezifische Arbeit w v,12 2 Wv,12 2 = = ∫ δw v = ∫ p d v = ? M 1 1 p = p(v) Wegabhängigkeit der Arbeit als Prozessgröße • isochore Zustandsänderung → z. B. ideale Flüssigkeiten mit ρ = w v,12 = 0 mit 1 = const v dv = 0 • isotherme Zustandsänderung (ideales Gas) p(v) = ? → p= 2 RT RT1 p1v1 p2 v 2 const = = = = v v v v v v v dv = −RT1 ln 2 = −p1v1 ln 2 v v1 v1 1 w v,12 = −const ∫ - Dissipative Arbeit WWelle12 = t 0 +Δt ∫ W Welle ( t ) dt = t = t0 t 0 +Δt ∫ Mdωdt = WR12 ≥ 0 t = t0 R Wel12 = t0 +Δt ∫ t = t0 ( t ) dt = W el t0 +Δt ∫ l2elReldt ≥ 0 t = t0 R WR12 + Wel12 = Wdiss12 ≥ 0 δW = δWV + δWR + δWelR = δWV + δWdiss = ( dU)ad δWges = δWV + δWdiss + δWä = ( dE )ad 3.2.4 Druckänderungsarbeit (Beispiel idealer Verdichter) Arbeit für eine Arbeitsperiode AP WAP = WV,12 + WV,23 + WV,34 + WV,41 2 3 4 1 1 2 3 4 = − ∫ pdV − ∫ pdV − ∫ pdV − ∫ pdV 2 = − ∫ pdV − p2 ( V3 − V2 ) − p1 ( V1 − V4 ) 1 2 = − ∫ p ( V ) dV + p2 V2 − p1V1 1 2 w D,12 = ∫ v ( p ) dp 1 2 = ∫ V ( p ) dp = WD,12 1 3.2.5 Arbeit und innere Energie v = const −dEUmg = δWmech = −Mgdz = ( dU)ad = Mdu ( T,v ) = Mdu ( T ) Untersuchungen zum sogenannten „Mechanischen Wärmeäquivalent“ durch James Prescott Joule (1818-1889) und Robert Mayer (1814-1878) 3.3 Der erste Hauptsatz 3.3.1 Formulierung mit der inneren Energie − dEUmg = dESystem = d (Ekin + Epot + U) = δWä + δW + δQ dU = δQ + δW bzw.: du = δq + δw quasistatisch: U2 − U1 = Q12 + W12 bzw.: u2 − u1 = q12 + w12 du = δq − pdv + δ W R 2 u2 − u1 = q12 − ∫ p ( v ) dv + w R,12 1 3.3.2 Enthalpie Definition: H = U + pV = Mh bzw. h = u + pv dh = du + d(p ⋅ v ) = du + pdv + vdp Ideales Gas: (pv = RT) dh = du + d(pv ) = c v (T )dT + R d T = dh(T ) ⎛ ∂h ⎞ dh = ⎜ ⎟ dT = c p (T )dT ⎝ ∂T ⎠p c p (T ) = c v (T ) + R mit ideale Flüssigkeit: dh = du + vdp = c (T )dT + vdp = dh(T, p ) (ρ = const) ⎛ ∂h ⎞ ⎛ ∂h ⎞ dh = ⎜ dT + ⎜ ⎟ dp ⎟ ⎝ ∂T ⎠p ⎝ ∂p ⎠T 1. Hauptsatz: (quasistationär) mit ⎛ ∂h ⎞ 1 v = = ⎜ ⎟ ρ ⎝ ∂p ⎠T d h = δq + v d p + δw R 2 h 2 − h 1 = q1 2 + ∫ v (p ) d p + w 1 R ,1 2 3.3.3 Wärme bei reversiblen Zustandsänderungen Voraussetzung: quasistatisch, δw diss = 0 δqrev = du + pdv = dh − vdp - reversibel isochor (dv = 0): δqrev ⎛ ∂u ⎞ = du = cvdT + ⎜ ⎟ dv ⎝ ∂v ⎠T 0 mit ⎛ ∂u ⎞ ⎛ δq ⎞ cv = ⎜ ⎟ = ⎜ rev ⎟ ⎝ ∂T ⎠v ⎝ dT ⎠v - reversibel isobar (dp = 0): Zustandsgl. allg. δqrev 0 ⎛ ∂h ⎞ = dh = cpdT + ⎜ ⎟ dp mit ⎝ ∂p ⎠T nur rev. isobar - reversibel isotherm (dT = 0): δqrev = ? ⎛ ∂h ⎞ ⎛ δq ⎞ cp = ⎜ ⎟ = ⎜ rev ⎟ ⎝ ∂T ⎠p ⎝ dT ⎠p 3.3.4 Anwendung des 1. Hauptsatzes auf abgeschlossene Gesamtsysteme Voraussetzung: Δekin = 0, Δepot = 0, Vi = const dUGS = ∑ dUi = δQ GS + δWGS = 0 ⇒ i Beispiel Kalorimeter: ∑ (Mc ) dT = 0 i i c i = const ∑ (Mc ) ( T i i2 − Ti1 ) = 0 Bestimmung von: • spezifischer Wärmekapazität cProbe • Mischtemperatur Ti2 = TM • Mischungsverhältnis M1/M2 Zusammenfassung Arbeit Zusammenfassung 1. Hauptsatz 3.4 Beispiele Beispiel 3.1: Gasometer Ein zylindrischer Gasbehälter (Gasometer) hat einen Durchmesser dG = 16 m und eine Höhe zG = 20 m. Er wird durch einen vertikal verschiebbaren Deckel der Masse MD = 50000 kg gasdicht abgeschlossen. Durch Sonneneinstrahlung vergrößert sich das Gasvolumen. Der Deckel hebt sich um ΔzG = 0,5 m an. Das Gas hat vor der Sonneneinstrahlung eine Temperatur von T1 = 293 K. Die Gaskonstante, die spezifische Wärmekapazität und der Luftdruck betragen: R = 287 J/(kgK), cp = 1004 J/(kgK) und pu = 105 Pa. Berechnen Sie a) die Gasmasse MG, die sich im Gasometer befindet, b) den Zustand T2, p2, V2 des Gases nach der Sonneneinstrahlung, c) die durch die Sonne zugeführte Wärme Q12, d) die Volumenänderungsarbeit WV12, e) die Änderung der inneren Energie ΔU = U2 – U1. Lösungen Beispiel 3.1: Gasometer Der Deckel des Gasometers hat die Fläche A G = dG2 π / 4 = 201,06 m 2. Der Absolutdruck p1 im Gasometer beträgt MD g = 0,10244MPa AG p1 = p u + Die Behältervolumina vor und nach der Sonneneinstrahlung ergeben sich zu: V1 = A G z G = 4021,2m 3 und V2 = A G ( z G + Δz G ) = 4121,8 m 3 . Die Gasmasse im Gasometer MG = V1ρ1 = V1p1 / (RT1 ) = 4898,7 kg bleibt während der Zustandsänderung konstant. Die Zustandsänderung durch Sonnenineinstrahlung vollzieht sich wegen des beweglichen Deckels isobar p 2 = p1 = const. Somit folgt aus den thermischen Zustandsgleichungen p1V1 = MGRT1 und p 2 V2 = M GRT2 die Temperatur des Gases nach der Sonneneinstrahlung T2 = V2 / V1T1 = 300,3K. Mit der Gleichung erhalten wir für die Volumenänderungsarbeit 2 W V12 = − ∫ pdV = − p1 ( V2 − V1 ) = −10,298 MJ. 1 Die durch die Sonne zugeführt Wärme Q12 lässt sich unmittelbar aus der Enthalpieformulierungen des ersten Hauptsatzes berechnen. Es ist Q12 = H2 − H1 = MG c p ( T2 − T1 ) = 36,051 MJ. Schließlich bestimmen wir noch die Änderung der inneren Energie mit dem ersten Hauptsatz U2 − U1 = Q12 + W V12 = 36,051 − 10,298 = 25,753MJ.