5.7 Reversibler und irreversibler Prozess im Vergleich
Werbung

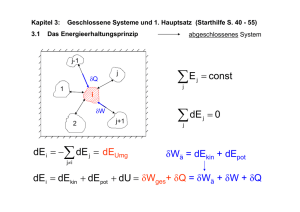
5. Prozessbewertung und zweiter Hauptsatz (Starthilfe S. 58-69) 5.1 Das Prinzip der Irrevesibilität - bestimmte Richtung der Prozesse δQ T1>T2 δWR ≥ 0 T2 - durch Reibung nimmt der Anteil der in Arbeit umwandelbaren Energie ab - reversibler Prozess als theoretischer Grenzfall isotherme Kompression pA δQ T=Tu isotherme Expansion Fä + dFä Folge von Gleichgewichten - alle natürlichen Prozesse sind irreversibel pA δQ Fä - dFä 5.2 Entropie und zweiter Hauptsatz gesucht wird eine Zustandsgröße zur Beschreibung der Richtung und des Ablaufes von Prozessen 1. HS: du + pdv = δq + δw R + (p − p SG ) dV mit δw R + (p − p SG ) dV ≥ 0 > δq 0 < adiabates System: (du + pdv )ad = δw diss ≥ 0 >0 irreversibler =0 <0 reversibler nicht möglicher Prozess Überführung in eine Zustandsgröße (integrierender Nenner) du (T, v ) + p (T, v )dv d ϕ(T, v ) = N(T, v ) Entropie dS = dU + pdV δQ rev , = TTD TTD Thermodynamische Temperatur S =s M TTD = Tid. Gas = T > 0 in K nichtadiabate Systeme - reversibler Prozess: quasistatisch, δw diss = 0 du + pdv = δqrev bzw. ds = du + pdv δqrev > = 0 T T < - realer Prozess: dS = δWdiss dU + pdV δQ (p − p SG ) dV + = + T T T T Berücksichtigung ΔT = T − Tu für Wärmetransport δQ dS = Tu ⎛1 1 ⎞ p − pSG δWdiss + ⎜⎜ − ⎟⎟δQ + dV + T T ⎝ T Tu ⎠ dS = δS Transp + 2. Hauptsatz: δSirrev δSirrev ≥ 0 5.3 Zweiter Hauptsatz für adiabate Gesamtsysteme (d S ) ges ad ⎞ ⎛ ⎜ = ⎜ ∑ dS j ⎟⎟ ⎠ad ⎝ j ⎛ ⎞ ⎜ = ⎜ ∑ δS Transp, j + ∑ δSirrev, j ⎟⎟ ⎝ j ⎠ad = (∑ δSirrev, j )ad ≥ 0 (dS ) ges ad ⎛ ⎞ ⎜ = ⎜ ∑ dS j ⎟⎟ ≥ 0 ⎝ j ⎠ad 2. Hauptsatz 5.4 Entropie als Zustandsgröße - Definition: 1 du + pdv dh − vdp ⎛ δqrev ⎞ ds = dS = = =⎜ ⎟ M T T ⎝ T ⎠quasist. - Integration: u = u ( T,v ) , p = p ( T,v ) stoffabhängig ⎛ ⎞ 1 - ideale Flüssigkeiten ⎜ v = = const, du = c ( T ) dT ⎟ : ρ ⎝ ⎠ 2 T2 2 c = const cdT pdv s2 − s1 = ∫ ds = ∫ +∫ T T 1 T1 1 - ideale Gase T2 T1 (pv = RT, du = c ( T ) dT ) : c v ( T ) dT v 2 Rdv s2 − s1 = ∫ +∫ T T T1 v1 T2 s2 − s1 = c ln v c v = const s2 − s1 = c v ln T2 v T p + Rln 2 = c p ln 2 − Rln 2 T1 v1 T1 p1 5.5 T,s-Diagramm (id. Gase) T du + pdv c v dT + pdv = T T dh − vdp c p dT − vdp ds = = T T ds = Voraussetzung: c p , c v = const s Isochore: Isobare: s − s1 = c v ln s − s1 = c p ln T T1 T T1 → → T = T1e s − s1 cv T = T1e s − s1 cp 5.6 Zustandsänderungen in adiabaten Systemen (id. Gase) T Kompression T Expansion Tds = du + pdv = dh − vdp = (δq + δw R )quasistat . s isentrope ZÄ (reversibel, adiabat) s ds = 0, s = const Isentropenbeziehungen 1 : du + pdv = 0 → c v dT = −pdv = − RT dv v → f (T, v ) = 0 2 : dh + vdp = 0 → c pdT = vdp = − RT dp p → ϕ(T, p ) = 0 3 = 2 / 1: Integration: (cp, c v , κ = const ) → cp cv =κ=− vdp pdv → f (T, v ) = 0 Isentropenexponent pv κ = const = p1v1κ = p2 v 2κ p = RT / v v = RT / p 5.7 Reversibler und irreversibler Prozess im Vergleich Voraussetzung: rev. Prozess: durev , dv rev → dsrev realer Prozess: du = durev dv = dv rev dU = δQrev + δWrev dQrev = δQ ~ δSTransp δW − δWrev ≥ 0 = δQ + δW + δW − δWrev = TdS ~ δSirrev Kompr . (δWrev > 0 ) : | δWrev | < | δW | min. Arbeitsau fwand Exp. max. Arbeitsge winn (δWrev < 0) : | δWrev | > | δW | Zusammenfassung – Entropie und 2. Hauptsatz • Definition- und Berechnungsgleichungen der Entropie: du + pdv dh + vdp δqrev ( δq + δw diss )quasistat. ds = = = = T T T T Integration abhängig vom Stoff ⎛ ⎝ - ideale Flüssigkeiten ⎜ ρ = T2 s2 − s1 = c ln T1 für 1 ⎞ = const, du = cdT ⎟ v ⎠ c = const ( - ideale Gase c p , c v = const s2 − s1 = c v ln ) T2 v T p + Rln 2 = c p ln 2 − Rln 2 T1 v1 T1 p1 • 2. Hauptsatz: ( dSges ) ad ⎛ ⎞ = ⎜ ∑ dS j ⎟ ≥ 0 ⎝ j ⎠ad > 0 irreversibel = 0 reversibel < 0 nicht möglich • T,s-Diagramm: 2 ∫ T ( s ) ds = q 12 1 = ( q12 )rev + w diss,12 = ( w diss,12 )ad