Thermodynamik
Werbung

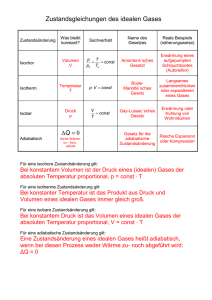
KAPITEL 7 - Thermodynamik 7.1 Wärme und Arbeit beim idealen Gas, erster Hauptsatz der Thermodynamik lap5/adm/eig/uni/vorl/mewae/mw-acs/Kap7/Kap7_1_s3 Bei Beschreibung von Systemen über makroskopische Größen sind detailierte Vorgänge häufig irrelevant: z.B. p als der Wirkung aller Stöße etc. (Für viele prakt. Probleme: einzige Möglichkeit, z.B. Motor ...) ∙ wichtigste Anwendung der Thermodynamik: Umwandlung von Wärme in mech. Energie und umgekehrt. Ende voriges Jhd.: Einsicht: Wärme ist Energie-Form! Frage: optimale (=maximale) Umwandlung? ∑ P.M. 1.Art: Energie ”aus dem nichts”: Maschine, die mehr W abgibt, als sie aufnimmt: Widerspruch zum Satz von der Erhaltung der Energie. P.M. 2.Art: Vorrichtung, die einem einzigen Wärmereservoir thermische Energie entzieht und in W mech. umwandelt (z.B.Schiff, das Fahrwasser abkühlt und nur daraus seine Bewegungsenergie nimmt, wäre Perpetuum Mobile 2.Art): durch En.-Satz nicht verboten. Abkühlung der Weltmeere um △T = −1 o C : brächte den Energie-Bedarf der Welt für einige Jahrzente! aber: P.M. 2.Art geht auch nicht: Quelle und Senke für thermische Energie erforderlich. Um Wärme aus Reservoir zu holen: △T < 0 erforderlich, kälterer Körper, der durch Temp.-Ausgleich Wärme aufnimmt und dabei Arbeit verrichtet (z.B. durch Ausdehnen eines Gases bei Erwärmung). Temperaturausgleich bedeutet Erwärmung des Körpers bei gleichzeitiger Arbeitsleistung. Hört auf, wenn Körper die Temperatur des Reservoirs erreicht hat. Damit dieser Zyklus wiederholt ablaufen kann, muß der Körper wieder abgekühlt werden d.h.,daß ein Teil der Energie, die dem warmen Reservoir entzogen wurde, an das kältere Reservoir abgeführt werden muß , dieser Teil steht folglich nicht für die Umwandlung in mech. Energie zur Verfügung! (”Verbot” eines P.M. 2. Art durch 2.Hauptsatz der Wärmelehre unter Verwendung des Begriffs der Entropie s.u.) ∙ Wichtiger Satz: 1. Hauptsatz der Wärmelehre dQ = dU + dW aufgenommen. nach aussen abgegeben Dabei ist also: △Q ... dem Körper (z.B. Gasvolumen) zugeführte (von diesem aufgenommene) Wärmemenge, ∆U ... Änderung der inneren Energie (U = 12 n f n T k T), ∆W ... vom Körper nach aussen geleistete Arbeit (z.B. p∆V bei Ausdehnung eines Gases. (Alle diese Größen können negativ werden, ihre Bedeutung ändert sich dann sinngemäß) Gilt für rev. Prozesse: reversibel: d.h. Ablauf von einem Gleichgewichtszustand ausgehend in ∞ kleinen Schritten δp, δV, δT angenommen, es wird also wieder eine Folge von Gleichgewichtszuständen durchlaufen, die Prozedur ist daher jederzeit umkehrbar. z.B. Ausdehnung eines Gases: p Gas = p o + δp ≈ p o also mit δp → 0, System also praktisch immer im Gleichgewicht. Der 1. HS ist also eine spezielle Form des Satzes von der Erhaltung der Energie und läßt sich auch folgendermassen ausdrücken: Die einem Gas zugeführte Energie bleibt erhalten, sie findet sich als innere Energie des Gases und nach aussen geleistete Arbeit wieder. z.B. Erwärmung eines Gasvolumens bei gleichzeitiger Ausdehnung: V 1 → V 2 und T 1 → T 2 mit V 2 > V 1 und T 2 > T 1 p 1 → p 2 nach Gasgleichung Dieser Übergang V 1 , T 1 , p 1 → V 2 , T 2 , p 2 kann dabei auf verschiedene Weise erreicht werden: z.B. Erwärmen/Ausdehnen in versch. Reihenfolge. Unabhänglig vom gewählten Prozeß ist aber dann z. B. △U immer gleich, wenn Anfangszustand (V 1 , T 1 , p 2 ) und Endzustand (V 2 , T 2 , p 2 ) gleich sind, ⇒ △U = △Q − △W unabh. von Art des Prozesses ∑ ∙ bemerkenswert: Innere Energie (= W kin i ) kann über makroskopische Größen definiert werden. Die zur Erwärmung einer Gasmenge erforderliche Wärmemenge (und damit die spezifische Wärme) ist also von der Art des Prozesses Abhängig, bei konstantem Volumen (△W = p∆V = 0, ”isochor”): △Q = ∆U = C V ∆T für 1 Mol, bei konstantem Druck (”isobar”, p gas = p aussen angenommen): △Q = ∆U + p∆V = C p ∆T C p , C V sind also die entsprechenden Molwärmen zu diesen Prozessen. ∙△Q verschiedener Prozesse hängen also zusammen, wenn jeweils gleicher Anfangs- und Endzustand. Kann nützlich sein, z.B.: Bestimmung der Verdampfungswärme von Wasser bei 20 o C und Atmosphärendruck aus dem Wert bei 100 o C: o p = 10 5 Pa Q 100 (1cal = 4, 187J) VD,H 2 O (= 539Kcal/Kg) = 2, 26MJoule/Kg o (= notw.Energie, um 1Kg Wasser von 100 C in Wasserdampf von 100 o C zu verwandeln). spez. Wärme c H 2 O = 4, 2.10 3 J/Kg o C, c Dampf = 2.10 3 J/Kg o C oC Wie groß Q 20 H2O ? also: Anfangszustand: Wasser bei 20 o C Endzustand Dampf bei 20 o C gewählter Weg (bequem) 1.) H 2 O (20 o C) → (100 o C) 2.) H 2 O (100 o C) → Dampf (100 o C) 3.) Dampf (100 o C) → Dampf 20 o C △Q 1 △Q 2 △Q 3 = 80.4, 2.10 3 J = 331KJ/Kg = 2260KJ/Kg = −80.2.10 3 =−160KJ/Kg Summe: 2431KJ/Kg = 2, 431MJ/Kg (≈ 581kcal/Kg) (Wie ist das zu verstehen, dass dieser Wert höher ist als der bei 100 o C?) (Der experimentell bestimmte Wert ist um ∼1% höher: Grund: Kohäsionskräfte sind stärker bei niederer Temperatur, geht in diese Rechnung nicht ein!) Weitere Überlegung: Expansion eines Gases in größeres Volumen: keine Wärme zugeführt: △Q = 0, keine Arbeit gegen den äußeren Druck zu leisten, beim idealen Gas auch keine Arbeit gegen die Kohäsionskräfte erforderlich: △W = 0, → △U = △Q − △W = 0 Innere Energie U eines idealen Gases ist unabhängig vom Volumen (reelles Gas: Arbeit gegen Kohäsionskräfte: △W > 0, △U < 0, U sinkt), bei gegebener Temperatur daher nach der Gasgleichung auch unabhängig von p, m i v 2i 1 wie nach der molekularkinetischen Betrachtung und der entsprechenden Beziehung: U = = 2 nfnT k T 2 ja auch zu erwarten ist. Diese Temperaturabhängigkeit von U kann auch folgendermaßen anhand der Erwärmung einer Gasmenge unter konstantem Volumen (dV = 0)dargestellt werden: ∑ dQ = C V dT = dU + pdV = dU → dU = C V dT für ideales Gas. Zusammenhang C p , C V aus einem isobaren Prozess abgeleitet:: dQ = C p dT = dU + pdV = C V dT + pdV pdV über Zustandsgleichung durch dT ausgedrückt: d dV d (pV) = p = (RT) = R → pdV = RdT → C p dT = C V dT + RdT dT dT dT Cp − CV = R Zustand eines idealen Gases im Gleichgewicht wird also durch die Variablen p,V,T beschrieben. Es ist daher sinnvoll, nach Gesetzhmäßigkeiten für verschiedene thermodynamische Prozesse in diesen Variablen zu suchen! Isotherme Volumsänderung: dT = 0 → dU = 0, → dQ = pdV .also p, V verändert, wobei T = const. und damit U= const bleibt. Z.B. Kompression eines Gases: pdV < 0, daher auch dQ < 0 : die bei der Kompression entstehende Wärme muß abgeführt werden. ... pV = const Adiabatische Volumsänderung: hier wird keine Wärme zu- oder abgeführt, es ist also dQ = 0 und damit dU = C V dT = −pdV = RT dV → C V dT = C V d ln T = −Rd ln V = −(C p − C V )d ln V → V T CV C V ln T + (C p − C V ) ln V = const → ln T + ln V (C p −C V ) = ln(T C V V (C p −C V ) ) = const → T C V V (C p −C V ) = e const = const , C p −C V Cp Cp Cp −1 −1 p CV CV TV CV = TV CV = pV V = V = const → R R Cp κ pV = const mit κ = C V Poisson’sche Gleichung ′ ′ ′′ ′′′ κ = C Vp ist wegen dU = C V dT = 12 n f n T k dT also von n f des Gases abhängig, für ein einatomiges Gas ist κ = 1, 67 (nachrechnen!) C V C p − C V = R, C V = 12 n f R → κ = C Vp = R+C = CRV + 1 = n2f + 1 z.B. für einatomiges Gas mit n f = 3 : CV κ einatomig = 1, 67 Schallausbreitung (Longitudinalwellen, Dichteschwankungen als f(x,t)) verläuft adiabatisch - keine Zeit für Temperaturausgleich, für die Schallgeschwindigkeit gilt daher: Es war v Schall = Kρ mit Kompressionsmodul K = − ∆pV für adiabatischen Prozess berechnet: ∆V C d(pV κ ) = 0 → pκV κ−1 dV + V κ dp = 0 → dp dV κ−1 dp = −pκ VV κ → K = −V dV = κp → v Schall = κp ρ Thermodynamik: keine Annahmen über detaillierte Vorgänge (wie in molek.kin. Th.; elast. Stöße kleiner Kugeln etc.) notwendig. ∙ Aber: Sätze der Thermodynamik gelten nur für Systeme im thermischen Gleichgewicht!