Einführung in die Meteorologie - Meteo Uni Bonn
Werbung

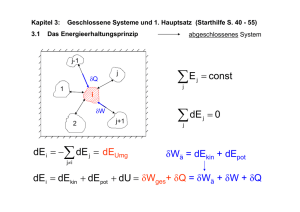
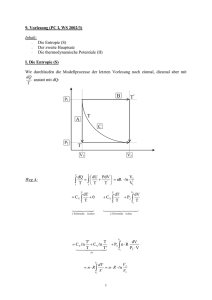
Einführung in die Meteorologie - Teil II: Meteorologische Elemente Clemens Simmer Meteorologisches Institut Rheinische Friedrich-Wilhelms Universität Bonn Sommersemester 2006 Wintersemester 2006/2007 II Meteorologische Elemente II.1 Luftdruck und Luftdichte II.2 Windgeschwindigkeit II.3 Temperatur II.4 Feuchte II.5 Strahlung II.3 Temperatur 1. Thermodynamische Systeme • thermodynamische Systeme • 0-ter Hauptsatz der Thermodynamik • Zustandsgrößen, Arbeit 2. 1. und 2. Hauptsatz der Thermodynamik • Carnot-Kreislauf 3. Potentiale und spezifische Wärme 4. 5. Messskalen Vertikalbewegungen • 6. 7. Potentielle Temperatur Fluss fühlbarer Wärme Temperaturmessung II.3.1 Thermodynamische Systeme Bei einem Luftvolumen interessiert uns meteorologisch nicht das einzelne Molekül und dessen Position und Bewegungszustand. Wir interessieren uns nur für deren relevante statistische Eigenschaften und die gegenseitigen Abhängigkeiten dieser statistischen Eigenschaften. Dies ist der Ansatz der statistischen Physik: Hier betrachten wird das Luftvolumen als ein sogenanntes thermodynamisches System. Thermodynamische Zustandsgrößen beschreiben ein thermodynamisches System z.B. p, T, V, n, innere Energie, …i.a. nicht unabhängig (siehe Gasgleichung) Gleichgewichtszustand p(t)=const, T(t)=const, …alle Zustandsgrößen sind zeitlich konstant Teilgleichgewichtszustand z.B. T(t)=const thermisches Gleichgewicht Was ist Temperatur? • Thermodynamik – Makro-Sicht, Masse+Volumen – Temperatur ist eine Zustandsgröße der Luft • die den Wärmeenergieinhalt (innere Energie) beschreibt, • die wichtig ist für die Richtung des Wärmetransports • Statistische Physik – Mikro-Sicht, Moleküle – Temperatur ist proportional zur mittleren kinetischen Energie der Moleküle (~v²) – Zeigt die Grenzen der Thermodynamik auf (Temperatur verliert ihren Sinn, wenn einzelne Moleküle betrachtet werden 0-ter Hauptsatz der Thermodynamik Die Temperatur kennzeichnet den Wärmezustand eines thermodynamischen Systems. Sind zwei Systeme miteinander in Kontakt, so ändert sich ihre Temperatur nur dann nicht, wenn diese gleich sind. Temperatur ist eine Zustandsgröße eines thermodynamischen Systems Im thermodynamischen Gleichgewicht ändert sich die Temperatur nicht Zustandsgrößen (a) Es sei der thermodynamische Zustand durch k Zustandsgrößen eindeutig bestimmt. Eine weitere Größe T ist dann ebenfalls eine Zustandsgröße, wenn gilt: Beispiel ideales Gas (k=2): T = T(p,V) = pV/(nR*) p T(p,V) ∆T = dT = 0 entlang geschlossenem Weg d.h. wenn bei einem beliebigen geschlossenen Weg des Systems im durch die k Zustandsgrößen aufgespannten Zustandsraum T wieder den gleichen Wert annimmt, oder wenn T eindeutig über die k Zustandsgrößen definiert ist. V Zustandsgrößen (b) Alternativ ist die Feststellung, dass T genau dann eine Zustandsgröße ist, wenn sie sich als totales Differenzial von Zustandsgrößen darstellen lässt, die ein thermodynamisches System vollständig beschreiben. Beispiel: T = f(p,V) ∂T dp ∂T ∂T p ∂ dT = dp + dV = ⋅ ∂T dV ∂p ∂V ∂V = ∇T ⋅ ds p dp ds dV V Achtung: Hier bezeichnen wir mit d nicht die Änderung eines mit dem Wind bewegten Volumens – eine Inkonsistenz im Bezeichnungssystem in der Meteorologie, leider. Auch der Nabla-Operator ist hier anders zu verstehen. Die Raumkoordinaten des Partikels sind ausgetauscht durch andere – allgemeinere – Koordinaten, die den Zustand eines Systems beschreiben. (Ausdehnungs)Arbeit eines Gases V V+ V p V = (Kraft/Fläche) x Volumen = Kraft x Weg = A (Arbeit) Dehnt sich ein Luftvolumen aus und verschiebt dabei angrenzende Luftvolumina gegen den dort herrschenden Druck, so leistet die Luft Arbeit an der Umgebung. Infinitesimal, d.h. sehr kleine Volumenänderungen ( V 0): A A=pdV Achtung: Wir benutzen A anstatt dA, weil „d“ vollständigen Differentialen, d.h. Zustandsgrößen wie der Temperatur vorbehalten ist Übung zu II.3.1 1. Vollziehe mit unterem Diagramm das geschlossene Linienintegral der Ausdehnungsarbeit eines Gases nach: 2 3 4 1 1 2 3 4 δA = pdV = pdV + pdV + pdV + pdV δA = ? δA = p2 (V2 − V1 ) − p1 (V2 − V1 ) > 0 also leistet das Gas Arbeit in p p2 1 2 p1 4 3 VV V1 diesem " Kreisprozess" δA ≠ 0 , 2 2. Schreibe mit Hilfe der Gasgleichung den Druck als vollständiges Differential von T und ; also dp=xdT+yd (bestimme x und y). II.3.2 Erster und zweiter Hauptsatz der Thermodynamik • • • • Ausdehnungsarbeit und Temperatur 1. Hauptsatz der Thermodynamik adiabatische Zustandsänderungen Carnot-Kreisprozess – Entropie – 2. Hauptsatz der Thermodynamik Quelle der Ausdehnungsarbeit und Auswirkung auf die Temperatur Bei fester Wand ändern auftreffende Luftmoleküle nur ihre Richtung; ihre kinetische Energie bleibt konstant und damit auch die Temperatur im Volumen. Bewegt sich die Wand z.B. durch den Druck der Luftmoleküle nach rechts, so haben die reflektierten Luftmoleküle eine geringere kinetische Energie; da die Temperatur proportional zur mittleren kinetischen Energie eines Luftmoleküls ist nimmt die Temperatur im Volumen ab. Ausdehnung eines Gases gegen einen äußeren Druck führt zur Abnahme der Temperatur des Gases. Die Temperatur hängt mit der inneren Energie des Gases zusammen. Es gibt also eine Umwandlung zwischen innerer Energie und Ausdehnungsarbeit ( Erster Hauptsatz der Wärmelehre) 1. Hauptsatz der Thermodynamik 1. Führt man einem idealen Gas die Wärmemenge Q zu, so kann das Gas diese in (Ausdehnungs-)Arbeit A und innere Energie U umwandeln: Q = A + U 2. Die Ausdehnungsarbeit eines idealen Gases ist gegeben durch A=p V 3. Die innere Energie eines idealen Gases ist nur von der Temperatur abhängig U=U(T) 4. Wir führen spezifische Größen ein, also Q q=Q/m, A a=A/m, U u=U/m mit m Masse du (T ) = δq − pdα δa oder dU (T ) = δQ − pdV δA Bezeichnungen • Eine Zustandsänderung eines thermodynamischen Systems wird als adiabatisch bezeichnet, wenn keine Wärmezu- oder –abfuhr erfolgt, also Q=0 oder q=0 . • Erfolgt die Zustandsänderung ohne diese Einschränkung, so spricht man von diabatischen Zustandsänderungen. Beispiel Carnot-Kreislauf (a) dU (T ) = δQ − pdV 1 → 2 isotherme Expansion (warm) dU (T ) ≡ 0 (da U nur von T abhängt) = δQ − pdV >0 δQ > 0 Wärmezufuhr Isothermen (T=const) p 1 δQ = pdV PV = nR *T 2 2 4 3 Adiabaten (kein Wärmeübergänge) = V nR *Tw dV V δQ = ∆Q12 = nR *Tw 1 2 1 2 dV = nR *Tw d ln V V 1 V2 = nR Tw (ln V2 − ln V1 ) = nR Tw ln V1 * * Beispiel Carnot-Kreislauf (b) 2 → 3 adiabatische Expansion (großes V ) δQ ≡ 0 (abgeschlossenes System) dU (T ) = − pdV dU (T ) = δQ − pdV >0 dU < 0 Temperaturabnahme Isothermen (T=const) p 1 Arbeitsleistung pdV des Systems auf Kosten der inneren Energie U 2 4 3 Adiabaten (kein Wärmeübergänge) V Einschub : Gleichverteilungssatz (später genauer) n Mole des Gases f Freiheitsgrade eine Moleküls → U (T ) = 1 2 fnR *T , dU = → 12 fnR *dT = − pdV 1 2 = Gasgleichung fnR *dT − nR*T dV V 2 2 2 f dT dV f → =− , d ln T = − d ln V → TkV3 = TwV2 f 2 T V f Beispiel Carnot-Kreislauf (c) dU (T ) = δQ − pdV 3 → 4 isotherme Kompression (kalt) dU (T ) ≡ 0 (da U nur von T abhängt) = δQ − pdV >0 δQ < 0 Wärmeabfuhr Isothermen (T=const) p 1 δQ = pdV = PV = nRT 2 4 4 nRTw dV V δQ = ∆Q34 = nR*Tk 3 3 Adiabaten (kein Wärmeübergänge) V 4 3 = nR *Tk ln V4 V3 4 dV = nR *Tk d ln V V 3 Beispiel Carnot-Kreislauf (d) dU (T ) = δQ − pdV 4 → 1 adiabatische Kompression (kleines V ) δQ ≡ 0 (abgeschlossenes System) dU (T ) = − pdV <0 dU > 0 Temperaturzunahme Isothermen (T=const) p 1 Arbeitsleistung − pdV am System erhöht innere Energie U 2 TkV4 4 3 Adiabaten (keine Wärmeübergänge) V 2 f = TwV1 2 f zusammen mit TkV3 V2 V3 = V1 V4 2 f = TwV2 2 f folgt Carnot-Kreislauf dU (T ) = δQ − pdV Isothermen (T=const) p 1 Folgerung 1 : dU (T ) ≡ 0 da U Zustandsvariable δQ = δA ≠0 ≠0 δQ = ∆Q12 + ∆Q34 > 0 zu zeigen als Übung 2 4 3 Adiabaten (keine Wärmeübergänge) V d.h. dem System wird insgesamt Wärme zugeführt, womit es Arbeit leistet Carnot-Kreislauf Folgerung 2 : dU (T ) = δQ − pdV Wirkungsgrad der Wärmekraftmaschine geleisteteArbeit η= Isothermen (T=const) hinein gesteckte Wärme p 1 ∆Q34 ∆Q12 + ∆Q34 = = 1− ∆Q12 ∆Q12 2 4 Adiabaten (keine Wärmeübergänge) = 1− nRTk ln V2 V3 V1 Tk = 1− Tw 3 nRTw ln V < 1 , umso größer V4 je größer die Temperaturdifferenz Carnot-Kreislauf dU (T ) = δQ − pdV Folgerung 3 : Definition der Entropie δQ = ∆Q12 + ∆Q34 ≠ 0 , aber δQ T Isothermen (T=const) p 1 = ∆Q12 ∆Q34 + ≡0 Tw Tk Definition Entropie : S = δQ T S ist eine Zustandsgröße Anmerkung : der Carnot - Kreislauf ist eine Idealisierung (Annahme : thermisches 2 Gleichgewicht). 4 3 Adiabaten (keine Wärmeübergänge) V Es gilt : η Carnot > η real reversibel also dS ≥ irreversibel Übung δQirrev T <0 δQ T In einem abgeschlossenen System ( Q = 0) bleibt die Entropie konstant oder nimmt zu. Carnot-Kreislauf dU (T ) = δQ − pdV Isothermen (T=const) p 1 2 4 3 Adiabaten (keine Wärmeübergänge) V Folgerung 4 : 2. Hauptsatz der Themodynamik : Wärme kann nicht vollständig in Arbeit umgesetzt werden. Folgerung 5 : Die Atmosphärefunktioniert wie eine Wärmekraftmaschine: Unter hohem Druck wird Wärme zugeführt (am Boden durch Wärmeflüsse), unter niedrigem Druck (oben, durch Ausstrahlung) wieder abgeführt. Folgerung 6 : Neue Formulierung des 1.HS : du(T ) = Tds − pdα Übungen zu II.3.2 1. 2. 3. Zeige, dass beim beschriebenen Carnot-Kreislauf (Folgerung 1) insgesamt Wärme zugefügt wird. Zeige, dass beim beschriebenen Carnot-Kreislauf das Linienintegral über Q/T bei irreversiblen Prozessen nicht verschwindet (Folgerung 3) Versuche eine qualitative nur schematische Darstellung einer idealisierten Hadley-Zirkulation im p-V-Diagramm. Dabei fließt Luft am Boden von den Hochdruckgebieten der Subtropen zu der tropischen Tiefdruckrinne und erwärmt sich dabei durch Wärmeaufnahme vom Untergrund leicht. Dort steigt sie adiabatisch auf und fließt dann zurück unter leichter Druckabnahme und Temperaturabnahme (durch Abstrahlung in das Weltall) zu den Subtropen, wo sie wieder adiabatisch zum Boden sinkt. II.3.3 Thermodynamische Potentiale und spezifische Wärme • Bislang hatten wir den Zustand eines thermodynamischen Systems immer im pV-Diagramm dargestellt (siehe Carnot-Kreisprozess). • Im p-V- Diagramm können wir über die ideale Gasgleichung die Temperatur T eines idealen Gases eindeutig darstellen (Isothermen im p-V-Diagramm). • Der 1. Hauptsatz als totales Differential du=Tds-pd gibt uns eine andere Möglichkeit der 2-dimensionalen Zustandsdarstellung eines thermodynamischen Systems, nämlich die innere Energie im s- -Raum. • Eine energetische Zustandsdarstellung (u hat die Einheit einer spezifischen Energie, J/kg) wird bevorzugt, weil dann der Satz der Energieerhaltung unmittelbar anwendbar ist (z.B. Änderungen müssen durch Zu-/Abfuhr anderer Energien bewirkt werden. • Energetische Zustandsvariable werden auch als thermodynamische Potentiale bezeichnet. Mit du = Tds − pd 1. T = ∂u ∂s ≡ also u = u(s, ) können folgende Beziehungen abgeleitet werden : ∂u ∂u ∂u ≡ , −p= da du vollständiges Diff. bzw. Definition part. Ableit. ∂s ∂ s ∂ ∂ 2u ∂ 2u ∂T ≡ → 2. ∂s∂ ∂ ∂s ∂ =− s ∂p ∂s sogenannte thermodyna mische Relationen Weitere thermodynamische Potentiale Die innere Energie ist offensichtlich eine adäquate Beschreibung eines thermodynamischen Systems, wenn man seinen Zustand in Abhängigkeit von der Entropie s und seinem spezifisches Volumen betrachtet. Oft sind andere Darstellungen zweckmäßig, z.B. im T- -Raum; dies erhält man durch Anwendung der sog. Legendre-Transformation. Ersetze s durch T durch Definition der freien Energie f = u - Ts → df = d (u − Ts ) = du − d (Ts ) = Tds − pdα − Tds − sdT = − pdα − sdT → f = f (T ,α ) Analog erhalten wir für α → p Enthalpie h(s, p) freie Enthalpie g(T,p) , also insgesamt : und s → T ∧ α → p Innere Energie : u (s,α ) h ( s, p ) = u + p α Enthalpie : f (T ,α ) = u − Ts Freie Energie : du = Tds − pd α dh = Tds + α dp df = −sdT − pd α Freie Enthalpie : g (T , p ) = u − Ts + p α dg = −sdT + α dp Damit haben wir drei weiter thermodynamische Potentiale, die zur Behandlung thermodynamischer Probleme verwendet werden können. Wenn wir z.B. den Sättigungsdampfdruck des Wasserdampfes, der nur von der Temperatur abhängt behandeln (e*=e*(T)), werden wir die freie Enthapie verwenden. Spezifische Wärmen c Wärmeenergiezufuhr pro Massen- und Temperatureinheit, [c]=J/(kg K) i.a. vom Weg, z.B. bei Gasen von Annahmen über p und abhängig spezifische Wärme bei konstantem Volumen cv cv ≡ δq dT = α Tds du = dT α dT ≡ α du dT da du = Tds-pd und u = u (T ) spezifische Wärme bei konstantem Druck c p cp ≡ δq dT p Tds = dT p dh ≡ dT u = cvT h = c pT da dh = Tds + dp und h = h(T ) Joule-Kelvin-Prozess Vakuum u (T = 0) = 0 h(T = 0) = 0 p dh = dT T bleibt konstant Beziehung zwischen cv und cp Tds = du + pdα = cv dT + d ( pα ) − αdp mittels Gasgleichung = cv dT + RdT − αdp = (cv + R )dT − αdp ≡ dh − αdp wegen 1. H.S. dh = Tds + dp = c p dT − αdp Luft : c p = 1004 J/(kgK) cv = 717 J/(kgK) RL = 287 J/(kgK) c p − cv = R cp 2 2 = 1 + = 1 + = 1,4 5 cv f f Anzahl der Freiheitsgrade (Nachweis übernächst e Seite) Freiheitsgrade = unabhängige Bewegungsmöglichkeiten eines Teilchens, mit denen es innere Energie speichern kann Jedes Molekül besitzt drei Translationsfreiheitsgrade entsprechend den drei Raumrichtungen, in die es sich bewegen kann. Zweiatomige Moleküle besitzen zusätzlich zwei Rotationsfreiheitsgrade mit Achsen senkrecht zur Verbindungsachse Dreiatomige nichtlineare Moleküle besitzen drei Rotationsfreiheitsgrade Hinzu kommen Vibrationsfreiheitsgrade; einer beim zweiatomigen Molekül, drei bei einem dreiatomigen Molekül. Diese sind aber bei den Atmosphärentemperaturen wenig „aktiviert“. Da Luft i. W. aus 2-atomigen Molekülen besteht hat sie 5 Freiheitsgrade. cp 2 = 1+ cv f Beweis von Gleichverteilungssatz : Pro Freiheitsgrad beträgt die Energie eines Moleküls E = 1 k BT mit k B = 1,3806 × 10- 23 J/K Boltzmann - Konstante 2 Dann folgt E= f 2 k BT = f dEmol = f 2 de = du = f cv = du dT R * T , J / Molekül mit L Loschmidtsche Zahl L 2 R *dT 2 = f R* 2 , J / Mol M R* dT M , J / kg mit M Molmasse * R , c p = cv + * R = M M 1+ f 2 cp cv = 1− f 2 Übungen zu II.3.3 1. 2. Leite die Formulierungen des 1. Hauptsatzes für Enthalpie und freie Enthalpie ab. Bestimme cp und cv für Luft unter der Annahme, dass diese nur aus Wasserdampf besteht. II.3.4 Definition der Temperatur und ihrer Maßskalen • • • • • 0-ter Hauptsatz Gasthermometer (über Gasgleichung) Gaskinetische Deutung 2. Hauptsatz der Thermodynamik Empirische Temperaturskalen (Celsius, Kelvin etc.) 0-ter Hauptsatz Temperatur ist eine Zustandsgröße. + Im thermischen Gleichgewicht haben alle Körper die gleiche Temperatur. Damit kann die Temperaturmessung erfolgen, in dem man einen Probekörper, dessen Temperatur man irgendwie messen kann, in den zu messenden Körper, z.B. die Luft, einbringen und so lange wartet, bis sich die Temperatur nicht mehr ändert. TP TK Prinzip des Gasthermometers nR* T Gasgleichung : pV = nR T * 2 Zustände mit n = const p,V,T und p0 ,V0 ,T0 i) p = p0 = const → T = T0 ii) V = V0 = const V V0 Rechten Schenkel senken bis beide Flüssigkeitsspiegel auf gleicher Ebene sind. Dann ist Innendruck gleich dem äußerem Luftdruck. Dann kann die Volumenänderung (V) bestimmt werden und damit T. T p0 V p = = T0 p V0 nR * T0 p0 → T = T0 T0 T0+ T T=T0 p p0 Rechten Schenkel heben bis linker Flüssigkeitsspiegel wieder auf ursprünglicher Höhe ist. Dann ist V=V0. Dann kann die Druckänderung (p) über die Höhe der Säule bestimmt werden und damit T. Gaskinetische Deutung der Temperatur Ekin m 2 3 = v = k BT 2 2 mittlere kinetische Energie der Moleküle , T = 0 → v = 0 2. Hauptsatz – Carnot-Kreisprozess ∆q1 ∆q2 = T1 T2 ∆q1 T1 = ∆q2 T2 beim reversiblem Kreisprozess Stoff - unabhängige Messung der Temperatur durch Bestimmung der Wärmeflüsse. Empirische Temperaturskalen Celsius - Skala : 0°C = 273,15 K Fahrenheit − Skala : 0° F = -17 ,78°C , 100° F = 37°C (Körpertemperatur des Menschen) [°F] = 9 5 [°C ] + 32 , [°C] = 5 9 ([°F ] − 32) Reaumur − Skala : 0°C = 0° R , 100°C = 80° R Übungen zu II.3.4 • Um wieviel % seines Volumens dehnt sich ein Luftvolumen aus, wenn es isobar von 0°C auf 27°C erwärmt wird? • Wie schnell ist im Mittel ein Sauerstoffmolekül, wenn die Lufttemperatur 20°C beträgt? II.3.5 Temperaturänderung der Luft bei Vertikalbewegungen • • • • • • • Adiabatische Form des 1. HS der Thermodynamik Poisson-Gleichung Potentielle Temperatur Temperaturprofil in der turbulenten Grenzschicht Adiabatischer Temperaturgradient Energiebetrachtung beim Aufsteigen Potentielle Temperatur und Entropie Problemstellung Wir betrachten die Temperaturänderung eines Luftvolumens, das wir in der Atmosphäre (Umgebungu) nach oben oder unten verschieben. Annahmen: 1. „trocken“: keine Kondensation von Wasserdampf 2. adiabatisch: keine Wärmeleitung, Strahlungserwärmung oder Strahlungsabkühlung, oder Diffusion, also q=0 3. Instantaner Druckausgleich mit der Umgebung, p=pu du (T ) = − pdα 1. HS für adiabatische Prozesse : Ausgle ich zwischen Innerer Energie und Ausdehnun gsarbeit 4. Beim Aufsteigen nimmt nach der statischen Grundgleichung dpu=- ugdz der Druck in der Umgebung (und im Luftvolumen p) ab. 5. Nimmt dabei die Dichte ab (und damit zu), so leistet das Gas Ausdehnungsarbeit auf Kosten der inneren Energie u: diese (und mit u=cvT auch die Temperatur T) nehmen ab. Tu(z) aktuelles Temperaturprofil z T − ∆T dT =? dz T T + ∆T T zunächst: Temperaturänderung mit dem Druck - Poisson-Gleichung adiabatisch δq = dh − αdp ≡ 0 cpdT = αdp = RLT dp p mit dh = cpdT undα = RLT Poisson − Gleichung p mit Variablentrennung RL dT dp = RL , cpd lnT = RLd ln p mitIntegration cp T p T R p R lnT2 − lnT1 = L (ln p2 − ln p1 ) , ln 2 = L ln 2 mit exp() T1 cp p1 cp 0 T p 0 -pk cp = k = 0,286 p p0 k StüweDiagramm 300 500 1000 cp p2 p1 T ( p ) = T ( p0 ) TrockenAdiabaten -p T2 = T1 RL dT dp T =∞ p =0 1000 T Definition der Potentiellen Temperatur = Temperatur, die ein Luftvolumen annimmt, wenn es adiabatisch auf einen Referenzdruck po (meist 1000 hPa) gebracht wird. Berechnung : Setze in Poisson - Gleichung -p 0 pA p2 = p0 A T2 ≡ θ pB p0 A TB Temperatur bei Referenzdruck p1,T1 → p,T beliebig B TA Referenzdruck B T p0 θ =T p RL cp Die potentielle Temperatur ist eine Konstante (konservative Größe) bei adiabatischen Bewegungen eines Luftvolumens. Adiabatischer Temperaturgradient cpdT = αdp = 1 ρ dT dz ad 1.HS für adiabatische Bewegung(mit Enthalpie) z (− ρu gdz) dT dz mit dp ≡ ∂pu = −ρu g∂z = −ρu gdz ∂Tu ∂z ad instantaner Druckausgleich mit Umgebung =− RLT pu T gdz = − gdz wieder mit p = pu p RLTu Tu dT → dz ad T g =− Tu c p g ≅− cp = −0,98 K/100m Tu z g − cp T >1 Tu T T <1 Tu T T Temperaturprofil bei Durchmischung a) Atmosphäre sei in Ruhe. Sie werde vom Boden (bei T0) durch Wärmeleitung etc. angeheizt. Strahlungsprozesse in der Atmosphäre seien vernachlässigbar. b) Einsetzen von Turbulenz und damit vertikale Durchmischung, die innerhalb der Atmosphäre adiabatisch erfolgen soll. z z T0 T T(z)=T0=const im thermischen Gleichgewicht T0 T Adiabatisches Profil stellt sich ein mit T0 als Temperatur in Bodennähe. Energiebetrachtungen beim Aufsteigen c p dTad = αdp ≅ −gdz Integratio n → c p (T − T0 ) + g ( z − z0 ) = 0 c pT0 = c pT + g ( z − z0 ) wähle z0 als Referenzhöhe c pθ = c pT + g ( z − z0 ) const Enthalpie potentielleEnergie Beim adiabatischen Aufstieg/Abstieg wird Enthalpie in potentielle Energie umgewandelt und umgekehrt. Aus der 1. Form des 1. HS mit der inneren Energie u folgte, dass bei adiabatischen Bewegungen innere Energie in Ausdehnungsarbeit umgewandelt wird bzw. umgekehrt. cp - und damit auch die potentielle Temperatur - sind Konstanten (konservative Größen) bei adiabatischen Umlagerungen. Entropie s und potentielle Temperatur δq = c p dT − αdp δq 1 dT ≡ ds = c p − dp ρT T T ds = c p d lnT − RL d ln p ds ≡ c p d lnθ p θ =T 0 p lnθ = lnT + RL RL cp cp ln p p0 c p lnθ = c p lnT − RL ln p − RL ln p0 const c p d lnθ = c p d lnT − RL d ln p T δq = Tds = c pTd lnθ = c p dθ ≈ c p dθ θ ~1 Wärmezu und –abnahmen sind in etwa proportional zur Änderung der potentiellen Temperatur – und nicht der thermodynamischen Temperatur!!! Übungen zu II.3.5 1. 2. 3. 4. Zeige dass bei adiabtischen Zustandsänderungen gilt dT/dp|p=0 = . Ein Teilchen habe bei 500 hPa die Temperatur – 20°C. Welche Temperatur hätte es bei adiabatischer Bewegung auf 1000 hPa? Wie ändert sich in einer isotherm geschichteten Atmosphäre die potentielle Temperatur mit der Höhe? In 800 hPa habe ein Luftvolumen von 1 kg Masse die Temperatur 0°C. Es sinke adiabatisch auf 1000 hPa ab. Dort erhöhe sich danach seine Temperatur isobar um 5 K. Welche Temperatur und welche potentielle Temperatur hat dann das Teilchen? Um wie viel haben sich seine vier massenspezifischen thermodynamischen Potentiale geändert? II.3.6 Fluss fühlbarer Wärme • • • • • Die Atmosphäre wird wesentlich durch ihren Kontakt mit der Erdoberfläche erwärmt. Direkt an der Erdoberfläche (wenige mm) geschieht das durch Wärmediffusion. Diese lässt sich wegen der Inhomogenität des Untergrundes nicht messen. Oberhalb dieser sehr dünnen Schicht erfolgt der Wärmetransport i.w. durch Turbulenz; dieser Transport lässt sich, wie im letzten Kapitel diskutiert, durch hochfrequente Messung von Temperatur und Vertikalgeschwindigkeit direkt messen (oder aus dem Temperatur- und Windprofil abschätzen). w‘T‘ ist nicht die geeignete Formulierung für den Wärmetransport, da sich T durch adiabatische Druckänderung mit der Höhe verändert, ohne dass Wärme transportiert wird. w‘ ‘ ist die geeignete Formulierung, da die potentielle Temperatur eine Konstante bei adiabtischen Abläufen ist. Wärmehaushaltsgleichung - Vereinfachung durch potentielle Temperatur dh = c p dT = Tds + αdp Än derung der Enthalpie im Volumenel ement 1.HS dh = cp dt → dT ds dp =T +α Änderun g mit der Zeit dt dt dt ∂T = + (v ⋅∇ )T ∂t ( ) ∂h ∂T ds dp = cp = − cp v ⋅ ∇ T + T +α Haushaltsgleichung der Enthalpie ∂t ∂t dt dt Advektion in das Volumen Quellen + Senken im Volumen Vereinfach ung durch potentielle Temperatur (Druckterm dann schon drin! ) c p dθ = c pθd lnθ = θds cp ( ) ∂θ = − cp v ⋅ ∇ θ + ∂t Advektion , cp ( ) dθ ds dθ ∂θ mit + v ⋅∇ θ =θ = dt dt dt ∂t ds θ dt =Qu Quellen und Senken ohne Druckterm Gemittelte Haushaltsgleichung (a) ∂θ Mittelung von c p = −c p v ⋅ ∇ θ + Qu ∂t ∂θ = − cp v ⋅ ∇ θ − cp c p ∇ v ′θ ′ → ∂t ( ( lokale Änderung der potentiellen Temperatur ) ) ( ) Advektion durch mittlere Strömung + Qu Divergenz des turbulente n Flusses von c pθ gemittelte r Quellterm Haushaltsgleichung der fühlbaren Wärme i ) Qu Erwärmung des Volumens durch innere Reibung + Divergenz der Strahlungsflüsse + Divergenz der molekulare nWärmeleit ung H mol H mol = −λ∇T = −c p ρa∇T mit λ Wärmelei tfähigkeit ( ≅ 0,026 J/(m2s )) und a = λ Annahme : ρc p Temperatur leitfähigkeit ( ≅ 2 × 10 -5 m 2s ) ∂T = 1 K / m → H mol ≈ 0,026 W/m 2 ∂x sehr klein! Gemittelte Haushaltsgleichung (b) ∂θ cp ∂t lokale Änderung der potentiell en Temperatur ii ) c p v ⋅ ∇ ( ) ( ) c p ∇ v ′θ ′ = − cp v ⋅ ∇ θ − Advektion durch mittlere Strömung + Qu Divergenz des turbulente n Flusses von c pθ gemittelte r Quellterm Advekti on fühlbarer Wärme (ist bei Divergenzfreiheit des Windfelde s proportional zur Divergenz des konvektive n Transports fühlbarer Wärme H konv mit H konv = c p ρ v ii ) c p∇v ′ ′ ∝ der Divergenz des turbulenten Flusses fühlbarer Wärme Hturb = ρc p v ′ ′. Ist i.a. schwierig zu messen; daher werden Parametrisierungsansätze entwickelt analog zu größerskaligen Flüssen. Gradientansatz : Hturb ≡ − ρc pK∇θ mit K (i.a. >> a) turbulenter Diffusionskoeffizent → H = Hmol + Hturb ≅ Hturb in der freien Atmosphäre Turbulente Wärmeflüsse und vertikales Temperaturprofil A z B : θ A = θ B → keine Profiländerung, kein Wärmefluss θ A > θ B → TA nimmt zu, TB nimmt ab, Wärmefluss nach unten θ A < θ B → TA nimmt ab, TB nimmt zu, Wärmefluss nach oben ∂θ z z T, = 0 → H = 0 (kein Wärmefluss) ∂z ∂θ > 0 → H < 0 (abwärts) ∂z ∂θ < 0 → H > 0 (aufwärts) ∂z z T, T, Übungen zu II.3.6 • Erläutere warum bei der Bestimmung des turbulenten Wärmeflusses (Fluss fühlbarer Wärme) H die potentielle Temperatur und nicht die Lufttemperatur verwendet werden muss. II.3.7 Temperaturmessung • Prinzipien: – Temperatur eines Probekörpers im thermischen Gleichgewicht (direkte Messung) – Strahlungsmessung und Interpretation nach Planckschem Strahlungsgesetz (Fernerkundung, Satelliten) – Laufzeitmessung des Schalls (Fernerkundung) • Meteorologisch wichtige Temperaturen: – Lufttemperatur ( Grundgleichungen) – Bodentemperatur ( Wärmeaustausch mit Untergrund) – Temperatur unter besonderen Bedingungen) • • • • Feuchtes Thermometer Luftfeuchte Thermometer unter Sonnenbestrahlung Sonnenstrahlung) Thermometer über kochendem Wasser Luftdruck) Temperatur eines beheizten Drahtes Windstärke) Direkte Messmethoden i) Flüssigkeitsthermometer: Prinzip: Ausdehnung von Flüssigkeiten bei Temperaturänderungen) ii) Bimetallthermometer: Prinzip: Unterschiedliche Ausdehnung zweier längs verlöteter Metallstäbe iii) Thermoelement: Prinzip: Verlöten zweier Metalle mit unterschiedlichen Austrittsarbeiten für Elektronen iv) Widerstandsthermometer: Prinzip: Widerstand R von Metallen und Halbleitern hängt von der Temperatur ab. Quecksilber (Hg) Schmelzpkt, °C Siedepkt., °C 96% Alkohol -38,8 -117 +359,7 +78 1 + 2 kleine große Austrittsarbeit ++ -- - + Tk Metalle : R = R0 (1 + αϑ ) Halbleiter : R = R0e b T Tw R R T T Flüssigkeitsthermometer • …sind (noch) meist verwendet in der Meteorologie • … benötigen wir jetzt um tieferen Verständnis der Temperaturmessung die Wärmehaushalts- und Oberflächenernergiebilanzgleichung • …daraus folgt die Notwendigkeit der Belüftung eines Thermometers. • …und die Bauart des Thermometers bestimmt die Trägheit (Ansprechzeit). • Alles gilt auch für die meisten anderen thermometerarten. Flüssigkeitsthermometer (1) Volumen : V (ϑ ) = V (ϑ = 0°C )(1 + βwϑ ) Aufbau: mit ϑ Temperatur in °C βw (Hg ) = 18 × 10 −5 K −1 TK → nur 1 des Volumens bei ∆T = 50K 100 → großer Flüssigkeitsbehälter mit sehr dünn ausgezogenem Schaft Wärmehaushaltsgleichung dU dT = m ⋅ c ⋅ K , J/s = W dt dt = S ⋅ F ab/zugeführteWärme über Oberfläche F durch Wärmeflussdichte S, [S ] = W / m 2 U innere Energie der Flüssigkeit m Masse der Flüssigkeit c spezifische Wärmekapa zität der Flüssigkeit Trägheit des Thermomete rs : mc F dT K dt möglichst groß, ↑ damit schnelle möglichst Angleichun g klein an Lufttemper atur also TL m, c klein F groß bei empfindlic hen Thermomete rn = S hängt i.w. nur von T -Differenz Thermomete r zu Luft ab Flüssigkeitsthermometer (2) 4 mc dTK = S = Si F dt i =1 = α L (TL − TK ) turbulente r Fluss fühlbarer Wärme an die Umgebung mit α L Wärmeüber gangskoeff izient + εKK kurzwellige Strahlungsbilanz mit ε K kurzwelliges Absorptionsvermögen TK und K einfallende kurzwellige Strahlungsflussdichte + S(TW − TK ) langwellige Strahlungsbilanz mit α S Strahlungsübergangszahl + (TS − TK ) und TW Umgebungst emperatur (z.B. Wand) Wärm eleitung aus dem Schaft mit β Wärmeüber gangskoeff izient und TS Schafttemp eratur dTK =0 Annahme : Stationarität, d.h dt 1 [ε K K + S(TW − TK ) + (TS − TK )] ≠ 0 TK − TL = αL TL TK (1- K)K K TW TK TS TK D.h. ist Tk konstant, so ist Tk nicht unbedingt die Lufttemperatur Tl , die ich messen will. Flüssigkeitsthermometer (3) Um TK ≡ TL (Thermometer zeigt Lufttemperatur an), also TK − TL = 1 αL [ε K K + S (TW − TK ) + (TS − TK )] ≅ 0 zu erreichen, können folgende Maßnahmen getroffen werden : 1) α L muss möglichst groß sein Mit α L ≅ 3 v , v Anströmge schwindigk eit d d Durchmesse r des Thermomete rs sollte das Thermomete r belüftet werden und/oder möglichst klein gehalten werden 2) Die Strahlungsterme können reduziert werden durch Strahlungsschutz und die Umgebung (Hütte) sollte auf Lufttemper atur gehalten werden 3) Der Schaft sollte ebenfalls möglichst auf Lufttemper atur gehalten werden (mit in Belüftung einbeziehen) und möglichst dünn sein. Flüssigkeitsthermometer (4) - Zeitverhalten des idealen Thermometers 1 mc F dTK F α L (TL − TK ) ≡ (TL − TK ) mit τ = = ≅ Trägheitszeit S τ Fα L dt mc keine Strahlung, mc kein Wärmeflus s ausSchaft 1 τ Integration (Annahme TL = const) : dTK 1 = d ln(TK − TL ) = − dt TK − TL τ TK − TL 1 = − (t − t 0 ) ln τ TK ,0 − TL TK − TL = (TK ,0 − TL ) e T −Differenz zur Zeit t − t TK t0 exp t −t 0 τ t0 T −Differenz zur Zeit t 0 Bei t − t 0 = τ → e − t −t 0 τ τ TL = e −1 = 0,368 ≈ 1 / 3 also nach einer Zeitdauer von τ ist die ursprüngliche Temperatur differenz auf ein Drittel abgesunken 0,368(TK ,0 − TL ) t Übung: Bestimme die Reduktion in % von TK,0-TL nach einer Zeitperiode von 2, 4 und 6 Übungen zu II.3.7 Bestimme die Reduktion in % der Anfangsdifferenz zwischen Thermometeranzeige und Lufttemperatur Tk,0TL nach einer Zeitperiode des zwei-, vier- und sechsfachen der Trägkeitszeit des Thermometers. Wie lange dauert es , bis man bei einem Thermometer mit Trägheitszeit 3 s bei einer Anfangsdifferenz von 10 K die Lufttemperatur mit einer Genauigkeit von 0,1 K bestimmen kann?