Termin 7
Werbung

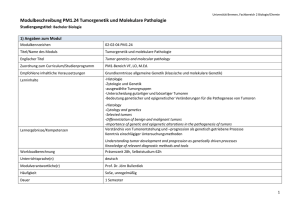
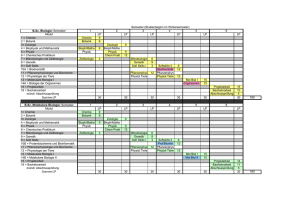
Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016, Termin 7 Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016 Fragen für die Übungsstunde 7 (11.07 - 15.07.) Methoden und Techniken II 1. Sie bekommen die Aufgabe, drei Mutationen (Mut1, Mut2 und Mut3) eines bakteriellen Gens zu charakterisieren. Ein Antikörper gegen das Genprodukt und eine radioaktiv markierte DNA-Sonde für das Gen sind in Ihrem Labor vorhanden. In einem ersten Schritt führen Sie mit allen Mutanten und dem Wild-Typ eine NorthernBlot- und eine Western-Blot-Analyse durch. Wie gehen Sie vor? Beschreiben Sie kurz die einzelnen Schritte. Hier sind die Resultate Ihrer Analysen: (Beachten Sie: Die Gelelektrophoresen liefen von „oben nach unten“: kleinere RNAMoleküle/Proteine laufen schneller, finden sich also im unteren Teil der Gele, größere RNA-Moleküle/Proteine verbleiben im oberen Teil der Gele.) a) Was können Sie anhand dieser Daten über die Mutationen sagen? 1 Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen b) c) SS 2016, Termin 7 Welches Ergebnis erhalten Sie, wenn Sie alle 3 Mutationen mit Hilfe eines Southern Blots untersuchen würden? Zeichnen Sie die zu erwartenden Signale in die Abbildung unten ein. Von Mut4 und Mut5 wissen Sie, dass diese die kodierende Sequenz betreffen. Die Abbildung zeigt den Southern Blot von Mut4 und Mut5. Was können Sie über die Art der Mutationen sagen? Welches Ergebnis erwarten Sie nach einer Northern- und Western-Blot-Analyse für Mut4 bzw. Mut5? 2 Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen 2) SS 2016, Termin 7 Sie interessieren sich für die Vererbung bestimmter Merkmale in Familien. Im ersten Experiment wollen Sie überprüfen, in welcher Form ein bestimmtes Gen vorliegt. Für diese Untersuchung stehen Ihnen zwei Sonden (5’-Sonde und 3’-Sonde) zur Verfügung (siehe Abbildung Restriktionskarte). Sie isolieren die DNA aus Zellen der Mundschleimhaut einer Person, führen die in der Tabelle angegebenen Restriktionsspaltungen mit den Enzymen EcoRI (E), PstI (P) und HindIII (H) aus und analysieren mittels Southern Blotting die hybridisierenden Banden. Bitte tragen Sie in die Tabelle ein, welche Banden (Angaben in kb) Sie erwarten: Restriktionskarte: Fragmentlängen in kb, die mit der 5’ Sonde Restriktionsspaltung mit 3’ Sonde hybridisieren HindIII PstI EcoRI HindIII + PstI HindIII + EcoRI EcoRI + PstI 3 Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016, Termin 7 3. Im zweiten Experiment analysieren Sie den Restriktions-Fragment-LängenPolymorphismus (RFLP), der mit einem anderen Merkmal gekoppelt ist und erhalten folgendes Bild einer Familie: Erläuterung: gefüllte Kästchen (♂) bzw. Kreise (♀) sind Träger des Merkmals. Fragen: a) Gibt es Kopplung zwischen dem Merkmal und einer Bande? Wenn ja, welche? b) Was fällt Ihnen bei der Tochter II:4 auf? c) Nennen Sie zwei mögliche Ursachen für Ihre Beobachtung! 4 Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016, Termin 7 4. Eine Stoffwechselerkrankung wird durch Mutationen in einem Gen X verursacht, das ein Protein Y codiert. Es wurden sechs Personen mit verschiedenen molekularbiologischen Methoden getestet. Person A ist die normale (gesunde) Kontrolle. Person B zeigt keine Symptome, jedoch einige ihrer Kinder. Die Personen C bis F leiden unter der Stoffwechselstörung. Man entnahm von allen Personen Gewebeproben und analysierte die DNA nach Fragmentierung durch das Restriktionsenzym HindIII in einem Southern-Blot. Eine Northern-Analyse der mRNA wurde ebenfalls durchgeführt. Bei beiden Analysemethoden testete man die Blots mit einer markierten cDNA des Gens X. Schließlich sollte ein Western-Blot mit einem enzymgekoppelten monoklonalen Antikörper das Vorliegen von Protein Y nachweisen. Die Ergebnisse sind hier für jede Person dargestellt: a) Warum zeigt Person B keine Symptome? b) Schlagen Sie mögliche Defekte bei den anderen Personen vor. 5 Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016, Termin 7 5. Ihre Aufgabe ist es, ein doppelsträngiges DNA-Fragment zu sequenzieren. Zu diesem Zweck haben Sie das Fragment in ein geeignetes Plasmid kloniert und das rekombinante Plasmid gereinigt. Sie wählen die Sanger-Methode, um Ihr Fragment zu sequenzieren. In der folgenden Abbildung ist ein Ausschnitt des Plasmids gezeichnet. Fett und groß gedruckt ist die Sequenz Ihres Fragments, dünn und etwas kleiner die (bekannte) Sequenz des Vektors. a) Geben Sie die Sequenz eines 8 Basen langen Primers an, der als Start für die Sequenzreaktion geeignet ist und Ihnen erlaubt, möglichst viele Basen vom Beginn des Fragmentes zu lesen. Beschriften Sie das 5’- und 3’-Ende des Primers. 3’ ......GGCTAACGTATAGATCCTAGGTACAAACCTGA ...... 5’ b) Nach der Anheftung des Primers teilen Sie den Reaktionsansatz in 4 Portionen und geben diese in 4 Reaktionsgefäße, in denen sich, jeweils spezifisch für die 4 Basen, ein Gemisch verschiedener Nukleotide und DNA-Polymerase befinden. Kreuzen Sie in der folgenden Tabelle an, welche Nukleotide sich in den jeweiligen Reaktionsgefäßen befinden: „A“ „C“ „G“ „T“ 32P-dATP dCTP dGTP dTTP ddATP ddCTP ddGTP ddTTP c) Nach erfolgter Inkubationszeit tragen Sie die Reaktionsgemische auf ein Polyacrylamidgel auf, trennen sie elektrophoretisch auf und machen die DNABanden autoradiographisch sichtbar. In der folgenden Abbildung sehen Sie das Ergebnis der Autoradiographie. Lesen Sie die Sequenz ab, 1. schreiben Sie sie in das unten vorgegebene Feld und 2. markieren Sie in der Sequenz unter a), welchen Bereich ihres Fragments Sie lesen können. Denken Sie an die Beschriftung der 3’- und 5’-Enden! 6 Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016, Termin 7 Gelesene Sequenz: 6. Sie haben genomische DNA vorliegen und wollen daraus das Gen abc mit der PCR-Methode vervielfältigen. a) Was brauchen Sie neben der DNA für den Reaktionsansatz? Beschreiben Sie kurz die einzelnen Schritte der PCR. b) Warum wird bei der PCR keine Helicase benötigt? c) Die folgende Sequenz ist ein Ausschnitt der genomischen DNA. Das Gen abc beginnt mit dem ATG und endet nach dem CAT (beides fett gedruckt). Geben Sie die Sequenz zweier Primer an, die Sie für die PCR einsetzen können. Die Primer sollten möglichst die folgenden Kriterien erfüllen: - Länge um 18 bp - GC-Gehalt 40-60 % - nicht mehr als 4 identische Basen ("runs") hintereinander - Tm zwischen 55 °C und 65 °C (abschätzen mit Formel Tm = 4 x G/C + 2 x A/T) - ein oder zwei, aber nicht mehr als drei G oder C am 3'-Ende 5‘-atgatttatgtatcgctaaaacagatatcaaactgctgcgatgtcaacagtatATG... ...CATtatatggttataaaatgtatgcagcacatctactcgtgttatgctgcaatttc-3‘ 7 Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016, Termin 7 d) Sie möchten das Gen abc von der genomischen DNA amplifizieren und das amplifizierte Produkt anschließend in ein Plasmid klonieren. Das Plasmid hat die Schnittstellen von AluI (ATCGAT), PstI (CTGCAG) und XhoI (CTCGAG). Wie müssen Sie Ihre Primer aus c) verändern, so dass das amplifizierte Produkt an jedem Ende eine Schnittstelle erhält? 7. Die folgende doppelsträngige DNA enthält die Sequenz eines eukaryotischen Gens: (a) (1) (2) (3) 5'-ATGGCCTTCACACAGGAAATAGCTATGGAGATGAACGGGC 1 ---------+---------+---------+---------+ 40 3'-TACCGGAAGTGTGTCCTTTATCGATACCTCTACTTGCCCG (4) ATGTCTCGGAGCTTTTAAGGATATCAACCCCTAAGCTC-3' 41 ---------+---------+---------+---------+ 80 TACAGAGCCTCGAAAATTCCTATAGTTGGGGATTCGAG-5' Die Transkription beginnt bei dem hervorgehobenen A/T Paar in Position 17 (mit (a) gekennzeichnet) und verläuft weiter nach rechts. a) Wie lauten die ersten 12 Nukleotide der entstehenden mRNA? Kennzeichnen Sie die 5' und 3' Enden der mRNA. b) Die ersten acht Aminosäuren des Peptids, das hier codiert wird, lauten NH2 – Met – Glu – Met – Asn – Gly – His – Ser - Phe- COOH (eine Codesonne finden Sie im Anschluss an diese Fragen). 1. Unterstreichen Sie die Nukleotide, die der 5' untranslatierten Region des primären Transkriptes des Gens entsprechen. 2. Kennzeichnen Sie die intronale Region des Gens. 3. Schreiben Sie die Aminosäuresequenz über die dazugehörigen Bereiche der DNA. 8 Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen c) SS 2016, Termin 7 Wie wirken sich die folgenden Mutationen auf das entstehende Peptid aus? Bitte begründen Sie Ihre Antwort kurz. (Verwenden Sie für diese Aufgabe die hinten angefügte Code-Sonne.) 1. Das G/C-Paar in Position 22 wird deletiert. 2. Das G/C-Paar in Position 27 mutiert zu einem C/G-Paar. 3. Das A/T-Paar in Position 31 wird deletiert. 4. Eine Inversion von 17 Basen, beginnend hinter Position 41. Geben Sie die resultierende DNA- und Peptidsequenz an. d) Die DNA hätte aus einer Gehirnzelle von Tapirus indicus stammen sollen. Wahrscheinlich ist diese Probe jedoch vertauscht worden und es handelt sich in Wirklichkeit um die DNA einer völlig anderen Spezies. 1. Aus welchem Grund fasste jemand diesen Verdacht? 2. Wie kann man das überprüfen? 8. Sie haben ein Protein, dessen Gen Sie gern isolieren möchten. Dazu müssen Sie in der Lage sein, eine molekulare Sonde herzustellen, um eine cDNA Bank analysieren zu können. Ihnen gelingt die Sequenzierung eines Tripeptids aus diesem Protein. Leiten Sie von der unten angegebenen Sequenz alle möglichen mRNA-Sequenzen ab und schreiben Sie diese auf, indem Sie in den Positionen, in denen der genetische Code degeneriert ist, Y für ausschließlich Pyrimidine, R für ausschließlich Purine und N für alle Basen einsetzen. Geben Sie anschließend die doppelsträngige Sequenz des dazugehörenden DNAStücks an. Vergessen Sie nicht, 5‘ - und 3‘ - Enden zu markieren! Verwenden Sie für diese Aufgabe die beigefügte Code-Sonne! Peptid: NH2 – Tyr – Pro – Asp – COOH mRNA: DNA: 9