DIFICLIR® hemmt die Toxinproduktion in vitro5–7
Werbung

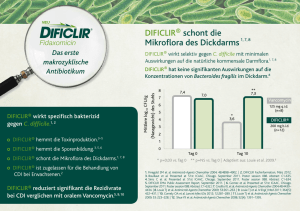
NEU Fidaxomicin Das erste makrozyklische Antibiotikum DIFICLIR® hemmt die Toxinproduktion in vitro5–7 DIFICLIR®: Reduzierte Konzentrationen der C. difficile-Toxine A und B im Vergleich zu Vancomycin Toxin A Clostridium-difficile-Infektion (CDI) – Ein komplexes Problem CDI sind die häufigste Ursache einer nosokomial erworbenen infektiösen Diarrhö in Industrieländern.1 Die Symptome der CDI werden durch C. difficile-Toxine verursacht.2 Die Fähigkeit von C. difficile, Sporen zu bilden, und deren Überlebensfähigkeit in Patienten und in der Umgebung sind die Hauptfaktoren für die Übertragung.2, 3 Die Schädigung der Mikroflora des Dickdarms ist mit einem erhöhten Risiko für CDI verbunden.4 125 125 100 100 75 50 25 0 Toxin B 150 TcdB (%) TcdA (%) 150 75 50 25 3 4 6 8 0 Zeit (Tage) 3 4 Zeit (Tage) 6 8 Vancomycin (1/4 x MHK – 0,125 µg/ml) DIFICLIR® (1/4 x MHK – 0,03125 µg/ml) Adaptiert aus: Sims et al. 2011 6 1. Crobach MJ et al. Clin Microbiol Infect 2009; 15: 1053–1066. 2. Poutanen SM & Simor AE. CMAJ 2004; 171: 51–58. 3. Viswanathan VK et al. Gut Microbes 2010; 1(4): 234–242. 4. Hopkins MJ & Macfarlane GT. J Med Microbiol 2002; 51(5): 448–454. 5. Bouillaut et al. Presented at 51st ICAAC, Chicago. September 2011. Poster session 088. Abstract C1-635. 6. Sims C et al. Presented at 51st ICAAC, Chicago. September 2011. Poster session 088. Abstract C1-634. 7. DIFICLIR EMA Public Assessment Report, September 2011. DIFICLIR® mit dem Wirkstoff Fidaxomicin – Ein neues makrozyklisches Antibiotikum NEU Fidaxomicin Dosierung und Verträglichkeit 3,6 DIFICLIR®-200-mg-Tabletten werden 2x täglich oral eingenommen.1 Dauerhaftes Ansprechen. Weniger Rückfälle. DIFICLIR® wirkt lokal im Gastrointestinaltrakt und zeigt eine geringe systemische Resorption.10,11 DIFICLIR® wird generell gut vertragen.6 DIFICLIR® ist indiziert bei Erwachsenen zur Behandlung von Clostridiumdifficile-Infektionen (CDI), auch bekannt unter der Bezeichnung C. difficile-assoziierte Diarrhö (CDAD).3 DIFICLIR® – Die gezielte Therapie Wirkt spezifisch bakterizid gegen C. difficile2,8 DIFLB006MAY12 1. Poutanen SM & Simor AE. CMAJ 2004; 171: 51–58. 2. Finegold SM et al. Antimicrob Agents Chemother 2004; 48: 4898–4902. 3. DIFICLIR – Summary of Product Characteristics, dated 19.12.2011. 4. Bouillaut et al. Presented at 51st ICAAC, Chicago. September 2011. Poster session 088. Abstract C1-635. 5. Sims C et al. Presented at 51st ICAAC, Chicago. September 2011. Poster session 088. Abstract C1-634. 6. DIFICLIR EMA Public Assessment Report, September 2011. 7. Gomez et al. Presented at 51st ICAAC, Chicago. September 2011. Poster session 088. Abstract C1-632. 8. Credito KL et al. Antimicrob Agents Chemother 2004; 48: 4430–4434. 9. Louie TJ et al. Antimicrob Agents Chemother 2009; 53: 261–263. 10. Louie TJ et al. Antimicrob Agents Chemother 2009; 53: 223–228. 11. Shue YK et al. Antimicrob Agents Chemother 2008; 52(4): 1391–1395. Hemmt die Toxinproduktion und die Sporenbildung4–6,7,9 Schont die Mikroflora des Dickdarms2,8,9 www.astellas.at Bezeichnung des Arzneimittels: DIFICLIR-200-mg-Filmtabletten. Qualitative und quantitative Zusammensetzung: Eine Tablette enthält 200 mg Fidaxomicin. Anwendungsgebiete: DIFICLIR ist indiziert bei Erwachsenen zur Behandlung von Clostridium-difficile-Infektionen (CDI), auch bekannt unter der Bezeichnung Clostridium-difficile-assoziierte Diarrhö (CDAD) (siehe Abschnitt 5.1). Offizielle Leitlinien zum angemessenen Gebrauch von Antibiotika sollten berücksichtigt werden. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. Pharmakodynamische Eigenschaften: Pharmakotherapeutische Gruppe: Antidiarrhoika und intestinale Antiphlogistika/Antiinfektiva, Antibiotika, ATC-Code: A07AA126. Liste der sonstigen Bestandteile: Tablettenkern: mikrokristalline Cellulose, vorverkleisterte Stärke, Hydroxypropylcellulose, butyliertes Hydroxytoluol, Carboxymethylstärke-Natrium, Magnesiumstearat. Umhüllung: Polyvinylalkohol, Titandioxid, Talkum, Macrogol, Lecithin (Soja). Inhaber der Zulassung: Astellas Pharma Europe B.V., Elisabethhof 19, 2353 EW Leiderdorp, Niederlande. Verschreibungspflicht/Apothekenpflicht: rezept- und apothekenpflichtig. 2/2012 „Weitere Angaben zu besonderen Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation.“