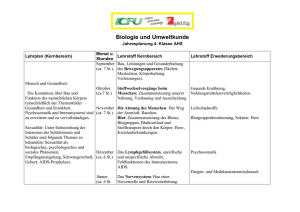
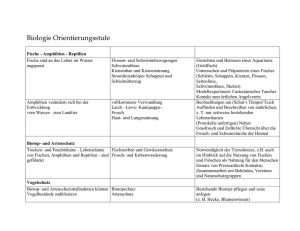
Methodenkatalog
Werbung

Fachbereich Landschaftsnutzung und Naturschutz Institut für angewandte Gewässerökologie (IaG) Schlunkendorfer Str. 2 e, 14554 Seddiner See Methodenkatalog zum Monitoring–Programm der Ökosystemaren Umweltbeobachtung (ÖUB) in den Biosphärenreservaten Brandenburgs für die Ökosystemtypen Acker, Grasland, Moor, Stand- und Fließgewässer Projektfinanziert durch die Landesanstalt für Großschutzgebiete Brandenburg / Landesumweltamt Brandenburg 4. Ausgabe, Mai 2006 Abbildungen auf Titelseite: Oben links: ÖUB- Fläche Trockenweide Liepe: mineralisches Grasland Oben rechts: ÖUB- Fläche Acker Bölkendorf in konventioneller Nutzung mit Feldsoll Unten links: ÖUB-Fläche Plötzendiebel: naturnahes Moor Unten rechts: GPS Einmessung mit A.-K. Hirsch im Plötzendiebel Alle Aufnahmen O. BRAUNER (1999) Zitiervorschlag: LUTHARDT, V., BRAUNER, O., DREGER, F., FRIEDRICH, S., GARBE, H., HIRSCH, A.-K., KABUS, T., KRÜGER, G., MAUERSBERGER, H., MEISEL, J., SCHMIDT, D. †, TÄUSCHER, L., VAHRSON, W.-G., WITT, B. & M., ZEIDLER (2006): Methodenkatalog zum Monitoring - Programm der Ökosystemaren Umweltbeobachtung in den Biosphärenreservaten Brandenburgs, 4. akt. Ausgabe, unveröff., im Auftrag des Landesumweltamt Brandenburg, FH-Eberswalde, Teil A 177 S. + Anhang; Teil B 134 S.+ Anhang. Redaktionelle Bearbeitung: CH. REUTTER ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vorwort Vorwort Ziel der Ökosystemaren Umweltbeobachtung (ÖUB) in den Biosphärenreservaten Brandenburgs ist es, vergleichbare umweltrelevante Daten für die Umweltberichterstattung und die Politikberatung zur Verfügung zu stellen. Die ÖUB beobachtet und erfasst ökologische Entwicklungstrends und erfüllt damit eine Frühwarnfunktion. Dies spielt insbesondere mit Blick auf schleichende Umweltveränderungen eine erhebliche Rolle. Die Daten werden langfristig erhoben, um Aussagen sowohl zu Fluktuationen als auch zu ablaufenden gerichteten Prozessen zu ermöglichen. Die ÖUB betrachtet verschiedene, miteinander in Beziehung stehende Elemente der belebten und unbelebten Natur. Dabei werden die regionalen Besonderheiten verschiedener Ökosysteme, ihre Belastungen und differenzierten Nutzungen berücksichtigt. Im Rahmen der ÖUB werden sowohl eigene Erhebungen durchgeführt als auch bestehende Routinemessprogramme der EU, des Bundes und der Länder, sowie sonstige laufende Dauerbeobachtungsprogramme integriert (LUTHARDT et al. 1999). Eine zielgerichtete Auswertung der Daten ist aber nur dann möglich, wenn diese sowohl über die Zeit, als auch den Raum miteinander vergleichbar sind. Hierzu bedarf es umfangreicher Vereinheitlichungen und Objektivierungen der Datenerhebung. Dies betrifft zum einen die Auswahl der zu erhebenden Parameter und zum anderen die bei der Datenerhebung und -auswertung eingesetzten Methoden, die einen hohen Indikationswert besitzen müssen und zu vergleichbaren Ergebnissen führen sollen. Um den Ansprüchen einer ökologischen Dauerbeobachtung auf ökosystemarer Ebene gerecht zu werden, wurde 1997 im Auftrag der Landesanstalt für Großschutzgebiete Brandenburg das Konzept erstellt und seither kontinuierlich praktisch umgesetzt (DIVERSE AUTOREN 1999). Für die konzeptionelle Erarbeitung der Ökosystemgruppe Acker waren dabei Prof. Dr. W.-G. Vahrson und Prof. Dr. R. Schmidt federführend. Das Monitoringkonzept zum Mineralischen Grasland wurde von Dr. B. Goldschmidt sowie die Moore und das Moorgrasland von Prof. Dr. V. Luthardt erarbeitet. Die Standgewässer wurden von Dr. R. Mauersberger, die Fließgewässer von Dipl.-Biol. W. Arp, die Sölle von Dipl.-Biol. F. Dreger sowie der Wald- und Forstteil von Prof. G. Hofmann übernommen. Im Zuge der Ersteinrichtung erfolgten von den bearbeitenden Institutionen weitere Konkretisierungen bzw. Modifizierungen und Prioritäten wurden ggf. verschoben. Die Ist – Zustandsbeschreibung der ausgewählten Untersuchungsflächen und die Analysen der ersten Zeitreihen, welche in einem umfangreichen Umweltbericht dargestellt werden, bieten bereits einen Einblick in die Vielfältigkeit zukünftiger Auswertungsmöglichkeiten und weisen darauf hin, dass die ausgewählten Untersuchungsparameter und –methoden geeignet sind, die Fragestellungen der ÖUB zu beantworten (LUTHARDT et al. 2005). ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vorwort Im Rahmen einer Expertenrunde wurden die bestehenden Messprogramme im Jahr 2005 evaluiert und kleinere Reduktionen bzw. Ergänzungen vorgenommen. Aufgrund finanzieller Einschränkungen wurden z.B. die Untersuchungsintervalle z.T. vergrößert. Insbesondere das Gewässerprogramm wurde an die internationalen Berichtspflichten der Wasser-Rahmen-Richtlinie angepasst. Weiterhin wird zur Zeit im Rahmen eines Promotionsvorhabens mit dem Titel: „Entwicklung praktikabler Auswertemodalitäten für die medienübergreifende Umweltbeobachtung im Rahmen der Erfordernisse der nationalen und internationalen Umweltgesetzgebung“ unter anderem an der Anpassung der ÖUB Daten an nationale und internationale Vorgaben sowie der Entwicklung halbautomatischer Auswerteschritte gearbeitet. Der jetzt vorliegende Methodenkatalog sollte als bindend für das weitere Monitoring betrachtet werden und Änderungen nur noch in begründeten Ausnahmen vorgenommen werden. Teil A des Methodenkatalogs behandelt das Monitoringprogramm für die terrestrischen Offenland-Ökosysteme Acker, Mineralisches und Moor-Grasland und Naturnahes Moor. Teil B beinhaltet das Monitoringprogramm für die Seen, andere Stand- und Fließgewässer. Teil C behandelt den Teil des Monitoringprogramms für die Wald- und Forst-Ökosysteme (liegt derzeit jedoch noch nicht vor!) TEIL A: Monitoringprogramm für die Ökosystemgruppen Acker, Grasland, Moor V. LUTHARDT, O. BRAUNER, F. DREGER, S. FRIEDRICH, A.-K. HIRSCH, W.-G. VAHRSON, B. WITT & M. ZEIDLER FH – Eberswalde Fr.- Ebertstr. 28 16225 Eberswalde Kontakt: [email protected] ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Inhaltsverzeichnis Inhaltsverzeichnis 1 TABELLARISCHE MONITORING - ÜBERSICHT............................................................ 11 1.1 ÜBERSICHTSTABELLE ALLER ZU ERHEBENDER PARAMETER DER TERRESTRISCHEN ÖKOSYSTEMTYPEN ...................................................................................................................... 11 1.2 BEGRIFFSBESTIMMUNGEN ............................................................................................................ 17 1.3 ÖKOSYSTEMBEZOGENE MONITORINGÜBERSICHT DER TERRESTRISCHEN ÖKOSYSTEMGRUPPEN 18 1.3.1 Acker-Ökosysteme ........................................................................................................ 19 1.3.2 Mineralische Grasland-Ökosysteme.............................................................................. 27 1.3.3 Naturnahe Moore........................................................................................................... 38 1.3.4 2 Entwässerte landwirtschaftlich genutzte und aufgelassene Moore (inkl. wiedervernässter Flächen)......................................................................................................................... 43 FLÄCHENEINRICHTUNG..................................................................................................... 53 2.1 AUSWAHL DER MONITORINGFLÄCHEN ........................................................................................ 53 2.2 FESTLEGUNG DES FLÄCHENDESIGNS ............................................................................................ 53 2.3 FLÄCHENVERMARKUNG ............................................................................................................... 55 2.3.1 Virtuelle Punktvermarkung mit DGPS.......................................................................... 55 2.3.2 Markierung mit Dauermagneten.................................................................................... 57 2.3.3 Punktvermarkung mit Holzpflöcken.............................................................................. 58 2.4 FOTODOKUMENTATION ................................................................................................................ 58 2.5 FOTOMONITORING - ERSTELLUNG DIGITALER PANORAMEN ........................................................ 60 2.6 AUFNAHME DES OBERIRDISCHEN EINZUGSGEBIETES VON NATURNAHEN MOOREN .................... 62 3 DETAILLIERTE METHODENBESCHREIBUNGEN MIT BEGRÜNDUNGEN ZUR PARAMETER- UND METHODENWAHL ............................................................................................ 63 3.1 BODEN .......................................................................................................................................... 63 3.1.1 Allgemeines Vorgehen .................................................................................................. 63 3.1.2 Alphabetische Parameterübersicht mit Begründung der Auswahl ................................ 64 3.1.3 Durchführung von Profilansprachen, Bodenbohrungen und Bodenbeprobungen ......... 68 3.1.3.1 Anlage und Ansprache der Profilgruben auf mineralischen Standorten........................... 68 3.1.3.2 Bohrstock - Bohrungen..................................................................................................... 69 3.1.3.3 Bodenansprache bei Moorstandorten ............................................................................... 70 3.1.3.4 Entnahme der Bodenproben ............................................................................................. 70 3.1.4 Dokumentation der Probenahme ................................................................................... 74 3.1.5 Transport von Bodenproben .......................................................................................... 74 3.1.6 Konservierung und Lagerung der Bodenproben............................................................ 75 3.1.7 Probenvorbehandlung.................................................................................................... 75 3.1.8 Beschreibung von Methoden, die nicht nach einer gültigen DIN vorgenommen werden sowie Hinweise und Ergänzungen zu gültigen DIN-Vorschriften ................................ 76 3.1.8.1 Kartierung von Wassererosionsspuren ............................................................................. 76 3.1.8.2 Feldbestimmung der gesättigten Wasserdurchlässigkeit (Kf) .......................................... 77 3.1.8.3 Eindringwiderstand / Durchdringungswiderstand ............................................................ 78 2 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.1.8.4 3.1.8.5 3.1.8.6 3.1.8.7 3.1.8.8 3.1.8.9 Inhaltsverzeichnis Bestimmung der mikrobiellen Biomasse und der Bodenatmung (nach ALEF 1991, BODE & BLUME 1995, DUNGER & FIEDLER 1989, LABO 1999, GRIMM & WIRTH 1998, SAG 1991 sowie WIRTH 1998) .................................................................................................78 Ergänzung zur DIN 19683 – 12 (Bestimmung der Trockenrohdichte) .............................81 Bestimmung des volumetrischen Bodenwassergehaltes und des Bodenwasserspannungspotenzials ....................................................................................81 Bestimmung der Einheitswasserzahl [nach SCHMIDT (1981) und (1986)] .......................82 Bestimmung der effektiven Kationenaustauschkapazität (KAKeff)...................................83 Bestimmung des pflanzenverfügbaren Magnesiums .........................................................84 3.1.8.10 Bestimmung des Nitratgehaltes im Boden ........................................................................85 3.1.8.11 Bestimmung des pflanzenverfügbaren Phosphors und Kaliums .......................................89 3.2 GRUNDWASSER..............................................................................................................................91 3.2.1 Allgemeines Vorgehen .................................................................................................. 91 3.2.2 Parameterbegründung und Methodenbeschreibung ...................................................... 91 3.2.2.1 Grundwasserstand / Pegelgang..........................................................................................91 3.2.2.2 Probenahme .......................................................................................................................92 3.2.2.3 Vor-Ort-Messungen...........................................................................................................92 3.2.2.4 Konservierung, Transport und Lagerung von Wasserproben............................................93 3.2.2.5 Chemische Laboranalysen.................................................................................................94 3.3 OBERFLÄCHENWASSER .................................................................................................................95 3.3.1 Allgemeines Vorgehen .................................................................................................. 95 3.3.2 Parameterbegründung und Methodenbeschreibung ...................................................... 95 3.3.2.1 Ausdehnung der offenen Wasserfläche .............................................................................95 3.3.2.2 Wasserstand / Pegelgang ...................................................................................................95 3.3.2.3 Vor-Ort-Messungen...........................................................................................................95 3.3.2.4 Probenahme .......................................................................................................................96 3.3.2.5 Konservierung, Transport und Lagerung von Wasserproben............................................96 3.3.2.6 Chemische Laboranalysen.................................................................................................96 3.4 VEGETATION / FLORA ....................................................................................................................98 3.4.1 Allgemeines Vorgehen .................................................................................................. 98 3.4.2 Parameterauswahl.......................................................................................................... 99 3.4.3 Erfassung des Gesamtartenspektrums ......................................................................... 100 3.4.3.1 Bioindikation ...................................................................................................................100 3.4.3.2 Methodik .........................................................................................................................100 3.4.3.3 Zeitbedarf ........................................................................................................................102 3.4.4 Aufnahme des Vegetationstransektes.......................................................................... 103 3.4.4.1 Bioindikation ...................................................................................................................103 3.4.4.2 Methodik .........................................................................................................................103 3.4.4.3 Zeitbedarf ........................................................................................................................105 3.4.5 Vegetationsaufnahme nach BRAUN - BLANQUET ........................................................ 106 3.4.5.1 Bioindikation ...................................................................................................................106 3.4.5.2 Methodik .........................................................................................................................106 3.4.5.3 Zeitbedarf ........................................................................................................................107 3 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Inhaltsverzeichnis 3.4.6 Vegetationszonierung .................................................................................................. 108 3.4.6.1 Bioindikation .................................................................................................................. 108 3.4.6.2 Methodik......................................................................................................................... 108 3.4.6.3 Zeitbedarf........................................................................................................................ 108 3.4.7 Wasserstufenkartierung ............................................................................................... 109 3.4.7.1 Bioindikation .................................................................................................................. 109 3.4.7.2 Methodik......................................................................................................................... 109 3.4.7.3 Zeitbedarf........................................................................................................................ 111 3.4.8 Bestimmung der oberirdischen Phytomasse ................................................................ 111 3.4.8.1 Bioindikation .................................................................................................................. 111 3.4.8.2 Methodik......................................................................................................................... 111 3.4.8.3 Zeitbedarf........................................................................................................................ 112 3.4.9 Bestimmung der Pflanzeninhaltsstoffe Stickstoff, Phosphor und Kalium................... 112 3.4.9.1 Bioindikation .................................................................................................................. 112 3.4.9.2 Methodik......................................................................................................................... 112 3.4.9.3 Zeitbedarf........................................................................................................................ 112 3.5 FAUNA ........................................................................................................................................ 113 3.5.1 Allgemeines Vorgehen ................................................................................................ 113 3.5.2 Vorgehen zur Auswahl der Tiergruppen ..................................................................... 113 3.5.3 Tabellarische Übersicht der Erfassungszeiträume für die faunistischen Monitoringgruppen in den einzelnen Ökosystemen .................................................................................... 115 3.5.4 Grundsätzliche Witterungsvoraussetzungen für eine reguläre faunistische Erfassung 116 3.5.5 Vegetationsstrukturerhebung bei der Laufkäfer- und Heuschreckenerfassung ........... 118 3.5.5.1 Bioindikation .................................................................................................................. 118 3.5.5.2 Methodik......................................................................................................................... 118 3.5.5.3 Erfassungszeitraum......................................................................................................... 119 3.5.5.4 Zeitaufwand .................................................................................................................... 119 3.5.6 Methodenbeschreibung und Bioindikation.................................................................. 120 3.5.6.1 Heuschrecken (Saltatoria) .............................................................................................. 120 3.5.6.1.1 Bioindikation............................................................................................................ 120 3.5.6.1.2 Semiquantitative Bestandserfassung ........................................................................ 120 3.5.6.1.3 Quantitative Bestandserfassung ............................................................................... 121 3.5.6.1.4 Gesamtarteninventar................................................................................................. 122 3.5.6.1.5 Erfassungszeitraum .................................................................................................. 123 3.5.6.1.6 Zeitbedarf ................................................................................................................. 123 3.5.6.2 Tagfalter und Widderchen (Rhophalocera und Zygaenidae) ......................................... 124 3.5.6.2.1 Bioindikation............................................................................................................ 124 3.5.6.2.2 Generelle Methodik.................................................................................................. 125 3.5.6.2.3 Semiquantitative Erfassung...................................................................................... 126 3.5.6.2.4 Erfassungszeitraum .................................................................................................. 128 3.5.6.2.5 Zeitbedarf ................................................................................................................. 128 3.5.6.3 Libellen (Odonata) ......................................................................................................... 129 3.5.6.3.1 Bioindikation............................................................................................................ 129 4 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Inhaltsverzeichnis 3.5.6.3.2 Erfassung der Imagines .............................................................................................130 3.5.6.3.3 Erfassung der Exuvien ..............................................................................................131 3.5.6.3.4 Erfassungszeitraum ...................................................................................................132 3.5.6.3.5 Zeitbedarf ..................................................................................................................133 3.5.6.4 Laufkäfer (Carabidae).....................................................................................................134 3.5.6.4.1 Bioindikation.............................................................................................................134 3.5.6.4.2 Methodik ...................................................................................................................134 3.5.6.4.3 Erfassungszeitraum ...................................................................................................136 3.5.6.4.4 Zeitbedarf ..................................................................................................................136 3.5.6.5 Spinnen (Araneae)...........................................................................................................137 3.5.6.5.1 Bioindikation.............................................................................................................137 3.5.6.5.2 Methodik ...................................................................................................................137 3.5.6.5.3 Zeitbedarf ..................................................................................................................137 3.5.6.6 Lurche (Amphibia) ..........................................................................................................138 3.5.6.6.1 Bioindikation.............................................................................................................138 3.5.6.6.2 Methodik ...................................................................................................................138 3.5.6.6.3 Erfassungszeitraum ...................................................................................................140 3.5.6.6.4 Zeitbedarf ..................................................................................................................140 3.5.6.7 Regenwürmer (Lumbricidae) ..........................................................................................141 3.5.6.7.1 Bioindikation.............................................................................................................141 3.5.6.7.2 Methodik ...................................................................................................................141 3.5.6.7.3 Erfassungszeitraum ...................................................................................................142 3.5.6.7.4 Zeitbedarf ..................................................................................................................142 3.6 BEWIRTSCHAFTUNG / NUTZUNG .................................................................................................143 3.6.1 Allgemeines Vorgehen ................................................................................................ 143 3.6.2 Parameterauswahl........................................................................................................ 143 3.7 METEOROLOGISCHE DATEN ........................................................................................................144 3.7.1 Allgemeines Vorgehen ................................................................................................ 144 3.7.2 Parameterbegründung und Methodenbeschreibung .................................................... 145 3.8 PHÄNOLOGISCHE DATEN .............................................................................................................147 3.8.1 Allgemeines Vorgehen ................................................................................................ 147 3.9 IMMISSIONSDATEN ......................................................................................................................151 3.9.1 Allgemeines Vorgehen ................................................................................................ 151 3.9.2 Parameterauswahl........................................................................................................ 153 3.10 DEPOSITIONSDATEN ....................................................................................................................156 3.10.1 Allgemeines Vorgehen ................................................................................................ 156 3.10.2 Parameterbegründung und Methodenauswahl............................................................. 156 4 BENÖTIGTE GERÄTE UND MATERIALIEN...................................................................157 4.1 4.2 4.3 4.4 GERÄTE UND MATERIALIEN ZUR FLÄCHENEINRICHTUNG UND VERMARKUNG .........................157 GERÄTE UND MATERIALIEN ZUR FOTODOKUMENTATION ..........................................................158 GERÄTE UND MATERIALIEN FÜR DIE BODENKUNDLICHE GELÄNDEARBEIT ...............................159 GERÄTE UND MATERIALIEN FÜR DIE GRUNDWASSER-BEPROBUNG ...........................................161 5 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 4.5 4.6 Inhaltsverzeichnis GERÄTE UND MATERIALIEN FÜR DIE FLORISTISCHE GELÄNDEARBEIT ...................................... 162 GERÄTE UND MATERIALIEN FÜR DIE FAUNISTISCHE GELÄNDEARBEIT ..................................... 163 5 LITERATURVERZEICHNIS................................................................................................ 166 6 ANHANG...........................................................FEHLER! TEXTMARKE NICHT DEFINIERT. 6 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Abkürzungsverzeichnis Verwendete Abkürzungen: BM Bodenmessfeld BR-FE Biosphärenreservat Flusslandschaft Elbe BR-SC Biosphärenreservat Schorfheide-Chorin BR-SW Biosphärenreservat Spreewalde DGPS Differential Global Positioning System DVWK Deutscher Verband für Wasserwirtschaft und Kulturbau e.V. DWD Deutscher Wetterdienst GPS Global Positioning System IaG Institut für angewandte Gewässerökologie (Seddin) LAGS Landesanstalt für Großschutzgebiete Brandenburgs (ab 2004 Landesumweltamt Brandenburg, Abteilung Großschutzgebiete) Level II-Fläche Forstliche Umweltkontrolle auf Intensitätsstufe zwei LFE Landesforstanstalt Eberswalde M Messfeld MF Monitoringfläche Pr. Probe VD Vegetationskundliche Dauerbeobachtungsfläche WRRL Wasser Rahmen Richtlinie ZALF e.V. Leibniz-Zentrum für Agrarlandschaftsforschung 7 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Tabellen- und Abbildungsverzeichnis Tabellenverzeichnis Tabelle 1: Übersicht der in der ÖUB berücksichtigten meteorologischen Daten, der Immissions- und Depositionsdaten ......................................................................................................................... 16 Tabelle 2: Übersicht der anzustrebenden Aufnahmezeitpunkte der Fotodokumentation ............................. 58 Tabelle 3: Übersicht über die aufzunehmende Anzahl der Leitprofil- und Oberbodenaufnahmen nach definiertem Flächendesign für die Offenland-Ökosystemgruppen.............................................. 72 Tabelle 4: Kennwerte der Einheitswasserzahl nach SCHMIDT (1986) für verschiedene Torfarten und Degradierungsstufen.................................................................................................................... 83 Tabelle 5: Erfassung des Gesamtartenspektrums der Flora der Grünland-ÖUB-Flächen (5-stufige Häufigkeitsklassifikation).......................................................................................................... 101 Tabelle 6: Skalierung der Artmächtigkeiten sowie des „Gehölz-Überschirmungsgrades“ für die Transektaufnahme (Bezug: Halbkreis von 2 m = 6,3 m2) ......................................................... 105 Tabelle 7: Kombinierte Artmächtigkeitsskala nach WILMANNS (1989: 30) und LONDO (1984 zit. in DIERSCHKE 1994) für die Vegetationsaufnahmen im Rahmen der ÖUB.................................. 107 Tabelle 8: Definition der Wasserstufen grundwasserbeeinflusster Standorte, nach SUCCOW (1988)........ 110 Tabelle 9: Tabellarische Übersicht der Erfassungszeiträume für die faunistischen Monitoringgruppen in den einzelnen terrestrischen Ökosystemgruppen ...................................................................... 115 Tabelle 10: Witterungsverhältnisse als Einflussfaktoren für reguläre Untersuchungsbedingungen bei faunistischen Erfassungen (nach ULRICH 1995, geändert)........................................................ 117 Tabelle 11: Häufigkeitsschlüssel für die Tagfaltererfassung auf Probeflächen (nach ULRICH 1995)........ 126 Tabelle 12: Logarithmische Abundanzklassen für die Libellenerfassung (nach SIEDLE 1992), verändert.131 Tabelle 13: Zeitaufwand für die einzelnen Untersuchungsparameter der Libellenerfassung..................... 133 Tabelle 14: Fangperioden und Fangfrequenzen der Laufkäfererfassung ................................................... 136 Tabelle 15: Abundanzklassen für Adulti und Juvenile der Amphibien...................................................... 139 Tabelle 16: Abundanzklassen für die Aufnahme von Laichballen /-schnüre und Larvalstadien der Amphibien ................................................................................................................................. 139 Tabelle 17: Übersicht der Niederschlagsmessstationen des DWD im Einzugsbereich des BR SchorfheideChorin........................................................................................................................................ 144 Tabelle 18: Pflanzenauswahl zur Bestimmung der Vegetationsperiode Jahreszeit in den Biosphärenreservaten Brandenburgs ......................................................................................... 147 Tabelle 19: Phänologische Meßstationen des DWD in den Biosphärenreservaten, die den ÖUB-Flächen am nächsten liegen .......................................................................................................................... 149 Tabelle 20: Phänologische Jahreszeiten und ihre Zeigerpflanzen nach dem Deutschen Wetterdienst (www.dwd.de) ........................................................................................................................... 150 Tabelle 21: Übersicht der erfassten Immissionsparameter des LUA Brandenburg (1998 – 2005) ............ 153 Tabelle 22: Klassenstufen der interpolierten Immissions-Jahresmittelwerte des LUA Brandenburg (Angaben jeweils in µg/m³)....................................................................................................... 154 8 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Tabellen- und Abbildungsverzeichnis Abbildungsverzeichnis Abbildung 1: Anlage einer Schürfgrube........................................................................................................68 Abbildung 2: Probenbegleitzettel für die Bodenprobeentnahme ..................................................................74 Abbildung 3: Design eines Transekt-Aufnahmepunktes der Vegetationserfassung ...................................105 Abbildung 4: Beispiel für die grafische Darstellung der Vegetationsperioden im BR Spreewald in den Jahren 1998-2004..................................................................................................................148 Abbildung 5: Messstellen des Luftgütemessnetzes Land Brandenburg (Stand: 27.02.2005), Quelle: http://www.mluv.brandenburg.de/cms/detail.php?id=lbm1.c.209332.de&_siteid=700, (01.03.2006)..........................................................................................................................152 9 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Inhaltsverzeichnis-ANHANG Übersicht ANHANG Teil A Standard-Flächendesign: 1. • Standard-Flächendesign; Acker hängig mit Catena 2. • Detailansicht - Ackercatena 3. • Standard-Flächendesign; Acker eben 4. • Standard-Flächendesign; mineralisches Grasland 5. • Standard-Flächendesign; genutzte und aufgelassene Niedermoore 6. • Standard - Probenahmeschema für Oberbodenbeprobung und Bohrstockeinschläge Datenblätter zur Erosionskartierung: 7. 8. 9. • Feldblätter zur Erosionskartierung • Aufnahmebögen (Nr.1-4) zur Messung bzw. Schätzung von Abtrags- bzw. Auftragsformen • Dokumentationsblätter zur Erosionskartierung Formblätter: 10. • Aufnahmeformblatt für Bohrstockeinschläge 11. • Formblatt für die bodenkundliche Profilaufnahme nach AG BODEN (2005) 12. • Aufnahmebogen für Moorbodenprofile 13. • Probenbegleitliste für die Bodenprobeentnahme 14. • Probenahmeprotokoll Bodenmikrobiologie • Aufnahmeformular Landwirtschaftliche Betriebsdaten für die Ökosystem Gruppe 15. 16. Acker • Aufnahmeformular Landwirtschaftliche Betriebsdaten für die Ökosystem Gruppe Grünland 17. • Vegetationsaufnahmebogen 18. • Ankreuzliste Gesamtarteninventar (Blütenpflanzen) 19. • Formblatt Vegetationsstruktur bei der Heuschrecken- und Laufkäfererfassung • Erfassungsbogen Heuschrecken (Gesamtarteninventar, Transekt, Isolationsquadrat) 21. • Erfassungsbogen Libellen (Odonata) 22. • Erfassungsbogen Tagfalter und Widderchen (Rhophalocera & Zygaenidae) 23. • Eingabemasken für die Datenbank 20. 10 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 1 Tabellarische Monitoring - Übersicht Tabellarische Monitoring - Übersicht 1.1 Übersichtstabelle aller zu erhebender Parameter der terrestrischen Ökosystemtypen Legende: ze: zwingend erforderlicher Parameter e: zusätzlich sinnvoller Parameter a : in Gräben b : nur bei ausgewählten Monitoringflächen Ökosystemtyp: Acker Mineralisches Grasland Naturnahes Moor Entwässertes, landwirtschaftlich genutztes Moor Aufgelassenes Moorgrasland (inkl. wiedervernässter Flächen) (inkl. wiedervernässter Flächen) Parameter Monitoringfläche Fotodokumentation ze ze ze ze ze Fotomonitoring (digitale Panoramen) e e e e e Relief ze ze (bei Hanglage) Wasser-Erosion ze ze ze ze ze ze ze Abgrenzung des Einzugsgebiets e Charakter des Einzugsgebietes (Biotopkartierung) e ze Flächenwasserhaushalt Boden Leitprofile / Bodenhorizontierung / Bodentyp ze ze Stratigrafie / Oberbodenhorizontierung ze Textur (Tongehalt, Korngrößenverteilung, Bodenart) ze ze Trockenrohdichte ze ze 11 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Ökosystemtyp: Acker Mineralisches Grasland Tabellarische Monitoring - Übersicht Naturnahes Moor Entwässertes, landwirtschaftlich genutztes Moor Aufgelassenes Moorgrasland (inkl. wiedervernässter Flächen) (inkl. wiedervernässter Flächen) Eindringwiderstand e Glührückstand / Glühverlust e ze ze Substanzvolumen / relative Lagerungsdichte e ze ze Einheitswasserzahl des Oberbodens (W1) ze ze ze Volumetrischer Bodenwassergehalt und Bodenwasserspannungspotential (pF – WG - Kurve) e Wasserleitfähigkeit, Infiltrationskapazität –Kf - Wert (gesättigt) e e pH-Wert ze ze ze ze ze Elektrische Leitfähigkeit ze CaCO3 ze ze ze ze ze Cges, (Corg, Humus) ze ze ze ze ze Nges ze ze ze ze ze C/N-Verhältnis ze ze ze ze ze P, K (gesamt) ze ze ze e Gesamt- (Nähr-) Stoffgehalte: (Al, Ca, Fe, Mn, Na, Mg, S)ges ze e (ze in Auen) Schwermetalle: (Cd, Cr, Cu, Ni, Pb, Zn)ges ze e (ze in Auen) e (nur in Auen) e (nur in Auen) Schwermetalle: (As, Hg, Ti)ges e (nur in Auen) PCB (Poly Chlorierte Biphenyle) NO3 e e 12 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Ökosystemtyp: Acker Mineralisches Grasland Tabellarische Monitoring - Übersicht Naturnahes Moor Entwässertes, landwirtschaftlich genutztes Moor Aufgelassenes Moorgrasland (inkl. wiedervernässter Flächen) (inkl. wiedervernässter Flächen) Basensättigung ze e e KAKpot / KAKeff ze e e verfügbare Nährstoffe: (Plak, Klak, MgCaCl2) ze ze (ohne MgCaCl2) ze (ohne MgCaCl2) e (ohne MgCaCl2) Mikrobiologische Parameter: Mikrobielle Biomasse, Basalatmung, Metabolischer Quotient ze e e e Nur auf grundwassernahen Standorten Grundwasser GW-Stand /-Gang e ze ze ze ze Temperatur e e e e e pH-Wert e e e e e Elektrische Leitfähigkeit e e e e e O2 e e e e e NO3 e e e e e Pegelgang / Wassertiefe e e e Ausdehnung der offenen Wasserfläche e Temperatur e e e pH-Wert e e e Elektrische Leitfähigkeit e e e O2 e e e Kges e e e Pges e e e Oberflächenwasser (ggf. in Mooren und Gräben) 13 e ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Ökosystemtyp: Acker Mineralisches Grasland Tabellarische Monitoring - Übersicht Naturnahes Moor Entwässertes, landwirtschaftlich genutztes Moor Aufgelassenes Moorgrasland (inkl. wiedervernässter Flächen) (inkl. wiedervernässter Flächen) Nges (anorganisch) e e e NO3 e e e Vegetation Pflanzen- und Artendiversität ze ze ze ze ze Diversität der Vegetation ze ze ze ze ze ze ze ze ze Pflanzenassoziation bzw. Vegetationsform e Vegetationszonierung Biomasseproduktion ze ze e Pflanzeninhaltsstoffe: (Nges, Pges, Kges) ze ze e Fauna Laufkäfer (Carabidae) ze Tagfalter / Widderchen (Rhophalocera / Zygaenidae) Regenwürmer (Lumbricidae) ze ze b oder e eb ze ze ze b oder e e e e ze e ze Heuschrecken (Saltatoria) ze e ze e Libellen (Odonata) ea ze ea ea Lurche (Amphibia) ea e ea ea e eb eb e e Bestellung / Nutzung (Mahd, Beweidung) ze ze ze Be- / Entwässerung ze ze ze Spinnen (Araneae) Bewirtschaftung / Nutzung 14 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Ökosystemtyp: Acker Mineralisches Grasland Tabellarische Monitoring - Übersicht Naturnahes Moor Entwässertes, landwirtschaftlich genutztes Moor (inkl. wiedervernässter Flächen) Einsaat / Dichte ze ze (ggf.) ze (ggf.) Dünger, mineralischer / organischer (Gülleausbringung etc.) ze ze ze Anwendung von Pflanzenschutzmitteln ze Ernte / Ertrag / Zuwachs ze e e 15 Aufgelassenes Moorgrasland (inkl. wiedervernässter Flächen) ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Tabellarische Monitoring - Übersicht Meteorologische Daten, Immissions- und Depositionsdaten Die meteorologischen Daten, die Immissionsdaten und die Depositionsdaten werden nicht direkt auf den Monitoringflächen erhoben. Hierfür wird auf die verschiedenen, bestehenden überregionalen Messnetze zurückgegriffen. Es werden, die den Untersuchungsflächen am nächsten liegenden Messstationen bzw. interpolierte Rasterdaten verwendet. Aufgrund der finanziellen und politischen Entwicklung wurden die erfassten Parameter der verschiedenen Messnetzbetreiber im Laufe des bisherigen Monitoring-Zeitraumes zum Teil stark reduziert, so dass die Datensätze differieren. Die Depositionsdaten liegen nur bis zum Jahr 2002 vor, danach kann die Auswertung nur anhand der jährlich erscheinenden verallgemeinernden Publikationen des LUA bzw. der LFE erfolgen. Tabelle 1: Übersicht der in der ÖUB berücksichtigten meteorologischen Daten, der Immissions- und Depositionsdaten Meteorologische Daten Immissionsdaten 1 Depositionsdaten 2 Niederschlag (Schneehöhe) (ze) As Ammonium Lufttemperatur (Spätfröste) (ze) Cd Calcium Relative Luftfeuchte (e) CO Chlorid Windrichtung / -stärke (e) H2S Fluorid Sonnenscheindauer (e) Mn K Potenzielle Evapotranspiration (e) Ni Kb5,65 Phänologische Jahreszeiten (e) NO Kb7,0 Dauer der Vegetationsperiode (ze) NO2 Mg NOx Na Ozon Nanorg. PM Norg. Schwebstaub Nges SO2 Nitrat Nitrit P Sulfat TOC 1 Daten liegen bis 2000 als arithmetische Jahresmittelwerte vor; für 2000 liegen die fett markierten Parameter als interpolierte Rasterdaten vor; ab 2001 nur noch PM (Schwebstaub) 2 Depositionsdaten liegen nur bis 2002 als Einzeldaten vor 16 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Tabellarische Monitoring - Übersicht 1.2 Begriffsbestimmungen Monitoringfläche (MF): Die Monitoringfläche ist die, für die Beobachtung des jeweiligen Ökosystemtyps konkret im Gelände ausgegrenzte Gesamtuntersuchungsfläche. Aufgrund natürlicher (z.B. stark wechselnder Bodenverhältnisse) bzw. anthropogen bedingter Heterogenität (z.B. Terrassierungen, Gräben, Wege) lässt sich die Monitoringfläche häufig nicht als einheitliches Ökosystem definieren. Vielmehr handelt es sich oft um eine Vergemeinschaftung verschiedener Ökosystemeinheiten (z.B. Feuchtwiesen-Komplex mit Bereichen unterschiedlicher Feuchtigkeitsgrade inklusive Trockeninseln sowie Meliorationsgräben). Jedoch ist in der Regel der zu beobachtende Ökosystemtyp (Beobachtungstyp) auf der Monitoringfläche dominant. Die Abgrenzung der Monitoringfläche ist gleichbedeutend mit der Fläche für die Erstellung der Gesamtartenlisten der Pflanzen und ausgewählten Tiergruppen sowie gegebenenfalls der Wasserstufenund Vegetationszonierungskartierung. Bodenmessfeld (BM): Ist die Dauerbeobachtungsfläche innerhalb des ausgewählten Beobachtungstyps für die Erfassung der Bodenparameter (inklusive der Regenwürmer), mit fest eingemessenen Leitprofilen bzw. Flachschürfen sowie Untersuchungspunkten für die Oberboden- und Bohrstockbeprobung mit einem ökosystemspezifisch definierten Flächendesign (vgl. ANHANG). Vegetationskundliche Dauerbeobachtungsfläche (VD): Bezeichnet die fest eingemessene Dauerbeobachtungsfläche für Vegetationsaufnahmen nach BRAUNBLANQUET. Messfeld (M): Als Messfeld werden zusammenfassend die flächenbezogenen Bereiche von vegetationskundlicher Dauerbeobachtungsfläche und Bodenmessfeld bezeichnet. In der Regel werden auf jeder Monitoringfläche zwei Messfelder eingerichtet und als Haupt- und Nebenmessfeld bezeichnet (vgl. Kapitel 2.2) Erläuterung zum Untersuchungsturnus: 4w a 3a 6a 12a - alle 4 Wochen - jedes Jahr - im 1. - - 4. - - 7. - - 10. - - 13. ...Jahr - im 1. - - - - - 7. - - - - - 13. - - - - - 19. ...Jahr - im 1. - - - - - - - - - - - 13. - - - - - - - - - - - 25. ...Jahr 17 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Tabellarische Monitoring - Übersicht Erhebungen im Rahmen der Ersteinrichtung: Angabe zur Durchführung der Erhebung der Parameter bei der Ersteinrichtung + Erhebung erfolgt (+) Erhebung eingeschränkt erfolgt Erhebung nicht erfolgt 1.3 Ökosystembezogene Monitoringübersicht der terrestrischen Ökosystemgruppen Die Daten zur Immission und Meteorologie werden in den nachfolgenden Übersichtstabellen nicht erwähnt (siehe Kapitel 3.7 und 3.9). 18 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Acker 1.3.1 Acker-Ökosysteme Zwingend erforderliche Parameter Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung 3a 10-20 min + Monitoringfläche Fotodokumentation ÖUB-Methode Relief GPS-Einmessung der Aufnahmepunkte nur zur Erstaufnahme siehe Kap. 2.3.1 (+) Wasser-Erosion (nur auf geneigten Flächen) Standardisierte Geländekartierung von Erosionsspuren nach der ‘Kartieranleitung zur Erfassung aktueller Erosionsformen’ erarbeitet vom Fachausschuss “Bodenerosion” des DVWK (1996), definiertes Foto, Erfassung der Verkürzung bzw. Aufhöhung der Geländeoberfläche durch GPS - Höhenermittlungen an definierten Punkten im cm -Bereich sowie durch definierte Bohrstockeinschläge und Leitprofilansprache ereignisbedingt alle 6a 0,5-1 d (je nach spezifischer Geländesituation) + 12a 4-6 h je Profil 20-30 min je Bohrstockeinschlag + 12a 25 h / 12 Proben + 12a (Leitprofil) 6a (Ap - Horizont und Pflugsohle) 48 h / 1 Probe (Labor) + Boden Profilgrubenanlage und –ansprache nach KA 5 (AG BODEN 2005), horiLeitprofil / Bodenhorizon- zontweise Beprobung mit Stechzylindern zur Laboranalyse der nachfolgend tierung / Bodentyp aufgezählten Parameter zusätzlich: Bohrstockeinschläge zur Erfassung der Standortheterogenität Textur (Tongehalt, Korngrößenverteilung, Bodenart) Trockenrohdichte Bestimmung der Korngrößenzusammensetzung in allen Horizonten der Leitprofile, Laboranalyse nach KÖHN – DIN 19 683-2 bzw. TGL 31222/02 (TGL 1985b) Volumengetreue Entnahme mit Stechzylindern, Laboranalyse nach DIN 19683-12 19 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Acker Methodik MonitoringIntervall Oberbodenbeprobung des Ap - Horizontes und der Pflugsohle nach definiertem Flächendesign Zeitbedarf Erhebung bei Ersteinrichtung 6a pH-Wert Elektrometrische Messung nach DIN ISO 10 390: 05.97 in der Bodenaufschlämmung mit CaCl2 12a (Leitprofil) 3a(Ap - Horizont) 10 min / 1 Probe + Elektrische Leitfähigkeit Laboranalyse in Bodenlösung nach DIN ISO 11265 mit destilliertem Wasser und Leitfähigkeitsmessgerät (Profile LF 197, WissenschaftlichTechnische Werkstätten GmbH, WTW) unter Angabe der Temperatur 12a (Leitprofil) 6a (Ap - Horizont) 16 h / 24 Proben + CaCO3 Messung der CO2-Entwicklung mit der Scheiblerapparatur 7.810100 ‘Calcimeter’ (siehe Bedienungsanweisung Normschliff Gerätebau Wertheim) nach Carbonatzerstörung mit HCl nach DIN ISO 10 693 12a (Leitprofil) 6a (Ap - Horizont) 10 min / 1 Probe + Cges Nges Prinzip nach DIN ISO 13878 und DIN ISO 10694; simultane direkte Messung von Cges u. Nges im Labor am CNS – 2000 - Elementaranalysator, bei einer Einwaage in ein Keramikschiffchen von 1-2 g lufttrockenem Boden, siehe gerätespezifische Bedienungsanweisung 12a (Leitprofil) 6a (Ap - Horizont) 8 min / 1 Probe + Corg Rechenwert Corg = Cges – CCaCO3, CCaCO3 = % CaC03 x 0,12 (0,12 = CAtomgew./ CaC03 Molek.gew. = 12 / 100 = 0,12 ) 12a (Leitprofil) 6a (Ap - Horizont) 2 min / 1 Probe + C/N – Verhältnis Berechnung des Verhältnisses Corg / Nges 12a (Leitprofil) 6a (Ap - Horizont 1 min / 1 Probe + Humus Rechenwert (% Humus = Corg x 1,724) 12a (Leitprofil) 6a (Ap - Horizont) 1 min / 1 Probe + Kges, Pges Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach ISO 11466 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma - Spektrofotometer (ICP) 12a (Leitprofil) 6a (Ap - Horizont) 4,5 h / 11 Proben + 20 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Acker Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung 12a (Leitprofil) 6a (Ap - Horizont) 4,5 h / 11 Proben + Gesamt-(Nährstoff-) Gehalte: Alges Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach ISO 11466 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma - Spektrofotometer (ICP) Cages s.o. s.o. s.o. + Feges s.o. s.o. s.o. + Mnges s.o. s.o. s.o. + Nages s.o. s.o. s.o. + Mgges s.o. s.o. s.o. + Sges siehe bei Nges 12a (Leitprofil) 6a (Ap - Horizont) 4,5 h / 11 Proben + Cd Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach ISO 11466 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma - Spektrofotometer (ICP) 12a (oder nach Hochwasserereignissen) 4,5 h / 11 Proben + Cr s.o. s.o. s.o. + Cu s.o. s.o. s.o. + Ni s.o. s.o. s.o. + Pb s.o. s.o. s.o. + Zn s.o. s.o. s.o. + Schwermetalle: 21 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Acker Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Basensättigung (BS) Merkblatt Nr. 1 des LUA NRW (HPLC-UV/ FL) (1994) Rechenwert, prozentualer Anteil der austauschbaren basischen Kationen an der Gesamtmenge der austauschbaren Kationen BS = Ca+Mg+K+Na in mval x 100- g / KAK eff in mval x 100 – g 6a KAK pot Laboranalyse unter Verwendung einer bei pH 8,1 gepufferten BaCl2-Lösung nach MEHLICH, DIN 19 684 –8 6a 16 h / 15 Proben + KAK eff Laboranalyse durch Perkolation mit NH4Cl-Lsg. 6a 4 h / 24 Proben + (+) verfügbare Nährstoffe: Plak, Laboranalyse nach AG BODEN (1997) S.73/74 mit Doppellactat (DL)Auszug 12a (Leitprofil) 3a (Ap - Horizont) 2,8 h / 24 Proben + Klak Laboranalyse nach AG BODEN (1997) S.73/74 mit Doppellactat (DL)Auszug 12a (Leitprofil) 3a (Ap - Horizont) 2,8 h / 24 Proben + MgCaCl2 Laboranalyse nach AG BODEN (1997) S. 71/72 mit Calciumchlorid-Auszug 12a (Leitprofil) 3a (Ap - Horizont) 4 h / 24 Proben + Mikrobielle Biomasse Ap – Horizont – Beutelprobe, Analyse durch substrat-induzierte Respiration (nach ANDERSON & DOMSCH 1978 und HEINEMEYER et al. 1989) 3a ca. 1-2 h für Probe / Bodenmessfeld + Basalatmung gleiche Probe wie oben, Analyse durch Durchflussverfahren (DOMSCH 1962) beschrieben bei HEINEMEYER et al. (1989) 3a ca. 1-2 h für Probe / Bodenmessfeld + Metabolischer Quotient gleiche Probe wie oben, Bestimmung nach ANDERSON & DOMSCH (1993) 3a ca. 1-2 h für Probenahme / Bodenmessfeld + Mikrobiologische Parameter: 22 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Acker Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Vegetation Pflanzen- Artendiversität Gesamtartenliste der Monitoringfläche durch intensive Geländebegehung, ohne Häufigkeitsangaben 6a 1 d / Monitoringfläche (außer Moose) + Diversität der Vegetation Gerades Transekt, Aufnahme alle 20 m, Halbkreis mit 2 m Radius 6a 1-2 d / Monitoringfläche (außer Moose) + 3a Gelände: 5 h / Beobachtungstyp u. Jahr Vorsortierung: 20 min / Falle u. Fangperiode Bestimmung: 45 - 60 min / Falle u. Fangperiode + 6a Probenahme im Gelände: 7-10 h / 1-1,5 m² (durch 3 Hk) Determination / Ermittlung der Biomasse: 4 - 8 h / m² + Fauna Laufkäfer (Carabidae) 6 Bodenfallen / Beobachtungstyp (Messfeld) (6,8 cm Durchmesser, transparente Regenabdeckung u. ggf. Beweidungsschutz); Fangflüssigkeit: Isopropanol-Glycerin-Gemisch (2:1) + Detergenz Zeitraum: 5 Fangperioden (Leerung 14-tägig) Mitte / Ende April - Anf. / Mitte Juni: 3 mal, Mitte / Ende Aug. - Anf. Okt.: 2 mal Erfassungsziel: Aktivitätsdichte, Artenspektrum, Dominanz Regenwürmer (Lumbricidae) Methodenkombination: Handauslese von 1 m² (Acker-Catena 1,5 m²) durch 16 (24) Grabungen von je 1/16 m² (25x25 cm) und 20 cm Tiefe); nachfolgend Tiefenaustreibung (0,2%ige Formalinlösung) mit ca. 30 min Wirkzeit Zeitraum: einmalig im Frühjahr (Mitte April - Anfang Juni) bzw. Herbst (Mitte. Sept. bis Anfang Nov.) Erfassungsziel: Artenspektrum (-zönose), Abundanz, Dominanz, Biomasse Bewirtschaftung / Nutzung Befragung der Bewirtschafter mit standardisiertem Formblatt zu: Bestellung, Fruchtart Erfassung über Bewirtschaftungsformblatt: Acker 1a 23 + ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Melioration (Be- / Entwässerung) Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Acker Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Erfassung über Bewirtschaftungsformblatt: Acker 1a + Saatdicht, Einsaat, BodenErfassung über Bewirtschaftungsformblatt: Acker bearbeitung 1a + Mineralischer Dünger Erfassung über Bewirtschaftungsformblatt: Acker 1a + Organischer Dünger (GülErfassung über Bewirtschaftungsformblatt: Acker leausbringung) 1a + Bestandesgüte, Pflanzenschutzmittel Erfassung über Bewirtschaftungsformblatt: Acker 1a bzw. ereignisbedingt + Ernte / Ertrag / Zuwachs Erfassung über Bewirtschaftungsformblatt: Acker 1a + 24 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Acker Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Monitoringfläche Fotomonitoring (Panorama) Methode nach TROSIEN (2001) 6a (+) Boden pF - WG – Kurve (volumetrischer Bodenwassergehalt und Bodenwasserspannungs-potential) Horizontweise volumengerechte Probenahme mit Stechzylindern, nur an Leitprofilen, Laboranalyse mit Eijkelkamp - Aparatur 08.01 ”Sandkasten zur pF - Bestimmung (pF 0-2,0) und 08.03 ”Membranpresse (pF 1,015,00)” s. gerätespezifische Anleitung 12a 12 Wochen / 24 Proben (+) Bohrlochmethode als horizontweise Infiltrationsmessung mit Feldpermeameter (Guelph Permeameter) 5-fache Wiederholung je Monitoringfläche Kf - Wert (gesättigte Was- und anschließende Errechnung des Kf-Wertes und / oder Ermittlung der serleitfähigkeit bzw. Infilt- geschätzten oder beobachteten Obergrenze des geschlossenen Kapillarraumes durch Wasserstandskontrolle im Leitprofil bzw. im Bohrstock zum rationskapazität) Aufnahmezeitpunkt. Zusätzliche Einschätzung der standortkundlichen Feuchtestufe bzw. des ökologischen Feuchtegrades 12a 1 h / Probepunkt (+) NO3 Probenahme direkt unter der durchwurzelten Schicht im Jahresgang von März - Dez., Laboranalyse nach DIN ISO 14256, Messung auch mit ionensensitiver Elektrode möglich (anstelle Spektrometer) 3a 1 h / Probe (Labor) + Schwermetalle: Nur in Auenbereichen (As, Hg, Ti)ges Für As und Ti Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach ISO 11466 und anschließender Auswertung mittels Induktivgekoppeltem Plasma - Spektrofotometer (ICP). Für Hg AAS Kaltdampftechnik nach DIN EN 1483: 08.97 4,5 h / 11 Proben - Eindringwiderstand Nach TGL 31222/10 und TGL 31222/01 3a 25 - ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Acker Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Grundwasser (nur bei grundwassernahen Standorten) GW-Stand / -Gang Monatliche Pegelmessung Grundwasser-Qualität: Nur im BR – Spreewald durch die Naturwacht!! O2 Monatliche Messung vor Ort mit O2 -Elektrode 3a (+) Temperatur Monatliche Messung vor Ort mit Elektrode 3a (+) pH - Wert Monatliche Messung vor Ort mit Elektrode 3a (+) Elektrische Leitfähigkeit Monatliche Messung vor Ort mit Elektrode 3a (+) NO3 Monatliche Laboranalyse mit INGOLD-Nitratelektrode Typ 152223000 gegen Eichreihe 3a (+) 1a 10 min / Pegel (Ablesung) + Fauna Spinnen (Araneae) entspricht Methodik zur Laufkäfererfassung 3a 26 Gelände: entfällt Bestimmung: ca. 90 - 120 min / Falle u. Fangperiode - ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Mineralisches Grasland 1.3.2 Mineralische Grasland-Ökosysteme Zwingend erforderliche Parameter Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Monitoringfläche Fotodokumentation ÖUB-Methode 3a 10-20 min. + Flächenwasserhaushalt Wasserstufenkartierung 6a 1 d / 5 ha + Relief ze bei Hanglage! GPS-Einmessung der Aufnahmepunkte nur zur Erstaufnahme siehe Kap. 2.3.1 (+) Profilgrubenanlage und –ansprache nach KA5 (AG BODEN 2005), horiLeitprofil / Bodenhorizonzontweise Beprobung mit Stechzylindern zur Laboranalyse der nachfolgend tierung / Bodentyp aufgezählten Parameter 12a 4-6 h / 1 Profil + Textur (Tongehalt, Korngrößenverteilung, Bodenart) Bestimmung der Korngrößenzusammensetzung in allen Horizonten der Leitprofile, Laboranalyse nach Köhn - TGL 31222/02 bzw. DIN 19683-2 12a 25 h / 12 Proben + Trockenrohdichte Volumengetreue Entnahme mit Stechzylindern, Laboranalyse nach DIN 19683-Blatt 12 12a im Bereich der rezenten Aue 6a 48 h / 1 Probe (Labor) + 3 h / je Bodenmessfeld + 10 min / 1 Probe + Boden Oberbodenbeprobung Beprobung des Ah-Horizontes (bzw. Aa) nach definiertem Flächendesign pH-Wert Elektrometrische Messung nach DIN ISO 10390: 05.97 in der Bodenaufschlämmung mit CaCl2 27 12a (Leitprofil) 3a (Ah - Horizont) ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Mineralisches Grasland Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Cges Nges Prinzip nach DIN ISO 13878 und DIN ISO 10694; simultane direkte Messung von Cges und Nges im Labor am CNS – 2000 - Elementaranalysator, bei einer Einwaage in ein Keramikschiffchen von 1-2 g lufttrockenem Boden, siehe gerätespezifische Bedienungsanweisung 12a (Leitprofil) 6a (Ah - Horizont) 8 min / 1 Probe + Corg Rechenwert Corg = Cges – CCaCO3, CCaCO3 = % CaC03 x 0,12 (0,12 = CAtomgew./ CaC03 Molek.gew. = 12 / 100 = 0,12 ) 12a (Leitprofil) 6a (Ah - Horizont) 2 min / 1 Probe + C/N – Verhältnis Berechnung des Verhältnisses Corg / Nges 6a 1 min / 1 Probe + Humus Rechenwert (% Humus = Corg x 1,724) 12a (Leitprofil) 6a(Ah - Horizont) 1 min / 1 Probe + CaCO3 Messung der CO2-Entwicklung mit der Scheiblerapparatur 7.810100 ‘Calcimeter’ (siehe Bedienungsanweisung Normschliff Gerätebau Wertheim) nach Carbonatzerstörung mit HCL nach DIN ISO 10693 6a 10 min / 1 Probe + Pges, Kges Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach ISO 11466 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma - Spektrofotometer (ICP) 12a (Leitprofil), 6a (Ah – Horizont) 4,5 h / 11 Proben + 12a (Leitprofil) 4,5 h / 11 Proben + Gesamt-(Nährstoff) GehalNur auf Auenböden (BR FE) te: Alges Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach ISO 11466 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma - Spektrofotometer (ICP) Cages s.o. s.o s.o + Feges s.o. s.o s.o + 28 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Mineralisches Grasland Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Mnges s.o. s.o s.o + Nages s.o. s.o s.o + Mgges s.o. s.o s.o + Sges Direkte Messung im Labor am CNS - 2000 –-Elementaranalysator, bei einer Einwaage in ein Keramikschiffchen von 1-2 g lufttrockenem Boden, siehe gerätespezifische Bedienungsanweisung 12a (Leitprofil) 8 min / 1 Probe + Schwermetalle: Nur auf Auenböden (BR FE) Cd Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach ISO 11466 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma - Spektrofotometer (ICP) 12a (Oberboden) 6a in rezenten Auen (oder nach 4,5 h / 11 Proben Hochwasserereignissen) + Cr s.o. s.o. s.o. + Cu s.o. s.o. s.o. + Ni s.o. s.o. s.o. + Pb s.o. s.o. s.o. + Zn s.o. s.o. s.o. + 29 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Mineralisches Grasland Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung verfügbare Nährstoffe: Plak, Laboranalyse nach AG BODEN (1997) S.73/74 mit Doppellactat (DL)Auszug 12a (Leitprofil) 3a (Ah – Horizont) 2,8 h / 24 Proben + Klak s.o. 12a (Leitprofil) 3a (Ah – Horizont) 2,8 h / 24 Proben + Grundwasser Nur bei grundwassernahen Standorten 1a Pegelinstallation: 1 h (Pegel / Fl.) Ablesen: 10 min / Pegel + Pflanzen - Artendiversität Gesamtartenliste der Monitoringfläche durch intensive Geländebegehung, mit Häufigkeitsangaben (5-stufig) 3a 0,5-1 d / Monitoringfläche (außer Moose) + Diversität der Vegetation gerades Transekt, Aufnahme alle 20 m, Halbkreis mit 2 m Radius 3a 1-3 d / Monitoringfläche (außer Moose) + Pflanzenassoziation bzw. Vegetationsform 2 Vegetationsaufnahmen nach BRAUN - BLANQUET je ausgewählter Vegetationseinheit 3a 1-2 h / Aufnahme (außer Moose) + Biomasseproduktion Ernte oberirdischer Phytomasse vor 1. Schnitt bzw. Beweidung auf 1m2, 5fache Wiederholung, anschließend Wägung 3a 4h/5m + GW-Stand /-Gang Monatliche Pegelmessung Vegetation 30 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Mineralisches Grasland Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Pflanzeninhaltsstoffe: Nges direkte Messung im Labor am CNS 2000 Elementaranalysator (simultane Bestimmung) 3a 10 min / 1 Probe + Pges Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach DIN 38414-S7 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma - Spektrofotometer (ICP) 3a 1 h / 1 Probe + Kges s. o. 3a 1 h / 1 Probe + 3a Gelände (inkl. Bestimmung): Bearb.: 1,5 – 3 (4) h / Begehung, 9 – 15 (18) h / Jahr u. Fläche (+) 3a Gelände: 5 h / Beobachtungstyp u. Jahr Vorsortierung: 20 min / Falle u. Fangperiode Bestimmung: 45 - 60 min / Falle u. Fangperiode + Fauna Tagfalter / Widderchen (Rhophalocera / Zygaenidae) Nur auf Trockenstandorten (BR SC) Methodenkombination: Transekt-Methode in standörtlich abgegrenzten Probeflächen durch Sichtnachweis u. ggf. Kescherfang (semiquantitative Schätzklassen, 4 Dichteklassen / 100m²) ergänzend Raupen-, Eigelege- u. Eiablagebeobachtungen (Bodenständigkeitsnachweis) Gesamtarteninventar (mit 5-stufiger Häufigkeitsklassifikation) Zeitraum: 4 jahreszeitliche Aspekte von Mai – August Laufkäfer (Carabidae) Auf frischen und feuchten Standorten (BR SW + FE) 6 Bodenfallen / Beobachtungstyp (Messfeld) (6,8 cm Durchmesser, transparente Regenabdeckung u. ggf. Beweidungsschutz). Fangflüssigkeit: Isopropanol-Glycerin-Gemisch (2:1) + Detergenz Zeitraum: 5 Fangperioden (Leerung 14-tägig) Mitte/ Ende April - Anf./ Mitte Juni: 3 mal, Mitte / Ende Aug. - Anf. Okt.: 2 mal Erfassungsziel: Aktivitätsdichte, Artenspektrum, Dominanz 31 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Regenwürmer (Lumbricidae) Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Mineralisches Grasland Methodik MonitoringIntervall Methodenkombination: Handauslese von 1 m² durch 16 Grabungen von je 1/16m² (25x25 cm) und 20 cm Tiefe; nachfolgend Tiefenaustreibung (0,2%ige Formalinlösung) mit ca. 30 min Wirkzeit Zeitraum: einmalig im Frühjahr (Mitte April – Anf. Juni) bzw. Herbst (Mitte Sept. bis Anf. Nov.) Erfassungsziel: Artenspektrum (-zönose), Abundanz, Dominanz, Biomasse Methodenkombination: Transekt-Methode (Verhören, Sichtnachweis, ggf. Kescherfang) auf je zwei 100 m² Transekten/ Beobachtungstyp (semiquantitativ, 6 Dichteklassen/ 100 m²) Gesamtarteninventar (5-stufige Häufigkeitsklassifikation) Heuschrecken (Saltatoria) Zeitraum: 2 Begehungen (Anf. / Mitte Juli - Anf. Sept.) sowie ggf. Erfassung der Grillen (Gryllidae), Dornschrecken (Tetrigidae) im Mai - Juni als Nebenbeobachtung Erfassungsziel: Relative Individuendichten/ 100 m²; Gesamtarteninventar (5-stufige Häufigkeitsklassifikation) Zeitbedarf Erhebung bei Ersteinrichtung 6a Probenahme im Gelände: 7-9 h/m² (bei 3 Personen) Determination / Ermittlung der Biomasse: 4 – 8 h/m² + 3a Gelände (inkl. Bestimmung): 35 - 50 min Transekt / Begehung, Gesamtinventar: 2 - 3 h / Fläche u. Jahr + Bewirtschaftung / Nutzung Befragung der Bewirtschafter mit standardisiertem Formblatt zu: Mahd, Beweidung Erfassung über Bewirtschaftungsformblatt: Grünland 1a + Be- / Entwässerung Erfassung über Bewirtschaftungsformblatt: Grünland 1a + mineralische / organische Düngung Erfassung über Bewirtschaftungsformblatt: Grünland 1a + Einsaat / Dichte (ggf.) Erfassung über Bewirtschaftungsformblatt: Grünland 1a + 32 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Mineralisches Grasland Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Monitoringfläche Fotomonitoring (Panorama) Methode nach TROSIEN (2001) 6a (+) Boden Basensättigung (BS) Rechenwert, prozentualer Anteil der austauschbaren basischen Kationen an der Gesamtmenge der austauschbaren Kationen BS = Ca+Mg+K+Na in mval x 100- g / KAK eff in mval x 100 – g 12a Bohrlochmethode als horizontweise Infiltrationsmessung mit Feldpermeameter (Guelph Permeameter) 5-fache Wiederholung je Monitoringfläche und anschließende Errechnung des Kf-Wertes und / oder Ermittlung der Kf - Wert (gesättigte Wasgeschätzten od. beobachteten Obergrenze des geschlossenen Kapillarraumes einmalig bei serleitfähigkeit bzw. InfiltErsteinrichtung durch Wasserstandskontrolle im Leitprofil bzw. im Bohrstock zum Aufrationskapazität) nahmezeitpunkt zusätzliche Einschätzung der standortkundlichen Feuchtestufe bzw. des ökologischen Feuchtegrades 5 min / 1 Probe + 1 h / Probepunkt - KAK pot Beprobung des Leitprofils, Laboranalyse unter Verwendung einer bei pH 8,1 gepufferten BaCl2-Lösung nach MEHLICH, DIN 19684 Teil 8 12a 16 h / 15 Proben + KAK eff Laboranalyse durch Perkolation mit NH4Cl-Lsg. 12a 4 h / 24 Proben + 12a (Leitprofil) 4,5 h / 11 Proben + Gesamt-(Nährstoff) Gehalte: Alges Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach ISO 11466 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma - Spektrofotometer (ICP) Cages s.o. s.o. s.o. + Feges s.o. s.o. s.o. + Mnges s.o. s.o. s.o. + 33 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Mineralisches Grasland Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Nages s.o. s.o. s.o. + Mgges s.o. s.o. s.o. + Sges Direkte Messung im Labor am CNS - 2000 – Elementaranalysator, bei einer Einwaage in ein Keramikschiffchen von 1-2 g lufttrockenem Boden, siehe gerätespezifische Bedienungsanweisung s.o. s.o. + Cd Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach ISO 11466 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma - Spektrofotometer (ICP) einmalig bei Ersteinrichtung 4,5 h / 11 Proben + Cr s.o. s.o. s.o. + Cu s.o. s.o. s.o. + Ni s.o. s.o. s.o. + Pb s.o. s.o. s.o. + Zn s.o. s.o. s.o. + As Nur auf Auenböden (BR FE) Für As und Ti Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach ISO 11466 und anschließender Auswertung mittels Induktivgekoppeltem Plasma - Spektrofotometer (ICP). Für Hg AAS Kaltdampftechnik nach DIN EN 1483: 08.97 12a (oder nach Hochwasserereignissen) 4,5 h / 11 Proben - Ti s.o. s.o. s.o. - Hg s.o. s.o. s.o. - Schwermetalle 34 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Polychlorierte Biphenyle (PCB) Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Mineralisches Grasland Methodik MonitoringIntervall Zeitbedarf Nur auf Auenböden (BR FE) Nach E DIN ISO 10382:02.98 u. DIN 38414-20:0106 u. VDLUFA - Methodenhandbuch, Bd. VII Erhebung bei Ersteinrichtung - Mikrobiologische Parameter: 1-2 h für die Probenahme / Bodenmessfeld Mikrobielle Biomasse Ah – Beutelprobe, Analyse durch substrat-induzierte Respiration (nach ANDERSON & DOMSCH 1978, HEINEMEYER et al. 1989) 3a Basalatmung Gleiche Probe wie oben, Analyse durch Durchflussverfahren (DOMSCH 1962) beschrieben bei HEINEMEYER et al. (1989) 3a - Metabolischer Quotient Gleiche Probe wie oben, Bestimmung nach ANDERSON & DOMSCH (1993) 3a - Grundwasser Nur bei Grundwassernahen Standorten - GW - Qualität: O2 / Temperatur monatliche Messung vor Ort mit Elektrode 3a 5 min / Pegel (+) pH monatliche Vor-Ort-Messung mit Elektrode 3a 5 min / Pegel (+) Elektrische Leitfähigkeit monatliche Vor-Ort-Messung mit Elektrode 3a 1 min / Pegel (+) NO3 Laboranalyse 3a 10 min / Pegelprobe (+) Bewirtschaftung / Nutzung Ernte / Ertrag / Zuwachs 1a 35 + ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Mineralisches Grasland Methodik MonitoringIntervall Fauna Auf Frisch- und Feuchtstandorten (BR SW + FE) Tagfalter / Widderchen (Rhophalocera / Zygaenidae) Methodenkombination: Transekt-Methode in standörtlich abgegrenzten Probeflächen durch Sichtnachweis u. ggf. Kescherfang (semiquantitative Schätzklassen, 4 Dichteklassen/ 100m²) ergänzend Raupen-, Eigelege- u. Eiablagebeobachtungen (Bodenständigkeitsnachweis) Gesamtarteninventar (mit 5-stufiger Häufigkeitsklassifikation) Zeitraum: 4 jahreszeitliche Aspekte von Mai – August Laufkäfer (Carabidae) Auf Trockenstandorten (BR SC) 6 Bodenfallen/ Beobachtungstyp (Messfeld) (6,8 cm Durchmesser, transparente Regenabdeckung u. ggf. Beweidungsschutz). Fangflüssigkeit: Isopropanol-Glycerin-Gemisch (2:1) + Detergenz Zeitraum: 5 Fangperioden (Leerung 14-tägig) Mitte/ Ende April - Anf./ Mitte Juni: 3 mal, Mitte / Ende Aug. - Anf. Okt.: 2 mal Erfassungsziel: Aktivitätsdichte, Artenspektrum, Dominanz Zeitbedarf Erhebung bei Ersteinrichtung 3a Gelände (inkl. Bestimmung): Bearb.: 1,5 – 3 (4) h / Begehung, 9 – 15 (18) h / Jahr u. Fläche (+) 3a Gelände: 5 h / Beobachtungstyp u. Jahr Vorsortierung: 20 min / Falle u. Fangperiode Bestimmung: 45 - 60 min / Falle u. Fangperiode + Libellen (Odonata) Methodenkombination: Nur an Gräben Imagines – semiquantitative Erfassung entlang definierter Grabenabschnitte (Sichtnachweis, Kescherfang), semiquantitative Exuviensuche (ggf. an 10 m Ufer-Probestreifen) Zeitraum: 4 Begehungen von Mitte Mai – Mitte August. + sonnenreicher Tag Ende April / Anf. Mai (Sympecma spp.) Erfassungsziel: Gesamtarteninventar, relative Häufigkeitsklassen, Bodenständigkeitsnachweis (Exuvien, Jungtiere, Eiablagebeobachtungen) 3a Imagines/Gelände (inkl. Bestimmung): 4 x 1,5 h/Fläche/a Exuvien/Gelände: 4 x 0,5 h/Fläche/a Bestimmung: 4 h /Fläche/a + Lurche (Amphibia) Kombiniertes Verfahren: Nur an Gräben Sichtbeobachtung entlang definierter Grabenabschnitte (Erfassung aller Stadien; am Tage), Verhören, ggf. Blind- und Sichtkeschern. Zeitraum: 3 Begehungen von März / April – Juni / Juli Erfassungsziel: prioritär Gesamtarteninventar, (ggf. semiquantitativ in 8 Abundanzklassen) 3a Gelände (inkl. Bestimmung): 3 x 0,5 h/Fläche/a + 36 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Spinnen (Araneae) Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Mineralisches Grasland Methodik MonitoringIntervall Entspricht Methodik zur Laufkäfererfassung 3a 37 Zeitbedarf Gelände: entfällt Bestimmung: ca. 90 - 120 min/Falle/Fangperiode Erhebung bei Ersteinrichtung - ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moore 1.3.3 Naturnahe Moore Zwingend erforderliche Parameter Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung 6a 10-20 min. + Monitoringfläche Fotodokumentation ÖUB-Methode Boden Stratigrafie Stratigrafie: 1 – 2 Bohrtransekte à 5 – 6 Bohrpunkten mit der MoorklappStratigrafie ein- 1 - 4 h pro Peilung sonde bis zum Untergrund, davon einer in der Nähe des Flachschurfstandormalig zur Erst- je nach Tiefe des tes. Horizontansprache nach TGL und KA 4/KA 5; Torfart-Ansprache und einrichtung Moores Angabe des Zersetzungsgrades nach v. POST + Oberbodenhorizontierung 1 Flachschurf pro Moor bis 5 dm Tiefe, Schaufel und Stechzylinderproben in 0 – 2 dm und 2 – 4 dm (horizontale Probenahme, horizontgebunden) Einheitswasserzahl des Oberbodens nach OHDE Oberboden 6a 0,5 h pro Flachschurf- + Je Probepunkt ca. 1 kg Torf aus 0-20 cm Tiefe, Laboranalyse nach SCHMIDT (1986) 6a Probenahme: ca. 15 min + pH-Wert Elektrometrische Messung nach DIN ISO 10390: 05.97 in der Bodenaufschlämmung mit CaCl2 6a 10 min / 1 Probe + CaCO3 Messung der CO2-Entwicklung mit der Scheiblerapparatur 7.810100 ‘Calcimeter’ (siehe Bedienungsanweisung Normschliff Gerätebau Wertheim) nach Carbonatzerstörung mit HCL nach DIN ISO 10693 6a 10 min / 1 Probe + Cges Nges Prinzip nach DIN ISO 13878 und DIN ISO 10694; simultane direkte Messung von Cges u. Nges im Labor am CNS – 2000 - Elementaranalysator, bei einer Einwaage in ein Keramikschiffchen von 1-2 g lufttrockenem Boden, siehe gerätespezifische Bedienungsanweisung, 6a 8 min /1 Probe + Corg Rechenwert Corg = Cges – CCaCO3, CCaCO3 = % CaC03 x 0,12 (0,12 = CAtomgew./ CaC03 Molek.gew. = 12 / 100 = 0,12 ) 6a 2 min / 1 Probe + C/N – Verhältnis Berechnung des Verhältnisses Corg / Nges, 6a 1 min / 1 Probe + 38 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moore MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Rechenwert (% Humus = Corg x 1,724) 6a 1 min / 1 Probe + Monatliche Pegelmessung 1a Ablesung: 10 min / Pegel + Pflanzen – Artendiversität Gesamtartenliste der Monitoringfläche durch intensive Geländebegehung, mit Häufigkeitsangaben (5-stufig) 6a 1 d / Moor (außer Moose) + Diversität der Vegetation Gerades Transekt, Aufnahme alle 10 m bzw. 20 m, Halbkreis mit 2 m Radius 6a 2-4 d / Moor (außer Moose) + Pflanzenassoziation bzw. Vegetationsform 2 Vegetationsaufnahmen nach BRAUN-BLANQUET je ausgewählter Vegetationseinheit 6a 1-2 h / Aufnahme (außer Moose) + 3a Imagines im Gelände (inkl. Bestimmung): 4 x 1,5 (3) h / Fläche u. Jahr Exuvien im Gelände: 4 x 0,5 (1,5) h / Fläche u. Jahr Bestimmung: 4 (8) h / Fläche u. Jahr + Humus Methodik Grundwasser GW-Stand /-Gang Vegetation Fauna Libellen (Odonata) Methodenkombination: Imagines – semiquantitative Erfassung (Sichtnachweis, Kescherfang), semiquantitative Exuviensuche (ggf. an 10 m Ufer-Probestreifen) Zeitraum: 4 Begehungen von Mitte Mai – Mitte August. + sonnenreicher Tag Ende April / Anf. Mai (Sympecma spp.) Erfassungsziel: Gesamtarteninventar, relative Häufigkeitsklassen, Bodenständigkeitsnachweis (Exuvien, Jungtiere, Eiablagebeobachtungen) 39 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moore Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Monitoringfläche Fotomonitoring (Panorama) Nach TROSIEN (2001) 6a - einmalig zur Ersteinrichtung - Biotopkartierung im Einzugsgebiet nach LUA (2004) 6a - Veraschung im Muffelofen bei 550° und Bestimmung durch VorherNachher-Wägung , nach DIN 19684 -3 6a Einzugsgebiet: Analyse des EinzugsgebieAusgrenzung des Einzugsgebietes nach Kartenanalyse tes Biotopkartierung Boden Glührückstand / Glühverlust Substanzvolumen Nach DIN 19683-14 (relative Lagerungsdichte) 30 min / 1 Probe + 6a - Oberflächen - Wasser Pegelgang Monatliche Pegelmessung 6a - Ausdehnung der offenen Wasserfläche Vermessung im März, Mai, Juli, September, November und Darstellung auf einer Karte 6a - Temperatur Vor -Ort-Messung mit Quecksilberthermometer nach DIN 38404-4; alternativ mit Elektrode 6a - O2 Vor – Ort - Messung mit Elektrode 6a - Nges (anorganisch) Laboranalyse; Bestimmung nach DIN 38409-27 6a - Pges Laboranalyse mit ICP nach DIN 38406 6a - Qualität oberflächlich vorh. Wassers (Kolk, Lagg, Graben): 40 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moore Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Kges Laboranalyse am AAS nach DIN 9964-3 6a - pH Vor – Ort - Messung mit Elektrode 6a - elektrische Leitfähigkeit Vor – Ort - Messung mit Elektrode 6a - NO3 Laboranalyse mit INGOLD - Nitratelektrode Typ 15 222 3000 gegen Eichreihe 6a - pH - Wert Monatliche vor – Ort – Messung mit Elektrode 6a Elektrische Leitfähigkeit Monatliche vor – Ort – Messung mit Elektrode 6a O2 Monatliche vor – Ort – Messung mit Elektrode 6a 1 min / Probenahme + Temperatur Immer gemeinsam mit Wasseranalysen; Messung mit in O2-Elektrode integriertem Temperaturfühler 6a 5 min / Probenahme + NO3 Laboranalyse mit INGOLD - Nitratelektrode Typ 15 222 3000 gegen Eichreihe 6a 10 min / Probenahme + Luftbildauswertung; Abmessung der Vegetationseinheiten durch Schrittmaß bzw. mit Hilfe eines Hand - GPS, Eintragung in Geländeskizze sowie Erstellung von Vegetationskarte 12a Im Gelände 6 h / ha + Grundwasser - Qualität 5-10 min / Probenahme + + Vegetation Vegetationszonierung 41 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moore Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Fauna Gesamtarteninventar (jeweils 5-stufige Häufigkeitsklassifikation) Heuschrecken (Saltatoria) Zeitraum: als Nebenbeobachtung parallel zur Libellenkartierung (Mai- August). Anmerkung: auf ausgewählten Flächen qualifizierte Erfassung 3a Gelände (inkl. Bestimmung): ca. 15-20 min / Begehung (+) Gelände (inkl. Bestimmung): ca. 0,5 h / Begehung (+) Tagfalter / Widderchen (Rhophalocera / Zygaenidae) Gesamtarteninventar (jeweils 5-stufige Häufigkeitsklassifikation) Zeitraum: als Nebenbeobachtung parallel zur Libellenkartierung (Mai August) Anmerkung: auf ausgewählten Flächen qualifizierte Erfassung 3a Laufkäfer (Carabidae) Nur ausgewählte Flächen 3a (+) Spinnen (Aranea) Nur ausgewählte Flächen 3a - Lurche (Amphibia) Kombiniertes Verfahren: Sichtbeobachtung (Erfassung aller Stadien; am Tage), Verhören, ggf. Blind- und Sichtkeschern. Zeitraum: 3 Begehungen, April - Juni/ Juli Erfassungsziel: prioritär Gesamtarteninventar des Laichgewässers (semiquantitativ in 8 Abundanzklassen) 42 3a Gelände (inkl. Bestimmung): 3 x 1 h/ Fläche u. Jahr + ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moorgrünland 1.3.4 Entwässerte landwirtschaftlich genutzte und aufgelassene Moore (inkl. wiedervernässter Flächen) Zwingend erforderliche Parameter Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Monitoringfläche Fotodokumentation ÖUB-Methode 6a 10-20 min. + Flächenwasserhaushalt Wasserstufenkartierung 6a 1 d / 5 ha + Boden Stratigrafie 1 – 2 Bohrtransekte mit 5 – 6 Bohrpunkten. Beprobung mit der Moorklapp0,5 – 2 h / Peilung, sonde bis zum Untergrund, davon einer in der Nähe des Flachschurfstandor- Einmalig zur je nach Tiefe des tes. Ansprache nach TGL und KA 4/KA 5; Torfart - Ansprache und Angabe Ersteinrichtung Moores des Zersetzungsgrades nach v. POST + Oberbodenhorizontierung 1 Flachschurf bis 5 dm Tiefe, Schaufel und Stechzylinderproben in 0 – 2 dm und 2 – 4 dm (horizontale Probenahme), zusätzlich 4 Wiederholungen gemäß Flächendesign (vertikale Probenahme). Trockenrohdichte Glührückstand / Glühverlust 6a (Oberboden) 3 h / Bodenmessfeld + Volumengetreue Entnahme mit Stechzylindern, Laboranalyse nach DIN 19683-Blatt 12 6a 48 h / 1 Probe + Veraschung im Muffelofen bei 550° und Bestimmung nach DIN 19684 Teil 3 6a 30 min / 1 Probe + Substanzvolumen Nach DIN 19683-14 (relative Lagerungsdichte) 6a 48 h Trocknung + 30 min für Glührückstandsanalyse (+) Einheitswasserzahl des Oberbodens nach OHDE 6a Probenahme: 15 min + Je Probepunkt ca. 1 kg Torf aus 0-20 cm Tiefe, Laboranalyse nach SCHMIDT (1986) 43 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moorgrünland Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Oberbodenbeprobung Beprobung aus den Tiefen 0-2 dm und 2-4 dm nach definiertem Flächendesign pH-Wert Elektrometrische Messung nach DIN ISO 10390: 05.97 in der Bodenaufschlämmung mit CaCl2 6a 10 min / 1 Probe + CaCO3 Messung der CO2-Entwicklung mit der Scheiblerapparatur 7.810100 ‘Calcimeter’ (siehe Bedienungsanweisung Normschliff Gerätebau Wertheim) nach Carbonatzerstörung mit HCL nach DIN ISO 10693 6a 10 min / 1 Probe + Cges Nges Prinzip nach DIN ISO 13878 und DIN ISO 10694; simultane direkte Messung von Cges u. Nges im Labor am CNS – 2000 - Elementaranalysator, bei einer Einwaage in ein Keramikschiffchen von 1-2 g lufttrockenem Boden, siehe gerätespezifische Bedienungsanweisung, 6a 8 min / 1 Probe + Corg Rechenwert Corg = Cges – CCaCO3, CCaCO3 = % CaC03 x 0,12 (0,12 = CAtomgew./ CaC03 Molek.gew. = 12 / 100 = 0,12 ) 6a 2 min / 1 Probe + C/N – Verhältnis Berechnung des Verhältnisses Corg / Nges, 6a 1 min / 1 Probe + Humus Rechenwert (% Humus = Corg x 1,724) 6a 1 min / 1 Probe + Nährstoffgehalte Nur in genutzten Mooren Plak, Laboranalyse nach AG BODEN (1997) S.73/74 - mit Doppellactat (DL)Auszug 6a 2,8 h / 1 Probe + Klak s.o. 6a 2,8 h / 1 Probe + Kges Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach ISO 11466 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma - Spektrofotometer (ICP) 6a 4,5 h / 11 Proben + Pges s.o. 6a 4,5 h / 11 Proben + 44 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moorgrünland Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Grundwasser Monatliche Pegelmessung 1a Ablesung: 10 min / Pegel + Pflanzen - Artendiversität Gesamtartenliste der Monitoringfläche durch intensive Geländebegehung, mit Häufigkeitsangaben (5-stufig) 3a 0,5-1 d / Monitoringfläche (außer Moose) + Diversität der Vegetation Gerades Transekt, Aufnahme alle 20 m, Halbkreis mit 2 m Radius 3a 1-3 d / Transekt (außer Moose) + Pflanzenassoziation bzw. Vegetationsform 2 Vegetationsaufnahmen nach BRAUN-BLANQUET je ausgewählter Vegetationseinheit 3a 1-2 h / Aufnahme (außer Moose) + Biomasseproduktion Nur in genutzten Mooren Ernte oberirdischer Phytomasse vor 1. Schnitt bzw. Beweidung auf 1m2, 5fache Wiederholung; anschließend Wägung und Bestimmung der Trockenmasse 3a 4h/5m + Pflanzeninhaltsstoffe: Nur in genutzten Mooren GW-Stand /-Gang Vegetation Nges Direkte Messung im Labor am CNS 2000 Elementaranalysator (simultane Bestimmung) 3a 10 min / 1 Probe + Pges Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach DIN 38414-S7 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma-Spektrofotometer (ICP) 3a 1 h / 1 Probe + Kges Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach DIN 38414-S7 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma-Spektrofotometer (ICP) 3a 1 h / 1 Probe + 45 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moorgrünland Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Fauna Laufkäfer (Carabidae) 6 Bodenfallen/ Beobachtungstyp (Messfeld) (6,8 cm Durchmesser, transparente Regenabdeckung u. ggf. Beweidungsschutz), Fangflüssigkeit: Isopropanol-Glycerin-Gemisch (2:1) + Detergenz Zeitraum: 5 Fangperioden (Leerung 14-tägig) Mitte/ Ende April - Anf./ Mitte Juni: 3 mal, Mitte / Ende Aug. - Anf. Okt.: 2 mal Erfassungsziel: Aktivitätsdichte, Artenspektrum, Dominanz Regenwürmer (Lumbricidae) Nur in genutzten Mooren Methodenkombination: Handauslese von 1 m² durch 16 Grabungen von je 1/16m² (25x25 cm) und 20 cm Tiefe; nachfolgend Tiefenaustreibung (0,2%ige Formalinlösung) mit ca. 30 min Wirkzeit (nicht bei hohem Grundwasserstand) Zeitraum: einmalig im Frühjahr (Mitte April – Anf. Juni) bzw. Herbst (Mitte Sept. bis Anf. Nov.) Erfassungsziel: Artenspektrum (-zönose), Abundanz, Dominanz, Biomasse Nur in genutzten Mooren und ausgewählten aufgelassenen Standorten Methodenkombination: Transekt - Methode (Verhören, Sichtnachweis, ggf. Kescherfang) auf je zwei 100 m² Transekten/ Beobachtungstyp (semiquantitativ, 6 Dichteklassen/100 m²) Heuschrecken (Saltatoria) Gesamtarteninventar (5-stufige Häufigkeitsklassifikation) Zeitraum: 2 Begehungen (Anf./ Mitte Juli - Anf. Sept.) sowie ggf. Erfassung der Grillen (Gryllidae), Dornschrecken (Tetrigidae) im Mai - Juni als Nebenbeobachtung Erfassungsziel: Relative Individuendichten/100 m²; Gesamtarteninventar (5-stufige Häufigkeitsklassifikation) 46 3a Gelände: 5 h / Beobachtungstyp u. Jahr Vorsortierung: 20 min / Falle u. Fangperiode Bestimmung: 45 - 60 min / Falle u. Fangperiode + 6a Probenahme im Gelände: 7-9 h / 1m² (durch 3 Hk) Determination / Ermittlung der Biomasse: 4 - 8 h / m² + 3a Gelände (inkl. Bestimmung): 35 - 50 min / Transekt u. Begehung + Gesamtinventar 2 - 3 h / Fläche u. Jahr + ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zwingend erforderliche Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moorgrünland Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Bewirtschaftung / Nutzung Nur in genutzten Mooren Befragung der Bewirtschafter mit standardisiertem Formblatt zu: Mahd, Beweidung Erfassung über Bewirtschaftungsformblatt: Grünland 1a + Be- / Entwässerung Erfassung über Bewirtschaftungsformblatt: Grünland 1a + Düngung Erfassung über Bewirtschaftungsformblatt: Grünland 1a + Ernte / Ertrag / Zuwachs Erfassung über Bewirtschaftungsformblatt: Grünland 1a + 47 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moorgrünland Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Monitoringfläche Fotomonitoring (Panorama) Methode nach TROSIEN (2001) 6a (+) Boden Plak, Nur in aufgelassenen Mooren Laboranalyse nach AG BODEN (1997) S.73 / 74 - mit Doppellactat (DL) Auszug 6a 2,8 h / Probe + Klak Nur in aufgelassenen Mooren s.o. 6a 2,8 h / Probe + Kges, Pges Nur in aufgelassenen Mooren Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach ISO 11466 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma - Spektrofotometer (ICP) 6a 2,8 h / Probe + Basensättigung (BS) Nur in genutzten Mooren Rechenwert, prozentualer Anteil der austauschbaren basischen Kationen an der Gesamtmenge der austauschbaren Kationen BS = Ca+Mg+K+Na in mval x 100- g / KAK eff in mval x 100 – g 12a 5 min / 1 Probe (+) Kf – Wert (Wasserleitfähigkeit) Nur in genutzten Mooren Horizontweise Infiltrationsmessung mit Feldpermeameter (Guelph Permeameter), 5-fache Wiederholung je Monitoringfläche und anschließende Errechnung des Kf - Wertes und / oder Ermittlung der geschätzten oder beobachteten Obergrenze des geschlossenen Kapillarraumes durch Wasserstandskontrolle im Leitprofil bzw. im Bohrstock zum Aufnahmezeitpumkt, zusätzliche Einschätzung der standortkundlichen Feuchtestufe bzw. des ökologischen Feuchtegrades 6a 1h / Probepunkt - KAK pot Beprobung des Leitprofils, Laboranalyse unter Verwendung einer bei pH 8,1 gepufferten BaCl2-Lösung nach MEHLICH, DIN 19684 Teil 8 12a 16 h / 15 Proben (+) KAK eff Laboranalyse durch Perkolation mit NH4Cl-Lsg. 4 h / 24 Proben - 48 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moorgrünland Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Mikrobiologische Parameter: Mikrobielle Biomasse Oberboden-Beutelprobe, Analyse durch substrat-induzierte Respiration (nach ANDERSON & DOMSCH 1978 und HEINEMEYER et al. 1989) Basalatmung Gleiche Probe wie oben, Analyse durch Durchflussverfahren (DOMSCH 1962) beschrieben bei HEINEMEYER et al. (1989) 3a 2 h für die Probenahme / Bodenmessfeld - 3a 2 h für die Probenahme / Bodenmessfeld - 3a 2 h für die Probenahme / Bodenmessfeld - Metabolischer Quotient Gleiche Probe wie oben, Bestimmung nach ANDERSON & DOMSCH (1993) Oberflächen - Wasser Nur in aufgelassenen wiedervernäßten Mooren Ausdehnung der offenen Wasserfläche Vermessung im März, Mai, Juli, September, November und Darstellung auf einer Karte 6a - Monatliche Pegelmessung 1a - pH - Wert Vor-Ort-Messung mit Elektrode 3a - Elektrische Leitfähigkeit Vor-Ort-Messung mit Elektrode 3a - O2 Vor-Ort-Messung mit Elektrode 3a - Temperatur Vor-Ort-Messung mit Quecksilberthermometer nach DIN 38404-4; alternativ mit in O2-Elektrode integriertem Temperaturfühler 3a - Nges (anorganisch) Laboranalyse; Bestimmung nach DIN 38409-27 3a - Kges Laboranalyse am AAS nach DIN 9964-3 3a - Grabenwasser Pegelgang Grabenwasser-Qualität: 49 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moorgrünland Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Pges Laboranalyse mit ICP nach DIN 38406 3a - No3 Laboranalyse mit INGOLD-Nitratelektrode Typ 152223000 gegen Eichreihe 3a - pH - Wert monatliche vor – Ort - Messung mit Elektrode 3a 5-10 min / Pegel + nur BR-SC Elektrische Leitfähigkeit monatliche vor – Ort - Messung mit Elektrode 3a 1 min / Pegel + nur BR-SC O2 monatliche vor – Ort - Messung mit Elektrode 3a Temperatur immer gemeinsam mit Wasseranalysen; Messung mit in O2-Elektrode integriertem Temperaturfühler 3a 5 min. / Pegel + nur BR-SC NO3 Laboranalyse mit INGOLD - Nitratelektrode Typ 15 222 3000 gegen Eichreihe 3a 10 min / Probenahme + nur BR-SC Biomasseproduktion Nur in aufgelassenen Mooren Ernte oberirdischer Phytomasse vor 1. Schnitt bzw. Beweidung auf 1m2, 5fache Wiederholung; anschließend Wägung und Bestimmung der Trockenmasse 3a 4h/5m (+) Pflanzeninhaltsstoffe: Nur in aufgelassenen Mooren Grundwasser GW-Qualität: + nur BR-SC Vegetation Nges Direkte Messung im Labor am CNS 2000 Elementaranalysator (simultane Bestimmung) 3a 10 min / 1 Probe (+) Pges Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach DIN 38414-S7 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma-Spektrofotometer (ICP) 3a 1 h / 1 Probe (+) Kges Laboranalyse durch Extraktion mit Königswasser-Aufschluss nach DIN 38414-S7 und anschließender Auswertung mittels Induktiv-gekoppeltem Plasma-Spektrofotometer (ICP) 3a 1 h / 1 Probe (+) 50 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moorgrünland Methodik MonitoringIntervall Zeitbedarf Erhebung bei Ersteinrichtung Fauna Tagfalter / Widderchen (Rhophalocera / Zygaenidae) Methodenkombination: Transekt - Methode in standörtlich abgegrenzten Probeflächen durch Sichtnachweis u. ggf. Kescherfang (semiquantitative Schätzklassen, 4 Dichteklassen/ 100m²) ergänzend Raupen-, Eigelege- u. Eiablagebeobachtungen (Bodenständigkeitsnachweis) Gesamtarteninventar (mit 5-stufiger Häufigkeitsklassifikation) Zeitraum: 4 jahreszeitliche Aspekte von Mai – August Libellen (Odonata) Methodenkombination (nur in Gräben): Imagines – semiquantitative Erfassung entlang definierter Grabenabschnitte (Sichtnachweis, Kescherfang), semiquantitative Exuviensuche (ggf. an 10 m Ufer-Probestreifen) Zeitraum: 4 Begehungen von Mitte Mai – Mitte August + sonnenreicher Tag Ende April/ Anf. Mai (Sympecma spp.) Erfassungsziel: Gesamtarteninventar, relative Häufigkeitsklassen, Bodenständigkeitsnachweis (Exuvien, Jungtiere, Eiablagebeobachtungen) Lurche (Amphibia) Kombiniertes Verfahren (nur in Gräben): Sichtbeobachtung entlang definierter Grabenabschnitte (Erfassung aller Stadien; am Tage), Verhören, ggf. Blind- und Sichtkeschern. Zeitraum: 3 Begehungen von März/ April – Juni/ Juli Erfassungsziel: prioritär Gesamtarteninventar, (ggf. semiquantitativ in 8 Abundanzklassen) 51 3a Gelände (inkl. Bestimmung): Bearbeitung: 1,5 – 3 (4) h / Begehung, 9 – 15 (18) h / Jahr u. Fläche + 3a Imagines Gelände (inkl. Bestimmung): 4 x 1,5 h / Fläche u. Jahr Exuvien Gelände: 4 x 0,5 h / Fläche u. Jahr Bestimmung: 4 h / Fläche u. Jahr + 3a Gelände (inkl. Bestimmung): 3 x 0,5 h / Fläche u. Jahr + ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Zusätzlich sinnvolle Parameter Regenwürmer (Lumbricidae) Tabellarische Methodenübersicht der terrestrischen Ökosysteme: Moorgrünland Methodik MonitoringIntervall Nur in aufgelassenen Mooren Methodenkombination: Handauslese von 1 m² durch 16 Grabungen von je 1/16m² (25x25 cm) und 20 cm Tiefe; nachfolgend Tiefenaustreibung (0,2%ige Formalinlösung) mit ca. 30 min Wirkzeit (nicht bei hohem Grundwasserstand). Zeitraum: einmalig im Frühjahr (Mitte April – Anf. Juni) bzw. Herbst (Mitte Sept. bis Anf. Nov.) Erfassungsziel: Artenspektrum (-zönose), Abundanz, Dominanz, Biomasse Nur in aufgelassenen Mooren Methodenkombination: Transekt - Methode (Verhören, Sichtnachweis, ggf. Kescherfang) auf je zwei 100 m² Transekten/ Beobachtungstyp (semiquantitativ, 6 Dichteklassen/ 100 m²) Heuschrecken (Saltatoria) Gesamtarteninventar (5-stufige Häufigkeitsklassifikation) Zeitraum: 2 Begehungen (Anf./ Mitte Juli - Anf. Sept.) sowie ggf. Erfassung der Grillen (Gryllidae), Dornschrecken (Tetrigidae) im Mai - Juni als Nebenbeobachtung Erfassungsziel: Relative Individuendichten/ 100 m²; Gesamtarteninventar (5-stufige Häufigkeitsklassifikation) Spinnen (Araneae) entspricht Methodik zur Laufkäfererfassung 52 Zeitbedarf Erhebung bei Ersteinrichtung 6a Gelände: (Probenahme) 7-9 h/ 1m² (durch 3 Hk) Determination / Ermittlung der Biomasse: 4 - 8 h / m² + 3a Gelände (inkl. Bestimmung): 60 - 90 min/ Beobachtungstyp + 3a Gelände: entfällt Bestimmung: ca. 90 - 120 min/ Falle u. Fläche - ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 2 Flächeneinrichtung Flächeneinrichtung 2.1 Auswahl der Monitoringflächen Die Auswahl der konkreten Flächen erfolgte auf Grundlage der Konzeption zur ÖUB (siehe VAHRSON et al. 1997, LUTHARDT 2003) in Abstimmung mit der Landesanstalt für Großschutzgebiete Brandenburgs (LAGS) und den Biosphärenreservatsverwaltungen. Die für die Ökosystemare Umweltbeobachtung ausgewählten Ökosystem-Flächen werden vom ÖUB-Team zur Vorerkundung aufgesucht. Auf Basis der Bodenzustandsform (Bohrstockeinschläge) sowie der Vegetationsausbildung werden die konkreten Messfelder für die spezifischen Beobachtungszieltypen ausgewählt. Die ausgewählten Bereiche werden zunächst mit Stangen markiert, um anschließend das jeweilige Beprobungsschema (Flächendesign), siehe ANHANG, einzurichten. 2.2 Festlegung des Flächendesigns Mit ”Flächendesign” wird die regelhafte Anordnung von Untersuchungspunkten bzw. -flächen auf der Monitoringfläche bezeichnet. Für die Acker-, Grasland- und Niedermoor-Ökosystemtypen wurden in Vorbereitung der Geländearbeit Standard-Flächendesigns entwickelt (siehe ANHANG). Im Gelände werden dann Messfelder bzw. Punkte für die Aufnahme des Bodens, der Vegetation und der Fauna eingemessen und markiert (Geräte und Materialien siehe Kapitel 4). Anschließend werden alle Untersuchungspunkte, soweit möglich, mit GPS eingemessen (Kapitel 2.3). Punkte, bzw. Erhebungsfelder, die nicht mit GPS eingemessen werden können, müssen entweder dauerhaft markiert und / oder deren Position anhand Feldskizzen und verbalen Beschreibungen detailliert festgehalten werden. In der Regel werden auf jeder Monitoringfläche zwei Messfelder eingerichtet, um vor unvorhergesehenen Ereignissen (z.B. durch Wildschweine umgebrochene Vegetationsaufnahme etc.) unabhängiger zu sein. Durch diese Doppelung wird zugleich eine höhere Stichprobenzahl erreicht. Zur besseren Unterscheidung werden die beiden Messfelder als sogenanntes Haupt- und Nebenmessfeld bezeichnet. Die Lage von Haupt- und Nebenmessfeld lässt sich aus den jeweiligen Karten der ÖUB - Monitoringflächen ersehen. In naturnahen Mooren wird jeweils nur ein Flachschurf unter Berücksichtigung eines Mindestabstandes von 10 m zu den Vegetationsdauerquadraten beprobt. Aufgrund der kleinräumigen Standortwechsel in vielen naturnahen Mooren wird das Aufnahmedesign unter Einhaltung dieser Voraussetzungen für jede Monitoringfläche spezifisch festgelegt. Die Aufnahmeflächen werden dabei vermarkt und möglichst mit GPS eingemessen. Um besonderen Standortbedingungen vor Ort wie z.B. kleinräumig wechselnden Bodenverhältnissen und Relief bzw. sehr schmal und langgestreckt ausgebildeten Ökosystemtypen gerecht zu werden, müssen die Standard-Flächendesigns gegebenenfalls spezifisch modifiziert werden. Hierdurch wird eine möglichst hohe Homogenität des Messfeldes und damit eine gute Vergleichbarkeit der Daten von Boden-, Vegetations- und Faunenerhebung gewährleistet. 53 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Flächeneinrichtung Das spezifische Flächendesign der einzelnen Monitoringflächen sowie eventuell vorgenommene Modifikationen vom Standard-Flächendesign werden genauestens dokumentiert und im zukünftigen Monitoring der ÖUB beibehalten. Die eingemessenen Eckpunkte werden auf dem Orthofoto der Monitoringfläche digital markiert und in der Datenbank abgelegt. 54 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Flächeneinrichtung 2.3 Flächenvermarkung Das genaue Wiederfinden aller Flächen und Untersuchungspunkte hat oberste Priorität bei einem auf Dauerbeobachtung ausgerichteten Messprogramm. Daher wurde darauf große Sorgfalt gelegt. Die Markierung erfolgt mittels GPS und in den Boden eingelassener Magnete. Bei nicht genutzten Monitoringflächen werden zudem Holzpflöcke als dauerhafte Markierung eingesetzt. 2.3.1 Virtuelle Punktvermarkung mit DGPS Auf landwirtschaftlichen Nutzflächen sind dauerhafte Markierungen nicht möglich, da diese entweder durch die Bewirtschaftung zerstört werden oder aber die Nutzung, und damit auch die weitere Ökosystementwicklung, in nicht gewünschter Weise beeinträchtigt würde. Als Alternative bot sich hier die Nutzung eines differentiellen Geo-Informationssystems (DGPS) an (siehe dazu auch Kapitel 4.1). Mit Hilfe dieses auf Satellitendaten basierenden Messsystems lässt sich jeder eingemessene Punkt auf relativ komfortable Weise und mit einer Genauigkeit in Horizontalposition von 2-4 cm (L1/L2-Empfänger) bzw. +/- 30 cm (L1-Empfänger) wiederfinden. Nach Möglichkeit empfiehlt es sich auch jeden dauerhaft verpflockten Punkt zusätzlich mit GPS einzumessen, für den Fall, dass die Holzmarkierungen verloren gehen. In gehölzreicheren Gebieten muss dafür das gegenüber größerer Überschirmung unempfindlichere System der L1-Empfänger verwendet werden. Das Messprinzip (Zwei-Frequenzempfänger; L1/L2) (nach GOLDSCHMIDT & VAHRSON 1997) Das GPS (Global Positioning System) funktioniert mit Hilfe des Empfangs und der Verarbeitung von Positions- und Zeitdaten, die von den GPS-Satelliten permanent ausgesendet werden. Die relativen, gemessenen Positionsdaten sind hochgenau (ca. 2 cm Lage- und ca. 4 cm ohne Netzausgleich), da 1. sie differentiell gemessen wurden 2. die Auswertung unabhängig vom Positionscode ist. ad 1. Es wird nicht eine isolierte Position bestimmt, sondern immer an 2 verschiedenen Stellen zur selben Zeit gemessen. Die Daten werden entweder vor Ort (Real Time) oder am Computer im Büro (Post Processing) verglichen und mit speziellen Iterationsalgorithmen ein hochgenauer Vektor, die sog. Basislinie (baseline), zwischen diesen beiden Positionen berechnet. ad 2. Die Satellitendaten sind auf 2 Trägerwellen unterschiedlicher Wellenlänge aufcodiert. Da es sich bei GPS um ein militärisches System handelt, sind auf der einen Welle die Daten mit einem sehr präzisen, aber unter Umständen zeitweilig nicht für die zivile Nutzung freigegebenen Code (P-Code = Precise Code) verschlüsselt. Die andere Trägerwelle enthält verfälschte, aber jederzeit zugängliche Daten, die nur eine ungenauere Positionsbestimmung zulassen (C/ACode = Coarse / Aquisition-Code). Das hier verwendete System nutzt die codierten Daten nur, um für die Iteration einen Anfangswert zu haben. Die Berechnung selbst erfolgt mit Hilfe der 55 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Flächeneinrichtung Trägerwelle, deren Wellenlänge exakt bekannt ist 3. Die Positionsbestimmung ist daher unabhängig vom Code und sehr genau. Die absoluten Positionen sind relativ ungenau (max. 5 m, bis zu 100 m), die Basislinie dagegen sehr genau (s.o.). Für eine exakte Einbindung der gemessenen Daten in das amtliche Koordinatensystem muss vor der eigentlichen Vermessung ein lokales Netz von Festpunkten eingemessen werden. Die Transformation 4 von dem GPS-eigenen Koordinatensystem (WGS84) in das von den Vermessungsämtern in Brandenburg verwendete Gauss-Krüger-System 5 nimmt das Auswertungs-Programm vor. Neben der Verschiebung der Koordinatensysteme werden durch diese Transformation auch lokale Geoidundulationen 6 ausgeglichen. Das Ergebnis ist ein Netz von Basislinien, das die später vermessenen Punkte zwar richtig, aber ungenauer als gemessen in das amtliche Koordinatensystem einordnet. Die Endgenauigkeit nach dem sogenannten Netzausgleich ist abhängig von der Güte des Netzes, d.h. der Menge und Genauigkeit der bei der NetzEinmessung berechneten Basislinien, und der Stärke der Geoidundulationen. Nach unserer Erfahrung ist die Genauigkeit i.d.R. um mindestens eine Zehnerpotenz schlechter (10-15 cm horizontal und 20-25 cm vertikal). Arbeitsschritte und dafür erforderlicher Zeitbedarf: • Aufstellen der Basisstation auf einem Topografischen Festpunkt (TP) und Installation der Messung: ca. 30 min • Installation des transportablen Teils der Messausrüstung auf der Monitoringfläche und Initialisierung der Messung: ca. 20 min – 1 h (je nach Satellitenkonstellation zum entsprechenden Zeitpunkt) • Einmessen jedes gewünschten Punktes mit einer Genauigkeit von 2 – 4 cm: ca. 2 min (i.d.R.) – 35 min und länger (je nach Satellitenkonstellation zum entsprechenden Zeitpunkt) • Beenden der Messung und Abbau der Basisstation von TP: ca. 15 min • Wiederauffinden von eingemessenen Punkten mit einer Genauigkeit von 2 – 4 cm: ca. 5 min / Punkt (bei optimaler Satellitenkonstellation) + Zeit für Auf- und Abbau der Basisstation sowie Initialisierung der Messung (s.o.) • Netzeinmessung (Vermessung von mind. 2 Basislinien, d.h. Integration von 4 TP’s): ca. 1 Arbeitstag / Monitoringfläche Eine genaue Arbeitsanweisung für das im Rahmen der ÖUB verwendete Trimble - GPS ist in einem kurzen Handbuch niedergeschrieben (unveröffentlichtes Manuskript). 3 Die Welle hat zwischen dem Satelliten und dem Empfänger n+x (n∈N, x∈R) Perioden durchlaufen. Der reelle Teil (x) der Schwingungsperiode bei Ankunft am Empfänger kann von diesem exakt bestimmt werden. Der ganzzahlige Teil (n) wird durch den Zeitvergleich mit den anderen Satellitendaten iterativ berechnet. 4 7-Parameter-Transformation: 3 Translations-, 3 Rotationsparameter und ein Skalierungsfaktor für die Veränderung der Vektorlänge 5 Im Krassovsky-Ellipsoid mit 3°-Meridianstreifen (Gartzer Bruch und Niederoderbruch: Mittelmeridian = 15°) 6 Abweichung des realen Geoids vom idealen Ellipsoids durch Unregelmäßigkeiten der Erdfelder (z.B. Schwerefeld), die bei extraterrestrischen Vermessungsmethoden nicht wirken, so dass damit andere Ergebnisse erzielt werden wie bei terrestrischer Vermessung 56 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Flächeneinrichtung Einmessungen mit Ein-Frequenzempfänger (L1) Bei Messungen mit einem einfacherem GPS-Empfänger (Ein-Frequenzempfänger; L1) ist das Messprinzip das gleiche, jedoch ist die relative Genauigkeit nicht so gut, da die Empfänger nur Satellitendaten einer Trägerwelle auswerten können und sich der korrekturdatensendende Referenzempfänger mehrere Kilometer weit weg befindet. Dafür entfällt der komplizierte Geräteaufbau. Der Empfänger ist nach vorheriger Konfiguration sofort messbereit. Das Einmessen der Punkte (ggf. auch Linien od. Flächen) dauert nur wenige Minuten. Die Punkteinmessung bei der Ersteinrichtung der Monitoringflächen im Biosphärenreservat Flusslandschaft Elbe erfolgte ausschließlich mit dem Rucksack-GPS (GS 50) der Firma Leica (siehe auch Kapitel 4.1). Datenhaltung: Die GPS-Daten werden derzeit in softwarespezifischen Rohdaten-Files und Projektdateien sowie in GIS verarbeiteten Dateien [ArcView-Shapedateien (*.shp) und dBase-Dateien (*.dbf)] gehalten. Die Koordinaten der Messpunkte liegen außerdem in einfachen *.txt - Dateien vor. 2.3.2 Markierung mit Dauermagneten Um ein punktgenaues Wiederfinden der Eck- und Transektpunkte zu gewährleisten werden die eingemessenen Punkte in Kombination zur Einmessung mit GPS mit Dauermagneten markiert. Diese Maßnahme stellt zudem eine zusätzliche Absicherung dar (z. B. bei der Entfernung der Pfähle durch Schwarzwild oder Menschen) und ermöglicht das genaue Wiederauffinden der Probeflächen insbesondere dort, wo der Einsatz von GPS-Technik nicht verfügbar bzw. in Folge der Geländesituation (Senke, starke Überschirmung) zu ungenau oder unmöglich ist. Bei der Ersteinrichtung der ÖUB - Flächen werden definierte Messfeldpunkte (vgl. Karten der MessfeldFlächendesigns im ANHANG) sowie mehrere Vegetationstransektpunkte mit Dauermagneten markiert 7. Die Magnete mit den Maßen von 30 x 16 mm werden mittels einer Setzhilfe in Schraubdosen (Filmdosen) in etwa 25 - 50 cm Erdtiefe 8 eingegraben. Sie können zukünftig mit einem Magnetsuchgerät (z. B. "MAGNA TRAK 100") mit einer Genauigkeit von etwa 5 cm wieder aufgefunden werden. Insbesondere in unübersichtlichem Gelände ist der kombinierte Einsatz mit einem GPS-Handgerät (z. B. LEICA GS 50) ideal. Das GPS ermöglicht dabei ein „grobes“ Wiederauffinden im „1 m Bereich“ und nachfolgend lässt sich mit dem Magnetsuchgerät die exakte Lage des Probepunktes bestimmen. Anschließend wird das Messfeld für die Dauer der Beprobung mit Markierungsstangen abgesteckt. Der kombinierte Einsatz von GPS und Magnetsuchgerät erweist sich neben einer nur bei ungenutzten Ökosystemen möglichen Markierung mit Holzpfählen als relativ zeitsparend. 7 8 Die zusätzliche Markierung mit Dauermagneten wird im Monitoring der ÖUB erst seit dem Jahre 2002 durchgeführt. Für die bereits zuvor eingerichteten Monitoringflächen wurden die Magnete jedoch nachträglich bei der ersten Wiederholungsuntersuchung gesetzt. Auf Ackerflächen muss die maximale Tiefpflugbearbeitung berücksichtigt werden. Versenkung in mindestens 50 cm Tiefe. Da die maximale Empfangstiefe des Magnetsuchgeräts (MAGNA TRAK 100) bei 70 cm liegt ggf. zwei Magnete verwenden. 57 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Flächeneinrichtung 2.3.3 Punktvermarkung mit Holzpflöcken An allen Standorten, die nicht landwirtschaftlich genutzt werden, ist neben der GPS-Einmessung sowie dem Setzen von Magneten eine Punktmarkierung durch eingeschlagene Holzpflöcke möglich. Die zur Verfügung stehenden Hölzer mit einem Ideal-Durchmesser von ca. 5-10 cm werden auf eine Länge von ca. 1,50 m, für die naturnahen Moore ca. 2 m, zugeschnitten und an einer Seite angespitzt. Für die dauerhafte Markierung der Anfangs- und Endpunkte von Vegetationstransekten am Rande landwirtschaftlich genutzter Flächen eignen sich am besten Holzpflöcke stärkeren Durchmessers (ca. 20 cm). Um eine lange Haltbarkeit der Markierungspflöcke zu erreichen, sollten möglichst folgende Holzarten verwendet werden: Robinie, Eiche, Riesen-Lebensbaum, Lärche oder Schwarz-Erle. Die eingeschlagenen Holzpfähle werden am oberen Ende mit einer ÖUB - einheitlichen Signierfarbe (gelb) markiert und / oder mit Edding-Markern beschriftet. Der Erhaltungszustand sowie die Vollständigkeit der Holzpflock-Markierungen (z. B. Entfernung der Pfähle durch Schwarzwild oder Menschen) sollte regelmäßig in mehrjährigem Abstand (vorzugsweise bei Folgeuntersuchungen) kontrolliert und diese ggf. ersetzt bzw. ergänzt werden. 2.4 Fotodokumentation Ohne den Ansprüchen einer kompletten Standardisierung gerecht zu werden, sollen für die Erfassung des Gesamteindruckes der Monitoringflächen sowie spezieller Gesichtpunkte Fotografien angefertigt werden. Darüber hinaus wird auch für die Bebilderung von Umweltberichten und die Öffentlichkeitsarbeit Bildmaterial benötigt. Die Bilder sind mit einer beliebigen Kamera, normaler Ausstattung (mit Weitwinkelobjektiv, unter Umständen für Detailaufnahmen auch mit Makro- oder Teleobjektiv) aufzunehmen. Empfohlen wird hier jedoch der zweckmäßigere und kostengünstigere Einsatz einer Digitalkamera, da hier die Bilder ohne Umwege für eine digitale Archivierung und Dokumentation bereitstehen. Die Fotos sind im jeweiligen Untersuchungsjahr (3- oder 6-jähriger Rhythmus) im Frühjahrsaspekt und im Sommeraspekt zu erstellen (siehe Tabelle 2) und sollten sowohl digital (auf CD) als auch als Papierfoto (für die Ordner) geliefert werden. Tabelle 2: Übersicht der anzustrebenden Aufnahmezeitpunkte der Fotodokumentation Terrestrische Ökosysteme Standgewässer und Sölle Frühjahrsaspekt März bis Anfang Mai März bis Anfang Mai Sommeraspekt Juli bis August Juli bis August Fließgewässer Qualmwasser April bzw. Juni zum Bei jeder Makrozoobenthos – Beprobung Untersuchungstermin Juli bis August Bei jeder Beprobung Jedes Foto ist mit Datum, Tageszeit, genauer Lagebeschreibung und Zusatzinformationen zu evtl. vorgefundenen Besonderheiten zu versehen. Zur Orientierung der Blickrichtung dienen die Himmelsrichtungen, z.B. Monitoringfläche Schäfergrund: Vegetationstransekt in Nord-Süd-Richtung oder Süd-Nord-Richtung. 58 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Flächeneinrichtung Vegetation Die Fotodokumentation der Untersuchungsflächen erfolgt von fest definierten Aufnahmepunkten aus. Hierfür dienen die mit Magneten vermarkten Endpunkte der Vegetationstransekte. Von den mit Stangen markierten Endpunkten des Transektes aus wird jeweils ein Bild in Richtung des gegenüberliegenden Endpunktes angefertigt. Bei sehr langen bzw. nicht vollständig einsehbaren Transekten ist eine Zwei- unter Umständen auch eine Dreiteilung notwendig. Dabei sollte die „Regel vom goldenen Schnitt“ (⅓ Himmel und ⅔ Motiv) berücksichtigt werden. Außerdem sind, unter Angabe der Himmelsrichtung (aus der das Bild aufgenommen wird) jeweils beide Vegetationsaufnahmeflächen so zu fotografieren, dass alle markierten Eckpunkte zu erkennen sind. Des weiteren sollten Bilder aufgenommen werden, die einen Gesamteindruck vermitteln bzw. die Lage der Untersuchungsfläche in der Landschaft dokumentieren (z.B. von einem erhöhten Punkt aus). Zusätzlich sind relevante Sonderstrukturen sowie faunistische oder floristische Besonderheiten durch aussagekräftige Aufnahmen separat festzuhalten. Boden Bei der Anlage von Bodenschurfen sollte die Profilwand bei günstiger Beleuchtung im Foto dokumentiert werden. Dabei ist darauf zu achten, dass die einzelnen Horizonte gut zu erkennen sind. Bemerkenswerte Besonderheiten sind ebenfalls gesondert zu dokumentieren. Darüber hinaus ist die Aufnahme so anzufertigen, dass die, direkt über der Schürfgrube befindliche Vegetation gut zu erkennen ist. Daher sollte es unbedingt vermieden werden, den Bereich über der Profilwand vor und während der Erdarbeiten zu betreten. Um eine ausreichende Beleuchtung der Profilwand zu gewährleisten ist auf den Stand der Sonne zu achten, bzw. ein ausreichend leistungsstarkes Blitzgerät zu verwenden. Fauna Die Libellen-Probeflächen, die nicht bereits durch das Gewässermonitoring erfasst wurden (z.B. Begleitbiotope bei Grünlandflächen), sind analog der Vorgehensweise bei Fließgewässern aufzunehmen. Außerdem sind Belegfotos von faunistischen Besonderheiten oder besonders typischen Arten anzufertigen. Des weiteren wäre es wünschenswert, besonders bevorzugte Habitatstrukturen der verschiedenen Entwicklungsstadien zu dokumentieren. Zusätzlich sinnvoll für die Dokumentation sind einzelne charakteristische Aufnahmen der Regenwurmund Laufkäferprobestellen (z.B. Standorte der Bodenfallen) sowie je ein Foto von den Heuschrecken- und den Tagfalter-Probeflächen (bei mineralischen Grasland im BR Schorfheide-Chorin). 59 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Flächeneinrichtung 2.5 Fotomonitoring - Erstellung digitaler Panoramen (nach TROSIEN 2001) Benötigte Arbeitsmaterialien: Stativ, Dreiwegeneiger, QTVR Kopf, Analoge- oder Digitalkamera, Weitwinkeladapter für Digitalkamera, Filme bzw. leere Speicherkarte, Kompass, Maßband, Aufnahmeblatt, Stift, Absperrband, Fluchtstangen. Arbeitsschritte: 1. Abstecken der mit GPS eingemessenen Punkte als Maßstab und zur Orientierung. 2. Markieren der Vegetationsaufnahmefläche mit Absperrband. 3. Ansetzten des Objektives an die Analogkamera bzw. des Weitwinkeladapters an die Digitalkamera und Vorbereitung der Kameras. Bei der Canon EOS 3 wird die Spiegelvorauslösung aktiviert und der Fernauslöser angesetzt. Bei der Nikon Coolpix 990 wird der Weißabgleich gemäß der Aufnahmesituation (Sonnenschein, bedeckter Himmel) eingestellt. Des weiteren ist die Verwendung des Weitwinkeladapters im entsprechenden Programm einzustellen. Da die Coolpix 990 über keinen Fernauslöseanschluss verfügt, wird zur Vermeidung von Verwacklungsunschärfen der Selbstauslösermodus aktiviert. Auch die Aufnahmegröße der Bilder und die Komprimierung bei der Speicherung ist entsprechend der Bedienungsanleitung vorzunehmen. Die Bilder wurden im Aufnahmemodus 2 : 3 mit der höchsten Auflösung fotografiert und mit normaler Kompression gespeichert. 4. Am QTVR Kopf wird die Bildanzahl für das 360° Panorama eingestellt. Es werden 16 Einzelaufnahmen gemacht. 5. Aufbau der Kamera auf den QTVR Kopf und Ausrichten des Nodal Point. Bei Verwendung der Canon EOS 3 mit angesetztem Batterieteil BP-E1 und dem Objektiv Sigma 2,8/24 mm beträgt die untere Einstellung am QTVR Kopf 76 mm und die obere Einstellung 36 mm. Bei Verwendung der Digitalkamera Nikon Coolpix 990 beträgt die untere Einstellung ebenfalls 76mm und die obere 25mm. Bei Verwendung eines anderen QTVR Kopfes muss die Kamera entsprechend eingerichtet werden. Diese Einstellungen müssen nur für die ersten Aufnahmen vorgenommen werden und bleiben dann eingestellt. 6. Ausrichten des Stativs über dem eingemessenen Aufnahmepunkt. 7. Kontrolle der Aufnahmehöhe mit Maßband. Bei Verwendung eines Stativs Manfrotto 055, einem Dreiwegeneiger 410 sowie dem QTVR Kopf von Kaidan, wird die korrekte Aufnahmehöhe von ca. 135 bis 137 cm bei Auszug der untersten Beinsegmente des Stativs erreicht. 8. Einnorden des Aufnahmesystems mit Hilfe eines Kompasses. Zum Einnorden wird der Kompass über der Kamera gehalten, allerdings soweit entfernt, dass er nicht durch die Metallteile des Aufnahmesystems beeinflusst wird. Die Ausrichtung erfolgt mit der Panoramaeinstellung des Dreiwegeneigers. 9. Nivellieren des QTVR Kopfes mit Hilfe des Dreiwegeneigers. 10. Belichtungsmessung des ersten Bildes. Bei der EOS 3 wird im Zeitautomatikprogramm (Av) die Blende 16 eingestellt und die Belichtungszeit gemessen. Bei der Digitalkamera wird ebenfalls im Zeitautomatikprogramm die Blende (...) eingestellt und die Belichtungszeit gemessen. 60 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Flächeneinrichtung 11. Die ermittelten Werte werden in das manuelle Programm übernommen. Anschließend werden die 16 Einzelbilder belichtet. Dazu wird nach jeder Aufnahme der QTVR Kopf um eine Rasterung weiter gedreht. 12. Die Aufnahmedaten werden in ein Datenblatt (vgl. TROSIEN 2001) eingetragen und die Aufnahmetechnik abgebaut. Weiterverarbeitung am PC Benötigte Arbeitsmittel: Apple Power PC, Diascanner, CD-Brenner, Bildbearbeitungsprogramm (vorzugsweise Adobe Photoshop), QTVR Authoring Studio Software. • Dias rahmen und mit Diascanner digitalisieren. Bei Einhaltung der beschriebenen Belichtungssteuerung ist keine Nachbearbeitung der Bilder notwendig. Es müssen allerdings dieselben Scannereinstellungen für alle Bilder beibehalten werden. Die Bilder werden mit ca. 1370 dpi (in Abhängigkeit vom verwendeten Scanner) gescannt. Im Bildbearbeitungsprogramm wird der schwarze Rand beschnitten. Die Bilder werden mit der Codierung der Untersuchungsfläche und der Bildnummer (z.B. SW_G5_01) in einem Ordner mit dem Code der Untersuchungsfläche, dem Namen der Fläche und dem Datum der Aufnahme (z.B. SW_G5_Schappigk_17_10_00) gespeichert. Die Dias werden mit dem Datum der Aufnahme, dem Code der Untersuchungsfläche und der Bildnummer beschriftet und in Klarsichthüllen abgelegt. • Die Daten der Digitalkamera werden auf den Computer übertragen und die Bilder, wie vorher beschrieben, bezeichnet und gespeichert. • Die Bilder werden zusammen mit den Datenblättern auf einer CD gesichert. • Da die Hardware zur Zeit derart große Bilddateien nicht verarbeiten kann, müssen die Bilder vor der Weiterverarbeitung auf einem Apple Macintosh bei den analog erstellten Bildern auf 50 % und bei den digitalen Bildern auf 60 % der Ausgangsgröße verkleinert werden. Dies kann jedoch im Zuge des technischen Fortschrittes überflüssig werden, was der Auflösung der fertigen Panoramen zu Gute komme würde. • Die Einzelbilder werden nun mit der QTVR Authoring Studio Software zu Panoramen zusammengeheftet. Die fertigen Panoramen werden ebenso wie die Ordner der Einzelbilder bezeichnet und auf einer CD gesichert. Zeitaufwand Vor Ort beträgt der Zeitaufwand für das Fotografieren eines Panoramas sowohl mit der Analogkamera als auch mit der Digitalkamera ca. 15 min. Dazu kommt noch der Zeitbedarf für das Aufsuchen der Fotopunkte und das Markieren der Vegetationsaufnahmeflächen mit Absperrband. Für das Digitalisieren und Nachbearbeiten der analogen Bilder muss für einen versierten Anwender mit ca. 60 min je Panorama gerechnet werden. Das endgültige Zusammenfügen der Einzelbilder zu einem Panorama und die Erstellung des QTVR-Movies benötigte ca. 30 min. Allerdings ist der Zeitaufwand für das Digitalisieren, Nachbearbeiten und Zusammenfügen sehr stark von der verwendeten Hardware abhängig. Da die Computer immer leistungsfähiger werden, ist hier zukünftig mit einem geringeren Zeitbedarf zu rechnen. Zusätzliche Zeit für das Einmessen der Markierungen sollte nicht entstehen, da diese bereits für andere Arbeiten vermessen werden müssen und somit genutzt werden können. 61 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Flächeneinrichtung 2.6 Aufnahme des oberirdischen Einzugsgebietes von naturnahen Mooren Zur Einschätzung des verfügbaren Wasserangebotes bzw. von Störungen oder Veränderungen desselben sollte für die untersuchten Moore (mit weitgehend geschlossenen Einzugsgebieten) auch die Betrachtung des oberirdischen Einzugsgebietes mit herangezogen werden. Die Aufnahme des Einzugsgebietes erfolgt einmalig zur Ersteinrichtung durch Analyse einer Topographischen Karte (1:10.000) mit Fehlerkorrekturen durch eine Geländebegehung. Für die ausgegrenzten Einzugsgebiete wird 6-jährlich eine Biotopkartierung nach Brandenburger Biotopkartierungsschlüssel (LUA 2004) in der Kartierintensität C vorgenommen und eine digitale Biotopkarte in Arc-GIS erstellt. 62 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3 Boden Detaillierte Methodenbeschreibungen mit Begründungen zur Parameterund Methodenwahl 3.1 Boden 3.1.1 Allgemeines Vorgehen Bei der Einrichtung einer Monitoringfläche wird der aktuelle Zustand des Bodens durch eine Standortaufnahme (z. B. Leitprofil- und Bohrstockansprachen) und durch eine Grundinventur der chemischen, physikalischen und biologischen Eigenschaften des Bodens festgestellt. Durch Wiederholungsuntersuchungen im Laufe des Monitoringzeitraumes lassen sich ggf. Veränderungen des ehemals festgestellten Bodenzustandes nachweisen (vgl. LABO 1999). Zusätzlich soll bei grundwassernahen Standorten der Grundwasserstand beobachtet werden. Die nachfolgend zusammengestellten Parameter und Erhebungsmethoden, orientieren sich weitgehend an den bereits laufenden Dauerbeobachtungsprogrammen (SAG (1991) „Konzeption zur Einrichtung von Boden-Dauerbeobachtungsflächen“, aktualisiert von LABO (1999)) und den Vorgaben der bodenkundlichen Kartieranleitung KA4 (AG BODEN 1994). Ab dem Aufnahmejahr 2006 erfolgen die Aufnahmen nach der bodenkundlichen Kartieranleitung KA5 (AG BODEN 2005). Für die analytische Bestimmung werden i.d.R. Verfahren vorgeschlagen, die genormt sind (DIN, DIN ISO, EN, etc.). Jedoch liegen nicht für jeden gewählten Parameter durchgängig genormte Verfahren vor. Hier wird zum Teil auf TGL-Vorschriften, aber auch auf gängige, in der Literatur beschriebene und von einigen Labors bereits erfolgreich eingesetzte Verfahren zurückgegriffen. 63 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden 3.1.2 Alphabetische Parameterübersicht mit Begründung der Auswahl Chemische Parameter Basensättigung - BS [%] Die Basensättigung ist ein Maß für die sogenannte Basizität eines Bodens. Sie gibt den %-Anteil der basischen Kationen (v.a. Ca 2+, Mg 2+, Na 2+, K+) an der potentiellen KAK (s.u.) an (SCHLICHTING 1995). CaCO3 - Gehalt [%] Der Kalkgehalt im Boden ist eine wichtige bodenchemische Größe. Er ist ausschlaggebend für die Säurepufferung und Hintergrund für das C/N - Verhältnis. Aber auch für die Stabilität des Bodengefüges ist der Kalkgehalt von Bedeutung. Kalkfreie bzw. entkalkte Böden geraten schnell in weniger leistungsfähige Pufferbereiche (Austauscher-Pufferbereich, Aluminium-Pufferbereich) und neigen zur Verschlämmung (VAHRSON et al. 1997). Corg [%] und Cges Als organischer Kohlenstoff wird der Kohlenstoffgehalt bezeichnet, der sich durch Abzug des karbonatgebundenen Kohlenstoffes vom Gesamtkohlenstoffgehalt einer Probe errechnen lässt (Corg = Cges - CCaCO3). Er wird zur Berechnung des Humusgehaltes sowie des C/N-Verhältnisses herangezogen. Humusgehalt [%] Der Humusgehalt ist ein Maß für die Intensität des Bodenlebens und Indikator für Temperatur, Wassergehalt, pH-Wert und Streuangebot des Standortes. Diese Parameter sind für eine rasche Zersetzung organischer Substanz notwendig. Elektrische Leitfähigkeit der Bodenlösung [µS /cm bzw. mS /cm] Die wasserlöslichen Salze sind meist nur im trockenem Boden existent, während sie im frischen bis feuchten Boden teilweise und im nassen Boden vollständig gelöst sein können. Der Salzgehalt wird über die elektrische Leitfähigkeit ermittelt, da der elektrische Strom durch Wasser um so besser geleitet wird, je höher die Ionenkonzentration im Wasser ist (SCHLICHTING 1995). Glührückstand und Glühverlust [%] Der Glührückstand, d.h. die verbleibende Asche (mineralischer Anteil) nach dem Verglühen der Probe bei 550 °C wird zur Berechnung des Substanzvolumens bzw. der relativen Lagerungsdichte (s.u.) bei Moorböden benötigt. Anhand des Glühverlustes wird der Anteil der org. Substanz einer Bodenprobe näherungsweise bestimmt. Für (Nieder)Moorböden ist die bei Mineralböden angewendete Umrechnung des Corg -Gehaltes auf den Humusanteil (s.u.) (% Humus x 1,724) mit Unsicherheiten behaftet, da der angenommene Kohlenstoffgehalt der org. Substanz von 58% für Torf nicht zutreffend ist. In Abhängigkeit vom Zersetzungsgrad der Torfe variieren die einzusetzenden Umrechnungsfaktoren zwischen 1,79 und 2,18. Für anthropogen veränderte Torfe sind sie kaum definierbar. Daher wird für (Nieder)-Moorböden der Glühverlust als Näherung des Humusgehaltes verstanden (LUTHARDT 1993). KAK pot, KAK eff [mval/100g Boden] Die potentielle Kationenaustauschkapazität ist ein Maß für die Belegungsfähigkeit der Austauscher, d.h. für die potentielle Filter- und Pufferkapazität des Bodens. Mit Hilfe der KAKpot können • Versauerungsneigung und Aushagerungspotenzial prognostiziert, • der Vorrat verfügbarer Mineralstoffe und die Auswaschungsgefährdung abgeschätzt sowie • der aktuelle pH-Wert eingeordnet werden. In den meisten Fällen ist auch in entkalkten Geschiebelehmen mit subneutralen bis schwach sauren pH-Werten keine nennenswerte Differenz der effektiven Kationenaustauschkapazität gegenüber der KAKpot zu erwarten. Versauerung spielt unter grünlandgenutzten Böden aufgrund regelmäßiger Kalkung eine untergeordnete Rolle. Lediglich Sand-Standorte mit einer ohnehin geringen KAKpot und nicht genutzte Standorte sind versauerungsanfällig. In kalkhaltigen Böden sind die Austauscher vollständig mit Metallkationen (hauptsächlich K+, Ca2+, Mg2+, auf gedüngten Böden auch NH4+) belegt, in kalkfreien Böden sind je nach pH-Wert Teile der Austauscher mit H3O+-Ionen belegt. Diese Protonen werden bei der Perkolation mit ungepufferter Lösung (Bestimmung von KAKeff) nicht gegen das Perkolationsion ausgetauscht. Die KAKeff ist daher bei kalkfreien Böden immer geringer als die KAKpot. Unterhalb von ca. pH 7, d.h. bei Kalkfreiheit läuft die Säurepufferung v.a. am Austauscher ab, erst bei pH-Werten unter pH = 4,2 beginnt der Aluminiumpufferbereich (VAHRSON et al. 1997). 64 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden (Nähr-)Stoffversorgung / (Nähr-)Stoffstatus (N, Ca, Al, Fe, S, Mn, Mg, Na, P, K)ges [% bzw. μg/g] und pflanzenverfügbare Nährstoffe (Plak, Klak, MgCaCl2) [mg / 100g Boden] C/N-Verhältnis Der Nährstoffstatus wird zur Einschätzung der Veränderungen der Trophie des Standortes, der Pflanzenversorgung und des Auftretens von Nährstoffdisharmonien herangezogen. Die Gesamt-(Nähr-)Stoffgehalte sind ein Maß für den potentiellen Nährstoff-Vorrat im Boden. Stickstoff und Kohlenstoff sind dabei von besonderer Bedeutung. Das von ihnen gebildete C/N-Verhältnis ist (besonders bei Grünland und Waldstandorten) ein Maß für Mineralisierungsvorgänge und wesentlicher Ausdruck der Trophie eines Standortes. Ein enges C/N-Verhältnis erhöht die Verfügbarkeit der Nährstoffe aus dem akkumulierten Humus (s.u.), insbesondere die Aktivität von Ammonifikanten und Nitrifikanten. Atmosphärischer N-Eintrag verengt das C/N-Verhältnis künstlich und erhöht somit zusätzlich den Gehalt mineralischen Stickstoffs im Boden (⇒ Eutrophierung, Auswaschung). Kurzfristig werden sich keine deutlichen Veränderungen des C/N-Verhältnisses zeigen, aber für Langzeitbeobachtungen ist die Erfassung des C/N-Verhältnisses “unabdingbar” (HARTER & LUTHARDT 1998). Phosphor und Kalium nehmen eine Schlüsselrolle in der Dauerbeobachtung der Nährstoffverhältnisse im Boden ein. Sie gelten als Indikatoren für Aushagerungseffekte, die aus Naturschutzsicht auf Grünlandstandorten angestrebt werden. Die DL-lösliche Fraktion (Plak und Klak) gilt in terrestrischen Böden als pflanzenverfügbar. Der aktuelle Nährstoff-Status ist daher gut an diesem Parameter ablesbar. Der Gesamtschwefelgehalt ist in terrestrischen Böden i.d.R. sehr gering (0,02-0,2%). Die nasse Deposition von H2SO4 und H2SO3 der letzten beiden Jahrhunderte hat in gut gepufferten Böden (je nach KAK, s.o.) zu einer Schwefel-Akkumulation geführt, die bei gleichzeitiger Immission basischer Stäube nicht zu einer Auswaschung basischer Kationen geführt hat. Nachdem die Staubemission weitgehend eingestellt wurde, können nun die weiterhin hohen Säureeinträge schnell zu einer Freisetzung des adsorbierten Schwefels und damit zu massiver Versauerung, Mineralstoffauswaschung und verminderter Bindungskapazität für die ebenfalls nach wie vor hohen Stickstoff-Einträge führen. Die naturschutzfachlich als positiv zu bewertenden Effekte auf die Aushagerungsgeschwindigkeit eutrophierter Standorte treten gegenüber den überregional bedeutsamen negativen Auswirkungen auf die Gewässer (Versauerung, Nährstoffüberlastung) zurück (VAHRSON et al. 1997). NO3 [mg / 100 g Boden] Umsetzungsprozesse von Nitrat-N und Ammonium-N laufen i.d.R. ziemlich schnell ab. Aus diesem Grund bedürfte eine realistische Einschätzung der Nitrat-Ammonium-Verhältnisse einer häufigeren Datenerfassung, als dies im Rahmen der ÖUB leistbar erscheint. Da der Nitratgehalt unterhalb des durchwurzelten Bodenhorizontes Rückschlüsse auf das Risiko des Nitrataustrages ins GW zulässt, und Stoffumsätze in dieser Bodentiefe nicht mehr in so hoher Geschwindigkeit ablaufen, erscheint hier eine Nitraterfassung sinnvoll. pH-Wert Der beste messbare Parameter zur Bestimmung der Säure-Basen-Verhältnisse ist der pH-Wert im Oberboden. Vergleichswerte liegen vor. Der pH-Wert ist eine Größe, von der nicht nur fast alle Parameter und Prozesse im Boden abhängig sind, sondern die auch direkt auf die Biozönose wirkt (Bodenorganismen, höhere Pflanzen). Schwermetalle (Cd, Cr, Cu, Ni, Pb, Zn)ges [% bzw. μg/g] Spezifische Schwermetallgehalte geben Auskunft über das aktuelle Säure - Basen -Verhältnis im Boden. Durch die wiederkehrenden Beprobungen sollen ggf. belastende Einträge, bzw. Veränderungen von einst festgestellten Schwermetallgehalten beobachtet werden. Schwermetalle (As, Hg, Ti) und PCB in Auenbereichen des BR Flusslandschaft Elbe Als generelle Spezifität der Ökosystemtypen des Ackers und Graslandes im BR Elbe ist der historische bzw. noch aktuelle Einfluss der Überflutungsdynamik der Elbe und zum Teil der zufließenden Flüsse. Aktuelle Forschungsarbeiten u.a. des LUA Brandenburg zeigen, dass gerade im Bereich der Auenflächen des BR Elbe erhöhte Belastungen an Schwermetallen, vor allem Arsen, Kupfer, Cadmium, Quecksilber, Blei und der PAK-Gehalte (Polyaromatische Kohlenwasserstoffe) gefunden wurden [SCHMIDT et al. (1998), SCHWARTZ et al. (1999), DINKELBERG et al. (2000)]. Nach Vorschriften des BundesBodenschutzgesetzes (1998) und der Bundes-Bodenschutz- und Altlastenverordnung (1999) ist bei landwirtschaftlich genutzten Flächen im Verdachtsfall der Wirkungspfad Boden–Nutzpflanze zu analysieren. Dafür wurden Prüf- und Maßnahmewerte für die Nutzung definiert, die konkret für folgende chemische Elemente bzw. Verbindungen festgelegt wurden: Ackerbau: Arsen, Cadmium, Blei, Quecksilber, Thallium, Benzo(a)pyren Grünland: Arsen, Blei, Cadmium, Kupfer, Nickel, Quecksilber, Thallium, Polychlorierte Biphenyle (PCB6). 65 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden Physikalische Parameter Eindringwiderstand Anhand des Eindringwiderstandes lassen sich unter Verwendung eines Penetrographen Bodenverdichtungen anzeigen. Die Methode erfolgt nach TGL 31222/10 und 31222/01. Einheitswasserzahl Die Einheitswasserzahl von Torfen dient der genauen Kennzeichnung des Grades der anthropogen bedingten, sekundären Torfumwandlungsprozesse, unabhängig von der Lagerungsdichte und der Objektivierung der Feldansprache. Erosionsspuren (Wassererosion – lateraler Stofftransport) Obwohl in den letzten Jahrzehnten z.T. große Anstrengungen zur Reduzierung des Bodenabtrags durch Wasser und Wind unternommen wurden, kommt der Bodenerosion auch heute noch ein Stellenwert zu, der ihre Berücksichtigung im Rahmen von Langzeitbeobachtungen an ausgewählten Monitoringflächen erforderlich macht (LABO 1999). Bodenerosion führt im Abtragungsbereich durch Verarmung an Humus und Pflanzennährstoffen und durch Verminderung des Wasserspeicher- und Filtervermögens zu einer Beeinträchtigung bis dauerhaften Zerstörung der Bodenfruchtbarkeit mit Verringerung der Erträge und Ertragssicherheit. Im Akkumulationsbereich treten Probleme durch eine Anreicherung von Nährstoffen und Pflanzenschutzmitteln, durch Verschmutzungen von Wegen und möglicher Einträge in Gewässer auf. pF-WG - Kurve [cmWS bzw. hPa - Vol%] “Die Bilanzierung der wassergebundenen Stoffflüsse erfolgt i.d.R. unter Einsatz von Wasser- und Stofftransportmodellen ... Hierzu ist die Messung des volumetrischen Wassergehaltes und der Saugspannung im Boden in hoher zeitlicher Auflösung erforderlich” (LABO 1999, S. 6-14). Die ermittelte Kurve aus Wassergehalt und Wasserspannungspotential eines Bodens dient zur weiteren Charakterisierung des Wasserhaushaltes (neben Kf-Wert, Dichte, Infiltrationskapazität, org. Substanz und Gefüge). Mit der pF-WG-Kurve ist die Ermittlung der Feldkapazität und des Permanenten Welkepunktes möglich. Substanzvolumen bzw. relative Lagerungsdichte bei Moorböden [%] Der Anteil der Festsubstanz (mineralischer Anteil) am Gesamtvolumen des Torfs gilt als Maß für die Strukturierung und Durchlüftung des Bodens als wesentlicher Faktor für das Bodenleben. Durch z.B. einen Anstieg des Substanzvolumens lässt sich eine Setzung und Verdichtung des Moorkörpers ableiten (SAUERBREI & SCHMIDT 1995). Textur (Korngrößenzusammensetzung) Die Korngrößenzusammensetzung ist einer der wichtigsten konstanten Standortparameter (Stamm-Standorteigenschaft). Sie ist Grundlage für die Interpretation chemischer und physikalischer Parameter. Mit der Bodenart sind z.B. KAKpot (Nährstoffhaushalt) und Kf-Wert (Wasserhaushalt) hoch korreliert, andere Parameter sind ebenfalls von der Bodenart abhängig (u.a. pH-Wert, Dichte). Die Textur ist somit ein langfristiger Kennwert für die Filtereigenschaften sowie die Standort-, Puffer-, und Habitatfunktion des Bodens (VAHRSON et al. 1997). Trockenrohdichte [g/cm³] Veränderungen der Trockenrohdichte des Ober- und Unterbodens deuten auf Verdichtung oder aber bei Extensivierung von Beweidung oder reduzierter Befahrung auf eine Auflockerung durch Bodenwühler hin. Gerade der letztgenannte Prozess ist aus zwei Gründen zu beobachten: Zum einen ist bis heute unklar, ob oder in welchem Umfang und in Abhängigkeit von welchen Parametern v.a. Unterbodenverdichtung reversibel ist. Zum anderen spielt v.a. die Oberbodendichte für die Aktivität des Bodenlebens sowie für den standörtlichen Wasserhaushalt eine Schlüsselrolle (VAHRSON et al. 1997). Wasserleitfähigkeit (gesättigt), Kf-Wert [ cm/s] Der Kf-Wert ist die entscheidende kapazitative Größe des Standortwasserhaushalts. Er ist v.a. abhängig von der Korngröße und von der Dichte des entsprechenden Bodenhorizontes. Verdichtung des Bodens durch Befahrung / Beweidung verringert den Kf-Wert und kann zu Staunässe, aber auch zur schlechteren Nachlieferung von Grundwasser führen, also insgesamt zu wechselfeuchteren Bedingungen. Eine Änderung des Kf-Wertes lässt auch Rückschlüsse auf veränderte Porenanteile zu. 66 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden Mikrobiologische Parameter Bodenmikroorganismen reagieren einerseits sehr schnell auf Veränderungen der ökologischen Bedingungen, sie sind andererseits als Generalisten und als Spezialisten an integrativen Leistungen des Ökosystems wie Remineralisierung toter organischer Substanz und Humusbildung maßgeblich beteiligt. Ziel der mikrobiologischen Bodenanalyse ist die Feststellung der im Boden ablaufenden Umsatzleistungen als eine der Komponenten der Bodenfruchtbarkeit und Selbstreinigungskraft der Böden sowie als Ausdruck der Funktion des Bodens als Lebensgrundlage und Lebensraum für Bodenorganismen. Hier ist die Untersuchung von FunktionsSummenparametern vorzunehmen (LABO 1999). Bodenatmung / Basalatmung [μg CO2-C / h / g TS-Boden] Die Bodenatmung ist einer der ältesten und immer noch am häufigsten gemessenen Parameter zur Bestimmung metabolischer Aktivitäten der Bodenmikroorganismen. Sie reagiert unterschiedlich auf Bodenverarbeitungs- u. Kultivierungsmethoden und wurde am häufigsten zur Beurteilung ökotoxikologischer Wirkung von Umweltchemikalien und Pflanzenschutzmitteln eingesetzt. Die Bodenatmung gibt Auskunft über die Leistungsfähigkeit vorhandener Populationen im Boden (ALEF 1991). Cmik (Mikrobielle Biomasse, mikrobielle Aktivität) [μg Cmik / g Boden oder mg Cmik / kg Boden] Die über substratinduzierte Respiration bestimmte mikrobielle Biomasse ist ein bundesweit einheitlicher und obligatorischer Parameter der biotischen Bodenuntersuchungen auf Bodendauerbeobachtungsflächen. Mit der mikrobiellen Biomasse wird eine biologische Komponente der Bodenfruchtbarkeit erfasst. Sie ist der Anteil organischer Substanz im Boden, der aus lebenden Mikroorganismen besteht (GRIMM & WIRTH 1995). Die ‘Mikrobielle Aktivität’ im Boden umfasst alle biochemischen Stoffumsetzungen, die durch Mikroorganismen katalysiert werden. Um diese Aktivität zu erfassen, wird die Bestimmung der Bodenatmung (C02-Bildung) herangezogen (s.o.). Metabolischer Quotient [μg CO2-C / h / g TS-Boden zu in μg Cmik / g TS-Boden] ”Der metabolische Quotient als Verhältnis der Bodenatmung zur mikrobiellen Biomasse gibt einen Hinweis auf den Energiebedarf der Bodenmikroorganismen zum Bodenentnahmetermin. Ein hoher metabolischer Quotient deutet auf einen hohen Erhaltungsbedarf dieser Biomasse hin, was zu einem höheren Umsatz an Kohlenstoff führen und in einem schnelleren Abbau und Verbrauch an organischer Substanz und damit Nährstofffreisetzung im Boden resultieren kann.” (GRIMM & BORK 1996). Sonstige Parameter Bodenhorizontierung / Leitprofil [cm] Die Ansprache des Bodentyps dient der Standortkennzeichnung, der Analyse der vertikalen Stoffverteilung zur Interpretation des Bodenentwicklungsgrades sowie zur Abschätzung (Quantifizierung) des lateralen Transportes (Erosion) durch Horizontverkürzung bzw. -auftrag. Ablaufende Bodenentwicklungen (Kalkauswaschung, Tonverlagerung etc.) können abgeleitet werden Bodenhorizontierung bei Moorböden [in cm, bzw. dm] Die Bodenhorizontierung dient zur Einschätzung der Bodenentwicklung und der Tiefe der sekundären Beeinflussung. Eine veränderte Bodenhorizontierung zeigt Änderungen des Wasserregimes, und damit veränderte Bodenentwicklung und Stoffflüsse. Relief Dieser Parameter dient bei reliefierten Monitoringflächen zur Einschätzung ihrer Einbettung in die Landschaft. Zudem dient das Mikrorelief als Indikator für Erosionserscheinungen. Bild-Dokument Die Visualisierung von Flächen- und Zustandsbeschreibungen ist eine wertvolle Ergänzung zum Verständnis der Gesamtsituation und gibt vor allem strukturelle Gegebenheiten wieder bzw. Farbeindrücke. 67 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden 3.1.3 Durchführung von Profilansprachen, Bodenbohrungen und Bodenbeprobungen 3.1.3.1 Anlage und Ansprache der Profilgruben auf mineralischen Standorten Im Rahmen der Grundinventur werden bei der Einrichtung einer Monitoringfläche eine (mineralisches Grasland, ebene Äcker) oder mehrere Schürfgruben (hängige Äcker) aufgegraben. Dadurch wird eine vollständige bodenkundliche Ansprache des Bodens sowie die Entnahme von gestörten und ungestörten Bodenproben über das gesamte Profil ermöglicht (LABO, 1999). Die Schürfgruben sollen in erster Linie der Standortcharakterisierung dienen und werden deshalb als Leitprofile betrachtet. Die Profilgruben werden innerhalb der Monitoringfläche nach vorgegebenem Flächendesign des jeweiligen Ökosystemtyps an (einer) möglichst repräsentativen Stelle(n) angelegt, angesprochen und beprobt. (siehe ANHANG). Darüber hinaus sind sowohl die Geländesituation, die vorhergehenden Bohrstockeinschläge sowie die fachliche Praxis der KA 5 (AG BODEN 2005) bei der Einrichtung der Schürfgruben zu berücksichtigen. Frühestens nach einem Zeitraum von 12 Jahren (also im 13. Jahr nach Erstbeprobung) wird das Profil erneut aufgegraben. Dabei wird die angesprochene Profilwand um etwa 20 cm weiter in den ungestörten Boden hinein abgestochen. Die Lage der jeweils angesprochenen Profilwand ist dem der Monitoringfläche zugehörigen Flächendesign zu entnehmen. Bei Catenen wird der Schurf so angelegt, dass die Profilwand in Richtung Hangfuß zeigt, um das Aufgraben zu erleichtern. Die Breite und Länge der Schurfe muss der zu erreichenden Tiefe angepasst werden. Die Breite der Stirnwand sollte aber mind. 0,8 m betragen. Der Aushub wird nach den verschiedenen Horizonten getrennt, auf einer 2x3 m Abbildung 1: Anlage einer Schürfgrube großen Plane, neben dem Profil gelagert, damit er nach Abschluss der Profilansprache wieder horizontgerecht eingebracht werden kann. Die Grasnarbe wird bei Mooren und mineralischem Grasland zuvor ca. spatentief abgestochen und die einzelnen Soden getrennt vom restlichen Aushub gelagert, um sie nach der Verfüllung, zur Minimierung von Offenstellen, wieder aufzutragen. 68 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden Entlang der Einstieg-Stufen sollte eine Ausstiegshilfe für Kleintiere eingebracht werden (Brett, dicker Ast, Bodenmaterial etc.). Die über der Stirnwand liegende Fläche sollte während des Aufgrabens, zwecks Fotobeleg, nicht betreten werden. Die Dokumentation der Profilansprache erfolgt über die Aufnahmebögen der KA 4 (AG BODEN 1994) - ab dem Jahr 2005 mit den Vorgaben der KA 5 (AG BODEN 2005) sowie durch bildliche Dokumentation (Schurf-Foto und ggf. Zeichnung). Der Zeitraum zwischen Schurfanlage und der Profilansprache, einschließlich der Probenahme sollte möglichst kurz sein. Die Ansprache und Beprobung sofort nach der Aufgrabung wird angestrebt, um Details, die beim Aufgrabungsvorgang festgestellt werden, mit in die Bodenansprache einfließen zu lassen. Bis zum Abschluss der Bodenansprache und Beprobung werden die Profilgruben mit 4 Holzpflöcken und rot-weißem Markierungsband gesichert. Ein Hinweisschild mit hinterlassener Telefonnummer für Rückfragen sollte an einem der Holzpflöcke angebracht werden. Beim Verfüllen des Profils sollten bei etwa 40-50 cm unter GOF einige Stücke Flatterband (etwa in Form eines Kreuzes) eingebracht werden, um das spätere Wiederauffinden zu erleichtern. Das Aufgraben eines Bodenprofils dauert durchschnittlich 1h, je nach Bewuchs und Bodenart. 3.1.3.2 Bohrstock - Bohrungen Zur Berücksichtigung der räumlichen Variabilität des Bodens werden die punktuell, in den Leitprofilen, gewonnenen Ergebnisse durch Pürckhauer-Bohrungen ergänzt. Bohrstock-Bohrungen bei hängigen Äckern: (siehe ANHANG) Der Catena folgend wird jeweils im Abstand von 10 m, 20 m und 30 m, auf der gleichen Höhe wie der Mittelpunkt der Leitprofil-Stirnwand, eine Bohrung bis in ca. 1 m Tiefe mit dem Pürckhauer-Bohrstock niedergebracht. Bohrstock-Bohrungen bei Äckern in ebener Lage: (siehe ANHANG) Um die Profilgrube herum werden vier Bohrungen in einem Abstand von 15 m, ausgehend vom Mittelpunkt des Bodenmessfeldes, in vier Richtungen (je 90°) bis in ca. 1 m Tiefe mit dem PürckhauerBohrstock niedergebracht. Bohrstock-Bohrungen bei Mineralischem Grasland: (siehe ANHANG) Um die Profilgrube herum werden vier Bohrungen in einem Abstand von 10 m, ausgehend vom Mittelpunkt des Bodenmessfeldes, in vier Richtungen (je 90°) bis in ca. 1 m Tiefe mit dem PürckhauerBohrstock niedergebracht. Für den Fall, dass der Bohrpunkt auf einen Feldweg etc. fallen würde, kann die Achse verlängert bzw. verkürzt werden. Ansprache der Bohrgutabfolge: Die Ansprache erfolgt, in gekürzter Weise, ebenfalls nach den Vorgaben der KA 5 (AG BODEN 2005). Das für die ÖUB verwendete Aufnahmeformblatt ist dem ANHANG zu entnehmen. 69 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.1.3.3 Boden Bodenansprache bei Moorstandorten Bei Moorstandorten wird aus Rücksicht auf das sensible Ökosystem und das, v.a. bei naturnahen Kesselmooren, hoch anstehende Grundwasser lediglich ein Flachschurf (bis ca. 50 cm Tiefe) gegraben, angesprochen und beprobt. Mit der Moorklappsonde wird dann tiefer, bis zum anstehenden Ausgangssubstrat, gebohrt und die Schichtenfolge (Stratigrafie) unter Angabe des Zersetzungsgrades (bei naturnahen Mooren) nach TGL 24300/04 (TGL 1985a) angesprochen. Zusätzlich zur Geländeansprache nach TGL werden die Daten später im Büro nach KA 4 / KA 5 (AG BODEN 1994 / 2005) aufbereitet. Das für die Moorbodenansprache verwendete Aufnahmeformblatt ist dem ANHANG zu entnehmen. 3.1.3.4 Entnahme der Bodenproben Probenahmen haben stets standortrepräsentativ zu erfolgen und sowohl die räumliche (horizontale und vertikale) als auch die zeitliche Variabilität einzelner Bodeneigenschaften zu berücksichtigen. Bei der Beprobung ist zu beachten, dass jede Probenahme eine Beeinträchtigung des Untersuchungsobjektes Boden darstellt, was zu einer zeitlichen Begrenzung der Untersuchungsreihen bzw. zu einer NichtWiederholbarkeit von Untersuchungen führen kann. Einmal beprobte Stellen können aus diesem Grund in der Regel nicht, bzw. nur nach langen Zeiträumen, wiederbeprobt werden. “Unter diesem Aspekt stellt jede Probenahme einen ”Flächenverbrauch” im Sinne eines Verbrauches von nicht gestörten und noch beprobbaren Teilarealen der BDF dar.” (LABO 1999). Die Bodenkunde unterscheidet punktuelle, flächenbezogene, horizontbezogene und tiefenbezogene Probenahmeverfahren. Bei der ÖUB soll neben der Beprobung der Leitprofile (punktuell-horizontbezogen) eine flächenbezogene Oberbodenbeprobung (horizontbezogen mit z.T. konkreten Tiefenvorgaben) der Monitoringflächen durchgeführt werden. Um dies über viele Jahre hinweg zu ermöglichen, muss die Probenahme so flächensparend wie möglich durchgeführt werden. Das heißt: zur Wiederholung der flächenbezogenen Probenahme sollen die Probenahmestellen innerhalb einer vorgegebenen Fläche verschoben werden, womit vermieden wird, dass durch vorausgegangene Probenahmen gestörte Bodenbereiche erneut beprobt werden. Aus Gründen des ökosystemaren Ansatzes (Untersuchung von bodenkundlichen, floristischen und faunistischen Parametern auf der selben Monitoringfläche) muss von dem Probenahmemuster der BodenDauerbeobachtungsprogramme abgewichen werden. Die Oberbodenbeprobung erfolgt nach definiertem Flächendesign für den jeweiligen Ökosystemtyp (siehe dazu Kapitel 2.2 sowie die StandardFlächendesigns im ANHANG) an vorher durch GPS und Magnete vermarkten Punkten. Vor Beginn des Monitorings sollte für jedes Bodenmessfeld ein Probenahmeplan mit zugehörigem Probenahmemuster vorliegen. “Die flächenbezogene Probenahme bedingt die Entnahme von Parallelproben. Die Analyse einer großen Anzahl von Parallelproben erlaubt die Berechnung von Mittelwert und Varianz für die verschiedenen, innerhalb einer BDF ermittelten Parameter, so dass statistisch abgesichert werden kann, ob die Werte einer Wiederholungsbeprobung signifikant von denen vorhergegangener Probenahmen abweichen.” (LABO 1999). Im Rahmen der ÖUB soll die Untersuchung der statistisch notwendigen Mindestmenge an Parallelproben je Monitoringfläche gewährleistet werden. Die Technik der Probenahme erfolgt nach den Vorschriften der DIN 19681 bzw. der KA 4 / KA 5 (AG BODEN 1994 / 2005). 70 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden Beprobung der Leitprofile auf mineralischen Standorten: Die Entnahme der Bodenproben aus den Leitprofilen erfolgt i.d.R. durch horizontales Versenken eines Stechzylinders (à 100 cm³) in die Stirnwand (in Ausnahmefällen auch in die Seitenwände) der Profilgrube, um eine Einheitlichkeit in der Mengenentnahme zu gewährleisten. Sofern Skelettgehalt und / oder Wurzelwerk einer genauen Festlegung der Entnahmestelle nicht entgegenstehen, sind die Proben aus der Mitte des jeweiligen Horizontes bzw. der entsprechenden Schicht auf einer horizontalen Linie unter optimaler Ausnutzung der Profilbreite zu gewinnen. Aus jedem ausgewiesenem Horizont sind mind. 3 Stechzylinder zu entnehmen. ”Die horizontweise Entnahme begründet sich darin, dass Horizonte Räume mit sehr spezifischen Reaktions- und Speichereigenschaften sind und aus diesen Gründen die Kompartimente darstellen, deren Untersuchung differenzierte Kenntnisse liefern kann.” (SCHÖNTHALER et al. 1998). Probenahmen in der Profilgrube sollten grundsätzlich von unten begonnen werden, damit untere Proben nicht durch herabfallende Probenpartikel verfälscht werden. Die Entnahme von ungestörten Bodenproben aus der Profilwand hat vor der Entnahme der gestörten Bodenproben zu erfolgen. Im Oberbodenhorizont wird der Stechzylinder vertikal, nach sorgfältiger Entfernung evtl. Humusauflagen, in den Mineralboden getrieben. Die Probenahme am Leitprofil dauert durchschnittlich 1-2 h, in Abhängigkeit von der Anzahl der zu beprobenden Horizonte. Zur Gewinnung lagerungsgetreuer Proben für physikalische Analysen, sind die Stechzylinder nicht horizontal sondern vertikal (also von oben) in den Boden einzubringen. Hierfür werden jeweils die einzelnen Horizonte abgestochen um den darunter liegenden Horizont zu beproben. Beprobung der Flachschürfe bei Moorstandorten: Die Probenahme erfolgt durch Schaufelproben (Beutel) und jeweils mind. 2 Stechzylinder (à 100 cm³) aus zwei Tiefen: 0-2 dm und 2-4 dm. Dabei ist zu beachten, dass nach Möglichkeit keine Horizontübergänge erfasst werden. Bei den naturnahen Mooren ist eine Stechzylinderentnahme i.d.R. nicht möglich. Hier kann man die Zylinder, annähernd lagerungsgetreu, mit der Hand füllen. Das ist dann aber besonders deutlich zu dokumentieren, um Fehlinterpretationen zu vermeiden! Für die Analyse der Einheitswasserzahl wird aus dem Bereich 0-2 dm zusätzlich eine Schaufelprobe gewonnen (siehe Kapitel 3.1.8.7). Für die Beprobung eines Flachschurfs wird i.d.R. eine halbe Stunde benötigt. Bei den naturnahen Kesselmooren erfolgt, aus Rücksicht auf das sensible Ökosystem, keine zusätzliche flächenbezogene Oberbodenbeprobung. Flächenbezogene Oberbodenbeprobung nach definierten Probenahmeschemen: Eine Detailansicht des Beprobungsschemas der Oberbodenbeprobung sowie der Bohrstockeinschläge innerhalb der Messfeld-Flächendesigns findet sich im ANHANG. Dabei wird die Beprobung bei der Ersteinrichtung in Richtung Norden (1. Wiederholung in Richtung Süden) in 20 cm Abstand zum Messpunkt (Magnet / Holzpfahl / GPS) in einem Raster von 20 x 40 cm vorgenommen. 71 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden Alle Einzelproben eines Bodenmessfeldes werden zu einer Mischprobe vereinigt (siehe dazu Flächendesigns im ANHANG). • auf Ackerflächen: Beprobung des Ap-Horizontes (regelmäßig gepflügter Horizont) und der Pflugsohle mit je 2 senkrecht eingetriebenen Stechzylindern à 100 cm3 Bei Äckern in ebener Lage und hängigen Äckern mit 3er-Catena muss mit ca. 4 h für die Probenahme je Monitoringfläche gerechnet werden (ohne Leitprofil). Für die Beprobung der Äcker in hängiger Lage mit 5er-Catena müssen durchschnittlich 7 h eingeplant werden (ohne Leitprofile). • auf mineralischem Grasland: Beprobung des Ah- bzw. Aa-Horizontes und evtl. vorhandener reliktischer Ap-Horizonte mit je 2 senkrecht eingetriebenen Stechzylindern à 100 cm3 (Vor dem Einstechen des Stechzylinders entfernt man die obersten 1-2 cm des Rasenfilzes mit dem Spaten). Für die Probenahme je Monitoringfläche (i.d.R. 2 Bodenmessfelder) auf mineralischem Grasland müssen (ohne Leitprofil) 2-4 h eingeplant werden. • auf Niedermooren: Die Beprobung erfolgt mittels Schaufelproben (Beutel) und jeweils mindestens einem Stechzylinder aus zwei Tiefen: 0-2 dm und 2-4 dm. Dabei ist zu beachten, dass nach Möglichkeit keine Horizontübergänge erfasst werden. Für die Analyse der Einheitswasserzahl wird zusätzlich je Probenahmepunkt der Monitoringfläche eine Schaufelprobe aus dem obersten anstehenden Horizont entnommen. Alle Einzelproben eines Bodenmessfeldes werden zu einer Mischprobe vereinigt (siehe Kapitel 3.1.8.7). Für die Beprobung einer Monitoringfläche (in der Regel 2 Bodenmessfelder) auf Niedermoor (inkl. Flachschurf) sollten durchschnittlich 3,5 h eingeplant werden. durchschnittlicher Zeitbedarf für eine einzelne Schaufel- bzw. Stechzylinderprobe: - ca. 3 min (inkl. Notizen bzw. Beutelbeschriftungen etc.) Tabelle 3: Übersicht über die aufzunehmende Anzahl der Leitprofil- und Oberbodenaufnahmen nach definiertem Flächendesign für die Offenland-Ökosystemgruppen Anzahl Leitprofil Oberbodenproben Acker (eben) 1 Acker (hängig 3er Catena) 3 Acker (hängig 5er Catena) 5 Grasland (mineralisch) 1 1 (Flachschurf) 12 9 15 9 9 72 Niedermoor ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden Folgende Hinweise und Ergänzungen sind zu beachten: 1) “Die Probenahme sollte, ebenso wie die Analytik, über eine möglichst lange Zeit vom gleichen Team bzw. der gleichen Institution vorgenommen werden. Auch wenn die jeweilige Vorgehensweise detailliert festgeschrieben ist, erhöht dies die Vergleichbarkeit der Daten” (SCHÖNTHALER et al. 1998). 2) Bei landwirtschaftlicher Nutzung sollte - zur Vermeidung systematischer Fehler bei der Probenahmedie Einstichlinie nie parallel zur Bearbeitungsrichtung liegen. Die Probenahme ist ausschließlich in der frostfreien Zeit (Frühjahr-Herbst) durchzuführen, wobei Ackerböden soweit abgetrocknet sein müssen, dass sie begehbar sind, nicht schmieren und ein vollständiges Einstechen in den Boden, auf die erforderliche Tiefe bei gleichmäßiger Füllung der Bohrstocknut, möglich ist. Der Boden darf aber auch nicht ausgetrocknet sein. 3) Pro Probepunkt bzw. Horizont sollten möglichst ca. 500 g feldfrischer Boden entnommen werden. Weist Probenmaterial ein sehr geringes spezifisches Gewicht auf (z.B. Torf), muss mehr Probematerial entnommen werden. 4) Alle offensichtlich vom Durchschnitt der Fläche abweichenden Stellen (z.B. Geil-, Hunger-, Fehlstellen, Maulwurfshügel) sind von der Probenahme auszuschließen. 5) Bei der Probenahme mittels Stechzylindern ist zu beachten, dass der Zylinder nicht verkantet, die Schnittfläche nicht verschmiert (wird) und keine zu große Pressung des Bodens erfolgt. Das volumengerecht entnommene Bodenmaterial kann vom Stechzylinder in einen Probenbeutel umgefüllt und sollte dabei ggf. auch zerbröckelt werden, um die Laborarbeit zu erleichtern. 6) Bei bestimmten Parametern (z.B. mikrobiologische Analysen, Untersuchung auf organische Spurenstoffe, Probenahme für pflanzenverfügbare Nährstoffe auf Ackerstandorten) sind besondere Vorschriften zu beachten; siehe dazu in den detaillierten Beschreibungen in Kapitel 3.1.8. 73 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden 3.1.4 Dokumentation der Probenahme Jeder entnommenen Beutelprobe sind Zettel mit folgenden Angaben einzulegen (siehe Abbildung 2). Dabei ist es günstig, die Zettel mit Bleistift zu beschriften, um ein Verlaufen der Schrift bei feuchten Proben zu vermeiden. Bei sehr feuchten Bodenproben, kann auch der Beutel mit einem Wasser bzw. –abriebfesten Stift beschriftet werden. Abbildung 2: Probenbegleitzettel für die Bodenprobeentnahme ÖUB-Projekt Fläche: Probe-Nr: Probenahme-Datum: Tiefe: Horizont: Probemenge (ggf.Volumen): Merkmale/Besonderheiten: Es ist zweckmäßig, den Transportkisten Listen der Probenaufstellung aller auf der Monitoringfläche entnommenen Proben beizufügen. Das dafür zu nutzende Formular ist dem ANHANG, Teil A zu entnehmen. Auf der Rückseite des Bogens können ggf. zusätzliche Angaben vermerkt werden: Besonderheiten bei der Probenahme wie Wildschweingrabungen o.a. Störungen besondere Wetterverhältnisse u.ä. Verweise auf zugehörige Dokumentationsblätter der Leitprofilansprache sonstige Bemerkungen Bearbeiter: 3.1.5 Transport von Bodenproben 1) Die Verpackung des Probenmaterials hat so zu erfolgen, dass eine Verwechslung der Probe oder eine Zerstörung der Verpackung ausgeschlossen ist. Auf eine dauerhafte (unabwaschbare), sorgfältige, überprüfbare und eindeutige Beschriftung und Kennzeichnung der Proben ist zu achten (Herkunft, Probennummer). 2) Je nach Zielsetzung der Analyse ergeben sich für die Probenahmegeräte und Transportgefäße sowie deren Verschlüsse unterschiedliche Materialvorgaben (siehe detaillierte Methodenbeschreibungen bzw. DIN-Vorschriften), da die Proben mit diesen Materialien in Wechselwirkung treten können. 3) Ungestörte Bodenproben in Stechzylindern sind so zu behandeln, dass sich Wassergehalt, Dichte und sonstige physikalische Parameter der Probe bis zur Weiterverarbeitung im Labor nicht verändern (Abdichtung der Zylinder mit Deckeln, verdunstungs- und erschütterungssichere Transportkoffer). Der Transport sollte möglichst schnell abgeschlossen sein. 74 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden 3.1.6 Konservierung und Lagerung der Bodenproben Es soll immer angestrebt werden, die Proben umgehend der Laboranalyse zuzuführen. Ist dies nicht möglich, kann das getrocknete Bodenmaterial über lange Zeiträume in geeigneten und korrekt beschrifteten Behältern (z.B. Papiertüten, stabilen Pappschachteln oder abgedeckten Gläsern) bis zur Analyse und darüber hinaus, kühl und trocken aufbewahrt werden. Für spezielle bodenphysikalische, bodenchemische bzw. mikrobiologische Parameter ist jedoch eine sofortige Analyse unerlässlich. Ggf. können die Proben einige Stunden dunkel, im Kühlschrank (ca. 3 - 4 °C) bzw. im Gefrierschrank (-20 °C) aufbewahrt werden. Die jeweiligen Voraussetzungen sind den entsprechenden Kapiteln der Methodenbeschreibung zu entnehmen. 3.1.7 Probenvorbehandlung Mit Probenvorbehandlung ist die Aufarbeitung der Probe bis zur eigentlichen Prüfung nach dem Standard für die jeweilige Analysemethode gemeint (nach SCHÖNTHALER et al. 1998 und AG BODEN 1997). Für Bodenproben gelten die Anweisungen der DIN ISO 11464: Probenvorbehandlung für physikalischchemische Untersuchungen. 75 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden 3.1.8 Beschreibung von Methoden, die nicht nach einer gültigen DIN vorgenommen werden sowie Hinweise und Ergänzungen zu gültigen DINVorschriften 3.1.8.1 Kartierung von Wassererosionsspuren Die Kartierung erfolgt nach den Vorgaben des DVWK (1996) sowie nach der Kartiermethodik der Merkblätter zur Bodenerosion in Brandenburg (FRIELINGHAUS 1997). Methodenprinzip: - - - Verfolgung der Verlagerungswege (Wassererosionsformen) vom Beginn des Abtrags über den Verlauf bis hin zu den Akkumulations- od. Austragsbereichen in die Feldsölle oder Nachbarbiotope. Einzeichnung der einzelnen vorhandenen Erosionsformen auf der Fläche in eine Feldkarte (M 1: 2000) mit definierter Symbolik nach DVWK (1996), ID-Nummern, Beobachtungsstandorten bzw. Blickrichtungen von Fotos. z.B.: - flächenhafte Abspülung - flächenhaft parallele lineare Abtragsformen - Rillen, Rinnen und Gräben - Akkumulation - Indikatorpflanzen - Pflanzenschäden durch Wasserüberstau oder Sedimentauftrag - Austrag aus der Fläche Erfassung der Kartierungsdaten in Feldblättern (siehe ANHANG) Dokumentation in Karten (M 1:10.000 bis 1:25.000) Datenhaltung in Schadens- bzw. Dokumentationsblättern (siehe ANHANG) Kartiert wird zum Ausgang niederschlags- und schneereicher Winter und nach Niederschlägen mit hoher Intensität oder mehr als 10-20 mm Menge, auf potentiell gefährdeten, ggf. gewässernahen Flächen mit unzureichender Bodenbedeckung. Kurzfassung der wichtigsten Kartierschritte 1. 2. 3. 4. 5. 6. 7. 8. Feldkartenerstellung (topographische Karte 1:10.000 vergrößert auf 1:5.000 bzw. in Ausnahmefällen auf 1:2.000 Am Schreibtisch Übersicht auf der Karte verschaffen Geländeübersicht durch Begehung Besehen der Sedimentationsbereiche und der Austrittswege Ablaufen der Erosionspfade hangaufwärts Nähere Bestimmung der einzelnen Pfade ggf. Markierung der Verästelungen durch Nummern (Basislinie im Akkumulationsbereich) Fotodokumentation (Erosionsformen, Gewässerrand, Eintrittspfade, Zeigerpflanzen, Pflanzenschäden) 76 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 9. 10. 11. 12. 13. Boden ggf. Bodenprobenahme im Akkumulationsbereich ggf. Bestimmung des Akkumulationsvolumens durch mehrere Einzelmessungen ggf. Beschreibung der Gewässercharakteristik (Beobachtungen zum Grad der Verschmutzung, Wasserstand, wasserführend oder nicht) Aufbereitung der Kartierergebnisse und Darstellung in Karten Ausfüllen der Dokumentationsblätter Zusätzliches Verfahren -direkte Messungen des Bodenabtrages durch Wasser: Langfristige Erfassung der Erniedrigung bzw. Erhöhung der Geländeoberfläche - durch GPS-Nivellements an definierten Punkten der Acker-Monitoringflächen im cm-Bereich - sowie durch wiederkehrende Profil- und Bohrstockansprachen (alle 12 Jahre). 3.1.8.2 Feldbestimmung der gesättigten Wasserdurchlässigkeit (Kf) Auf den Ackermonitoringflächen soll außerhalb der vom Flächendesign definierten Beprobungspunkte an 5 Punkten, jeweils in mittlerer Höhe der ermittelten Horizonte (vgl. Leitprofile / Bohrstockeinschläge), eine Kf-Wert-Bestimmung mit einem Feldpermeameter durchgeführt werden. Dazu kann beispielsweise das ‘Guelph Permeameter’ der Firma Eijkelkamp verwendet werden. „Das Guelph Permeameter ist ein ‘constant head’ Permeameter, das nach dem Mariotte-Flaschen-Prinzip funktioniert. Nach dem Bohren eines Loches wird das Guelph Permeameter angelegt. Das Wasser aus dem Permeameter läuft langsam in das Bohrloch und dringt in den Boden. Zu einem bestimmten Zeitpunkt entsteht eine gesättigte Bodenkugel, und das Wasser sinkt mit einer konstanten Geschwindigkeit (die gemessen werden kann) zurück in den Boden. Diese Messdaten, zusammen mit dem Durchmesser des Bohrlochs und der Wasserhöhe im Bohrloch, werden zur Bestimmung der (gesättigten) Wasserdurchlässigkeit des Bodens benötigt. Das komplette Set ist in einem Koffer untergebracht und enthält u.a.: das Guelph Permeameter − ein Stativ − einen Bohrer − eine Vaku-Testpumpe − einen faltbaren Kanister − und diverses Zubehör (z.B. Eijkelkamp Agrisearch Equipment - Gerätebeschreibung). − weitere Informationen siehe Gebrauchsanweisung des ‘Guelph Permeameter’ (operating instruction (8/86) Bemerkung: Die Kf-Wert-Bestimmung ist sehr zeitaufwendig. Pro Bohrloch kann die Analyse bis zu 2 h und länger dauern, je nach Substrat, Lagerungsdichte und aktueller Feuchte. Weiterhin muss berücksichtigt werden, dass bei leichteren Böden eine ausreichende Menge Wasser zur Verfügung steht (Volumen des beiliegenden Kanisters reicht dann nicht unbedingt aus!) − 77 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.1.8.3 Boden Eindringwiderstand / Durchdringungswiderstand Hierbei handelt es sich um eine Methode zur Messung der Bodenfestigkeit, die den Verformungswiderstand des Bodens gegen Druck-, Scher- und Zugbeanspruchung kennzeichnet, sie basiert auf der Zerstörung des Bodenverbandes (vgl. z.B. WILDE 2000). Es besteht eine enge Beziehung zwischen Eindringwiderstand und Lagerungsdichte sowie Wassergehalt. Die Aufnahmen erfolgen mittels eines Penetrometers bzw. Penetrographen. Das Penetrometer misst mit einem (elektronischen) Kraftsensor, der über den Sondenstab mit dem Messkegel verbunden ist, die vom Boden entgegenwirkende Kraft (z.B. Penetrograph (06.02) der Firma Eijkelkamp P 1.51-1). Die Durchführung und Auswertung der Aufnahmen erfolgt nach TGL 31222/10. Wobei darauf zu achten ist, dass die Aufnahmen bei Frühjahrsfeuchte (nicht nass und nicht trocken, vgl. auch TGL 31222/01) erfolgen müssen. Auf ebenen Ackerflächen erfolgt die Beprobung auf einer runden Aufnahmefläche (Radius von ca. 2 m) innerhalb des Bodenmessfelds, deren Mittelpunkt das Leitprofil darstellt (vgl. ANHANG Flächendesign). In diesem Bereich werden 15 Einstiche mit dem Penetrometer eingebracht. Bei hängiger Lage und Aufnahmen nach dem Catena.-Prinzip werden die Einstiche seitlich des Leitprofils (die Seite, die nicht durch andere Aufnahmeflächen belegt ist) anschließend an die Regenwurmerfassungsflächen in Oberhang-, Mittelhang- und Unterhagposition mit je 15 Wiederholungen vorgenommen. 3.1.8.4 Bestimmung der mikrobiellen Biomasse und der Bodenatmung (nach ALEF 1991, BODE & BLUME 1995, DUNGER & FIEDLER 1989, LABO 1999, GRIMM & WIRTH 1998, SAG 1991 sowie WIRTH 1998) Bemerkung zur Methodenwahl: Eine direkte Bestimmung mikrobieller Biomasse im Boden wäre zweifelsohne der geeignetste Weg. Die verfügbaren Techniken stoßen jedoch auf viele methodische Schwierigkeiten. Es ist zu beachten, dass die im Labor gemessenen potentiellen oder aktuellen Aktivitäten zunächst keine Aussage über absolute Mineralisationsraten oder Stoffwechselintensitäten der Mikroflora am Standort (in situ) geben können. Derartige Messungen sind jedoch erforderlich, um verschiedene Standorte hinsichtlich aktueller Umsetzungsprozesse untereinander zu vergleichen und den Einfluss verschiedener Umweltfaktoren bzw. Bodenbearbeitungsund Kultivierungsmethoden zu beurteilen (ALEF 1991). Indirekte oder auf Kulturtechniken beruhende Methoden stellen, trotz berechtigter Kritik hinsichtlich ihrer Selektivität oder ihres Nachweises von Potentialen, geeignete Techniken zur Erfassung und Quantifizierung des Auftretens und der Vergesellschaftung der am Abbau organischer Substanz beteiligten mikrobiellen Populationen dar (WIRTH schriftl. Mitteilung). Bemerkung zum Untersuchungsturnus: “Da bei bodenmikrobiologischen Untersuchungen nur Ergebnisse von Proben vergleichbar sind, die nach gleicher vorangegangener Witterung, zur gleichen Jahreszeit gezogen wurden, wird vorgeschlagen, die Untersuchungen auf Ackerflächen jährlich durchzuführen. Auf anderen landwirtschaftlich genutzten Standorten ist ein mindestens 3-jähriger Turnus vorzusehen.” (LABO 1999, S.5-35). Im Rahmen der ÖUB können derzeit alle bodenanalytischen Untersuchungen, auch auf Äckern, nur im 6jährigen Turnus durchgeführt werden. 78 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden Entnahme der Bodenproben: • günstigster Zeitpunkt: Die bodenmikrobiologischen Eigenschaften schwanken im Laufe des Jahres bedingt durch Witterungseinflüsse und Bodeneigenschaften, bei landwirtschaftlicher Nutzung auch durch Bewirtschaftungsmaßnahmen (Fruchtart, Bearbeitung, Düngung). Streng genommen sind nur Untersuchungsergebnisse vergleichbar, die zur gleichen Jahreszeit und bei gleicher Fruchtart gezogen wurden. Auf landwirtschaftlich genutzten Flächen empfiehlt es sich daher, die Proben im zeitigen Frühjahr (März / April) unmittelbar vor Vegetationsbeginn und Bewirtschaftungsmaßnahmen (Ausbringung von Agrochemikalien) zu nehmen, da zu diesem Zeitpunkt leicht umsetzbare Ernterückstände weitgehend mineralisiert sind sowie der Einfluss der Rhizosphäre und der im jeweiligen Jahr angebauten Frucht noch nicht zum Tragen kommt. • Menge des Probenmaterials: Für eine repräsentative mikrobiologische Charakterisierung ist eine flächen-repräsentative Probenahme erforderlich, d.h. möglichst viele Einzelproben werden zu einer Mischprobe (à ca. 1,5 kg ) zusammengefasst (SAG 1991). • Technik: ”Die Entnahmetiefe soll bei Acker die regelmäßig durchmischte Krume bis oberhalb der Pflugsohle umfassen ..., da sich die biologische Aktivität im wesentlichen auf diesen Bereich konzentriert.” (SAG 1991). Bei Grünland soll die Entnahmetiefe bei 0-10 und 10-20 cm liegen (LABO 1999). für Catenen: - - Entnahme von je einem Stechzylinder (à 100 cm3) aus 2 Tiefen (ca. 2-7 cm und 7-12 cm) an 9 Probepunkten, jeweils 3 für Oberhang, Mittelhang und Unterhang die Proben aus den zwei Tiefen werden jeweils vermischt Sammlung der Mischproben in PE-Tüten oder PE-Behältern (vorherige Sterilisation nicht notwendig) ergibt 3 Mischproben à ca. 1200g Boden, je eine für Ober-, Mittel- und Unterhang für DBF in ebener Lage: - - Entnahme von je einem Stechzylinder (à 100 cm3) aus 2 Tiefen von ca. 2-7 cm und 7-12 cm nach definiertem Raster der Oberbodenbeprobung (siehe Flächendesign Acker im ANHANG) Erhalt von 1 Mischprobe à ca. 1200 g für die jeweilige DBF Dokumentation der Probenahme: Hierzu empfiehlt sich das Führen spezieller Dokumentationsblätter (siehe ANHANG) Transport / Probenvorbereitung / Lagerung: - - - Proben für mikrobiologische Untersuchungen sind +/- offen zu transportieren, um Gasaustausch zu gewährleisten. Grundsätzlich sollten Probenahme, Transport und Weiterverarbeitung der Proben im Labor am selben Tag erfolgen. Bei längerem Transport sind die Proben möglichst in einem Kühlbehälter zu lagern, damit sie keinen erhöhten Temperaturen ausgesetzt sind. 79 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme - Boden Falls die Verarbeitung der Proben nicht am Tag der Probenahme durchgeführt werden kann, ist eine Lagerung, sofort nach Transport, im Kühlschrank bei + 3-4°C bis zur Aufbereitung möglich. ”Bei einer Analyse innerhalb von 4 Wochen sind die Proben im Kühlschrank, bei längerer Lagerungszeit bei -20 °C im Gefrierschrank aufzubewahren. Gefrorene Proben sind 48 Stunden im Kühlschrank aufzutauen und vor der weiteren Aufbereitung mindestens 2 Tage bei Zimmertemperatur zu lagern.” (SAG 1991). ”Die Proben sind innerhalb von 24 - 48 h nach der Entnahme der mikrobiologischen Analyse zu unterwerfen und bis zu diesem Zeitpunkt im naturfeuchten Zustand zu halten. Zwischenzeitlich ausgetrocknete Böden liefern stark abweichende Ergebnisse” (DUNGER & FIEDLER 1989). - gründliche Durchmischung der einzelnen Mischproben Sieben der naturfeuchten Proben auf < 2 mm (außer Niedermoor-Bodenproben) Falls der Boden zu feucht ist, muss er auf eine zum Sieben geeignete Feuchtigkeit bei Raumtemperatur angetrocknet werden. Er darf dabei jedoch niemals bis zur Lufttrockne austrocknen (nicht unter 40 % der FK), da Populationen und Enzyme hierdurch geschädigt und bei Wiederbefeuchtung durch teilweise schnelle Vermehrung in Dichte und Leistungen stark verändert werden. - - Der gesiebte Boden wird nochmals homogenisiert. weiterhin kühle Lagerung der in PE-Beutel eingerollten, gesiebten Proben (max. 4 Wochen) bis zur Analyse Vorinkubation der Proben bei Zimmertemperatur einen Tag vor der Analyse Bestimmung der max. Wasserhaltekapazität (WHK) und Einstellung der WHK auf 40 - 60 % Analytik: - Je Mischprobe sollten mind. 3 Labor-Parallelen (besser 5) zur Analyse kommen. Bestimmung der mikrobiellen Biomasse (Substrat - induzierte Respiration) nach ANDERSON & DOMSCH 1978, modifiziert nach BECK 1984 unter Glukosezugabe und Ermittlung der CO2-Abgabe bei 22°C und 40-60% mWK mittels computergesteuerten Infrarot-Gasanalysator nach HEINEMEYER et al. (1989), Angabe des mikrobiellen Kohlenstoffs in μg Cmik g-1 TS-Boden. - Bestimmung der Basalatmung an unbehandeltem (ohne Glukosezusatz) gesiebten Boden, ebenfalls mit der HEINEMEYER -Anlage. Zur Mittelwertbildung wird nach einer bodenarteigenen Equilibrierungsphase, die nach etwa 1-3 Stunden zu einem konstanten Werte-Plateau führt, jeweils 6 Messstunden ab Plateau-Beginn herangezogen. Die Basalatmung wird in μg CO2-C h-1 g-1 TS Boden angegeben. - Berechnung des metabolischen Quotienten (nach ANDERSON & DOMSCH 1978, 1993) durch das Verhältnis von Basalatmung zum mikrobiellen Biomasse-C [μg CO2-C h-1 g-1 TS Boden zu in μg Cmik / g TS- Boden = q CO2*10-3] 80 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.1.8.5 Boden Ergänzung zur DIN 19683 – 12 (Bestimmung der Trockenrohdichte) (nach BMELF 1994) Die Bestimmung der Trockenrohdichte erfolgt nach DIN 19683-12. Der so ermittelte Wert kann mit erheblichen Fehlern behaftet sein, wenn nennenswerte Anteile von Wurzeln bzw. Halmen oder ein hoher Skelettanteil in der Probe vorhanden sind. In diesen Fällen ist eine Korrektur vorzunehmen: dFB = MPr - MSk / VPr - (MSk / dSk*) Kürzel: dB = Trockenrohdichte der Stechzylinderprobe dFB dSk MPr MSk VPr = = = = = Dichte des Feinbodens Dichte des Skeletts Masse der trockenen Stechzylinderprobe bei 105 °C Masse des Skeletts in der Stechzylinderprobe Volumen der Stechzylinderprobe * Die Dichte der Steine lässt sich nicht immer mit dem Wert 2,65 g x cm-3 angeben. Dieser Wert kann eingesetzt werden z.B. für Ton- und Kieselschiefer und Quarzit. Angewitterte Steine oder bestimmte geologische Bildungen (z.B. Bims) haben deutlich geringere Dichten aufgrund ihres Porenanteils. Hier sind entsprechende Messungen erforderlich. 3.1.8.6 Bestimmung des volumetrischen Bodenwassergehaltes und des Bodenwasserspannungspotenzials Durchgeführt wird diese Untersuchung mit der Eijkelkamp-Apparatur - 08.01 ”Sandkasten zur pFBestimmung (pF 0-2,0)“ und 08.03 ”Membranpresse (pF 1,0 – 15,00)“ (nach EIJKELKAMP 1990 und 1992). Methodenprinzip: Die Wasserbindung hängt eng mit der Porenmenge bzw. der Porengrößenverteilung eines Bodens zusammen, da Wasser neben Hydratations- (an Partikeloberflächen) und osmotischen Kräften (durch Salze der Bodenlösung) besonders durch Kapillarkräfte (in Hohlräumen) gebunden wird. Die Bindungsintensität ist gekennzeichnet durch die Saugspannung, die überwunden werden muss, um eine Bodenprobe zu entwässern. Die in Böden auftretenden Saugspannungen reichen dabei von pF -∞ bis +7 (SCHLICHTING 1995). Lagerungsgetreu entnommene Bodenproben werden bis zur Wassersättigung befeuchtet und mit der o.g. EIJKELKAMP -Apparatur schrittweise definierten Spannungen ausgesetzt (zuerst Unterdruck, dann Überdruck). Dabei wird erfasst, wie viel Wasser die Probe bei der jeweils anliegenden Spannung halten kann. Nach Abschluss aller Messungen und Wägungen werden die Zylinderproben bis zur Gewichtskonstanz (bei 105°C) getrocknet und gewogen, um das Trockengewicht zu erhalten. Die Gewichtsdifferenzen zwischen den Wägungen während der Spannungsaussetzung und dem Trockengewicht ergeben die Wassergehalte. Spannung und zugehöriger Wassergehalt der entsprechenden Bodenprobe werden in einer spezifischen Kurve abgetragen. Anhand dieser Kurve sind dann die Feldkapazität, der Welkepunkt sowie die Porenverteilung ablesbar. „Da die Größe der Poren der Intensität ihrer Wasserbindung proportional ist (log ∅ in μm = 0,5 - log bar oder, da 3 + log bar = pF, log μm = 3,5 - pF bzw. vereinfacht μm = 3/bar) und Wasser die Dichte 1 hat, kann man aus der Wassermenge, die eine Probe unter definierten Saugspannungen enthält, auf das Volu- 81 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden men der Poren schließen, deren Grenzdurchmesser durch die angelegte Saugspannung definiert sind. Dabei wird Kreisform der Poren unterstellt (...) und ebenso wie bei der Korngrößenanalyse kann nicht das genaue Volumen der verschiedenen Poren, sondern nur ein Raum angegeben werden, der durch einen oberen und unteren Grenzdurchmesser ausgezeichnet ist.“ (SCHLICHTING 1995, S. 104). Probenahme: Im Rahmen der ÖUB ist nur eine Beprobung der Leitprofile möglich. Aus jedem Horizont sollten mind. 5 senkrecht eingetriebene lagerungsgetreue Stechzylinder entnommen werden. Dafür ist die rechte oder linke Profilwand horizontweise abzustechen. Vorbereiten der Proben, Vorbereitung der Geräte, Durchführung der Analyse und Wägung der Proben: (siehe gerätespezifische Anleitung) Hinweis / Einschränkung: „Die Bestimmung erfolgt unterhalb pF 3 meist an 100 cm3 Stechzylinderproben, damit auch die Grobporen repräsentativ erfasst werden, oberhalb pF 3 zwecks rascherer Gleichgewichtseinstellung hingegen an dünnen (< 0,5 cm) Scheiben der Zylinderproben. Oberhalb pF 4 kann bei tonärmeren Proben auf Volumenproben verzichtet werden. Eigentlich hängt das Ergebnis auch von der Höhe der Stechzylinder ab, da auch eine in der Probe selbst befindliche Wassersäule entwässernd wirkt und demnach mit einer Zylinderhöhe 0 gearbeitet werden müsste. Praktisch von Belang ist dieser Einfluss aber nur bei pF < 1,5.“ (SCHLICHTING 1995, S. 104). 3.1.8.7 Bestimmung der Einheitswasserzahl [nach SCHMIDT (1981) und (1986)] Prinzip: Wasserfesthaltevermögen der Torfe unter konstantem Druck. Definition: Die Einheitswasserzahl entspricht dem Wassergehalt des Bodens, den dieser unter einer wirksamen Spannung von 100 kPa festzuhalten vermag. Berechnung: W1 = Wassermasse (Bodenfrischmasse – Bodentrockenmasse) / Bodentrockenmasse Methode: Es wird etwa 1 kg grubenfrischer Torf ausschließlich aus dem obersten Torfhorizont (i.d.R. von 0-20 cm) als Mischprobe aus 4-5 Einzelproben nach dem Flächendesign (siehe ANHANG) entnommen und so gelagert, dass Wasserverluste nicht auftreten können (PE-Beutel). Bei naturnahen Mooren wird die gesamte Probe von einem Probepunkt (Flachschurf) entnommen. Bei der Vorbereitung der Untersuchung werden an 4 bis 5 Punkten der Gesamtprobe insgesamt ca. 200 g Boden entnommen, die unter Wasserzusatz in einer Schale zu einem zähflüssigen Brei geknetet werden. Die Wasserzugabe wird so bemessen, dass in Bodenvertiefungen etwas Wasser stehen bleibt. Im Abstand von jeweils 2 bis 4 Stunden werden dem Boden bei Bedarf weitere Wassermengen zugesetzt. Es wird eine Sättigungs- bzw. Quellzeit von insgesamt 24 Stun- 82 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden den eingehalten. Die Laststufen 5 , 20 und 100 kPa können im Abstand von 1 bis 2 Stunden aufgebracht werden. Für die Endlast werden 24 h Belastungszeit benötigt. Die ausführliche Methodenbeschreibung ist SCHMIDT (1986) zu entnehmen. Auswertung: Tabelle 4: Kennwerte der Einheitswasserzahl nach SCHMIDT (1986) für verschiedene Torfarten und Degradierungsstufen Torfart / Stufe der pedogenen Veränderung W1 Vermullter Torf <1,5 Schwach vermullter Torf 1,5 bis 1,8 Erlenbruchtorf 1,95 Vererdeter Torf >1,8 bis 2,2 Schwach vererdeter Torf >2,2 Schilftorf 2,5 bis 3,8 Seggentorf 3,2 bis 3,6 Die Grenzwerte sind für Torfe mit Glührückständen bis zu 30 % gültig! 3.1.8.8 Bestimmung der effektiven Kationenaustauschkapazität (KAKeff) Methodenprinzip (nach MEIWES 1984): Die Bodenprobe wird beim jeweiligen pH-Wert des Bodens mit einer ungepufferten Salzlösung (z.B. NH4Cl oder BaCl2) behandelt und die ausgetauschten Kationen in der Austauschlösung bestimmt. Beim Schütteln des Bodens mit 0,5 mol/l Ammoniumchloridlösung werden die Kationen des Bodens gegen Ammoniumionen ausgetauscht und in Lösung gebracht. Nach Filtration der Bodenlösung ist die Konzentration der in Lösung gegangenen Ionen spektroskopisch (mit Plasmaspektrometer - ICP und / oder Atomabsorbtionsspektrometer - AAS) zu bestimmen und in Ionenäquivalente umzurechnen. Die Summe der Ionenäquivalente ist die KAKeff. Anwendung: Bestimmung in carbonatfreien Böden. Reagenzien: Extraktionslösung: 134,0 g Ammoniumchlorid (NH4Cl) mit destilliertem Wasser zu 5 l Wasser lösen. Durchführung: Vor Beginn der Untersuchung ist von der Ammoniumchloridlösung der pH-Wert (= pH0) zu bestimmen. Diese Lösung ist 24 Stunden vor der Untersuchung anzusetzen. 10 g lufttrockener Mineralboden, 5 g humoser Boden oder 2 g Humus, jeweils Feinboden der Siebfraktion < 2mm werden auf der Analysenwaage in ein Wägeschiffchen auf 1 mg genau eingewogen und quantitativ in 500 ml Weithals-Plasteflaschen überführt. Mit einem 100 ml Messzylinder werden genau 100 ml Extraktionslösung (0,5 mol/l Ammoniumchloridlösung.) zugegeben, die Flaschen fest verschlossen und an- 83 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden schließend 1 h in der Überkopfschüttelmaschine bei 30 U/min. geschüttelt. Danach werden die Proben über Trichter und Papierfilter (Rundfilter 589/3) in 100 ml Erlenmeyerkolben filtriert. Dabei sind die ersten 1020 ml des Filtrats zu verwerfen. Falls das Filtrat trüb durchläuft, ist unter Verwendung des gleichen Filters nochmals zu filtrieren. Die Filtrate sind in gerätespezifische Messröhrchen zu füllen und der Messung zuzuführen. Des weiteren erfolgt eine Bestimmung des pH-Wertes (= pHp) der mit Boden geschüttelten Lösung. Messung: 1. 2. 3. Die Messung der Elemente (K, Ca, Mg, Na, Al, Fe, Mn) erfolgt am ICP. Die Messung für Ba erfolgt am AAS. Die pH-Werte zur Ermittlung der H+-Konzentration sind mit einem Labor-pH-Messgerät zu bestimmen (siehe dazu Gerätevorschrift). Berechnung: 1. Berechnung der Summe der Kationenäquivalente per Rechnerprogramm. KAK eff [mval / 100 g Boden] = IÄNA + IÄK + IÄCa + IÄMg + IÄAl + IÄFe + IÄBa + IÄMn + IÄH Zuvor ist die H+ Konzentration wie folgt zu berechnen ( ) ( ) C H + = 10 − pHp − 10 − pHO × 4,545 × 10 4 C (Al ges. )× 0,1112 10 − pHp 1 + −5,85 10 μval / g Boden C(H+) in μval/g geteilt durch 10 = H+ in mval / 100 g Boden pH0 = pH-Wert der Ammoniumchloridlösung (muss 24 h vor Bestimmung angesetzt werden) pHp = pH-Wert der extrahierten und filtrierten Lösung - bei pH0 > pHp wird die H+-Konzentration gleich Null gesetzt C(Alges) = Konzentration Al in μg/g - zur Korrektur der H+-Konzentration 3.1.8.9 Bestimmung des pflanzenverfügbaren Magnesiums Probenahmezeitpunkt: Die Probenahme für pflanzenverfügbare Nährstoffe auf Ackerstandorten erfolgt am besten zwischen Ernte und nachfolgender Düngung. Die letzte Düngung soll längere Zeit zurückliegen und es sollten mind. 10 mm Niederschlag gefallen sein (VDLUFA 1991 & 1997). Analyseprinzip: (nach SCHACHTSCHABEL 1956) Extraktion des austauschbaren Magnesiums mit Calciumchloridlösung und Bestimmung des Magnesiums mit Atom-Absorptions-Spektralfotometrie bei 285,2 nm. Gerätebedarf: Schüttelmaschine: rotierend mit 30-35 U/min, Atom-Absorbtions-Spektralfotometer (AAS), Brenngas: Acetylen. Reagenzien: 84 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden 0,0125 mol/l Calciumchloridlösung Magnesium-Standardlösung (1 g Mg/1000 ml) Durchführung: 5 g lufttrockenen, auf 2 mm gesiebten Boden (bei Moor- und Anmoorboden 10 ml feldfeuchten Boden einwiegen und 100 ml 0,0125 mol/l Calciumchloridlösung) in Schüttelflaschen einwiegen, 50 ml 0,0125 mol/l Calciumchloridlösung zugeben und 2 h maschinell über Kopf schütteln. Filtrieren, die ersten 15 ml des Filtrates verwerfen und im klaren Filtrat Magnesium mit Hilfe eines AAS bestimmen. Bemerkungen zur Methode: Standardmethode zur Ermittlung des pflanzenaufnehmbaren Mg Methode an Feldversuchen geeicht Bei sandigen Böden werden ca. 80 %, bei Tonböden nur 60 % des extrahierbaren Mg erfasst. - 3.1.8.10 Bestimmung des Nitratgehaltes im Boden Probenahme: Das Probematerial sollte am besten vor Beginn der Vegetationsperiode aus dem Bereich unter der durchwurzelten Schicht entnommen werden. Analyseprinzip (nach VDLUFA 1997 – Kapitel A6.1.3.1, modifiziert nach REICHELT, Landesforstanstalt Eberswalde, Abt. Bodenkunde / Forschungslabor) Die Nitrate werden aus feldfeuchten bzw. entsprechend vorbehandelten Bodenproben mit 1%iger Kaliumaluminiumsulfatlösung extrahiert und nach Zugabe von ISA-Lösung die Konzentration an Nitrat mit der Nitrat-Ionensensitiven Elektrode gemessen. Anwendungsbereich: Die Methode ist für Böden aller Art geeignet, sofern die Probenvorbereitung richtig erfolgte (siehe Kapitel 3.1.7). Geräte: - - Waage, Ablesbarkeit 0,1 g Analysenwaage, Ablesbarkeit 0,1 mg Kunststoff-Flaschen von 500ml Fassungsvermögen mit Silikonstopfen 28/34 mm Überkopf-Schüttelmaschine mit 30-35 U/min Wägeschiffchen Messzylinder, Nennvolumen 50 ml und 100 ml Analysentrichter, Durchmesser 5,0 cm, mit ca. 3 cm langem Auslaufrohr Rund- oder Faltenfilter , z.B. Rundfilter Filtrak Nr. 132 oder Macherey-Nagel Nr. 619G oder Faltenfilter Macherey-Nagel Nr. 619G1/4 Messkolben, Nennvolumen 100 ml, 250 ml, 500 ml, 1000 ml Messpipette, Nennvolumen 5 ml oder 10 ml Vollpipette, Nennvolumen 5 ml, 10 ml, 20 ml, 50 ml, 100 ml Bechergläser, Nennvolumen 50 ml 85 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme - Boden Nitrat-Ionensensitive Elektrode mit Bezugselektrode und Temperaturfühler Spannungsmesser, z.B. Mikroprozessor pH/ION Meter pMX 2000 von WTW Magnetrührer mit kunststoffummanteltem Rührstäbchen Chemikalien: Als Chemikalien werden nur solche des Reinheitsgrades ‘Zur Analyse’ und als Wasser wird destilliertes verwendet. Extraktionslösung, c (KAl(SO4)2 . 12 H2O) = 10 g/l, Herstellung durch Lösen von 10 g der Chemikalie in destilliertem Wasser zu 1 l ISA - Lösung (Ionen-Stärke Adjustier - Lösung), Herstellung: 600 g Al2(SO4)3 x 18 H2O (reinst) werden in etwa 600 ml destilliertem Wasser unter Erwärmen gelöst und die Lösung nach Abkühlen auf Raumtemperatur in einem Messkolben auf 1 l aufgefüllt. Nitrat-Standard-Lösungen: - 1. Standard-Vorratslösung (1 g Nitrat / l) Herstellung: 1,6305 g zwei Stunden bei 120°C getrocknetes KNO3 werden mit der Extraktionslösung (s.o.) zu 1 l gelöst. Die Lösung ist mehrere Monate haltbar. 2. Standard-Gebrauchslösung ( 100mg Nitrat / l) Herstellung: 100 ml Standard-Vorrats-Lösung (s.o.) werden mit der Extraktionslösung (s.o.) zu 1 l verdünnt. Eich-Standard-Reihe: Die Standard-Gebrauchslösung (s.o.) wird wie folgt mit Extraktionslösung (s.o.) verdünnt: 5 ml Standard-Gebrauchslösung verdünnt auf 500 ml (1 mg Nitrat / l) 5 ml Standard-Gebrauchslösung verdünnt auf 250 ml (2 mg Nitrat / l) 5 ml Standard-Gebrauchslösung verdünnt auf 100 ml (5 mg Nitrat / l) 10 ml Standard-Gebrauchslösung verdünnt auf 100 ml (10 mg Nitrat / l) 20ml Standard-Gebrauchslösung verdünnt auf 100 ml (20 mg Nitrat / l) 50 ml Standard-Gebrauchslösung verdünnt auf 100 ml (50 mg Nitrat / l) Standard-Gebrauchslösung, unverdünnt (100 mg Nitrat / l) Die ersten drei Lösungen sind unmittelbar vor Gebrauch anzusetzen, die anderen vier halten sich etwa einen Monat. Probenvorbereitung: Die frischen, gekühlten in das Labor transportierten Bodenproben werden von Hand durch das Kunststoffsieb gedrückt. In der derart homogenisierten Probe sofort die Trockenmasse bestimmen und parallel dazu zur Bestimmung des Nitratgehaltes einwiegen. Falls die Siebung nur mit großem Zeitaufwand möglich ist (Lehm), genügt es auch, die Probe von Hand zu zerdrücken und Steine auszulesen. Die Abweichungen durch Inhomogenität sind geringer als die bei längerer Bearbeitung eintretenden Veränderungen. Bei Verwendung von eingefrorenen Proben (-25°C) die Beutel auf eine feste Unterlage schlagen, so dass die Proben in ihre Einzelaggregate zerfallen. Die Proben noch in gefrorenem Zustand ohne Wägeschiffchen direkt in den Kunststoffflaschen einwiegen (höhere Gehalte durch biologische Umsetzung bei langsamem Auftauen). Schnellgetrocknete Proben (siehe Arbeitsvorschrift zur Aufbereitung von Bodenproben) wie allgemein im Labor üblich einwiegen. Herstellung des Extraktes: 86 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden 10 g der homogenisierten Probe (bei niedrigen Nitratgehalten auch 20 g, bei Humus oder humusreichen Proben nur 5 g) werden in einem Wägeschiffchen auf 0,1 g genau eingewogen und quantitativ in 500 mlKunststoffflaschen überführt. Mit einem Messzylinder werden 100 ml Extraktionslösung zugegeben, die Flaschen mit Silikonstopfen fest verschlossen und eine Stunde mit der Schüttelmaschine geschüttelt. Der Extrakt wird durch ein stickstofffreies Falten- od. Rundfilter filtriert, wobei die ersten 25 ml zu verwerfen sind. Soll im Extrakt auch der Ammoniumgehalt bestimmt werden, so ist die eingesetzte Menge an Boden und Extraktionslösung zu verdoppeln. In jeder Probenserie sind zwei Blindproben (nur Extraktionslösung), eine Wiederholungsprobe aus der vorhergehenden Serie und eine Kontrollprobe mit bekanntem Gehalt mitzuführen (Schütteln, Filtrieren, Messen). Vorbereitung der Messeinrichtung: - Schutzrohr der Nitrat-Elektrode abnehmen, dabei ionenselektive Membran nicht berühren - Nitrat-Elektrode abspülen, Elektrodenkörper mit einem sauberen Papiertuch abwischen, ionenselektive Membran nur vorsichtig abtupfen Bei Referenz-Elektrode Brücken-Elektrolyt (ISA-Lösung) einfüllen bis zum Rand der Einfüllöffnung, Schliff etwas öffnen (vorsichtig drehen) und etwas Elektrolyt ausfließen lassen, Schliff wieder zudrehen (nicht zu fest), Brücken-Elektrolyt nachfüllen, auf Blasenfreiheit achten Referenz-Elektrode abspülen und mit Papiertuch abwischen Elektroden im Halter befestigen und mit dem Messgerät verbinden - - Eichen: Jeweils 50 ml der Eichlösung werden mit einem Messzylinder abgemessen und in 50 ml-Bechergläser überführt. Mit einer Messpipette gibt man jeweils 1 ml ISA-Lösung zu. Das Becherglas wird auf einen Magnetrührer gestellt und ein Rührstäbchen dazugegeben. Man taucht Nitrat- und Referenz-Elektrode in die Eichlösung ein, setzt den Magnetrührer in Betrieb, schaltet das Messgerät ein und drückt die Taste ‘mV REL’. Man wartet die Messwerteinstellung ab und notiert den konstanten Endwert. Die mV-Messwerte werden in einem Eichdiagramm gegen den Logarithmus der jeweiligen Nitrat-Konzentration = logarithmische Achse, mV-Werte = lineare Achse) eingetragen. Unterhalb von 10 mg/l Nitrat verläuft die Eichkurve nicht mehr linear, in diesem Bereich ist eine Kurve zu zeichnen. Die Eichlösungen sollten in mehreren Messgefäßen bereitgehalten werden. Bei Verwendung nur eines Messgefäßes ist dieses beim Wechsel der Lösungen gründlich zu spülen. Bei der Eichung vorteilhaft mit den niedrigstkonzentrierten Lösungen beginnen und in Richtung zunehmender Konzentration arbeiten. Wenn die Eichkurve bereits vorliegt und die letzte Messung innerhalb der vergangenen vier Wochen erfolgte, so genügt die Überprüfung der Eichkurve an zwei Eichpunkten (2 und 50 mg/l). Nur wenn keine Übereinstimmung vorliegt, muss eine komplette neue Eichkurve aufgenommen werden. Bestimmung des Nitratgehaltes: 50 ml des hergestellten Extraktes (s. oben, klares Filtrat) werden, mit Hilfe einer Messpipette, mit 1 ml ISA-Lösung versetzt und in 50 ml-Bechergläsern mit Hilfe der Ionensensitiven Elektrode 9 der Nitratgehalt gemessen. Mit Hilfe des Eichdiagramms werden aus den mV-Messwerten die Nitratkonzentrationen der Probelösungen ermittelt. 9 siehe dazu Anleitung zur ionenselektiven Elektrode NO3-, Dr. W. Ingold AG, Urdorf, Schweiz. 87 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden Nach Abschluss der Messungen ist die Nitrat-Elektrode abzuspülen und im Schutzrohr trocken aufzubewahren. Aus der Referenz-Elektrode ist -falls nicht mit Sicherheit am nächsten Tag wieder gemessen wirddie ISA-Lösung abzulassen und die Einfüllöffnung mit der Gummikappe wieder zu verschließen. Die Referenz-Elektrode wird trocken aufbewahrt. Bei Eichung, Messung sowie Aufbewahrung ist die detaillierte Bedienungsanleitung der Elektrode zu beachten. Auswertung / Berechnung: Die in den Extrakten bestimmten Nitrat-Konzentrationen müssen auf die eingewogene Probemenge umgerechnet werden. Bei Konzentrationsangaben der Messlösung in mg/l ergibt sich der Gehalt in der Probe zu x(mg / 100 g Boden ) = a × b × f × 100 1000 × c wobei x = Gehalt in der Probe bei der jeweiligen Feuchte a = Nitrat-Konzentration in der Messlösung (mg/l) b = Extraktionsmittelmenge (100ml) c = Bodeneinwaage zur Extraktion (20 bzw. 50 g) f = Verdünnungsfaktor des Extraktes durch Zugabe der ISA-Lösung (1,02) Bei Extraktionsmittelmengen von 100 ml und Bodeneinwaagen von 20 bzw. 50 g vereinfacht sich die Gleichung zu Einwaage 20 g x(mg / 100 g Boden ) = Einwaage 50 g a × 1,02 2 x(mg / 100 g Boden ) = a × 1,02 5 Störungen / Einschränkungen: Der Nitrat-Stickstoffgehalt von Böden unterliegt einer starken Witterungsabhängigkeit. Sinnvolle, ökologisch aussagekräftige Ergebnisse können nur bei einer ganzjährigen Beprobung erreicht werden. Wird nicht mit einer hohen zeitlichen Auflösung der Beprobung gearbeitet, zeigen die Messungen ein diffuses Verhalten (HARTER & LUTHARDT 1996). Die Messung des Nitrats wird durch anionische Tenside (Detergentien) gestört. Außerdem darf das Verhältnis der Konzentration verschiedener anderer Ionen zu Nitrat bestimmte, in der Bedienungsanleitung der Elektroden angegebene, Werte nicht überschreiten. 88 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden 3.1.8.11 Bestimmung des pflanzenverfügbaren Phosphors und Kaliums Probenahme: Die Probenahme für pflanzenverfügbare Nährstoffe auf Ackerstandorten erfolgt am besten zwischen Ernte und nachfolgender Düngung aus dem durchwurzeltem Bodenbereich. Die letzte Düngung soll längere Zeit zurückliegen und es sollten mindestens 10 mm Niederschlag gefallen sein (VDLUFA 1991). Prinzip: (nach AG BODEN 1997) Extraktion der Nährstoffe Phosphor und Kalium mit einer durch Salzsäure auf pH 3,6 eingestellten Lösung von Calciumlactat und anschließender fotometrischer Bestimmung. Gerätebedarf: Schüttelmaschine, rotierend mit 30-35 U/min, Spektralfotometer oder Filterfotometer für P-Bestimmung (einzustellende Wellenlänge: 580 nm; Flammenfotometer oder AAS für K-Bestimmung (Wellenlänge: 767 nm) Reagenzien: - - 240 g Calciumlactat mit ca. 1200 ml kochendem destilliertem Wasser übergießen und umrühren bis alles gelöst ist. Zur noch warmen Lösung 80 ml Salzsäure (c(HCl) = 10 mol/ö) geben und nach dem Erkalten mit destilliertem Wasser auf 2000 ml auffüllen 500 ml DL-Lösung mit destilliertem Wasser zu 10 l verdünnen. Die Lösung täglich frisch bereiten. Ihr pH-Wert muss 3,6 betragen. Standardlösungen für Phosphor und Kalium: - - - Standard-Vorratlösung: 1,7575 g Kaliumdihydrogenphosphat und 0,5625 Kaliumchlorid mit destilliertem Wasser zu 1 l lösen 50 g Ammoniumheptamolybdat in etwa 800 ml destilliertem Wasser von ca. 50 °C lösen und nach dem Erkalten mit destilliertem Wasser auf 1000 ml auffüllen. Die Lösung ist mehrere Wochen haltbar. 1,25 g Ascorbinsäure und 350 mg Zinn (II)-chlorid, in 50 ml Salzsäure (c = 10 mol/l) lösen und mit destilliertem Wasser auf 100 ml auffüllen. Die Lösung täglich frisch zubereiten. Durchführung: 5 g lufttrockener Boden (bei Moorböden und Anmoorböden 10 ml feldfeuchten Boden einwiegen) in Schüttelflaschen einwiegen, mit 250 ml DL-Gebrauchslösung (siehe Reagenzien) versetzen, 90 min über Kopf schütteln, filtrieren und die ersten 20-30 ml des Filtrates verwerfen. Messung von Phosphor: Zu 25 ml Bodenextrakt 1 ml Molybdatreagenz und 1 ml Reduktionslösung jeweils in die Mitte der Flüssigkeitsoberfläche dazu dosieren und jeweils schütteln. Nach 10 min bis maximal 25 h nach dem Einfärben die Extinktion bei 580 nm mit einem Spektralfotometer in 10-mm-Küvetten gegen den Reagenzblindwert messen. Messung von Kalium: 89 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Boden Filtrat direkt in ein Flammenfotometer (Brenngas: Acetylen oder Propan) einsaugen und den Messwert bei 767 nm ablesen. Bemerkungen: - Methode ist an zahlreichen Feldversuchen zur Ermittlung des Düngerbedarfs geeicht. Methode führt zu Fehlinterpretationen bei Böden mit Carbonatgehalten über 5 % ! 90 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Grundwasser 3.2 Grundwasser 3.2.1 Allgemeines Vorgehen Bei grundwasserbeeinflussten Monitoringflächen ist die Beobachtung von Grundwasserschwankungen im Jahresgang, sowie die Änderung ausgewählter chemischer Parameter vorgesehen. Für die Beobachtung des Grundwassers im Rahmen der ÖUB empfiehlt es sich, in unmittelbarer Nähe der Monitoringfläche mindestens einen (beprobbaren) Pegel (Piezometerrohr) bis in eine Tiefe von mind. 50 cm unterhalb des geschätzten mittleren Grundwasser-Niedrigstandes einzulassen (VAHRSON et al. 1997). Die neu errichteten bzw. schon vorhandenen Pegel sollen in regelmäßigen Abständen abgelesen und beprobt werden. Jedoch ist zu beachten, dass eine wasserchemische Untersuchung nur in Pegelrohren mit einem Mindestdurchmesser von 10 cm realisiert werden kann. Vor der Beprobung ist ein Abpumpen des stehenden Wassers erforderlich, um die Analyse bzw. Probenahme in dem frisch nachgelaufenen Wasser vornehmen zu können. 3.2.2 Parameterbegründung und Methodenbeschreibung 3.2.2.1 Grundwasserstand / Pegelgang Die Beobachtung des Pegelganges dient der genauen und schnellen Erfassung von Veränderungen des Wasserhaushaltes (als maßgeblicher Faktor des Ökosystems) im Jahresverlauf. Der Grundwasserstand ist ausschlaggebend für Reduktion und Oxidation im Boden. Messprinzip (nach SCHLICHTING 1995, LABO 1999 und DIN 19680, siehe auch DIN 38402-13): In einem Messrohr bildet sich im gesättigten Bereich ein freier Wasserspiegel aus. Die Höhe des Wasserspiegels gibt das hydraulische Potential für den Bereich an, aus dem Wasser in das Rohr eintreten kann. Geräte für Einbau und Messung: Piezometerrohre (∅ 2 Zoll entspr. 5 cm) inkl. Überziehstrumpf (Gaze od. Perlon) und Verschlusskappen (ggf. auch perforiert am unteren Rohrende), Bohrer für Perforierung, kleine Schaufel, Klappspaten bzw. Erdbohrer, Sand (zur Verfüllung der Zwischenräume sowie als zusätzlicher Filter), Zollstock oder Lichtlot bzw. Patsche (akustisches Lot) Das Rohr soll in dem zu messenden Bereich (z.B. Schwankungsbereich des Grund- bzw. Stauwassers) perforiert bzw. geschlitzt sein. Die Tiefe, d.h. die Rohrlänge und der durchlässige Bereich werden durch Sondierungen vorher festgelegt. Das Piezometerrohr darf auf keinen Fall den Wasserstauer des zu messenden Wasserkörpers durchstoßen. In Moorböden darf der Torf- bzw. Muddekörper ebenfalls nicht durchstoßen werden, da unter Umständen aus dem Untergrund aufquellendes Wasser den Wasserstand verfälscht. Insbesondere bei Böden, die stark zur Verschlämmung neigen, und deshalb das Rohr zusetzen, empfiehlt es sich, ein größeres Bohrloch vorzubohren und das Rohr mit einem Kies-Sand-Mantel zu umgeben. Der Boden wird in der Nähe der Oberfläche stark angedrückt und das Rohr mit einer Verschlusskappe versehen. Zur besseren Wiederauffindbarkeit sollte ein mit Flatterband markierter Holzpflock in die Nähe des Rohrpegel gesetzt werden. 91 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Grundwasser Es empfiehlt sich jedoch aus den o.g. Gründen und aufgrund der längeren Nutzbarkeit durch eine Fachfirma einen massiven, genormten Pegel setzen zu lassen. Messung: Die Messung erfolgt vorzugsweise mit einem Lichtlot (bei Erreichen des Wasserspiegels leuchtet eine kleine Lampe auf). Bei nicht zu tief anstehendem Grundwasser eignet sich auch ein trockener Zollstock. Maßeinheit [cm od. m unter bzw. über GOF] Darstellung der Ergebnisse: Die Höhe des Wasserspiegels wird in cm unter GOF angegeben. Wird das Grundwasser am Standort durch mehrere Pegel ermittelt, so sind die Höhenunterschiede des Geländes zu nivellieren, damit die Wasserspiegel auf ein einheitliches Niveau bezogen werden können. Die Darstellung erfolgt als Diagramm, in dem die Tiefe gegen die Zeit abgetragen wird. Methodische Fehlerquellen: In das Piezometer tritt Wasser nur aus Grobporen ein, deshalb kann der Boden (fast) vollständig wassergesättigt sein (Haftwasser), ohne dass in Piezometern freies Wasser auftritt. Bei geringer Wasserleitfähigkeit hinkt die Anzeige stark den Veränderungen im Boden nach. Wurde bei Einbau die falsche Tiefe perforiert, kann es zu Fehlmessungen kommen, da das Rohr als Dränage wirkt oder zwei Wasserkörper auf die Anzeige einwirken. 3.2.2.2 Probenahme Die Beprobung des Grundwassers erfolgt (nach Ablesung des Pegels!) mit einer Pumpe (ggf. auch Schöpfkelle). Günstig ist der Einsatz einer einfachen Hand-Vakuum-Pumpe, die nicht zu schwer ist, mit der aber das Wasser schnell abgesaugt werden kann. Zuerst wird das Wasser komplett abgepumpt und verworfen. Das nach einiger Zeit nachlaufende „frische“ Wasser wird beprobt. Das Wasser wird in eine 250 ml-PE-Flasche abgepumpt. (vgl. auch VAHRSON et al. 1997). 3.2.2.3 Vor-Ort-Messungen Temperatur [°C]: Die aktuelle Temperatur ist bei jeder Wasseranalyse mit anzugeben, da die Parameter sehr stark von ihr abhängen. Dabei wird der von der Sauerstoffelektrode ermittelte Temperaturwert verwendet. Sauerstoffgehalt [mg/l]und [%]: Der Sauerstoffgehalt des Grundwassers ist in Ökosystemtypen mit grundwassernaher Oberfläche entscheidend für die Vegetationsausprägung (Anpassung von spezialisierten Pflanzenarten an Sauerstoffarmut im Wurzelbereich) und die Streuzersetzung. Bei sehr niedrigen O2-Gehalten gehen außerdem Schwermetalle in Lösung, die in den Vorflutern, die das Einzugsgebiet entwässern, toxisch auf Elemente der limnischen Biozönose wirken können. Je langsamer der Grundwasserstrom ist, desto eher ist der Sauerstoff durch Oxidation v.a. von zwei- zu dreiwertigem Eisen verbraucht (VAHRSON et al. 1997). 92 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Grundwasser Messung: Der Sauerstoffgehalt wird zusammen mit der Temperatur vor Ort mit einer amperiometrischen Elektrode nach CLARK (Zweielektrodenprinzip) mit integriertem Temperaturmessfühler (z. B. WTW ”Profile Oxi 196”) gemessen. Zeitbedarf: 5 min/Probe pH-Wert: Der pH-Wert des Grundwassers gibt Auskunft über die Pufferkapazität des Einzugsgebietes. Bei sehr niedrigen pH-Werten gehen, ebenso wie bei geringem Sauerstoffgehalt, Schwermetallsalze in Lösung, die in den Vorflutern wiederzufinden sind (z.B. im Spreewald: Stäube aus dem Braunkohletagebau). Nur die zeitliche Dokumentation des Grundwasser-pH-Wertes lässt Aussagen über tiefgründige Versauerung zu (VAHRSON et al. 1997). Messung: Da der pH-Wert sich, v.a. bei schwacher Pufferung, sehr rasch unter dem Einfluss von Temperaturänderungen, oder auch einfach über Gleichgewichtseinstellungen mit Bestandteilen der Atmosphäre verändert, wird er möglichst im Feld gemessen. Der pH-Wert wird im Grundwasserpegel mit einem transportablen pH-Meter z. B. der Firma WTW (Wissenschftlich-Technische-Werkstätten) ”Profile pH 197” (Messung über Standard-pH-Einstabmesskette SenTix 50) gemessen. Zeitbedarf: 5-10 min / Probe Elektrische Leitfähigkeit [μS/cm]: Die Elektrische Leitfähigkeit (LF) ist ein Summenparameter für gelöste, dissoziierte Stoffe. Ihre Größe hängt von der Konzentration und dem Dissoziationsgrad der Ionen sowie von der Temperatur und der Wanderungsgeschwindigkeit der Ionen im elektrischen Feld ab. Die LF gibt Hinweise auf den Anteil gelöster Salze im Grundwasser. Messung: Da sich auch die Elektrische Leitfähigkeit mit der Temperatur und im Kontakt zur Atmosphäre ändert, wird dieser Parameter möglichst im Grundwasserpegel mit einer Standard-Leitfähigkeitsmesszelle Tetra Con 325 (z. B. WTW ”Profile LF 197”) gemessen. Zeitbedarf: 1 min / Probe 3.2.2.4 Konservierung, Transport und Lagerung von Wasserproben Inhaltsstoffe von Wasserproben können sich schnell verändern, v.a. bei Vorhandensein von größeren Mengen organischer Stoffe und günstigen Bedingungen für die Entwicklung von Mikroorganismen. Aus diesem Grund ist grundsätzlich eine physikalische Konservierung von Wasserproben durch Kühlung vorzusehen, da Temperaturerhöhung die Geschwindigkeit biochemischer Umsetzungen steigert. 93 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Grundwasser Es ist immer ratsam, die Proben so rasch wie möglich zu untersuchen. Ist dies nicht möglich, so können die Proben auf –18°C eingefroren werden. Wichtig ist, dass das Einfrieren und Auftauen zügig erfolgen. Es empfiehlt sich ein Transport in der Kühltasche. Beachte! Beim Einfrieren können irreversible Fällungen auftreten, welche die Ergebnisse verfälschen (RUMP & KRIST 1992). 3.2.2.5 Chemische Laboranalysen Nitrat-Gehalt (NO3-Gehalt) [mg/l]: Die Analyse erfolgt nach der aktuellen DIN-Vorschrift (DIN EN ISO 13395) mittels Elektrode. Zuvor erfolgt eine Filtration der Wasserprobe. 94 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Oberflächenwasser 3.3 Oberflächenwasser 3.3.1 Allgemeines Vorgehen Oberflächenwasser wird –wenn vorhanden- in den naturnahen bzw. aufgelassenen Mooren (Grabenwasser, Kolk-, oder Laggwasser) beobachtet. 3.3.2 Parameterbegründung und Methodenbeschreibung 3.3.2.1 Ausdehnung der offenen Wasserfläche Die Ausdehnung der offenen Wasserflächen wie dem Rand-Lagg naturnaher Kesselmoore unterliegt im Jahresverlauf einer starken Dynamik. Sie ist jedoch nicht nur Ausdruck der aktuellen Witterungsverhältnisse, sondern auch für Veränderungen (z.B. Zufluss aus dem Einzugsgebiet) und Störungen bzw. Beeinflussungen des Wasserhaushaltes des Moores. Deshalb wird eine Kartierung der Ausdehnung der offenen Wasserfläche alle 2 Monate (März, Mai, Juli, September, November) innerhalb des Untersuchungsjahrs vorgenommen. Die Methodik erfolgt wie bei der Ermittlung der Vegetationszonierung (Kapitel 3.4.6). Im Ergebnis werden ArcGis Karten erstellt. 3.3.2.2 Wasserstand / Pegelgang Die Beobachtung des Pegelganges dient der genauen und schnellen Erfassung von Veränderungen des Wasserhaushaltes (als maßgeblicher Faktor des Ökosystems) im Jahresverlauf. Zur Erfassung kann eine am Gewässerrand fest installierte Messlatte dienen. 3.3.2.3 Vor-Ort-Messungen Temperatur [°C]: Die aktuelle Temperatur ist bei jeder Wasseranalyse mit anzugeben, da die Parameter sehr stark von ihr abhängen. Die Messung erfolgt mit Quecksilberthermometer nach DIN 38404-4. Alternativ kann die Temperatur mit in die übrigen Messelektroden (pH-, O2-, LF-) integrierten Temperaturfühler gemessen werden. Wird der Sauerstoffgehalt bestimmt, sollte der von der Sauerstoffelektrode ermittelte Temperaturwert verwendet werden. Sauerstoffgehalt [mg/l]: Der Sauerstoffgehalt wird vor Ort unmittelbar nach der Probeentnahme mit einem galvanischen Sauerstoffsensor mit integriertem Temperaturmessfühler (WTW ”Profile Oxi 197”) gemessen, da er sich mit der Temperatur und im Kontakt zur Atmosphäre verändert. Zeitbedarf: bis zu 4 min / Probe pH-Wert: 95 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Oberflächenwasser Der pH-Wert wird ebenfalls möglichst im Feld, mit einem transportablem pH-Meter der Firma WTW (Wissenschftlich-Technische-Werkstätten) ”Profile pH 197” (Messung über Standard - pH Einstabmesskette) gemessen, weil auch er sich, v.a. bei schwacher Pufferung, sehr rasch unter dem Einfluss von Temperaturänderungen, oder auch einfach über Gleichgewichtseinstellungen mit Bestandteilen der Atmosphäre verändert. Zeitbedarf: bis zu 4 min / Probe Elektrische Leitfähigkeit [μS/cm]: Die Elektrische Leitfähigkeit (LF) ist ein Summenparameter für gelöste, dissoziierte Stoffe. Ihre Größe hängt von der Konzentration und dem Dissoziationsgrad der Ionen sowie von der Temperatur und der Wanderungsgeschwindigkeit der Ionen im elektrischen Feld ab. Die LF gibt Hinweise auf den Anteil gelöster Salze im Wasser. Messung: Da sich auch die Elektrische Leitfähigkeit mit der Temperatur und im Kontakt zur Atmosphäre ändert, wird auch dieser Parameter möglichst vor Ort gemessen, mit einer 4-Elektroden-Leitfähigkeitsmesszelle (WTW ”Profile LF 197” - konduktometrische Messung). Zeitbedarf: ca. 1 min / Probe 3.3.2.4 Probenahme Für die Oberflächenwasserbeprobung wird eine repräsentative Stichprobe (an 5 verschiedenen jahreszeitlichen Terminen innerhalb der Vegetationsperiode: März, Mai, Juni, Juli, September) an einer definierten Stelle entnommen. 10 Zur Entnahme wird der Probenahmebehälter (PE-Flasche) zunächst mit dem zu beprobenden Wasser gespült, fast randvoll gefüllt und sofort verschlossen. 3.3.2.5 Konservierung, Transport und Lagerung von Wasserproben siehe Kapitel 3.2.2.4 Grundwasser 3.3.2.6 Chemische Laboranalysen Grundsätzliche Schritte der Probenvorbehandlung Mit Probenvorbehandlung ist die Aufarbeitung der Probe bis zur eigentlichen Prüfung nach dem Standard für die jeweilige Analysemethode gemeint. (nach SCHÖNTHALER et al. 1998 und AG BODEN 1997) − Prüfung auf unterschiedliche Feststoffanteile − ggf. Auslesen gröberen Materials von Hand 10 In Söllen mit temporärer Wasserführung kann es jedoch insbesondere in niederschlagsärmeren Phasen zum Ausfall einzelner Parameter bzw. des gesamten Untersuchungsprogramms kommen. 96 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Oberflächenwasser − Filtration (ggf. Membranfilter 45 μm) oder Zentrifugation, Sicherung des Filterrückstandes für die evtl. Analytik von Schwermetallen und organischen Schadstoffen − Herstellung der Mischproben aus gleichen Anteilen der ggf. bearbeiteten Urprobe durch Mischen und Teilen bis zur Reduzierung auf die Analysenproben − evtl. Bestimmung des Eindampf- bzw. Abdampfrückstandes nach DIN 38409-1 Nitrat-, Nges-Gehalt [mg/l]: Die Nitrat-Analyse erfolgt nach DIN EN ISO 13395. Die Bestimmung des Gesamt-Stickstoffs sollte nach DIN 38409-27 erfolgen. Gesamtphosphat, Pges [mg/l]: Laboranalyse mit ICP nach DIN 38406. Kges-Gehalt [mg/l]: Die Ermittlung des Gesamtgehaltes an K erfolgt im Prinzip nach DIN ISO 9964-3. Anstelle CäsiumChlorid kann auch Strontium-Chlorid verwendet werden. Gemessen wird am AAS (AtomabsorptionsSpektrometer). 97 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vegetation / Flora 3.4 Vegetation / Flora 3.4.1 Allgemeines Vorgehen Die Stellung der Vegetation als „Produzent im Ökosystem“ ist hinreichend bekannt. Die Zusammensetzung und Entwicklung der Pflanzengemeinschaften ist Monitoringziel an sich für alle Ökosystemtypen, unabhängig von ihrer Naturnähe. Aktuell ist hier besonders die anhaltende Tendenz des Verschwindens der autochthonen Arten aus den naturnahen Ökosystemen und dem Verschwinden vor allem von Archaeophyten aus den Halbkulturformationen auf der einen Seite - und das Ausbreiten von Ubiquisten und Neophyten in alle Ökosystemtypen also Nivellierung - auf der anderen Seite zu nennen. Jedoch beobachtet man in einigen Gebieten gegenwärtig auch den Effekt, dass sich aufgrund der Umstrukturierung der landwirtschaftlichen Produktion in den neuen Bundesländern - vor allem weniger Düngereinsatz, gezielte Landschaftspflege - Arten wieder verstärkt ausbreiten. Der Erhalt von Artenvielfalt in Landschaften ist eines der obersten Ziele nachhaltig naturschutzfachlichen Handelns, so dass diese Tendenzen unbedingt einer mit standardisierten Methoden zeitlich und räumlich nachvollziehbaren Dauerbeobachtung bedürfen. Jedoch ist nicht nur das Vorkommen von Arten an sich Beobachtungsziel, sondern auch die typisch wiederkehrende und relativ stabile Vergesellschaftung von Pflanzenarten. Auch diese ist in unserer Landschaft selten geworden und ist Ziel der Beobachtung. Für die naturnahen und halbnatürlichen Ökosysteme steht die Frage: Halten sich die Vergesellschaftungen oder in welcher Richtung schichten sie sich um? Für alle anderen Ökosysteme formuliert sich die Frage: Stellen sich wieder typische Vergesellschaftungen in Anpassung an die neuartigen Standortverhältnisse ein oder wird alles von Ubiquisten überprägt und ist demzufolge nicht mit den klassischen pflanzensoziologischen Methoden voneinander abzugrenzen? Zum anderen ermöglicht die Auswertung der Vegetationsaufnahmen über die Anwendung ökologischer Zeigerwerte das frühzeitige Erkennen bei Veränderungen von Standortparametern, die in Messwerten noch nicht auszudrücken sind bzw. nur außerordentlich aufwendig zu erfassen sind. Oftmals ist es nur über die Kombination von abiotischen und biotischen Parametern möglich, die tatsächlichen Verhältnisse wiederzuspiegeln - als Stichwort seien hier nur die pflanzenverfügbaren Nährstoffgehalte vor allem in organischen Böden genannt. Neben den Rückschlüssen auf die abiotischen Standortverhältnisse sind auch Rückschlüsse bzw. ergänzende Interpretationsmöglichkeiten für Veränderungen der Fauna vor allem über Strukturdaten möglich. Die Beschreibungen zur zusätzlichen Erhebung der Vegetationsstruktur bei der Heuschrecken- und Laufkäfererfassung finden sich in Kapitel 3.5.5. Die gewählten Methoden für die Erfassung von Vegetationsdaten differieren in Abhängigkeit der Spezifitäten der einzelnen Ökosystemgruppen. Die Vegetationserfassung der terrestrischen Offenlandökosysteme erfolgt als hierarchisch gestaffeltes System auf verschiedenen Beobachtungsebenen, die mit einem weitgehend reduzierten Aufwand und höchstmöglich standardisiertem Vorgehen, allerdings geschultem Personal, umfangreiche Auswertungen ermöglicht und eine komplexe Betrachtung der ablaufenden Prozesse in ihren Zusammenhängen, Richtungen und Wirkungen gewährleistet. 98 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vegetation / Flora 3.4.2 Parameterauswahl Die Recherche diverser Monitoringprogramme ergab, dass i.d.R. zur Vegetationserfassung fest markierte Dauerquadrate unterschiedlicher Flächengröße und Anordnung genutzt werden – dies ist das üblichste Verfahren. Des Weiteren werden Transektmethoden in unterschiedlicher Variation angewandt, um zu ausgewählten Fragestellungen Antworten zu erhalten – hier sind vor allem Erfolgskontrolluntersuchungen von Managementmaßnahmen zu nennen. Wesentlich seltener ist die Kombination beider Vorgehensweisen. Obwohl sich die ÖUB nur streng auf die topische Ebene bezieht, wurde für den Offenlandbereich die Kombination von drei Verfahren mit unterschiedlichem räumlichen Bezug gewählt, die hierarchisch ineinander geschachtelt werden können. Dies hat den entscheidenden Vorteil, dass mehrere Diversitätsebenen beobachtet werden können: Arten, Gesellschaften und ein definierter Landschaftsraum. Die ersten Auswertungen der Ersteinrichtung belegen die Sinnhaftigkeit dieser Vorgehensweise (LUTHARDT & BRAUNER 2002, LUTHARDT et al. 2005). Die Pflanzenarten-Diversität wird über die Erstellung einer Gesamtartenliste aller in der Monitoringfläche vorhandenen Arten einschl. der Moose erfasst. Anhand der Liste erhält man einen Überblick über die Artenvielfalt, gegebenenfalls Vorkommen von Rote-Liste-Arten bzw. von sogenannten „Störzeigern“. Um einen räumlich zuordenbaren Überblick über die Anordnung verschiedener Vegetationsausbildungen, über Verschiebungen im Artgefüge und Dominanzverhalten zu erhalten, wird eine speziell angepasste Transektmethode angewendet. Um den Aspekt der typischen Vergesellschaftung von Pflanzen abzubilden, werden am Beispiel ausgewählter Vegetationseinheiten komplette Aufnahmen nach BRAUN-BLANQUET vorgenommen. Zusätzlich zu den aufgezählten Erfassungen wird ergänzend, für die naturnahen Moore eine Skizze der flächenmäßigen Verteilung der Vegetationszonierung angefertigt. Für die als Grasland genutzten Standorte wird als ergänzender Parameter die Biomasseproduktion erfasst und es werden die Pflanzeninhaltsstoffe Stickstoff, Phosphor und Kalium ermittelt. Fragen des Nährstoffstatus spielen eine große Rolle für eine nachhaltige Landbewirtschaftung, für die Artenvielfalt und das Konkurrenzgefüge sowie die Einschätzung der Stoffflüsse in der Landschaft. Auf Grasland-Ökosystemen wird zudem die Wasserstufenkartierung mittels der Vegetation als Parameter für den Flächenwasserhaushalt angewandt. 99 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vegetation / Flora 3.4.3 Erfassung des Gesamtartenspektrums 3.4.3.1 Bioindikation Die Pflanzenarten-Diversität ist über die Erstellung einer Gesamtartenliste aller in der Monitoringfläche vorhandenen Arten aufzunehmen. Die Erfassung erfolgt unter Einbeziehung aller randlich vorkommenden Arten oder Arten von irgendwelchen Störstellen bzw. Sonderstandorten. Anhand der Liste erhält man einen Überblick über die Artenvielfalt, gegebenenfalls Vorkommen von Rote-Liste-Arten bzw. sogenannten “Störzeigern” und registriert über die Jahre stärkere Veränderungen in der Häufigkeit bzw. das Verschwinden oder Neuhinzukommen von Arten. Es ergeben sich verschiedene Auswertungsmöglichkeiten: Analyse des Artenspektrums bezüglich des Anteils autochthoner Arten / Archaeophyten / Neophyten; Rote-Liste-Arten, ökosystemtypische / nicht ökosystemtypische Arten etc. Über das Einwandern bzw. Verschwinden von Arten in der Zeit können über deren ökologische Ansprüche Aussagen zur Entwicklung des Systems (einschließlich Konkurrenzverschiebungen) getroffen werden. 3.4.3.2 Methodik Die Erstellung der Gesamtartenliste erfolgt durch intensive Geländebegehung der gesamten Monitoringfläche. Als Grundlage für die Geländearbeit dient die Standard-Geländeliste für die Floristische Kartierung Brandenburg 11 siehe ANHANG. Alle vorkommenden Arten werden in der Liste abgestrichen, bzw. zusätzlich notiert (Moose) 12. (Falls aus neuer Zeit Gesamtartenlisten von einzelnen Monitoringflächen (z.B. KRATZERT 1998, MICHAELIS 1996, TIMMERMANN 1992) vorlagen, wurden diese zur Grundlage genommen). Es werden alle Arten erfasst, die innerhalb des Areals, welches als zu beobachtende Monitoringfläche definiert wurde, vorkommen, unabhängig davon, ob sie randlich einstreichen, sich an die Ränder zurückgezogen haben, oder Störstellen besiedeln. Als Zusatzinformation wird vermerkt, welche Arten nur randlich, d.h. nur im Abstand von 2 m von der äußeren Grenze der Monitoringfläche, zu finden sind. Dies wird eingetragen in die Spalte “Begehungsgebiete” der Geländeliste. Zu den nur randlich vorkommenden Arten gehören auch die Pflanzen der die Flächen direkt umgebenden Entwässerungsgräben oder (Feld-)Gehölzstandorte. Bei Äckern wird die Ökosystemtyp-Grenze definiert als die Schlaggrenze, gleichbedeutend mit der letzten gepflügten Reihe. Säume an Wegen o. ä. werden nicht mit aufgenommen. Die Grenze eines Solls bildet die Außenkante der nicht beackerten Fläche. Zu empfehlen ist, zuerst mit der Transektaufnahme der Fläche zu beginnen, die dabei erfassten Arten auf der Gesamtartenliste zu vermerken und die anschließende Begehung der Gesamtfläche auf die im Transekt 11 Erhältlich bei: Botanischer Verein von Berlin und Brandenburg, Königin-Luise-Str. 6-8, 14195 Berlin, www.botanischer-verein-brandenburg.de, Tel. 030/7748437. 12 Bei Mooren werden die in den Transekten und Vegetationsaufnahmen erfassten Moose auch in der Gesamtartenliste der Datenbank geführt. 100 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vegetation / Flora nicht erfassten Bereiche zu konzentrieren. Es wird mit einem Umkreisen der Fläche begonnen und die weiteren Muster der Begehung nach den Geländegegebenheiten ausgerichtet. Bei der Ersteinrichtung wurde zusätzlich eine Feinuntergliederung der Monitoringfläche in standörtlich differenzierte Bereiche vorgenommen (herleitbar aus den Karten der Wasserstufen, bzw. Vegetationszonierung), und jeweils detaillierte Artenlisten erstellt, die der Erstbeschreibung der Flächen zu entnehmen sind. Zudem wurden alle Arten in 3 Häufigkeitsklassen erfasst: 3-stufige Häufigkeitsklassifikation: 1: selten (Art auf Montoringfläche mit 1-2 Fundorten) 2: zerstreut (Art auf Monitoringfläche zerstreut, > 2 Fundorte) 3: häufig (Art auf Monitoringfläche +/- regelmäßig mit hoher Individuenzahl auftretend) Tabelle 5: Erfassung des Gesamtartenspektrums der Flora der Grünland-ÖUB-Flächen (5-stufige Häufigkeitsklassifikation) 1 (ss) Art auf Monitoringfläche sehr selten; ein bis sehr wenige Einzelfunde, oft an Sonderstrukturen gebunden. 2 (s) Art auf Monitoringfläche selten; vereinzelt auf gesamter Fläche vorkommend und / oder auf kleine Areale (Sonderstandorte) beschränkt; hier dann jedoch stellenweise in höheren Individuenzahlen / Dominanzen auftretend. 3 (z) Art auf Monitoringfläche zerstreut vorkommend; auf der gesamten Fläche und / oder mehreren Teilarealen regelmäßig in überwiegend mittleren Individuenzahlen / Dominanzen auftretend. 4 (v) Art auf Monitoringfläche verbreitet; auf der gesamten Fläche und / oder überwiegenden Teilarealen regelmäßig in überwiegend höheren Individuenzahlen / Dominanzen auftretend. 5 (h) Art auf Monitoringfläche häufig; auf der gesamten Fläche und / oder überwiegenden Teilarealen in überwiegend hohen bis sehr hohen Individuenzahlen / Dominanzen auftretend. Ab 2006 werden die Häufigkeitsangaben zur Gesamtartenliste in einer 5-stufigen Skalierung für die Graslandökosysteme (Moor- und mineralisches Grasland, aufgelassenes Grasland) im Standardprogramm mit erfasst (siehe Tabelle 5). Auf Ackerflächen erfolgt die Erfassung in 5 Häufigkeitsklassen fakultativ. Die Gesamtartenliste für die naturnahen Moore ist in den Monaten Juli bis September zu erstellen. Die Artenliste für das Grünland auf mineralischen Standorten bzw. Moorgrünland sollte zwischen Ende Mai und Juli in Abhängigkeit von den Mahd- bzw. Weideterminen erfolgen. Die Aufnahme der Ackerflächen ist maßgeblich an den jeweiligen Bewirtschaftungsrhythmus gebunden und muss von Fall zu Fall festgelegt werden. Bei jedem Aufenthalt im Gelände wird die Liste unabhängig vom jahreszeitlichen Aspekt ergänzt, um Vollständigkeit zu erzielen. 101 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vegetation / Flora Die Artenliste wird alphabetisch sortiert. Die Nomenklatur erfolgt bisher nach EHRENDORFER (1973). Zukünftig wird auch für die Datenbank die Verwendung der Nomenklatur nach WISSKIRCHEN & HAEUPLER (1998) angestrebt. 3.4.3.3 Zeitbedarf Der Zeitbedarf wird mit einem halben bis ganzen Tag veranschlagt, je nach Größe der Fläche. Bei den Moosarten ist der Bestimmungsaufwand (Büro) hinzuzurechnen. 102 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vegetation / Flora 3.4.4 Aufnahme des Vegetationstransektes 3.4.4.1 Bioindikation Transekte stellen ein verbindendes methodisches Element zwischen Artenliste (ohne genaue Artmächtigkeitsangaben), Vegetationsaufnahme (ohne die Garantie einer Flächenrepräsentanz) und Vegetationskartierung (sehr aufwendig, schwer reproduzierbare räumliche Grenzziehung) dar. Das Verfahren wird in vielfachen Modifizierungen breit angewandt. Der Vorteil besteht ergänzend zu der Artenliste darin, dass ein räumlicher Überblick über die Anordnung der verschiedenen Vegetationsausbildungen, sowie über Verschiebungen im Artgefüge und Dominanzverhalten gegeben wird. Es ergeben sich zahlreiche Auswertungsmöglichkeiten über räumliche Darstellungen in Verbindung mit der Ermittlung ökologischer Zeigerwerte nach ELLENBERG et al. (1992). Jedoch werden nicht alle auf der Fläche vorkommenden Arten erfasst (im Durchschnitt 50 % der Gesamtartenzahl, Schwankung 13 - 77 %, genaueres dazu in LUTHARDT & BRAUNER 2002), so dass in Ergänzung dazu die Gesamtartenliste nötig ist. 3.4.4.2 Methodik Entlang einer an den Anfangs- und Endpunkten fest markierten, damit genau wiederfindbaren geraden Linie quer durch die Gesamtfläche werden in einem definierten, standardisierten Abstand auf der Fläche eines Halbkreises alle Arten angesprochen und deren Artmächtigkeit in 5 groben Stufen aufgenommen. Pro Fläche werden 1 (-2) Transekte eingerichtet. Bei Anzahl und Lage der Transekte wird Wert darauf gelegt, die standörtlichen Verhältnisse in ihrer Variabilität möglichst vollständig abzubilden. Folgende Punkte sind bei der Festlegung der Transekte zu beachten: • Möglichst die gesamte Bandbreite der Standorts- und Vegetationsverhältnisse sollte abgebildet werden. • Es sollten vor allem Bereiche geschnitten werden, in denen in naher Zukunft Veränderungen (z. B. Austrocknung, Eutrophierung) sehr wahrscheinlich sind. • Sinnvoll ist eine Lage entlang bereits vorhandener Bodentransekte, wodurch von vornherein auf die standörtlichen Gegebenheiten geschlossen werden kann. Die Anfangs- und Endpunkte des Transektes werden festgelegt und an dauerhaften Punkten fest markiert. Diese Punkte werden mit GPS eingemessen (falls nicht möglich: andersartige genaueste Beschreibung). Eine Markierung kann z. B. durch einen farbigen Anstrich erfolgen. Falls keine dauerhaften Punkte vorhanden sind, werden die Anfangs- und Endpunkte durch eingeschlagene, dauerhafte Pfähle (Robinie, Eiche) markiert. Vom Anfangspunkt aus gesehen wird die genaue Himmelsrichtung festgelegt, in die das Transekt führt. Zwischenpunkte des Transektes werden für die Dauer der Untersuchung mit Fluchtstangen markiert bzw. in ungenutzten Ökosystemen dauerhaft durch eingeschlagene Holzpfähle gekennzeichnet, die mit GPS eingemessen werden. 103 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vegetation / Flora Anfangs- und Eckpunkte und einige Zwischenpunkte werden zusätzlich mit Magneten markiert (konkrete Angaben siehe Orthofoto in der Datenbank). Die Markierungen erfolgen in der Regel bei 1 m, 10 m und 50 m nach Transektbeginn sowie bei 1 m vor Transektende. Zur genaueren Wiederauffindbarkeit der Transektaufnahmen sind bei genutzten Monitoringflächen des mineralischen Grünlands und des Moorgrünlands zusätzlich Magnete bei allen 100 m Abschnitten (100 m, 200 m, 300 m,...), die zudem mit GPS eingemessen werden, sinnvoll. In Abhängigkeit von der Länge des Transektes erfolgt bei kleineren Flächen (bis ca. 100 m Transektlänge) alle 10 Meter, bei langen Transekten alle 20 Meter ein Transekt-Stop. Dies wird bei der Ersteinrichtung festgelegt und dann so beibehalten. Dadurch wird auf dem Transekt die erforderliche Genauigkeit der Abbildung der Vegetationszonierung erzielt. Die Wahrscheinlichkeit erhöht sich für die kleineren Ökosysteme, dass auch kleinere, oftmals sehr sensible Vegetationseinheiten erfasst werden. Auf landwirtschaftlich genutzten Monitoringflächen wird die besondere Spezifik der Randsituation dokumentiert. Kennzeichnend für die Randbereiche landwirtschaftlich genutzter Flächen sind geringere mineralische Düngung, geringerer Eintrag von Tierkot sowie geringerer Eintrag von Pflanzenschutzmitteln. Somit finden sich auf intensiv genutzten Flächen viele typische Arten der Wiesen, bzw. Äcker nur noch unmittelbar an der Schlaggrenze. Zur Dokumentation dieser besonderen Standorte bzw. Vegetationsverhältnisse wird jeweils der erste und letzte Transekt-Stop unmittelbar an den Rand der Monitoringfläche gelegt. In Abhängigkeit von der jeweiligen Fläche erübrigt sich dieser zum Teil, wenn entweder beim Transekt-Stop bei 20 m noch die Randsituation vorhanden ist, oder aber Transekt-Anfangs- oder – endpunkt nicht identisch sind mit der Schlaggrenze. Das Vorgehen auf der jeweiligen Fläche wird bei der Ersteinrichtung dokumentiert und für die Dauer der ÖUB so beibehalten. Vor Beginn der Aufnahme wird das Transekt mit Fluchtstangen abgesteckt und dadurch für die Dauer der Aufnahme markiert. Die Abstände zwischen den Transekt-Stops werden durch eine 10 bzw. 20 Meter lange Schnur mit Stäben an den Enden abgemessen. Die Aufnahme der Pflanzenarten erfolgt (in Begehungsrichtung gesehen rechts) jeweils in einem Halbkreis mit 2 m Radius. Mit Hilfe von drei Schnüren (á 2m) an deren Ende jeweils ein Stab befestigt ist, wird ausgehend von dem Transekt-Stop ein Halbkreis markiert (siehe Abbildung 3). Zu diesem Zweck werden 3 Stäbe jeweils mit einer 2 m langen Schnur mit Schlaufe am Ende versehen. Die Schlaufen werden auf den Stab gesteckt, der den Transekt-Stop markiert. Hierdurch kann an 3 Punkten der Halbkreis mit einem Radius von 2 Metern abgesteckt werden. 104 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vegetation / Flora Radius 2m 10 m bzw. 20 m Transektrichtung 2 4 6m Abbildung 3: Design eines Transekt-Aufnahmepunktes der Vegetationserfassung Alle Arten von Gefäßpflanzen (in naturnahen und wiedervernässten Mooren zusätzlich die Bryophyten) werden mit Artmächtigkeitsstufen von 1 bis 5 versehen (siehe Tabelle 6). Außerhalb der Aufnahmefläche stehende, diese jedoch überschirmende Gehölze werden gesondert mit dem Vermerk „Überschirmung“ erfasst. Die Deckung des Kronenbereiches wird in 5 Deckungsgradstufen angegeben (siehe Tabelle 6: Skalierung der Artmächtigkeiten sowie des „Gehölz-Überschirmungsgrades“). Zusätzlich wird an jedem Transektpunkt die Gesamtdeckung und die mittlere Wuchshöhe des Vegetationsbestandes erfasst. Die Höhenangabe bezieht sich dabei auf die obere Schicht (mit großer Deckung) der fotosynthetisch aktiven Organe. Die Eingabemaske für die Datenbank ist dem Anhang zu entnehmen. Tabelle 6: Skalierung der Artmächtigkeiten sowie des „Gehölz-Überschirmungsgrades“ für die Transektaufnahme (Bezug: Halbkreis von 2 m = 6,3 m2) Skala 1 Artmächtigkeiten / GehölzÜberschirmung <1% 2 1 – 10 % 3 > 10 – 25 % 4 > 25 – 50 % 5 > 50 % 3.4.4.3 Zeitbedarf Die Einrichtung des Vegetationstransektes (Abstecken mit Fluchtstangen) dauert bei 1-2 Personen je nach Größe und Übersichtlichkeit der Fläche eine Stunde bis einen halben Tag. Die Aufnahme des Vegetationstransektes, inklusive Abstecken und Einfluchten der Transekt-Stops, dauert in Abhängigkeit von der Länge des Transektes, der Artenausstattung und des Kenntnisstandes des Bearbeiters bezüglich der Determinierung der Pflanzensippen (Moose!) 1 bis 3 Tage je Monitoringfläche. Insbesondere bei den naturnahen Mooren ist der Bestimmungsaufwand für die Moose (Büro) zu berücksichtigen. 105 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vegetation / Flora 3.4.5 Vegetationsaufnahme nach BRAUN - BLANQUET 3.4.5.1 Bioindikation Die Vegetationsaufnahme nach BRAUN-BLANQUET dient zur Ermittlung der genauen Artenzusammensetzung, Vergesellschaftung der Arten und der Vegetationsstruktur. Neben der lebenden Phytomasse wird im Zuge der Vegetationsaufnahme auch die abgestorbene Biomasse (Streuschicht) erfasst. Die tote oberirdische Phytomasse zeigt in sehr extensiv genutztem Grasland bzw. aufgelassenem Grasland die Nutzungsintensität bzw. Dauer der Auflassung an. Oft ist die Phytomasseproduktion in aufgelassenem Grasland so hoch, dass die Zersetzung der Produktion nicht mehr nachkommt und abgestorbene Pflanzenteile zu einer Of-Auflage akkumulieren. Dies beeinträchtigt die Keimungsbedingungen vieler höherer Pflanzen ebenso wie die Fortbewegung bodennah lebender Tiere (Raumwiderstand). 3.4.5.2 Methodik Pro Ökosystem werden 1-2 sensible bzw. typische Vegetationsausbildungen ausgewählt. Je ausgewählter Vegetationseinheit erfolgen die Vegetationsaufnahmen in einfacher Wiederholung, um von zufälligen Ereignissen, wie z.B. Umbruch durch Wildschweine, unabhängiger zu sein. Die Größe der Aufnahmefläche richtet sich nach dem jeweiligen Vegetationstyp und erfolgt in Anlehnung an DIERSCHKE (1994: 151). Innerhalb der angegebenen Spannen wird die Größe den jeweiligen Gegebenheiten angepasst, um die Homogenität und Repräsentativität (nicht nur der Arten, sondern auch deren Dominanzen) der Aufnahme zu gewährleisten. Die Form (Rechteck oder Quadrat) und Größe der einzelnen Aufnahme wird vor Ort bei der Erstaufnahme festgelegt, beschrieben und in der gesamten Dauer der Ökosystemaren Umweltbeobachtung so beibehalten. Die definierten Eckpunkte werden, wenn möglich, mit GPS eingemessen und mit Magneten markiert (siehe Orthofoto in der Datenbank). Bei nicht genutzten Ökosystemen werden die Eckpunkte zusätzlich durch einen eingeschlagenen Pfahl markiert. Da die Aufnahmeflächen unterschiedliche Größen besitzen, ist die Frequenzmethode (vgl. HOFMANN 1997) nicht durchführbar. Statt dessen muss zur Ermittlung der Artmächtigkeit eine Schätzskala zur Anwendung kommen. Gewählt wird die Artmächtigkeitsskala nach LONDO (1984 zitiert in DIERSCHKE 1994: 159), da sich bei der Dauerbeobachtung von kleineren Sukzessionsschritten die BRAUN-BLANQUET-Skala als zu ungenau erwies (vgl. NIETFELD 1994: 70, SCHIEFER 1981 zit. in NIETFELD 1994: 85, SCHMIDT 1974 zit. in DIERSCHKE 1994: 159). Insbesondere in den Deckungsgraden “3” und “4” sind erst größere Sukzessionsschritte mit der BRAUNBLANQUET-Skala dokumentierbar. Im unteren Bereich ist diese jedoch gut anwendbar und hinreichend genau. Es ergibt sich deshalb folgende Skala: (Tabelle 7) 106 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vegetation / Flora Tabelle 7: Kombinierte Artmächtigkeitsskala nach WILMANNS (1989: 30) und LONDO (1984 zit. in DIERSCHKE 1994) für die Vegetationsaufnahmen im Rahmen der ÖUB. Skala Individuenzahl Deckung [%] Mittelwert [%] r 1, kleine Wuchsformen ≤1 0,1 + 2-5, kleine Wuchsformen ≤1 0,5 1 6-50 (inkl. 1-5 bei großen Wuchsformen) ≤5 2,5 2m > 50 ≤5 2,5 2a beliebig 5 - 15 10 2b beliebig >15 - 25 20 3 beliebig >25 - 35 30 4 beliebig >35 - 45 40 5 beliebig >45 - 55 50 6 beliebig >55 - 65 60 7 beliebig >65 - 75 70 8 beliebig >75 - 85 80 9 beliebig >85 - 95 90 10 beliebig >95 - 100 (100) Es werden alle Pflanzen einschließlich der Bryophyten erfasst. Neben der Ermittlung der Deckung der einzelnen Schichten wird auch der Gesamtdeckungsgrad der lebenden Phytomasse notiert. Für die Ermittlung der Artmächtigkeiten wird nur eine Krautschicht ausgewiesen. Die Summe der mittleren Deckungsgrade der einzelnen Arten kann den Gesamtdeckungsgrad der Krautschicht deshalb weit übersteigen. Zusätzlich wird die mittlere Wuchshöhe des Vegetationsbestandes erfasst. Die Höhenangabe bezieht sich dabei auf die obere Schicht (mit großer Deckung) der fotosynthetisch aktiven Organe. Die Mächtigkeit der Streuschicht wird in Zentimeter, deren Deckung in Prozent angegeben. Die Methode der Vegetationsaufnahme wird nicht auf den Ackerstandorten angewendet. Die Vegetationsaufnahme erfolgt in Abhängigkeit von den Bewirtschaftungsterminen zwischen Mai und September. 3.4.5.3 Zeitbedarf Bevor die Vegetationsaufnahme erfolgen kann, ist zunächst deren Wiederauffinden nötig. Dies erfolgt in der Regel durch die Kombination von GPS und Magnetsuchgerät. Nur in ungenutzten Ökosystemen kann die Fläche fest vermarkt werden. Die Dauer der Aufnahme beträgt je nach gewählter Flächengröße und Artinventar 1 bis 2 Stunden pro Vegetationsaufnahme. Bei den Moosarten ist der Bestimmungsaufwand (Büro) hinzuzurechnen. 107 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vegetation / Flora 3.4.6 Vegetationszonierung 3.4.6.1 Bioindikation Zusätzlich zu den aufgezählten Erfassungen ist es eine sinnvolle Ergänzung, für die naturnahen Moore (und die Sölle) eine Skizze der flächenmäßigen Verteilung der Vegetationszonen anzufertigen. Dies ergibt sich aus dem z. T. kleinflächig wechselnden Mosaik der Vegetation in diesen Ökosystemtypen. Eine Erhöhung der Anzahl der Transekte ermöglicht erst bei hohem Aufwand eine flächenmäßig räumliche Abbildung der Monitoringfläche. Die Vegetationszonierung leistet dies bei den zumeist kleinen Arealen mit wesentlich geringerem Aufwand. 3.4.6.2 Methodik Die Skizzierung der Vegetationszonierung erfolgt für die größeren Flächen nach Ausscheidung kartierbarer Vegetationseinheiten, die durch Luftbildauswertung gewonnen werden. Als Kartengrundlage dient eine Skizze (basierend auf einer Luftbildauswertung) der großflächigen Vegetationseinheiten. Durch intensive Geländebegehung im Abstand von ca. 20 Metern erfolgt die Auskartierung und ggf. weitere Untersetzung. Hierdurch kann sich im Extremfall ein Verschiebungsfehler der Vegetationsgrenzen von 10–20 Metern ergeben. Wo möglich, werden zur erhöhten Genauigkeit die Flächen mit Hilfe eines Rucksack-GPS eingemessen. Die Vegetationseinheiten werden in Karten im Maßstab 1 : 2500 oder 1 : 1000 eingetragen, je nach Größe der Monitoringfläche. Falls aus neuerer Zeit Karten der Vegetationszonierung für die konkrete Fläche vorliegen, werden diese für die Ersteinrichtung übernommen. Im Gelände werden für jede Vegetationsausbildung die kennzeichnenden Pflanzenarten notiert. Gearbeitet wird nach der pflanzensoziologischen Methode. Die gefundenen Einheiten werden dann Assoziationen, zumindest aber Verbänden zugeordnet. Vorgegangen wird nach der gängigen pflanzensoziologischen Literatur wie z.B. POTT (1995), SCHUBERT, HILBIG & KLOTZ (1995), PASSARGE (1996) und (1999). Die Vegetationszonierungen werden digitalisiert und in ArcGis dargestellt. 3.4.6.3 Zeitbedarf Der Zeitbedarf variiert erheblich in Abhängigkeit von der Flächengröße, der Kleinflächigkeit der Vegetationszonierung und der Begehbarkeit. Die Begehbarkeit ist deshalb entscheidend, da für die Vegetationszonierung Abstände in Metern ermittelt werden müssen. Viele Flächen sind sehr klein, schlecht begehbar und zeigen ein kleinflächiges Vegetationsmosaik. Auf 1 ha hochgerechnet ergibt sich ein Zeitbedarf von 6 Stunden. 108 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vegetation / Flora 3.4.7 Wasserstufenkartierung 3.4.7.1 Bioindikation Wasserstufen dienen der Beurteilung des Flächenwasserhaushalts auf Graslandstandorten. Die ausgewiesenen Wasserstufen sind durch durchschnittliche Grundwasserstände hinterlegt. Wechselfeuchtigkeit ist zusätzlich ausgewiesen. 3.4.7.2 Methodik Zur Feststellung der Wasserstufe bedient man sich der vorkommenden Gefäßpflanzenarten. Die Methode ist beschrieben bei KOEPKE et al. (1985) und KOEPKE (1989). Diese wird in der ÖUB weiterhin benutzt, da zu Beginn der Ersteinrichtung noch keine Neubearbeitung der Methodik vorlag. Für die Feucht- und Frischwiesen liegt eine Neubearbeitung mit Modifizierungen der Methodik von SUCCOW & JOOSTEN (2001) vor. Diese wird im Vergleich im Jahr 2006 (Feuchtgrünland BR Spreewald) getestet und danach über das weitere Vorgehen entschieden. In jeder andersartigen Vegetationsausbildung (z.B. auffälliger Wechsel von Arten, starke Verschiebung von Dominanzen) werden alle Arten notiert (ohne Berücksichtigung des Deckungsgrades bzw. der Häufigkeit). Die Auswertung erfolgt anhand der Literatur entnommenen Daten zur Wasserstufenamplitude der einzelnen Arten. Zur Auswertung werden alle Arten einer Vegetationsausbildung untereinander aufgelistet und deren Amplitude bezüglich der Wasserstufen durch Kreuze dargestellt. Für jede Wasserstufe werden die aufgelisteten Kreuze addiert. Der höchste gefundene Wert kennzeichnet die Wasserstufe der jeweiligen Vegetationseinheit (SUCCOW in KOEPKE 1989). Die ausgewiesenen Wasserstufen sind in der Literatur (SUCCOW 1988, SUCCOW & JOOSTEN 2001) durch durchschnittliche Grundwassergänge hinterlegt (vgl. Tabelle 8). Für geübte Kartierer ist diese relativ aufwendige Vorgehensweise nicht mehr notwendig. Durch die Betrachtung der Gesamtheit der Arten kann bereits im Gelände die jeweilige Wasserstufe in einer Geländeskizze eingetragen werden. Bei der Ansprache der Wasserstufe muss der Kartierer entscheiden, welche der gefundenen Arten nur noch reliktisch vorhanden sind und welche die aktuellen Wasserverhältnisse widerspiegeln. Beispielsweise zeigen bei Wiedervernässung viele Arten ein hohes Beharrungsvermögen. 109 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vegetation / Flora Tabelle 8: Definition der Wasserstufen grundwasserbeeinflusster Standorte, nach SUCCOW (1988) Bezeichnung Verbale Beschreibung Mittlerer Grundwassserstand [cm] im Frühjahr im Sommer 5+ nass ca. 30 – 0 über Flur ≤ 20 unter Flur 4+ sehr feucht bis halbnass (stark grundwasserbeherrscht) ca. 0 – 20 unter Flur ca. 0 – 25 unter Flur 3+ feucht (grundwasserbeherrscht) ca. 10 – 20 unter Flur ca. 20 – 45 unter Flur 2+ mäßig feucht (grundwasserbestimmt) ca. 20 – 40 unter Flur ca. 45 – 65 unter Flur 1 frisch k.A. k.A. 2- mäßig trocken (grundwasserbeeinflusst) ca. 30 - 60 unter Flur ca. 70 - 120 unter Flur 3- trocken (schwach grundwasserbeeinflusst) ca. 70 - 90 unter Flur ca. 100 - 150 unter Flur über Flur ca. 60 - 100 unter Flur k.A. k.A. 4+/2- wechselnass 3+/2- wechselfeucht 2+/- mäßig wechselfeucht ca. 0 – 60 unter Flur ca. 40 - 120 unter Flur 3+/- wechseltrocken ca. 40 – 80 unter Flur ca. 100 - 150 unter Flur 2+/3- mäßig wechseltrocken ca. 50 - 90 unter Flur ca. 100 - 150 unter Flur Wasserstufen grundwasserferner Standorte, nach SUCCOW (1988): 2- (mäßig trocken) 3- (trocken) 4- (sehr trocken) 5- (dürr) Zusätzlich zur vorhandenen Literatur wird festgelegt (LUTHARDT mündlich 1999): Wasserstufe 4+ ergibt sich, wenn feuchtigkeitsliebende Großseggen-Arten mit mehr als 50 % Deckung vorkommen. Wasserstufe 4+/2-, 3+/2- bzw. 2+/2- ergeben sich beim dominanten Auftreten einer oder mehrerer der folgenden Arten: Potentilla anserina, Ranunculus repens, Glechoma hederacea. Mit Hilfe von Fluchtstangen wird die Monitoringfläche zur besseren Orientierung in 25 m x 25 m große Quadrate unterteilt. Durch Geländebegehung wird die gesamte Fläche abgelaufen und die Grenzen der einzelnen Vegetationsausbildungen, die vor allem an den dominierenden Arten festgemacht werden, in eine Geländeskizze (Topographische Karte 1:5000) eingetragen. Wo möglich, werden zur erhöhten Genauigkeit die Flächen gleicher Wasserstufe mit Hilfe eines Rucksack-GPS eingemessen. Wenn bereits eine Karte der Vegetationszonierung der betreffenden Monitoringfläche vorliegt, können anhand dieser die Wasserstufen direkt übertragen werden, da die Karte der Wasserstufen eine Vergröberung darstellt. 110 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.4.7.3 Vegetation / Flora Zeitbedarf Der Zeitbedarf ist in erster Linie abhängig von der Flächengröße und der Homogenität der Fläche. Bei mittlerer Homogenität ergibt sich inklusive Abstecken mit Fluchtstangen ein Zeitbedarf von ca. 1 Tag für 5 Hektar. 3.4.8 Bestimmung der oberirdischen Phytomasse 3.4.8.1 Bioindikation Fragen des Nährstoffstatus spielen eine große Rolle für eine nachhaltige Landbewirtschaftung zum einen, für die Artenvielfalt und das Artengefüge zum anderen und für die Stoffflüsse in der Landschaft zum dritten. Sie dient ferner zur Beurteilung der Produktivität des Standorts und ist ein Maß für die Struktur und Dichte des Bestandes, die ihn als Lebensraum für die Fauna charakterisiert. Daher wird es für die als Grasland genutzten Standorte zur Ermittlung der Nährstoffverfügbarkeit die Biomasseproduktion erfasst, da die Nährstoffverfügbarkeit allein aus den Bodenanalysewerten oftmals nicht abzulesen ist. 3.4.8.2 Methodik Die Lage der Beerntungs-Quadrate sollte sowohl in der Nähe der Vegetationsaufnahme als auch in der Nähe der Flächen für die faunistischen Aufnahmen liegen. Somit können Aussagen bezüglich der Zusammenhänge zwischen Fauna und Quantität bzw. Struktur der Phytomasse gewonnen werden. An 5 Stellen außerhalb der Vegetationsaufnahme-Flächen werden repräsentative Quadrate (100 cm x 100 cm) ausgewählt. Hier soll die Vegetation möglichst so wie in der Vegetationsaufnahme beschaffen sein. Die Quadrate werden nicht eingemessen oder markiert, sondern jeweils vom Bearbeiter selbst ausgesucht. Hierdurch wird vermieden, dass jedes Mal durch die Beerntung die gleiche Fläche vorzeitig gemäht wird, wodurch sich Änderungen in der Vegetation ergeben können. Ein mitgeführter Rahmen von 100 cm x 100 cm wird auf den Boden gelegt, und die gesamte oberirdische Phytomasse innerhalb des Rahmens geerntet (Sichel, Sense oder Rasenkantenschere) wobei die Schnitthöhe 3-5 cm beträgt. Das Frischgewicht wird im Gelände mit einer transportablen Waage ermittelt. Anschließend wird der Mittelwert der 5 Proben errechnet. Der Mittelwert (in g/m²) wird auf kg/ha umgerechnet (x 10). Von den 5 Proben werden jeweils eine repräsentative Mischprobe entnommen (ca. 1-1,5 kg) und in frischem Zustand erneut ausgewogen. Diese Mischproben werden bei 80°C im Trockenschrank getrocknet und erneut gewogen, um die Trockenmasse zu bestimmen (MÜHLENBERG 1993: 28). Die Entnahme der oberirdischen Phytomasse erfolgt (relativ kurz) vor dem ersten Schnitt bzw. ersten Viehauftrieb. Der Zeitpunkt hierfür ist je nach Ökosystemtyp zwischen Anfang Mai und Ende Juni. 111 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Vegetation / Flora 3.4.8.3 Zeitbedarf 2 Im Gelände werden für Ernte und Abwägen für 5 Teilflächen à 1m ca. 4 Stunden benötigt. Die Laborbearbeitung umfasst ca. 30 min. 3.4.9 Bestimmung der Pflanzeninhaltsstoffe Stickstoff, Phosphor und Kalium 3.4.9.1 Bioindikation Im Boden lassen sich Aushagerungs- und Eutrophierungstendenzen erst mit großer Zeitverzögerung und in abgeschwächter Form nachweisen. Schneller reagiert die Vegetation (Vergesellschaftung der Arten) auf Änderungen im Nährstoffhaushalt. Noch bevor Umschichtungen in der Vegetation stattfinden, reagieren die Pflanzen auf Standortveränderungen bereits durch geänderte Inhaltsstoffe (HARTER 1998: 161). Da die ÖUB auch eine Frühwarnfunktion erfüllen soll, ist die Einführung dieses Parameters unerlässlich. 3.4.9.2 Methodik Im Labor wird das Schnittgut zum Trocknen ausgebreitet, zwei mal gewendet und nach vollständiger Lufttrocknung Mischproben entnommen, die erneut gewogen werden. Von der luftgetrockneten Phytomasse (siehe Kap. 3.4.8) werden ca. 80 bis 100 g entnommen und auf 2 mm Korngröße zerkleinert (z.B. Hochleistungs-Schneidmühle Typ SM 2000). Anschließend werden von dem Probenmaterial mit Korngröße 2 mm 5 - 10 g entnommen und auf 0,5 mm zerkleinert (z.B. UltraZentrifugal-Mühle Typ ZM-1). Der Gehalt an Nt wird im Labor durch direkte Messung am CNS-2000Elementaranalysator festgestellt (simultane Bestimmung). Zur Ermittlung von Pt und Kt fand im Jahr 2006 ein Methodenwechsel statt. Nach dem neuen Verfahren erfolgt eine Laboranalyse durch Extraktion mit Salpetersäure-Druck-Aufschluss nach HFA* B 3.2.1 und anschließend eine Auswertung mittels Induktiv-gekoppeltem Plasma-Spektrofotometer (ICP, nach HFA* Teil D). Vor dem Wechsel wurde anstelle des Salpetersäure-Druck-Aufschlusses mit dem KönigswasserAufschluss extrahiert (nach DIN 38414-S7). 3.4.9.3 Zeitbedarf Die Zerkleinerung auf 2 mm dauert ca. 15 min / Probe, die folgende Zerkleinerung auf 0,5 mm ca. 10 min / Probe. Der Zeitbedarf zur Ermittlung von Pt und Kt beträgt 1 Std. / Probe. Für die Analyse von Nt werden 10 min / Probe benötigt. * HFA – Handbuch Forstliche Analytik 2005, www.bmelv.de 112 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna 3.5 Fauna 3.5.1 Allgemeines Vorgehen Der Einsatz faunistischer Indikationsmethoden ist auf der Ebene dieser sektorübergreifenden ökologischen Umweltbeobachtung von hoher Bedeutung. Im allgemeinen sind die ökologischen Ansprüche von Tieren und Pflanzen nicht vollständig deckungsgleich. Tiere besitzen eine mehr oder minder ausgeprägte Mobilität und benötigen in vielen Fällen ein Nebeneinander unterschiedlicher Vegetationstypen (HEUBLEIN 1983, zit. in HÄNGGI 1989). Bei vielen Indikatorgruppen handelt es sich gegenüber bestimmten ökologischen Parametern nicht um Bioindikatoren im engeren Sinne. Aus dem Fehlen spezifischer Arten lassen sich oftmals nicht von vornherein Rückschlüsse auf die Qualität eines Standortes ziehen. Ihr Vorkommen ermöglicht jedoch durch ihr Anspruchsverhalten gegenüber äußeren Faktoren (u. a. Vegetationsstruktur, Insolation, Bewirtschaftungsintensität) eine ökologische Charakterisierung unterschiedlicher Biotoptypen als Biodeskriptoren (vgl. KLEINERT 1991). 3.5.2 Vorgehen zur Auswahl der Tiergruppen Verbunden mit der für viele Tiergruppen vergleichsweise aufwendigen Erfassung bzw. Determination, entsteht ein hoher zeitlicher und finanzieller Aufwand. Das führt im Rahmen eines langfristig angelegten Monitorings zu der Situation, dass nicht alle als grundsätzlich sinnvoll und geeignet erscheinenden Organismengruppen eingebunden werden können. Ziel des faunistischen Monitorings im Rahmen der ÖUB ist deshalb die Erhebung mehrerer sich gegenseitig in ihren Aussagen sinnvoll ergänzender faunistischer Artengruppen mit unterschiedlichen Anspruchstypen, der Besiedlung unterschiedlicher Straten bzw. Stellungen in der Nahrungspyramide und Mobilitätsgraden (vgl. z. B. BFN 2000, MÜHLENBERG 1993, RECK 1990, 1992, RIECKEN 1992a, 1992b, ZUCCHI 1990). Im räumlichen Verbund mit vegetations- und bodenkundlichen Untersuchungen sowie Witterungsund Nutzungsdaten ermöglichen sie ein differenziertes Erfassen und Bewerten von Änderungstendenzen innerhalb des Ökosystems und seiner Biozönosen. Nachfolgend werden die Kriterien aufgeführt, die für die Auswahl der spezifischen Faunengruppen von grundlegender Bedeutung waren: • Hoher Indikationswert als Biodeskriptor für die Stabilität bzw. Dynamik von Ökosystemen. • Überdurchschnittlich gut bekannte ökologische Kenntnisse über die Gruppen. • Indikation von Sachverhalten (z. B. Strukturvielfalt), die über abiotische Parameter nicht oder nur sehr aufwendig zu erfassen sind. • Indikation auf topischer Betrachtungsebene (kleiner bis mittlerer Flächeneinheiten). • Ergänzendes Repräsentieren unterschiedlicher Teillebensräume, Straten bzw. Trophiestufen. • Möglichst größerer Artenreichtum bzw. ökologische Spanne von Anspruchstypen. • Artengruppen mit unterschiedlicher Ausbreitungsfähigkeit. • Übergreifend in mehreren Ökosystemkomplexen einsetzbar. • Weitgehend objektivierbare (z. B. wechselnde Bearbeiter) und finanzierbare Erfassbarkeit in einem langfristig orientierten Monitoring, u. a. durch sinnvolle Synchronisierung der Erfassungsmethoden und -zeiträume unterschiedlicher Gruppen. 113 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna Bei Artengruppen mit gleichwertiger Aussagekraft (ähnliche Anspruchstypen, vergleichbarer Kenntnisstand zu Vorkommen, Verbreitung und Ökologie) stellen die methodische Erfassbarkeit und die Personalsituation (Fachbearbeiter) wichtige Auswahlkriterien für das Monitoring dar (vgl. u.a. RECK 1990, 1992). Kapitel 3.5.3) zeigt die Auswahl der Tiergruppen im Rahmen des faunistischen Monitorings der Ökosystemaren Umweltbeobachtung für die Ökosystemgruppen des terrestrischen Offenlandes. Die faunistischen Erhebungen erfolgen mit vorrangig halbquantitativen Methoden. Für die mit Freilandmethoden relativ einfach zu erfassenden Tiergruppen (Heuschrecken, Libellen, Tagfalter / Widderchen) wird ein hierarchisch gestaffeltes System mit unterschiedlichen Flächenbezügen angewendet. So werden diese Gruppen zum einen auf definierten Probeflächen ausgewählter Standorteinheiten sowie zur Ermittlung des Gesamtarteninventars auf der gesamten Monitoringfläche erfasst. Nachfolgend wird die methodische Vorgehensweise zur Erfassung der faunistischen Auswahlgruppen und wichtiger Begleitparameter im Rahmen der Ökosystemaren Umweltbeobachtung vorgestellt. Daneben werden Angaben zur Bioindikation durch die einzelnen Gruppen gemacht. 114 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna 3.5.3 Tabellarische Übersicht der Erfassungszeiträume für die faunistischen Monitoringgruppen in den einzelnen Ökosystemen Tabelle 9: Tabellarische Übersicht der Erfassungszeiträume für die faunistischen Monitoringgruppen in den einzelnen terrestrischen Ökosystemgruppen Entwässertes Niedermoor und Grasland Heuschrecken Tagfalter Laufkäfer Libellen 1 Amphibien M/E4 M/E4 Naturnahe Moore 1 Regenwürmer Libellen Tagfalter Äcker Heuschrecken Amphibien Laufkäfer Regenwürmer M4/A6 A/M4 A/M5 M5/M6 M7/A8 M8/A9 M/E4 M/E5 M/E5 M/E5 M/E5 M6 A/M6 A/M6 M6 A/M5 M5/A6 M5/A6 M6/A7 E6/A7 M 8 / (A 9) M/E7 M/E7 A/M9 A/M8 A/M8 A/M7 A/M7 E7/M8 A/M8 M 9 / (A 10) M4/A6 M 9 / A 11 M5/M6 M5/A6 M/E5 E6/A7 A/M6 E7/M8 E8/A9 M8/A9 A/M9 M9/A 10 A / M / E: Anfang / Mitte / Ende + Angabe des Monats (): suboptimaler Erfassungszeitpunkt 1 In Meliorationsgräben 115 M 9 / A11 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna Anmerkungen zu grundsätzlichen Anforderungen an die Erfassungszeiträume: • Optimale Erfassungsperioden für die spezifischen Monitoringgruppen. • Synchronisierung der Erfassungszeiträume unterschiedlicher Faunengruppen (Optimierung von Zeitund Kostenaufwand). • Prioritäre Anpassung an zwingend erforderliche Monitoringgruppen. • Angabe zeitlicher Erhebungsspannen (A / M ≤ 20 Tagen) in Abhängigkeit von jahresspezifischer Phänologie und aktuellen Witterungsbedingungen sowie unter Berücksichtigung der zeitlich parallelen Bearbeitung mehrerer Monitoringflächen. • Einhaltung einer Mindestzeitspanne von wenigstens 10 Tagen zwischen den einzelnen Begehungen. 3.5.4 Grundsätzliche Witterungsvoraussetzungen für eine reguläre faunistische Erfassung Die Aktivitätsrate von Tieren ist mehr oder weniger eng an äußere Witterungseinflüsse und Tageszeiten gebunden. Für die Standardisierung einer semiquantitativen Erfassung von Heuschrecken fordert z. B. POLLARD (1977, zit. in MÜHLENBERG 1993) windarmes Wetter sowie Mindesttemperaturen von 13°C (bei mindestens 60% Besonnung) bzw. von > 17°C bei höherer Bewölkung. Voraussetzung für die Flugaktivität der meisten mitteleuropäischen Libellenarten sind Lufttemperaturen von etwa (12-) 16-30 °C. Als Optimum werden für die meisten Arten Lufttemperaturen von etwa 20-25 (27) °C bezeichnet. Von wesentlicher Bedeutung ist auch die Intensität der zugleich vorherrschenden Sonneneinstrahlung. So ist bei gleicher Umgebungstemperatur die Aktivität bei sonniger Witterung deutlich höher als bei bewölktem Himmel (vgl. STERNBERG & BUCHWALD 1999). Um den Einflussfaktor aktueller Witterungsverhältnisse bei der semiquantitativen Erfassung der Tagfalter / Widderchen, Heuschrecken, Libellen und Amphibien 13 zu minimieren, sollten alle Kartierungen klimatische Mindestvoraussetzungen erfüllen. Bei jeder Erhebung dieser Gruppen werden Kurznotizen zum aktuellen Bewölkungsgrad, zur Temperatur und zu den Windverhältnissen gemacht. In Anlehnung an ULRICH (1995, vgl. MÜHLENBERG 1993) erfolgt für die witterungsgebundene Erfassung (z. B. Transekt-Methode) der Tagfalter / Widderchen, Heuschrecken und Libellen eine 3-stufige Beurteilung der aktuellen Witterungsbedingungen (siehe Tabelle 10). 13 Bemerkungen zu geeigneten Witterungsvoraussetzungen für die Amphibien-Kartierung finden sich in Kap 3.5.6.6.2. 116 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna Tabelle 10: Witterungsverhältnisse als Einflussfaktoren für reguläre Untersuchungsbedingungen bei faunistischen Erfassungen (nach ULRICH 1995, geändert) Sonne + sonnig o heiter - wolkig - bedeckt Temperatur + 24 - 28 °C o 17 - 23 °C, bzw. > 28 °C - < 17 °C Wind + windstill - leichter Wind o leichter - mittlerer Wind - starker Wind Zur Beurteilung der aktuellen klimatischen Gesamtbedingungen für die Bewertung regulärer Untersuchungsbedingungen erfolgt eine Aufsummierung der 3 Witterungsparameter. Witterungsbedingungen: +++/++ + sehr gut gut o mäßig -/--/--- schlecht (Erfassung nach- bzw. wiederholen) Als unterer Grenzwert für reguläre Untersuchungsverhältnisse gilt bei der Erfassung der Tagfalter-, Libellen- und Heuschreckenkartierung die Summen-Stufe ”o” 14. Sind die klimatischen Gesamtbedingungen noch schlechter, sollten die Untersuchungen in der Folgezeit nach- bzw. wiederholt werden. In Grenzfällen lassen sich die einzelnen Einflussfaktoren tendenziell gegeneinander abwägen. Dabei sollte jedoch keiner der Faktoren eindeutig schlechter als „o“ sein. Die aktivitätsgebundene tageszeitliche Aufnahmespanne erstreckt sich in Abhängigkeit der aktuellen Witterung von ca. 10.30 Uhr bis 18.00 Uhr. 14 Bei der Generalisierung der klimatischen Mindestvoraussetzungen ist zu berücksichtigen, das z. B. die Flugaktivität der meisten Tagfalterarten temperatursensibler ist als die vieler Libellenarten oder die Rufaktivität von Heuschrecken. 117 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna 3.5.5 Vegetationsstrukturerhebung bei der Laufkäfer- und Heuschreckenerfassung 3.5.5.1 Bioindikation Die Ausbildung der Vegetationsstruktur ist für das Vorkommen verschiedener Arthropoden-Zönosen von grundlegender Bedeutung (vgl. u.a. SÄNGER 1977, OPPERMANN1989). Durch die Bestimmung der Vegetationsdichte in abgestuften Vegetationshöhen lassen sich somit wichtige Rückschlüsse auf Wechselbeziehungen mit dem Vorkommen der untersuchten Faunengruppen in den Probeflächen (insbesondere Heuschrecken, Laufkäfer, Tagfalter) ziehen. Die Raumstruktur der Vegetation unterliegt dabei einer jahreszeitlichen Dynamik und steht in Abhängigkeit zu den Standortverhältnissen und der Nutzung. Zur Bestimmung der Vegetationsdichte dienen unterschiedliche Schätzverfahren für die Deckungsgrade verschiedener Vegetationshöhen. Der Einsatz von Vegetations-Stratimetern (vgl. OPPERMANN 1989) bietet unabhängig vom Bearbeiter eine hohe Objektivität der Messungen, erfordert jedoch einen relativ hohen Kosten- und Arbeitsaufwand. Da die Erhebung der Strukturparameter zudem nur eine Momentaufnahme in Abhängigkeit von aktuellen Nutzungszeitpunkten und das Mittel für eine größere Probefläche darstellt, wird hier der weniger zeit- und arbeitsaufwendigen Schätzmethode der Vorzug gegeben. 3.5.5.2 Methodik Die Erfassung der Vegetationsstruktur erfolgt begleitend zur Transekt-Methode bei der Kartierung der Heuschrecken und an den Bodenfallenstandorten für die Laufkäfererfassung. Als Maß für die Dichte eines Vegetationsbestandes und somit für den Raumwiderstand wird die horizontale Durchsicht in 10, 30, 50 und 100 cm Höhe über der Erdoberfläche geschätzt. Als Hilfsmittel dient dabei ein nach unten hin offener Holzrahmen (Vegetationshürde). In den betreffenden Höhen befinden sich dünne Metallstäbe für die in einem jeweils 30 cm tiefen Vegetationsausschnitt in 10 % Schritten die horizontale Durchsicht geschätzt wird. Bei mehr als 70 % Durchsicht verringern sich die Schätzintervalle auf 5 % (vgl. FARTMANN 1997, OPPERMANN 1987). Ziel ist der Vergleich der Vegetationsstruktur verschiedener Probeflächen untereinander und im Rahmen einer langjährigen Dauerbeobachtung sowie ihr Einfluss als wichtiger Habitatstruktur-Parameter auf die Ausbildung spezifischer faunistischer Biozönosen. Darüber hinaus werden die Deckungsanteile der Vegetationsstrukturparameter mit Hilfe eines visuellen Schätzverfahrens in 5 %-Schritten erhoben (Formblatt siehe ANHANG). Für geschätzte Deckungsanteile zwischen 0-5 % bzw. 95-100 % erfolgt die Angabe durch < 5 % bzw. > 95 %. Die Anteile von stehendem Altgras und der Verfilzungsgrad werden jeweils 3 groben Schätzklassen zugeordnet. 118 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.5.5.3 Fauna Erfassungszeitraum Die Erhebung der Vegetationsstruktur erfolgt einmalig 15 für den Frühjahrsaspekt von Mitte Mai bis Anfang Juni zu einem Fallenleerungstermin bei der Laufkäfererfassung als Durchschnittwert im Bereich der Bodenfallenstandorte sowie einmalig für die %-Deckungsanteile (Ende Juli / Anfang August) bzw. bei Grünland zweimalig für die horizontale Durchsicht und die Altgras- und Verfilzung begleitend zur Heuschreckenerfassung mit der Transekt-Methode von Ende Juli / Anfang August bzw. Ende August / Anfang September. 3.5.5.4 Zeitaufwand Für die begleitende Erhebung der Vegetationsstruktur-Parameter werden bei einiger Übung 16 etwa 5 min veranschlagt. 15 Der Spätsommer- / Herbstaspekt der Vegetationsstrukturerhebung wird von den Heuschreckentransekten des Beobachtungstyps für die jeweiligen Bodenfallenstandorte übernommen. 16 Vor einer erstmaligen Erhebung der Vegetationsstruktur ist eine Abgleichung der visuellen Schätzungsmethode mit dritten Personen durchzuführen. 119 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna 3.5.6 Methodenbeschreibung und Bioindikation 3.5.6.1 3.5.6.1.1 Heuschrecken (Saltatoria) Bioindikation In Brandenburg leben 53 heimische Heuschreckenarten (KLATT et al. 1999), und für das Gebiet der Bundesrepublik Deutschland sind insgesamt 79 Arten nachgewiesen (DETZEL 1998). Die autökologischen Ansprüche der einzelnen Arten sind relativ gut bekannt (vgl. z. B. BELLMANN 1993a, DETZEL 1998, INGRISCH & KÖHLER 1998). Das Vorkommen bestimmter Heuschreckenarten und gemeinschaften bietet die Möglichkeit zur Charakterisierung und Bewertung der Ausbildung unterschiedlicher Biotoptypen. Die artspezifischen Habitatpräferenzen werden überwiegend durch das Mikroklima bestimmt (BELLMANN 1993a). Dieses wiederum setzt sich aus einer Kombination unterschiedlicher Standortfaktoren zusammen. BROCKSIEPER (1978) ermittelte als entscheidenden Einfluss auf die Verbreitung von Heuschrecken die Ausbildung und Faktorenkombination von Sonnenstrahlung, Bodenfeuchte, Windoffenheit, Steingehalt, nächtlicher Abkühlung und Pflanzendeckung. 3.5.6.1.2 Semiquantitative Bestandserfassung Die semiquantitative Erfassung der Heuschrecken erfolgt mit der Transekt-Methode durch Handfänge, Sichtansprache und Verhören entlang standörtlich abgegrenzter Probeflächen von jeweils 100 m². Zur effektiveren Erfassung der Arten, die leise bzw. in einem für das menschliche Ohr nicht wahrnehmbaren Frequenzbereich (> 20000 Hz) stridulieren, kommt dabei ein Ultraschallfrequenzmodulator (Bat-Detektor) zum Einsatz (vgl. u. a. FROEHLICH 1989). Je Dauerbeobachtungsstandort befinden sich in Abhängigkeit von der räumlichen Entfernung und standörtlichen Homogenität der beiden Bodenmessfelder im Umfeld der vegetationskundlichen Dauerquadrate 2 Transekte von je 100 m². Zusätzlich werden für jede Monitoringfläche ggf. 1 - 3 Transekte in wertgebenden und / oder dominanten Vegetationsbeständen ausgewählt. Die mit GPS vermessenen Anfangs- und Endpunkte der Transekte werden mit Stangen markiert und die Heuschrecken 3 m rechts und links davon auf 2 parallelen Streifen von jeweils 25 m Länge und 2 m Breite kartiert. Die unterschiedliche Strukturhomogenität bzw. Flächenausdehnung des jeweiligen Beobachtungstyps in den Monitoringflächen erfordert zudem eine Probeflächen-Variante mit 100 m² von 2x2x25 m. In Hochstaudenfluren und hochwüchsigen Großseggenriedern wird die Transektbreite aufgrund der geringen Überschaubarbeit auf jeweils 1 m festgelegt (Varianten: 2x1x50 m, 4x1x25 m). Zur vergleichenden Einschätzung der Individuendichten, der in den einzelnen Transektflächen des Untersuchungsgebietes nachgewiesenen Heuschreckenarten, wird mittels einer Zuordnung in Häufigkeitsklassen, wie sie BRUCKHAUS & DETZEL (1997) vorschlagen, eine semiquantitative Bestandserfassung vorgenommen. 120 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna Häufigkeitsklassen (Individuendichte / 100 m²): I: Einzelfund II: 2 - 5 Ind. III: 6 - 10 Ind. IV: 11 – 20 Ind. V: 21 – 50 Ind. VI: > 50 Ind. Die Angaben zu den relativen Häufigkeiten beziehen sich dabei auf die Individuenklassendichte / 100 m² Fläche in den jeweiligen Transektflächen und auf das Dichte-Optimum zur spezifischen Haupterfassungszeit der Imagines (vgl. INGRISCH & KÖHLER 1998). 3.5.6.1.3 Quantitative Bestandserfassung Als erforderlicher Parameter kommt in Kombination mit der Transekt-Methode in ausgewählten Graslandund genutzten Niedermoor-Ökosystemen im unmittelbaren Umfeld der vegetationskundlichen Dauerquadrate die Isolationsquadrat-Methode (”Fangkäfig”) zum Einsatz. Hierbei handelt es sich um ein mit reißsicheren Leinenstoff bespanntes, von einer einzelnen Person handhabbares, zusammenlegbares Gestell mit einer Grundfläche von 1 m² und einer Höhe von ≥ 80 cm (vgl. DORDA 1995). Das Isolationsquadrat wird auf die Vegetation geworfen und anschließend sorgfältig nach Heuschrecken abgesucht. Die häufig an die Seitenwände springenden Tiere werden mit der Hand abgesammelt. Um eine (annähernd) vollständige Erfassung abzusichern, wird die eingeschlossene Fläche solange abgesucht, bis etwa 60 sec. lang kein weiteres Tier gefunden wird (vgl. LAUßMANN 1999). Diese Methode bietet die Möglichkeit einer quantitativen Erfassung der Heuschrecken und somit auch der Veränderung von Individuendichten (INGRISCH & KÖHLER 1998). Um die Individuenzahlen der einzelnen Dauerbeobachtungsflächen miteinander vergleichen zu können, wird das Isolationsquadrat mit je 20 m² / Dauerquadrat auf allen Flächen gleich häufig gesetzt (vgl. z.B. DORDA 1995). 121 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.5.6.1.4 Fauna Gesamtarteninventar Für das ermittelte Gesamtarteninventar der Probeflächen des Beobachtungstyps 17 sowie der gesamten Monitoringfläche wird unter Berücksichtigung art- und gruppenspezifischer Individuendichten sowie der spezifischen Haupterfassungszeit (vgl. z. B. DETZEL 1998, INGRISCH & KÖHLER 1998) eine Einschätzung des Beobachtungsstatus (Bodenständigkeit) und die Einstufung in eine 5-stufige Häufigkeitsklassifikation vorgenommen: 1 (ss): Art auf Monitoringfläche / Probefläche sehr selten; ein bis sehr wenige Einzelfunde, vorwiegend an Sonderstrukturen gebunden bzw. Zufallsbeobachtungen / Gaststatus. 2 (s): Art auf Monitoringfläche / Probefläche selten; vereinzelt auf gesamter Fläche vorkommend und / oder auf kleine Areale (Sonderstandorte) beschränkt; hier jedoch stellenweise regelmäßig in geringen bis mittleren Individuendichten auftretend. 3 (z): Art auf Monitoringfläche / Probefläche zerstreut; auf der gesamten Fläche und / oder mehreren Teilarealen regelmäßig in geringen bis mittleren, gelegentlich auch höheren Individuendichten auftretend. 4 (v): Art auf Monitoringfläche / Probefläche verbreitet; auf der gesamten Fläche und / oder überwiegenden Teilarealen regelmäßig in mittleren bis hohen Individuendichten auftretend. 5 (h): Art auf Monitoringfläche / Probefläche häufig; auf der gesamten Fläche und / oder überwiegenden Teilarealen in hohen bis sehr hohen Individuendichten auftretend (Eudominanz). Wenn Arten auf der Monitoringfläche vorrangig oder ausschließlich auf Sonderstandorten bzw. nur randlich nachgewiesen werden konnten, so wird dies in der Datenbank gesondert vermerkt. Dabei ist auch die Nennung mehrerer Sonderstandorte möglich. Alle anderen Arten werden mit „t“ als flächentypisch gekennzeichnet. Angaben zum Hauptvorkommen bzw. zum Status: t: a: b: c: d: e: Flächentypisch Hochstaudenfluren (z. B. Grabenränder) und/ oder Gebüsche, Waldsäume, Feldgehölze (Krautbzw. Gehölzschicht) Trockenstandorte auf Feuchtwiesen (z. Teil randlich: z.B. trockene Wegsäume) Feuchtflächen (z. Teil genutzt) auf Trockenstandorten Torfmoosrasen (naturnahe Moore) Gast, offensichtlich zugewanderte (Einzel)Exemplare, zum Teil makropter Um das vollständige Inventar der Heuschrecken im Untersuchungsgebiet zu erfassen, sind aufgrund der sehr unterschiedlichen Lebensweise der einzelnen Arten verschiedene, sich ergänzende Methoden anzuwenden (vgl. BRUCKHAUS & DETZEL 1997). 17 Integriert Nachweise von Arten, die phänologisch bedingt nur außerhalb der 2 TransektAufnahmetermine erfasst (insb. Tetrigidae und Gryllidae) bzw. nicht unmittelbar in Probeflächen, z.B. jedoch wenige Meter benachbart, verhört bzw. gesichtet wurden. 122 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna In Einzelfällen kann für die ergänzende Erfassung gehölzbewohnender Arten in gehölzbeeinflussten Bereichen (z. B. naturnahe Moore) die Klopfmethode 18 eingesetzt werden. Hierbei werden Äste von Feldhecken, Feldgehölzen, Solitärgehölzen und angrenzenden Waldsäumen mit Hilfe eines stabilen Stockes abgeklopft und die Tiere in einem Klopfschirm (z. B. umgedrehter Regenschirm) aufgefangen (vgl. MÜHLENBERG 1993, BRUCKHAUS & DETZEL 1997). Ergänzend erfolgt eine qualitative Auswertung der Bodenfallen-Beifänge für die Ermittlung des Artenspektrums auf den Dauerbeobachtungsflächen. Die mitteleuropäischen Heuschreckenarten lassen sich im Allgemeinen anhand morphologischer bzw. gesangspezifischer Merkmale im Freiland bestimmen. Zur Nachweissicherung „kritischer Funde“ sollten Belegaufnahmen bzw. die Mitnahme einzelner Belegexemplare erfolgen. Bei gesangsaktiven Arten empfiehlt sich auch die Anfertigung von Tonbandaufzeichnungen und ihre Identifizierung mit Hilfe eines Tonträgers für Heuschrecken-Gesänge (z. B. BELLMANN 1993b). 3.5.6.1.5 Erfassungszeitraum Die Erhebung des Gesamtarteninventars auf der Monitoringfläche und des spezifischen Beobachtungtyps erfolgt an insgesamt 2 Geländeterminen von Anfang / Mitte Juli bis Anfang September (vgl. Übersicht zu Erfassungsperioden in Kapitel 3.5.3). Die Aufnahme nach der Transekt-Methode erfolgt auf den Probeflächen zweimalig (Ende Juli / Anfang August sowie Ende August / Anfang September). Die quantitative Bestandserfassung mit dem Isolationsquadrat findet einmalig Ende Juli / Anfang August statt. Für den Nachweis von Tetrix spp. (Dornschrecken) und Gryllus campestris (Feldgrille) ist zusätzlich eine Frühjahrsbegehung als Nebenbeobachtung im Rahmen der Tagfalter- bzw. der Laufkäfererfassung im Mai / Juni notwendig. 3.5.6.1.6 Zeitbedarf Für die einmalige Durchführung der Transekt-Methode werden inklusive der Vegetationsstruktur-Messung ca. 35 - 50 min veranschlagt. Bei zweimaliger Aufnahme ergibt sich damit in Abhängigkeit der Untersuchungsflächen mit 3 - 5 Transekt-Probeflächen ein Zeitbedarf von 4 - 6 Stunden. Die quantitative Erfassung mit dem Isolationsquadrat erfordert je nach Individuendichte, Vegetationshöhe und -Struktur zwischen 30 und 45 min / 20 m². Die parallele Erfassung des Gesamtarteninventars der Probeflächen und der Monitoringfläche nimmt bei mittlerer Flächengröße unter Einsatz eines Ultraschall-Detektors zusätzlich pro Untersuchungsjahr etwa 2 3 Stunden in Anspruch. 18 Betrifft in Brandenburg vorrangig Meconema thalassinum. Die meisten heimischen arbusticolen (strauch-) /arboricolen (baumbewohnenden) Arten lassen sich vorteilhafter durch Verhören (Leptophyes spp. mit Bat-Detektor) nachweisen. 123 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.5.6.2 3.5.6.2.1 Fauna Tagfalter und Widderchen (Rhophalocera und Zygaenidae) Bioindikation Nach SETTELE et al. (1999) sind für die Bundesrepublik Deutschland (Stand: 1. Juni 1998) 193 Tagfalterarten bekannt. In Brandenburg ist das Vorkommen von insgesamt 117 Tagfalter- bzw. 14 Widderchenarten nachgewiesen von denen für 21 Arten bzw. 1 Art keine aktuellen Fundmeldungen nach 1980 mehr vorliegen und diese somit als „Ausgestorben oder verschollen“ gelten (GELBRECHT et al. 2001). Bestandsaufnahmen zur Tagfalterfauna zählen auf verschiedenen Ebenen der Landschaftsplanung zum Standardprogramm für Belange des Arten- und Biotopschutzes (vgl. FINCK et al. 1992, RECK 1992). Tagfalter und Widderchen repräsentieren unterschiedliche Anspruchstypen innerhalb der phytophagen Fauna. Neben der Bindung an bestimmte Futterpflanzen steht das Vorkommen vieler Arten in Abhängigkeit verschiedener Faktoren wie dem Mikroklima, der Flächengröße, dem räumlichen Verbund von Teilhabitaten oder auch der Existenz spezifischer Wirtsameisen für Bläulinge (Lycaenidae). Die meisten Arten reagieren sensibel auf Habitatveränderungen, wie sie durch Nutzungsintensivierungen oder Biotopzerstörungen verursacht werden (HERMANN 1992). Nach EBERT & RENNWALD (1991) haben infrastrukturelle Veränderungen, wie die Erweiterung des Siedlungsraumes und des Verkehrsnetzes sowie Flurbereinigungs- und Intensivierungsmaßnahmen in der Land- und Forstwirtschaft zu überregionalen Populationsrückgängen geführt. Das Vorkommen bestimmter Arten innerhalb ihres natürlichen Verbreitungsgebietes charakterisiert so eine bestimmte Ausbildung des betreffenden Biotops und ist somit für die Beurteilung von Flächen hinsichtlich der Belange des Arten- und Biotopschutzes geeignet (THOMAS 1991, zit. in HERMANN1998). Bioindikation durch Präimaginalstadien Von hoher indikatorischer Bedeutung ist der Nachweis der Bodenständigkeit durch Eiablagebeobachtungen oder Funde der Präimaginalstadien einer spezifischen Falterart im Biotop. Viele Arten sind im Präimaginalstadium hochspezialisiert, während sie im adulten Stadium eher zum Generalismus neigen (THOMAS 1991, zit. in HERMANN 1998). So wurden in einer Reihe von Untersuchungen zu extrem gefährdeten Arten Veränderungen der Larvalhabitate als entscheidende Rückgangsursache ermittelt (u.a. THOMAS 1980, WARREN 1991 beide zit. in HERMANN 1998). Die Qualität und Ausdehnung geeigneter Entwicklungsstätten ist somit für das Vorkommen und die Häufigkeit vieler Arten wichtiger als die Saughabitate der Imagines (HERMANN 1998). Bei einigen Tagfalterarten lassen sich die Präimaginalstadien zuverlässiger und zeitsparender nachweisen als ihre Imagines. In einer tabellarischen Zusammenstellung von HERMANN (1998) werden 45 % der heimischen Falterfauna als "gut" bis "sehr gut" erfassbar anhand ihrer Eier- und Raupensuche bezeichnet. Ihre Individuendichte ist in der Regel um das 10- bis 100fache höher als bei den Faltern. Ein weiterer Vorteil liegt in der Witterungsunabhängigkeit bei der Bestandsaufnahme der Eier und Raupen (HERMANN 1998, SETTELE et a. 1999). 124 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.5.6.2.2 Fauna Generelle Methodik Eine streng lineare Transekterfassung von Tagfaltern mit üblicherweise zwischen 5 und 10 m breiten und damit gerade noch überschaubaren Streifen (vgl. z. B. STEFFNY 1982, MÜHLENBERG 1993) ermöglicht einen hohen Standardisierungsgrad mit einer Minimierung des Bearbeitereinflusses. Voraussetzung hierfür ist, dass die Untersuchungsflächen jedoch auf größerer Strecke weitgehend homogen ausgebildet sind und eine Mindestprobenflächengröße von wenigstens 0,25 ha nicht unterschreiten. Werden beispielsweise, wie bei den im Rahmen dieser Untersuchung überwiegend von kleinflächigen Standortwechseln charakterisierten Trockenrasenstandorten, Teilabschnitte von 30 m Länge und 10 m Breite ausgegrenzt, so führt dies zu einer Probeflächengröße von lediglich 0,03 ha. Ein entscheidender Nachteil entsteht durch das mögliche Übersehen oder das im selben Habitat (Probefläche) jedoch unmittelbar an den Linientransekt angrenzende Vorkommen naturschutzfachlich bzw. bioindikatorisch wertgebender Arten. Um so mehr wenn diese artspezifisch bedingt nur niedrige Flugdichten und / oder geringe Mobilitäten aufweisen bzw. auf spezifische Rand- oder Teilstrukturen der Probeflächen angewiesen sind. Die Methodik im Rahmen der ÖUB versucht, parallel zum Anspruch einer weitgehenden Standardisierung, diese Fehlergröße durch das Ausweisen flächiger Probeflächen zu minimieren. Die Tagfalter- und Widderchenarten werden semiquantitativ innerhalb standörtlich abgegrenzter Probeflächen von mindestens 0,25 (bis etwa 2) ha durch repräsentatives schleifenförmiges Begehen auf jeweils 2x5 m breiten Streifen durch die Transekt-Methode 19 erfasst (vgl. MÜHLENBERG 1993, SETTELE et al. 1999, STEFFNY 1982 u. a.). Bei linienförmig homogenen Probeflächen entlang von Grabenstrukturen und Flächensäumen verringert sich in Abhängigkeit von der räumlichen Ausdehnung die Streifenbreite auf 5 m. Die Probeflächen werden von einem erfahrenen Fachbearbeiter solange abgegangen, bis über einen Zeitraum von 15 - 20 min keine weiteren Arten mehr gefunden werden (vgl. HERMANN 1992, SETTELE et al. 1999). Auf jeder Monitoringfläche befinden sich einschließlich der Dauerbeobachtungsstandorte mit dem jeweiligen Beobachtungstyp insgesamt 1-3 Probeflächen. Die Auswahl und Abgrenzung der Probeflächen erfolgt unter Berücksichtigung der für die jeweilige Untersuchungsfläche wertgebenden (tagfalterrelevanten) Strukturen und / oder bestandsbildenden Vegetationsbestände (vgl. z. B. HERMANN 1992, SETTELE et al. 1999). Die Determination erfolgt im Freiland durch Sichtansprache sowie gezielte Kescherfänge mit anschließendem Wiederfreilassen. In wenigen Ausnahmefällen (Melitaea spp., Pyrgus spp., Zygaena purpuralis / minos) sind zur Artbestimmung der Imagines genitalmorphologische Untersuchungen erforderlich. Voraussetzung für optimale Erfassungsgrade der Imagines stellt eine sonnige, warme und windarme Witterung dar (HERMANN 1998). Zur Standardisierung der Methodik gelten die in Tabelle 10 angegebenen Witterungsbedingungen. Ergänzend erfolgt auf den Probeflächen und der Monitoringfläche eine stichprobenartige Suche nach den Präimaginalstadien der Arten. Die gezielte Ei-, Raupen- und Puppensuche in geeigneten Habitatstrukturen 19 Die relativ groben Schätzklassen (vgl. Häufigkeitsschlüssel für Probeflächen) ermöglichen dabei eine vergleichbare Häufigkeitseinschätzung der Falterarten, ohne die in standörtlich einheitlichen Probeflächen notwendige „Totalbegehung“. Der Zeitaufwand steigt deshalb neben der Flächengröße insbesondere auch mit Zunahme der Strukturvielfalt innerhalb der Probefläche. Besondere Bedeutung besitzen biodeskriptiv/ wertgebende Habitatstrukturen für (stenöke) Arten mit spezifischen Ansprüchen an die Biotopausbildung. Hierzu bietet die flächenspezifische Ist Zustandsanalyse eine wichtige Datengrundlage. 125 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna sowie Eiablagebeobachtungen ermöglicht den Bodenständigkeitsnachweis und erhöht so den Aussagewert über die Wertigkeit des Lebensraumes für die jeweilige Falterart. Gesondert notiert werden auch Paarungsund Balzflugbeobachtungen sowie Arten die eine Probefläche eindeutig nur überflogen haben (Überflieger): Bz: K: Eb: Ef: P: R: Ü: +: Balzflug Kopula Eiablage Eifund (ohne vorherige Eiablagebeobachtung) Puppenfund Raupenfund Überflieger einzelne Beobachtung ++: mehrfache Beobachtung 3.5.6.2.3 Semiquantitative Erfassung Bei den einzelnen Begehungen auf den Probeflächen werden die Individuenzahlen der beobachteten Falterarten notiert und nach dem Häufigkeitsschlüssel von ULRICH (1995) verschiedenen Schätzklassen zugeordnet. Tabelle 11: Häufigkeitsschlüssel für die Tagfaltererfassung auf Probeflächen (nach ULRICH 1995) Häufigkeitsstufe 1 2 3 4 5 6 Individuenzahl 1 2-5 6-10 11-20 21-50 51-100 7 8 101-250 251-500 9 >500 Die maximale Häufigkeit einer Art auf einer Probefläche bezieht sich auf die höchste im Untersuchungsjahr ermittelte Schätzklasse. Zur Einschätzung der relativen Siedlungsdichte für die Arten innerhalb der Probeflächen werden zusätzlich die von HERMANN (1992) vorgeschlagenen Häufigkeitsklassen notiert 20: E: I: II: III: Einzelindividuum innerhalb des Teillebensraumes (Probefläche) 1-4 Individuen / 100 m² an der / den Hauptfundstelle/n der Probefläche 5-10 Individuen / 100 m² an der / den Hauptfundstelle/n der Probefläche > 10 Individuen / 100 m² an der / den Hauptfundstelle/n der Probefläche Die Angabe zur relativen Häufigkeitseinschätzung spiegelt dabei die an der / den Hauptfundstelle/n der Probefläche angetroffenen Individuendichten ohne die Einbeziehung von Extremwerten wieder. Bei 20 Die Einstufung in bestimmte Häufigkeitsklassen und Siedlungsdichten auf den Probeflächen wird sich in vielen Fällen entsprechen (Bsp.: geringe Individuenzahlen führen in der Regel zu geringen Siedlungsdichten). Durch die Erfassung in Häufigkeitsklassen wird die spezifische Probefläche mit Untersuchungen in den Folgejahren besser vergleichbar und kann so detailliertere Hinweise auf Entwicklungen in der Fläche liefern. Daneben werden insbesondere Arten mit sehr niedrigen Individuenzahlen (aber > Einzelexemplar) besser darstellbar. Die Vorteile einer gleichzeitigen Abschätzung der Siedlungsdichten (als Basisdaten) liegen in einer geringeren Abhängigkeit vom spezifischen Bearbeiter sowie von Nutzungs- und Witterungseinflüssen. 126 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna mehrbrütigen Arten entspricht die angegebene Häufigkeitsklasse der maximal ermittelten Individuendichte im Untersuchungsjahr. Anmerkung Die Erfassung der gesehenen bzw. gefangenen Tiere umfasst bei halbquantitativen Erfassungsmethoden auch unter standardisierten Bedingungen jeweils nur einen unbekannten Anteil an der Gesamtpopulation. Für quantitative Einschätzungen sind populationsbiologische Untersuchungen (z. B. Fang- / Wiederfang) notwendig. Die an den einzelnen Begehungsterminen ermittelten Häufigkeiten stellen zudem lediglich Momentaufnahmen dar. Berücksichtigt man daneben aber auf Populationsdichte und -dynamik einflussnehmende ökologische Faktoren und Potenzen, wie z. B. artspezifische Lebensstrategien (vgl. tabellarische Übersicht bei SETTELE et al. 1999), so ermöglicht die Erfassung der Individuen-Schätzklassen und der relativen Siedlungsdichte durch 5 Begehungen eine gute Übersicht über die relativen Häufigkeiten der einzelnen Arten im Untersuchungsgebiet. Für die bei der Untersuchung auf den Probeflächen und auf der gesamten Monitoringfläche nachgewiesenen Arten wird eine 5-stufige Häufigkeitsklassifikation vorgenommen 21: 1 (E): Art auf Monitoringfläche / Probefläche sehr selten (Einzelfund) als Einzelexemplar nachgewiesen; vorwiegend an Sonderstrukturen gebunden bzw. Zufallsbeobachtung (Gast / im Überflug (Ü)). 2 (s): Art auf Monitoringfläche / Probefläche selten; (ein bis) wenige Einzelfunde bzw. sehr vereinzelt auf gesamter Fläche vorkommend und / oder auf kleine Areale (Sonderstandorte) beschränkt; hier mit geringen Individuenzahlen / bzw. -dichten auftretend. 3 (z): Art auf Monitoringfläche / Probefläche zerstreut; vereinzelt auf gesamter Fläche vorkommend und / oder auf kleine Areale (Sonderstandorte) beschränkt; hier jedoch stellenweise regelmäßig mit geringen bis mittleren Individuenzahlen / bzw. -dichten auftretend. 4 (v): Art auf Monitoringfläche / Probefläche verbreitet; auf der gesamten Fläche und / oder mehreren Teilarealen regelmäßig zur Haupterfassungszeit mit mittleren bis höheren Individuenzahlen / bzw. -dichten auftretend. 5 (h): Art auf Monitoringfläche / Probefläche häufig bis sehr häufig; zur Haupterfassungszeit in mittleren bis hohen bzw. eudominant mit überwiegend hohen bis sehr hohen Individuenzahlen / bzw. dichten auftretend. 21 Unter Berücksichtigung artspezifischer Individuendichten und Strategien (vgl. WEIDEMANN 1995, SETTELE et al. 1999). 127 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna Ergänzend erfolgen für alle nachgewiesenen Arten Angaben zum beobachteten Status im Gesamtuntersuchungsgebiet. Angaben zum Status: a: b: c: Bodenständigkeitsnachweis durch Raupen- und / oder Eifunde, frisch geschlüpfte Falter, Eiablagebeobachtungen, hohe Individuendichten / Abundanzen. Zum Teil an Sonderstrukturen gebunden. Vermutliche Bodenständigkeit (regelmäßige Beobachtung, ökologischer Anspruchstyp). Zum Teil an Sonderstrukturen gebunden. Vermutlich nicht bodenständig (Einzelbeobachtung; Überflug; abweichender ökologischer Anspruchstyp). Zum Teil jedoch Nutzung als Sonn- und Nektarhabitat bzw. Vorkommen / Bodenständigkeit außerhalb der Monitoringfläche auf benachbarten / angrenzenden Standorten / Flächentypen. 3.5.6.2.4 Erfassungszeitraum Der Erhebungszeitraum erstreckt sich über 4 jahreszeitliche Aspekte 22: Mitte / Ende Mai, Mitte Juni, Anfang / Mitte Juli und Ende Juli / Mitte August (vgl. Übersicht zu Erfassungsperioden in Kapitel 3.5.3). 3.5.6.2.5 Zeitbedarf Der Zeitbedarf für die semiquantitative Erfassung innerhalb der Probeflächen und die ergänzende Kartierung des Gesamtartenspektrums steht in Abhängigkeit von der Probeflächenzahl, der Größe und der Strukturvielfalt des Untersuchungsgebietes. Als mittlere Zeitspannen lassen sich zwischen 1,5 und 4 Stunden je Begehung veranschlagen. Daraus resultiert bei 4 Begehungen im Untersuchungsjahr ein Zeitbedarf von 6 bis 15 Stunden je Monitoringfläche. 22 HERMANN (1992) bezeichnet, unter Berücksichtigung der wichtigsten jahreszeitlichen Aspekte, 4 - 5 Flächenbegehungen als Untergrenze für eine annähernd vollständige Erfassung der Tagfalter- / Widderchenfauna eines Gebiets. 128 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.5.6.3 3.5.6.3.1 Fauna Libellen (Odonata) Bioindikation Für das Gebiet der BRD sind 80 Libellenarten bekannt (STERNBERG & BUCHWALD 1999). In Brandenburg konnten davon bisher 66 Arten nachgewiesen werden. Die Bestände einer Vielzahl dieser Arten besitzen dabei eine zentrale Bedeutung für ihre bundesweite Verbreitungssituation (MAUERSBERGER 2000). Die flugfähigen Imagines vieler Libellenarten haben eine vergleichsweise kurze Lebenserwartung von zumeist nur wenigen Wochen. Den größten Teil ihres Lebens (im Extrem bis zu 5-6 Jahre) verbringen sie dagegen mit ihrer Larvalentwicklung im Wasser (SIEDLE 1992). Durch unterschiedlich sensible Reaktionen verschiedener Anspruchstypen auf Veränderungen ihres Lebensraumes sind Libellen sehr gut als Bioindikatoren für aquatische Lebensräume geeignet. Die meisten Arten kennzeichnen Vegetationsstrukturen des Flachwassers, deren Verzahnung miteinander und vor allem deren thermische und hydrologische Bedingungen. Einige Arten stellen Anforderungen an spezielle Sedimente, hohe Wasserqualität und / oder bestimmte Sauerstoffverhältnisse. Weiterhin ist der Fortpflanzungserfolg vieler Arten maßgeblich vom Zustand und der Steuerung des gewässerinternen Nahrungsnetzes (Beuteverfügbarkeit, Konkurrenzbedingungen, Prädationsdruck) abhängig, obwohl viele Details dieser Zusammenhänge noch unerforscht sind. Aufgrund der intensiven autökologischen Bearbeitung dieser Artengruppe (vgl. z.B. STERNBERG & BUCHWALD 1999, 2000) besteht somit eine gute Voraussetzung für das Monitoring und die Bewertung von Libellenvorkommen (SIEDLE 1992). Im Rahmen der ÖUB erfolgt die Erfassung der Libellenfauna als zwingend erforderlicher Parameter in den naturnahen Mooren, an den Feldsöllen am Hangfuß der beobachteten Acker-Catenen, an den Seen (jeweils BR Schorfheide-Chorin) sowie an den untersuchten Abschnitten im Rahmen des FließgewässerMonitorings (BR Spreewald, BR Flusslandschaft Elbe). Als zusätzlich sinnvolle Ergänzung wird ihre Erhebung an definierten Uferabschnitten der räumlich-funktional mit Monitoringflächen des mineralischen Graslandes und des Moor-Grünlandes verknüpften Meliorationsgräben eingestuft. Auf allen Flächen wird eine kombinierte Kartierung der Imagines sowie der Exuvien (Larvenhüllen) vorgenommen. Für die im Rahmen der ÖUB untersuchten Kleingewässer (Feldsölle, kleinere Restseegewässer naturnaher Moore) stellt aufgrund der hohen Mobilität der Imagines vieler Arten der jeweilig betrachtete Gesamtlebensraum die Bezugsfläche für die Ermittlung der Abundanzklassen dar . Die Erfassung an den Fließgewässern und Meliorationsgräben erfolgt in definierten Probeflächen repräsentativer Teilabschnitte von möglichst 100 m Uferlänge. Die Untersuchungen aller Kleingewässer und der meisten Fließgewässerabschnitte erfolgen vom Land aus. Die endpunkte der Untersuchungsabschnitte an den Fließgewässern und Melioratonsgräben werden in einer Karte der ÖUB-Monitoringfläche vermerkt und mit GPS eingemessen. Neben der Verortung der Probeflächenerfolgt eine kurze verbale Beschreibung der Uferstrukturen(Gewässergrund mit Sediment / Detritus, Beschattung, Überschirmung, Beeinträchtigungen wie Angeloder Grillstellen) mit konkreter Häufigkeitsangabe bestandsprägender Pflanzenarten (Submers-,Emers- und Ufervegetation). Von allen untersuchten Probeflächen bzw. den jeweils betrachteten Gesamtlebensraum wird eine Fotodokumentation angelegt (vgl. Kapitel 2.4) 129 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.5.6.3.2 Fauna Erfassung der Imagines Die Erfassung der Imagines erfolgt durch Sichtnachweis (ggf. mit Fernglas) sowie mit gezielten Kescherfängen. Die Artbestimmung der Tiere wird im Freiland vorgenommen und diese anschließend wieder freigelassen. Darüber hinaus werden Beobachtungen, die auf eine mögliche Bodenständigkeit schließen lassen (frisch geschlüpfte Tiere, Paarungen, Eiablage, Patrouillenflug), vermutliche Gastbeobachtungen sowie ggf. zu spezifischen Habitatpräferenzen der einzelnen Arten innerhalb dieser Lebensräume notiert. Die Imaginalbeobachtung ist insbesondere für die Erfassung der Kleinlibellen (Zygoptera) bedeutsam, die sich im Gegensatz zu den Großlibellen (Anisoptera) eher stationär und weniger territorial verhalten. Damit ist der Unterschied zwischen der Schlupfabundanz (=Fortpflanzungserfolg als entscheidende Monitoringaussage) und der (viel leichter nachzuweisenden) Imaginalabundanz bei Kleinlibellen viel kleiner als bei Großlibellen. Bei letzteren, vor allem den Aeshniden und Gomphiden, ermöglicht der Exuviennachweis oftmals deutlich genauere Aussagen über das Monitoringgewässer als die Imaginalbeobachtung (Beispiel: aus der Sichtung eines territorialen Männchens der Königslibelle lässt sich nicht ableiten, ob es sich um einen Gast von einem mehrere Kilometer entfernten Gewässer handelt und die Art am Monitoringobjekt keinen Fortpflanzungserfolg hatte, oder ob die Art im Monitoringabschnitt zahlreich bodenständig ist). Bei vielen Kleinlibellen hingegen ist davon auszugehen, dass eine hohe Dichte flugaktiver Tiere auch mit hohem Fortpflanzungserfolg am Gewässer korreliert. Hinzu kommt, dass die häufig zu beobachtenden frischgeschlüpften Individuen direkte Auskunft über die Bodenständigkeit liefern. Daraus folgt, dass für das Monitoring konkreter Gewässerökosysteme bei den Großlibellen der Schwerpunkt auf die Aufsammlung von Exuvien (s.u.) gelegt werden muss. Die Abundanz als Individuenzahl pro definierte Probeflächenlänge wird für die Auswertung in logarithmische Klassen (siehe Tabelle 12) eingeteilt. Die Angaben zur maximalen relativen Häufigkeit im Untersuchungsjahr beziehen sich dabei auf den Begehungstermin mit der spezifisch höchsten Individuendichte innerhalb des Erfassungszeitraumes. 130 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna Zur Standardisierung der Erfassungen gelten die in Tabelle 10 angegebenen Witterungsvoraussetzungen. Tabelle 12: Logarithmische Abundanzklassen für die Libellenerfassung (nach SIEDLE 1992), verändert. Individuenzahl 3.5.6.3.3 Abundanzklassen Imagines Exuvien 1 1 A 2-5 2 B 6-10 3 C 11-30 4 D 31-50 5 E 51-100 6 F 101-300 7 G 301-500 8 H 501-1000 9 I 1001-3000 10 J 3001-5000 11 K 5001-10000 12 L > 10000 13 M Erfassung der Exuvien Nach dem Schlüpfen bleiben die leeren Larvenhäute, die Exuvien zurück. Diese lassen sich bis auf wenige Ausnahmen bis zur Art bestimmen (vgl. u.a. GERKEN & STERNBERG 1999, HEIDEMANN & SEIDENBUSCH 1993) und ermöglichen so den Bodenständigkeitsnachweis der Arten, ohne die Tiere stören oder töten zu müssen. Bei guter Witterung lässt sich noch die überwiegende Zahl der Exuvien der letzten zwei Wochen finden (SIEDLE 1992). Die Exuvien von Kleinlibellen sind weitaus empfindlicher als die robusteren Großlibellenexuvien. Da Zygopterenexuvien auch aufwendiger zu determinieren sind (in vielen Fällen nur unter dem Binokular), bleibt die quantitative Untersuchung speziellen Fragestellungen vorbehalten. Bei der Exuviensuche sollte möglichst eine größere bzw. nachhaltige Beschädigung der Ufervegetation minimiert werden. Sichtfunde im Bereich schwer zugänglicher Ufer- und Gewässerabschnitte können dabei z. B. mit Hilfe eines Keschers mit Teleskopstiel besammelt werden. Hierbei wird der Kescher zuvor in das Wasser getaucht und die im feuchten Zustand elastischere Larvenhaut von ihrem Schlupfstandort abgestreift. An charakteristischen Standorten werden bei einer umfangreicheren repräsentativen Stichprobe alle aufgefundenen Exuvien gesammelt und für den Artnachweis bzw. den Nachweis auf Bodenständigkeit determiniert. Auf Basis der gefundenen Exuvien erfolgt in der Datenbank eine Zuordnung zu den Abundanzklassen der einzelnen Begehungen sowie bei der Auswertung die Aufsummierung aller Exuvienfunde für das betreffende Untersuchungsjahr (vgl. Tabelle 12). Restgewässer naturnaher Moore 131 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna Für die im Rahmen der ÖUB untersuchten kleineren Restseegewässer naturnaher Moore stellt in der Regel das jeweilige Gesamtgewässer die Bezugsfläche für die Ermittlung der Abundanzklassen dar. Es werden qualitativ bis semiquantitativ Exuvien zu den 4 genannten Terminen aufgesammelt. Damit werden Informationen über das Gesamtartenspektrum sowie grob über die Häufigkeitsunterschiede zwischen den Arten zusammengetragen. Neben den Großlibellen wird wegen des breiteren Spektrums der Zygopteren an Kleingewässern, an dem vielfach auch spezialisierte Arten beteiligt sind, die Aufsammlung von Kleinlibellenexuvien stärker einbezogen. An charakteristischen Standorten werden bei einer umfangreicheren repräsentativen Stichprobe alle aufgefundenen Exuvien gesammelt und für den Artnachweis bzw. den Nachweis auf Bodenständigkeit determiniert. Bei Kleingewässern, die sich hydrologisch relativ statisch verhalten (z.B. Moorkolke als Kleinstrestseen in Verlandungsmooren), ist zudem die quantitative Euvienaufsammlung zur Dokumentation von Veränderungen als zwingend anzusehen. Die quantitativ untersuchten Exuvienabschnitte werden aufgrund der geringen Gesamtgröße der meisten Kleingewässer mit 10 m Länge gewählt. Da sich eine quantitative Erfassung der Exuvien von Kleinlibellen sowie zum Teil auch bei einigen Heidelibellenarten als extrem zeitaufwendig erweist, werden die Larvenhüllen dieser Arten bei individuenreicheren Vorkommen geschätzt. In der Datenbank erfolgt deshalb der Eintrag ob die Exuvienzahlen der einzelnen Arten gezählt oder geschätzt wurden. Gräben Die Erfassung an den Fließgewässern und Meliorationsgräben erfolgt in definierten Probeflächen repräsentativer Teilabschnitte von wenigstens 100 m Uferlänge. Ansonsten gelten analog die bei den Kleingewässern gemachten Angaben. Aus den Ergebnissen der Erfassung der Imagines und Exuvien wird der Status für jede gefundene Art abgeleitet: Angaben zum Status (a): (b): (c): (d): Bodenständigkeitsnachweis: Funde von Exuvien / Larven (Makrozoobenthos-Untersuchung), schlupfreifen Larven sowie frisch geschlüpfter Imagines. Vermutlich bodenständig: Beobachtung von Fortpflanzungsverhalten (Eiablage, Paarungsrad) bzw. hohe Abundanzen und / oder regelmäßige Präsenz am Gewässer, Revierverhalten, Fund unausgefärbter Imagines. Bodenständigkeitsstatus unsicher (geringe bis mittlere Abundanz, kein Reproduktionsverhalten, Biotop entspricht den Ansprüchen der Art). Vermutlich nicht bodenständig (Gast): Einzelbeobachtungen, kein Reproduktionsverhalten, abweichender ökologischer Anspruchstyp. 3.5.6.3.4 Erfassungszeitraum Zur Erfassung des Gesamtartenspektrums und einer Einstufung der Imagines und Exuvien in logarithmische Abundanzklassen werden für die ÖUB bei geeigneter Witterung vier Begehungen 23 innerhalb der Hauptflugperiode, von Mitte / Ende Mai bis Mitte / Ende August, durchgeführt (vgl. Tabelle 9). Die Bege23 Anmerkung: Für die semiquantitave Erfassung fordert SIEDLE (1992) etwa 10 halb- bis ganztägige Begehungen und für die Erfassung eines möglichst vollständigen Artenspektrums etwa 5 Begehungen pro Gebiet. 132 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna hungszeiträume für die naturnahen Moore liegen dabei von Mitte Mai / Anfang Juni, Ende Juni / Anfang Juli, Mitte / Ende Juli, Mitte bis Ende August. Die Erhebungen in den Seen, Feldsöllen und Fließgewässern und Meliorationsgräben finden jeweils etwa 1-2 Wochen früher statt. Für die Erfassung der Winterlibellen (Sympecma spp.) dient daneben in den Beobachtungsgewässern mit Amphibienmonitoring ein sonnenreicher Tag im Zeitraum Mitte April / Anfang Mai. 3.5.6.3.5 Zeitbedarf Nachfolgend wird tabellarisch eine Übersicht über den Zeitbedarf der Kartierungen gegeben, die zwischen verschiedenen Gewässertypen und Aufgabenstellungen unterscheidet. Die Tabelle gilt für Gewässer, für die bereits ein Überblick über das Artenspektrum besteht und wo bereits die Probeflächen ausgewählt sind. Alle Angaben sind auf den Einsatz eines Spezialisten ausgelegt, der die Imaginalerfassung weitestgehend ohne Fang und vollständig ohne Bestimmungsbuch absolviert. Sollen alle Arten pro Gewässer gefangen werden, erhöht sich der Aufwand mindestens auf das Dreifache. Tabelle 13: Zeitaufwand für die einzelnen Untersuchungsparameter der Libellenerfassung Erfassungstyp Freiland Exuvienbestimmung und Zählung Pro Termin Pro Termin 1) Seen 2h 0,5h 2) Seen, die auch wasserseitig kartiert werden müssen 2,5h 0,5h 3) Seen mit quantitativer Exuvienaufsammlung 2,5h 0,5h 4) Seen ohne Imaginalerfassung 1,5h 0,5h 5) Kleingewässer (mit Zygopterenexuvien) 2h 1,5h 6) Kleingewässer mit quantitativer Exuvienaufsammlung 2,5h 0,5h 7) Fließgewässer 2h 0,5h 8) Fließgewässer mit quantitativer Exuvienaufsammlung 2,5h 0,5h Pro Kartiertag können durchschnittlich vier Gewässer untersucht werden, wobei aufkommende Bewölkung oder Regen einen Abbruch der Geländearbeiten nach sich ziehen können, wenn die Imaginalerfassung Teil der Aufgabenstellung ist. Lediglich Erfassungstyp 4 ist weitgehend witterungsunabhängig. 133 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.5.6.4 3.5.6.4.1 Fauna Laufkäfer (Carabidae) Bioindikation Für die BRD sind 539 Laufkäferarten mit aktuellen bzw. ehemaligen Vorkommen belegt. In Brandenburg konnten davon 339 Arten nachgewiesen werden. Hiervon werden 131 Arten (39,6%) in der landesweiten Roten Liste aufgeführt (SCHEFFLER et al. 1999). Laufkäfer gehören in Mitteleuropa zu den am besten bearbeiteten Insektengruppen. Dies ist auf das Vorhandensein vieler Arbeiten zu Einzelarten, Artengruppen und bestimmten Anspruchstypen zurückzuführen (TRAUTNER 1992). Laufkäfer eignen sich durch die Vielfalt ihrer spezifischen Habitatansprüche und die Kenntnis ihrer Reaktionen auf Veränderungen wichtiger abiotischer Parameter gut als Indikatororganismen (z.B. DÜLGE et al. 1994, TRAUTNER 1992, WACHMANN et al. 1995). Bedeutsame nachgewiesene Einflussgrössen sind: Temperatur, Licht, Bodenfeuchte, pH-Wert des Bodens, Bodentyp, Bodenstruktur, Konkurrenzphänomene, Biozide u. strukturelle Standortbedingungen (u.a. BASEDOW 1998, TRAUTNER 1992, WACHMANN et al. 1995). Während bei euryöken Arten die Bindung an spezifische Standortfaktoren weite Amplituden umfassen kann, besteht bei stenöken Arten gegenüber mindestens einem Faktor eine enge Bindung und eine niedrige Toleranz hinsichtlich Schwankungen (WACHMANN et al. 1995). Das Differenzieren natürlicher Populationsschwankungen (Abundanzfluktuationen) der einzelnen Arten von sukzessiven Veränderungen der Artengemeinschaften durch geänderte Standortfaktoren erfordert die Notwendigkeit einer mehrjährigen Datenbasis (WACHMANN et al. 1995). 3.5.6.4.2 Methodik Als Erfassungsmethoden für die Laufkäferfauna sind neben den Bodenfallen unterschiedliche Verfahren bekannt: Bodeneklektoren, Handfänge, Entnahme und Auslese von Bodenproben, Lichtfang (vgl. TRAUTNER 1992 u.a.). Der Vorteil von Bodenfallen liegt im Erhalt von Zeitreihen bei quantifizierbaren Fangergebnissen. Einen Nachteil stellt die Untererfassung aktivitätsarmer Arten dar (MÜLLER 1984, WACHMANN et al. 1995). Die Ergebnisse sind dabei abhängig von Fangdauer, Anzahl, Beschaffenheit, Anordnung der Fallen, spezifischer Fangwahrscheinlichkeit der Arten sowie der unterschiedlichen Raumstruktur der Biotope. Die Aktivitätsdichte ist witterungsbedingt und jahreszeitlich schwankend. Im Hinblick auf Naturschutzaspekte und Arbeitsaufwand sollten zeitlich begrenzte und nicht über die gesamte Vegetationsperiode laufende Fänge erfolgen (vgl. TRAUTNER 1992). Nach BAEHR (1987) sind nach 2-jähriger Bodenfallen-Untersuchung nur etwa 80% des Artenbestandes eines Standortes erfasst. BARNDT (1976, zit. in HANDKE & MENKE 1995) bezeichnet die Zahl von 5 Fallen jedoch als ausreichend, um innerhalb eines Jahres in einem einheitlichen Lebensraum das charakteristische Arteninventar zu erfassen. Höhere Fallenzahlen vermindern allgemein äußere Störgrößen wie Ausfälle durch Überflutung, Mahd, Entfernung bzw. Zerstörung durch Spaziergänger oder Tiere. Die Erfassung des Gesamtartenspektrums der Monitoringflächen mit ihren zum Teil komplexen und heterogenen Standortausprägungen ist somit nur eingeschränkt möglich und nicht vordergründig Zielstellung. Die Erfassung der Laufkäfer für die ÖUB erfolgt mit jeweils 6 Bodenfallen in standörtlicher Bindung an die ausgewählten Beobachtungstypen der Monitoringflächen. Dazu werden in den Grasland- und Nieder- 134 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna moor-Ökosystemen 2 Gruppen mit jeweils 3 Fallen an den Rändern der 2 vegetationskundlichen Dauerquadrate im Abstand von ca. 10 m (unter Beachtung der Standorthomogenität) zueinander gesetzt 24. In den Acker-Ökosystemen vom Typ „hängig“ mit Catena erfolgt eine Aufteilung in 3 Gruppen (Ober-, Mittel, Unterhang) mit jeweils 2 Fallen. Bei Acker-Catenen mit Unterhang-Messfeldern in unmittelbarer Sollrandlage beträgt der Mindestabstand der Bodenfallen zur Sollkante 5 m. Bei „ebenen“ Ackerflächen werden die 6 Fallen gleichmäßig innerhalb sowie an den Rändern des Bodenmessfeldes angeordnet (vgl. ANHANG zum Standard-Flächendesign). Für die im Monitoring eingesetzten Bodenfallen sind glattwandige, ca. 15 cm lange Kunststoffrohre (zurechtgesägtes Regenabflussrohr mit 7 cm Durchmesser) ebenerdig in den Boden einzugraben. In diese Rohre werden Plastikbecher (z. B. 250 g Joghurtbecher) mit 6,8 cm Innendurchmesser und 10 cm Höhe eingelassen. Bei der Entleerung können diese problemlos herausgenommen werden und mit ca. 100 ml neuer Fangflüssigkeit (Isopropanol-Glycerin-Gemisch, vgl. ALBRECHT 1990) befüllt werden. Dieser Fallentyp entspricht dem 1963 von DUNGER (zit. in ESSER 1997) beschriebenen Typ der ”Einsatzfalle”. Um Unterspülungen im Randbereich zu minimieren, wird die Oberfläche des Becherrandes ggf. mit Hilfe eines durch Heftklammern befestigten Plexiglasringes vergrößert (KLAPKAREK, mündliche Mitteilung 1999). Zum Schutz vor Regenwasser (Überflutungs- bzw. Verdünnungsgefahr) werden die Becher mit einer transparenten Plexiglasscheibe von 20 cm Kantenlänge, durch die als Stützen je drei 20 cm lange Metallspieße gesteckt werden, abgedeckt. Um eine mikroklimatische Beeinflussung hinsichtlich der Luftzirkulation möglichst gering zu halten, ist dabei ein Bodenabstand von mindestens 5 cm zu gewährleisten (ESSER 1997). Auf Flächen mit Rinderbeweidung sowie Reh- und Schwarzwildvorkommen erfolgt eine Absicherung durch Eisenbügel. Hierzu werden aus 1 cm starken Baueisen (Armierungsstahl) 40 cm hohe und breite Bügel gebogen, von denen 2 diagonal zueinander über der Falle stehen (vgl. ABRAHAM 1991). Fangflüssigkeit Alkohol-Glycerin-Gemisch (2 Teile 70 %-iges Isopropanol + 1 Teil 85 %-iges Glycerin) 25 + 2-3 Tropfen Oberflächenentspannungsflüssigkeit (Detergenz). 24 Zum leichteren Wiederfinden werden die Fallen in einer reihe aufgestellt und mit einem Holzpfahl mit Flatterband markiert. Soweit bekannt, sollten sie zudem möglichst in Bearbeitungsrichtung stehen, da dies das Umfahren bei zwischenzeitlich durchgeführter Mahd erleichtert. 25 Glycerin erhält die Tiere weich und erleichtert damit Genitalpräparationen. Zudem verhindert es im Freiland das vollständige Austrocknen der Fallen. 135 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.5.6.4.3 Fauna Erfassungszeitraum Tabelle 14: Fangperioden und Fangfrequenzen der Laufkäfererfassung 26 Fangperioden Fangfrequenzen Frühjahr (Mitte / Ende April bis Anf. / Mitte Juni) 3 Spätsommer / Herbst (Mitte / Ende Aug. / Anf. Oktober) 2 Die Leerungen der Bodenfallen und der Austausch der Fangflüssigkeiten erfolgen 14-tägig fortlaufend im Frühjahr bzw. Herbst. 3.5.6.4.4 Zeitbedarf Der Zeitaufwand für das Installieren von 6 Bodenfallen / Dauerbeobachtungsfläche beträgt ca. 60 - 80 min. Die nachfolgenden Leerungen erfordern ca. 45 min je Begehung. Daraus ergibt sich ein jährlicher Zeitaufwand von ca. 5 Stunden / Beobachtungstyp. Um den zeitlichen Aufwand und die Bodenbearbeitung zu reduzieren, können die HT-Rohre der Bodenfallen auf Grünland vom Frühjahr bis zum Herbst des gleichen Jahres im Boden verbleiben. Dazu wird das HT-Rohr mit einem Dauermagnet bestückt sowie mit Erde und einem Markierungsband oder einer Kunststofftüte gefüllt. Der Standort wird mit einem genaueren Hand-GPS eingemessen (mindestens 2-3 m Genauigkeit) und im Herbst in Kombination mit einem Magnetsuchgerät wiederaufgesucht. Der Zeitbedarf für das Aussortieren der Laufkäfer (sowie Spinnen, sonstige Käfer-Familien, Heuschrecken und Regenwürmer) aus den Bodenfallen-Beifängen ist eng an die Individuenzahlen der Fallenfänge gebunden. Je Einzelfalle und Fangperiode werden zwischen 20 und 30 min veranschlagt. Der Zeitaufwand für die Bestimmung der Laufkäfer steht u. a. in Abhängigkeit von den spezifischen Individuenzahlen und Arteninventar (z. B. Notwendigkeit von Genitalpräparationen). Für die Bearbeitung einer einzelnen Fallenprobe lassen sich bei großem Erfahrungshorizont des Bearbeiters zwischen 45 - 60 min kalkulieren (SOMMER 1999, mündliche Mitteilung). Auf dieser Berechnungsgrundlage ergibt sich für eine Dauerbeobachtungsfläche mit 6 Einzelfallen und 5 Fangperioden ein jährlicher Bestimmungsaufwand von etwa 25-30 Stunden. Daneben existiert ein vom Umfang abhängiger Zeitposten für die Archivierung der Fänge bzw. die Präparation von Belegexemplaren. 26 In Anlehnung an zeitliche Erfassungsmindeststandards von TRAUTNER (1992) 136 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.5.6.5 3.5.6.5.1 Fauna Spinnen (Araneae) 27 Bioindikation In Brandenburg sind 641 Arten (PLATEN et al. 1999), für die Bundesrepublik Deutschland 956 Arten (PLATEN et al. 1995) und für Mitteleuropa etwa 1300 Arten (HÄNGGI 1989) bekannt. Die einheimische Spinnenfauna mit ihrer relativ großen Artenzahl deckt ein breites Spektrum unterschiedlicher ökologischer Anspruchstypen ab. Ihre Artenzusammensetzung wird insbesondere von strukturellen, geographischen und abiotischen Faktoren sowie von der Besiedlungsgeschichte beeinflusst (HÄNGGI 1989). Vorteile für die Bioindikation durch Spinnen stellen das Vorkommen vieler stenöker Arten, eine geringe Beutespezifität sowie geeignete Möglichkeiten zur Erfassung mittels Barberfallen dar. Als Nachteil besteht die im Vergleich zu Artengruppen wie den Laufkäfern und Tagfaltern eher geringe faunistische Datendichte bezüglich einer Einstufung in ökologische Anspruchsgruppen (HÄNGGI 1989). In den letzen Jahren ist der wissenschaftliche Bearbeitungsstand bei der Autökologie der Spinnenfauna jedoch zunehmend vorangeschritten (vgl. z. B. KIECHLE 1992). 3.5.6.5.2 Methodik Die Erfassung der Spinnen erfolgt im Rahmen der Laufkäfererfassung mittels Bodenfallen (vgl. Kap. 4.4.1.). Die Spinnen besitzen dabei den Status einer bioindikativ wichtigen Beifanggruppe („zusätzlich sinnvoller“ Parameter), die selektiv aussortiert und konserviert werden, um (ggf. auch partiell) durch die Bearbeitung im Rahmen von Praktikums- oder Diplomarbeiten in die Ökosystemare Umweltbeobachtung integriert werden zu können. Erfassungszeitraum Der Erfassungszeitraum orientiert sich an den Fangperioden und Fangfrequenzen für die Laufkäfererfassung (vgl. Kapitel3.5.6.4.3). 3.5.6.5.3 Zeitbedarf Der Zeitbedarf für die Installation und Leerung der Bodenfallen ist systemgebunden und bleibt durch die Einbeziehung der Spinnen als Monitoringgruppe unverändert. Der Bestimmungsaufwand für Spinnen ist bei entsprechendem Erfahrungshorizont etwa doppelt so groß wie für die Laufkäfer-Determination (mündliche Mitteilung KLAPKAREK 1999). 27 Nach Abstimmung mit LAGS-Brandenburg u. Rhön-Projekt nicht mehr zwingend erforderlicher faunistischer Parameter. 137 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.5.6.6 3.5.6.6.1 Fauna Lurche (Amphibia) Bioindikation Für Deutschland sind insgesamt 20 und für Brandenburg 14 heimische Amphibienarten bekannt (NOWAK et al. 1994). Die Kenntnisse über ihre autökologischen Ansprüche und Gefährdungsursachen sind als weitgehend gut einzuschätzen (vgl. GÜNTHER 1996). Sie eignen sich neben der Charakterisierung von Binnengewässern (Laichgewässer) auch zur Beurteilung der Grenzsysteme Gewässer / Land sowie Offenland zu gehölzdominierten Lebensräumen (RECK 1990). 3.5.6.6.2 Methodik Die Erfassung der Amphibienvorkommen erfolgt durch die Kombination von Sichtbeobachtungen (am Tage; Erfassung aller Stadien), Verhören, nächtliches Ableuchten sowie im Einzelfall von ergänzendem Blind- und Sichtkeschern. Bei Froschlurchen werden Ruf- durch Sichtbeobachtungen nicht rufender adulter Individuen ergänzt. Eine semiquantitative Erfassung der Schwanzlurche (Teichmolch, Kammmolch) insbesondere in Gewässern mit stärkerer Trübung ist mit dieser Methodenkombination nur unzureichend möglich. Der zusätzliche Einsatz von Licht- oder Reusenfallen erweist sich jedoch durch die regelmäßig notwendigen Kontrollgänge für die ÖUB als zu zeitintensiv. Die Laichaktivitätsphasen sind artspezifisch unterschiedlich und eng an äußere Witterungsbedingungen gebunden. Eine Grundvoraussetzung für die erfolgreiche Erfassung von Amphibien stellt eine geeignete Witterung dar. Optimale Witterungsverhältnisse bestehen bei Temperaturen von deutlich > 5°C, einer hohen Luftfeuchtigkeit bzw. leichtem Regen (vgl. MÜNCH 1991 u. a.). Eine quantitative Erfassung der Amphibienaktivität im Laichgewässer ist nur über das Aufstellen von umgrenzenden Fangzäunen erreichbar (vgl. MÜNCH 1991, REINHARD 1992). Damit verbunden ist die tägliche Kontrolle und Leerung der Fangeimer, die im Rahmen einer langfristig angelegten ÖUB nicht zu gewährleisten ist. Vorrangiges Erfassungsziel stellt deshalb die semiquantitative Einschätzung des Gesamtarteninventars in den spezifischen Laichgewässern dar (vgl. Tabelle 15 und Tabelle 16). Die Angaben zur relativen Häufigkeit beziehen sich dabei auf den Begehungstermin mit der spezifisch höchsten Individuendichte innerhalb des Erfassungszeitraumes. Als Nebenbeobachtung werden die parallel beobachteten Reptilienarten semiquantitativ erfasst. Analog zu den Libellen stellt bei den untersuchten Standgewässern in den naturnahe Mooren der jeweilig betrachtete Gesamtlebensraum die Bezugsfläche für die Ermittlung der Abundanzklassen dar. Darüber hinaus werden Beobachtungen zu spezifischen Habitatpräferenzen der einzelnen Arten innerhalb dieser Lebensräume erfasst. Die Erfassung in den Meliorationsgräben erfolgt zusammen mit der Libellenfauna an definierten Probeflächen repräsentativer Teilabschnitte von ≥ 100 m. 138 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna Tabelle 15: Abundanzklassen für Adulti und Juvenile der Amphibien Individuenzahl Abundanzklassen Sub-, Adulte Juvenile I 1 1 II 2-5 2-5 III 6-10 6-10 IV 11-30 11-30 V 31-50 31-50 VI 51-100 51-100 VII 101-200 101-200 VIII 201-500 201-500 IX > 500 > 500 Angaben zum Status: a: Bodenständigkeits- u. Reproduktionsnachweis durch Laicherfassung (Ballen, Schnüre) b: Bodenständigkeits- u. Reproduktionsnachweis durch Erfassung von Larvalstadien c: vermutliche Bodenständigkeit ohne Reproduktionsnachweis (hohe Individuendichten und / oder Paarungsbeobachtungen, Rufaktivitäten, regelmäßige Erfassung, ökologische Ansprüche) d: Bodenständigkeitsstatus unsicher e: vermutlich nicht bodenständig (Einzelbeobachtung / Gast, abweichende ökologische Ansprüche) Tabelle 16: Abundanzklassen für die Aufnahme von Laichballen /-schnüre und Larvalstadien der Amphibien Laichballen / -schnüre Abundanzklassen A B C D E F G ... M N O ... Anzahl 1 2-5 6-10 11-20 21-30 31-40 41-50 ... 101-120 121-140 141-160 ... Larvalstadien Abundanzklassen a b c d e 139 Individuenzahl 1-10 11-100 101-500 501-5000 > 5000 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.5.6.6.3 Fauna Erfassungszeitraum Die als „zusätzlich sinnvoll“ eingestufte Erhebung der Amphibienfauna 28 in den naturnahen Mooren und Meliorationsgräben erfolgt zu 3 Geländebegehungen. Die Kartierungen konzentrieren sich dabei auf März bis Juni zur Hauptlaichzeit der Amphibien. Um den Nachweis der Bodenständigkeit und erfolgreichen Reproduktion (larvale Stadien) sowie spätlaichender Arten zu gewährleisten, erfolgt eine Begehung im Juni (vgl. RECK 1992). 3.5.6.6.4 Zeitbedarf REINHARD (1992) schätzt bei der Erfassung der Amphibien den Zeitbedarf für die Geländearbeit im Vergleich zur Auswertungszeit bedeutend höher ein als bei vielen anderen zoologischen und botanischen Artengruppen. Ein durchschnittlicher Zeitbedarf von 1-3 Stunden pro Begehung steht dabei in Abhängigkeit vom Strukturreichtum und von der Größe des Laichbiotops. In Anbetracht der relativ geringen Größe der Gewässer (Moor-Restseen, Grabenabschnitte) im Rahmen des Monitorings werden 1-1,5 Std. / Begehung veranschlagt. 28 Amphibien-Erfassungen sind hier vorrangig im Zusammenhang mit der parallelen Erfassung „zwingend erforderlicher“ Monitoring-Gruppen zweckmäßig (z. B. Laufkäfer, Libellen, Regenwürmer). 140 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 3.5.6.7 3.5.6.7.1 Fauna Regenwürmer (Lumbricidae) Bioindikation Für Deutschland sind insgesamt 39 Regenwurmarten bekannt (GRAFF 1983). Regenwürmer besitzen als Vertreter der Makrofauna den größten Massenanteil an den Bodentieren. Eine wesentliche Funktion der Regenwürmer als saprophage Faunengruppe liegt in der Beeinflussung der mikrobiellen Aktivität bei der Laub- und Blattstreuzersetzung (MÜHLENBERG 1993). In Grünland-Ökosystemen wurden mittlere Regenwurm-Dichten von 8-300 Ind. / m² mit einer Biomasse von 20-80g / m² ermittelt (KÜHNELT 1950 und DUNGER 1974 beide zit. in MÜHLENBERG 1993). Durch ihre sich jahreszeitlich und witterungsbedingt nur relativ geringfügig ändernden Populationsstrukturen stellen Regenwürmer im Rahmen vieler bodenzoologischer Untersuchungen eine obligatorische Indikatorengruppe dar (vgl. SAG 1991, GRIMM & BORK 1996). Monitoring-Ziele sind u. a. langfristige Beobachtungen zur Ausbildung spezifischer Regenwurmzönosen (Abundanz, Artensprektrum, Dominanz) in Abhängigkeit unterschiedlicher Umwelt- und Bewirtschaftungseinflüsse (SAG 1991). In Untersuchungen zu Einsatzmöglichkeiten von Regenwürmern als Indikatoren für Bodenzustände (FILSER et al. 1995) konnte z. B. der Rückgang der Abundanzen und Biomassen der Bodenorganismen infolge langjähriger Intensivnutzung nachgewiesen werden. Mit Hilfe von Korrelationsanalysen wurden u. a. folgende Beziehungen ermittelt: • < Abundanzen mit steigendem C/N-Verhältnis • > Abundanzen mit steigendem Anteil der mikrobiellen Biomasse am C-Gehalt • negative Beziehung zu medianem Korndurchmesser (durch positive Korrelation zum Tongehalt) • Indifferenz gegenüber hohen Skelettanteilen • entgegengesetzte Beziehungen zu N-Gehalt und pH-Wert. 3.5.6.7.2 Methodik Nach AXELSSON et al. (1971, zit. in MÜHLENBERG 1993) sind mit der Methode der Handauslese bis zu 95% der gesamten Wurm-Biomasse zu erfassen. Das ermöglicht eine quantitative Erfassung der Regenwürmer unabhängig ihres Aktivitätszustandes. Einen geringeren Zeitaufwand, jedoch auch eine verminderte Effektivität (< Individuenzahlen) verursacht eine ausschließliche Formalin-Extraktion (BOUCHE 1969, zit. in MÜHLENBERG 1993, SAG 1991, zit. in GRIMM & BORK 1996). Nach EDWARDS & LOFTY (1977, zit. in MÜHLENBERG 1993) ist die beste Methode zur Erfassung einer hohen Arten- und Individuendichte die Kombination von Handauslese und nachfolgender Tiefenaustreibung durch Formalin 29. Daher erfolgt die Erfassung der Regenwürmer im Rahmen der ÖUB mittels einer Methodenkombination aus Handauslese und nachfolgender Tiefenaustreibung. Mittels Spaten und Stechrahmen-Schablone erfolgt ein zügiges Ausgraben (Fluchtgefahr) der 16 (Acker, hängig: 24) Erdproben von je 1 / 16 m² (25 x 25 cm) und 20 cm Tiefe. Das Bodenmaterial wird auf eine Plane ausgebreitet und sorgfältig nach Regenwürmern durchsucht. Bei Grasland- und Niedermoorflächen 29 Alternativ zur Formalin-Methode eignet sich dabei nach einigen Autoren auch die Anwendung von 1,5 %iger Senflösung (vgl. z. B. GUNN 1992, VETTER 1996). 141 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Fauna werden die Tiere nach der spezifischen Ausweisung einer Schichtengrenze bei der erstmaligen Erhebung getrennt nach Oberboden und Unterboden ausgelesen. Im Anschluss an den Bodenaushub werden zusätzlich tiefgrabende Arten mit 0,2 %-iger Formalinlösung (ca. 1,5 l je Loch, Sammelzeit ca. 30 min; Kontrollintervalle ca. 5 min) ausgetrieben. In aktuell langzeitig überstauten Grünland- und Moorgrünlandflächen mit hohem Grundwasserstand wird auf eine Tiefenaustreibung verzichtet (vgl. SCHUSTER 2001). Je Einzelprobe erfolgt in 10 cm Tiefe eine Messung der aktuellen Bodenfeuchte (Gewichts-%, nach DIN 19683-4) sowie mittels Bodenthermometers eine Messung der Bodentemperaturen in 5 und 10 cm Tiefe. Die genaue Lage und Anordnung der Probeflächenpunkte im spezifischen Untersuchungsjahr wird durch die Anlage eines Probenahmerasters vorgegeben (siehe ANHANG). Dabei werden je zwei Stechrahmenproben innerhalb der jeweils 1 m² großen Probequadranten platziert. Die Tiere werden in gesonderten Transportbehältnissen (kühl und feucht) mit standorteigenem Boden zum Labor befördert und bis zur Determination im Kühlschrank bei ca. 10 °C gelagert (vgl. GRIMM & BORK 1996). Die Bestimmung erfolgt vorzugsweise im lebenden Zustand. Als Literatur wird dabei GRAFF (1953), SIMS & GERARD (1985) sowie ggf. HERR & BAUCHHENSS 1987 und THIELEMANN (1989) verwendet. Die Tiere werden artspezifisch (Unterteilung in Adulte und Juvenile) ausgewogen (0,001g Genauigkeit) und anschließend möglichst wieder an ihren entsprechenden Standort zurückgebracht. Aus dem Datenmaterial der Standortproben wird der Mittelwert berechnet und auf Individuen / m² bzw. Biomasse (g/m²) hochgerechnet (KÄMMERER 1996). Ergänzend zur oben beschriebenen Methode erfolgt eine qualitative Auswertung der Bodenfallen-Beifänge zur Ermittlung des Gesamtartenspektrums auf den Dauerbeobachtungsflächen. 3.5.6.7.3 Erfassungszeitraum Die Probenahme erfolgt einmalig zu den Aktivitätszeiten der Regenwürmer im Frühjahr (Mitte April bis Anfang Juni) oder Herbst (Mitte September bis Anfang November). Im Zuge einer langfristigen Vergleichbarkeit der Analysen sollten die Untersuchungstermine für die einzelnen Flächen immer zur selben Jahreszeit sowie unter frostfreien Witterungsbedingungen erfolgen. Nach tiefgreifenderen Bodenbearbeitungen auf Ackerflächen sollte die Probenahme frühestens nach vier Wochen bis zur Stabilisierung der Hohlräume erfolgen (SAG 1991). 3.5.6.7.4 Zeitbedarf GRIMM & BORK (1996) berechnen bei einer dreiköpfigen Arbeitsgruppe 7 bis 12 Stunden für die Probennahme eines Standortes mit 16 Stichproben von je 1/16 m². Diese Zeitvorgaben lassen sich nach den ersten Felduntersuchungen im Rahmen des ÖUB-Projektes weitgehend bestätigen. Dabei befinden sich sandige Acker- und Grasland-Standorte mit etwa 7 Stunden / m² am unteren Zeitlimit, während für Niedermoorstandorte etwa 8-10 Stunden / m² veranschlagt werden. Für eine insgesamt 1,5 m² große Probefläche bei einer Acker-Catena entspricht dies einem Zeitbedarf von etwa 10 - 12 Stunden. Der Zeitbedarf für die Individuen- und Biomassebestimmung der Tiere steht in Abhängigkeit von der Individuendichte der Probefläche und dem Erfahrungshorizont des Bearbeiters. Als mittlere Zeitspanne werden zwischen 3 und 5 Stunden je m² Probefläche veranschlagt. 142 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Bewirtschaftung / Nutzung 3.6 Bewirtschaftung / Nutzung 3.6.1 Allgemeines Vorgehen Die Auswahl der Parameter orientiert sich an SAG (1991) und LABO (1999). Die Erhebung erfolgt durch eine Selbstauskunft der Landwirte. Die Bereitschaftserklärung von Seiten der Landwirte war unter anderem ein Auswahlkriterium bei der konkreten Flächensuche (neben der generellen Einverständniserklärung der Eigentümer / Nutzer der Flächen, diese in das Untersuchungsprogramm aufnehmen zu dürfen). Um, die Dateneinholung von den landwirtschaftlichen Betrieben zu vereinheitlichen, wurden die von der SAG (1991) vorgeschlagenen Formblätter modifiziert (siehe ANHANG). Im Rahmen der Flächendokumentation erfolgt u. a. -soweit dies möglich ist- eine Recherche der Nutzungsgeschichte für die einzelnen Monitoringflächen. 3.6.2 Parameterauswahl Parameter / Maßnahme: • Nutzungsgeschichte • Bearbeitung: Datum, Anzahl der Arbeitsgänge, Art der Bearbeitung (Pflügen, Grubbern, Striegeln etc.), Bearbeitungstiefe • Mineralische Düngung: Datum, Düngemitteltyp (Name), Ausbringungsmenge, Entwicklungsstadium des Bestandes • Organische Düngung: Datum, Düngerart (Stallmist, Gülle, Jauche, Klärschlamm, Kompost etc), Tierart – bei Wirtschaftsdünger, Ausbringungsmenge, Entwicklungsstadium des Bestandes • Saat: Datum, Fruchtart, Ansaatmischung (bei Grünland), Arten, Saat-, Pflanzstärke (Gewicht bzw. Anzahl pro ha) • Pflanzenschutz: Datum, PSM (Wirkstoff), Ausbringungsmenge, Entwicklungsstadium des Bestandes • Beweidung: Datum des Beweidungsbeginns, Datum des Beweidungsendes, Art der Weidetiere, Anzahl der Weidetiere, Durchschnittsgewicht der Weidetiere • Ernte: Datum, Fruchtart / Schnittnutzung, Ertrag (dt/ha), Qualität des Erntegutes, Art der Ernterückstände, Verbleib der Ernterückstände • Zufütterung bei Beweidung: Menge, Zeitraum und Art der Zufütterung 143 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Meteorologische Daten 3.7 Meteorologische Daten 3.7.1 Allgemeines Vorgehen Die klimatischen Voraussetzungen bilden einen wesentlichen Rahmen für die Ausprägung eines Ökosystems. Die kontinuierliche Erfassung der Witterungsdaten ist daher eine Grundlage, um die langfristige Entwicklung der beobachteten Ökosysteme interpretieren zu können. Innerhalb der ÖUB werden jedoch keine eigenen Wetterstationen betrieben, so dass auf Fremddaten zurückgegriffen werden muss. Der Deutsche Wetterdienst (DWD) betreibt mit den Stationen Angermünde, Zehdenick, Cottbus-West, Lübben-Blumenfelde sowie Lenzen fünf Wetterstationen in engem räumlichen Bezug zu den drei Biosphärenreservaten. Obwohl die Station Lenzen aufgrund ihrer Lage die klimatischen Verhältnisse auf den Untersuchungsflächen im BR Flusslandschaft Elbe am besten wiedergeben würde, muss auf die Daten der niedersächsischen Station Lüchow zurückgegriffen werden, da für die Station Lenzen lediglich Messdaten bis 1950 und dann erst wieder seit 2002 vorliegen (LUTHARDT 2005). Weitere hauptamtliche Wetterstationen im Bereich des BR Flusslandschaft Elbe befinden sich in ca. 20 bis 40 km Entfernung [Boizenburg / Elbe (Brandenburg), Marnitz (Mecklenburg-Vorpommern), Seehausen (Sachsen-Anhalt) und Lüchow (Niedersachsen)]. Bei Vergleichen zeitgleicher Messreihen der o.g. Stationen mit der Station Lenzen konnte, trotz auch hier bestehender Abweichungen, die beste Übereinstimmung mit den Werten der Station in Lüchow festgestellt werden (LUTHARDT 2003). Durch die enge räumliche Nähe zu den Biosphärenreservaten ermöglichen die vom DWD eingeholten Daten der genannten fünf Wetterstationen eine großräumige Aussage zu Klima und Witterung in den Großschutzgebieten. Zusätzlich betreibt der DWD zahlreiche Niederschlagsmessstationen, welche allerdings ausnahmslos im oder in unmittelbarer Nähe des BR Schorfheide-Chorin liegen (siehe Tabelle 17). Tabelle 17: Übersicht der Niederschlagsmessstationen des DWD im Einzugsbereich des BR Schorfheide-Chorin Messstationen Altenhof Friedrichswalde Groß Dölln Groß Schönebeck Oderberg/Mark Templin Weiterhin werden auf der Level-II-Fläche (Kienhorst) der LFE Klimadaten gesammelt. Eine weitere Wetterstation wird vom ZALF e.V. in Groß Ziethen betrieben und befindet sich damit im Zentrum des Biosphärenreservates Schorfheide-Chorin. In den BR Spreewald und Flusslandschaft Elbe existiert nach bisherigem Kenntnisstand kein vergleichbares, die Wetterstationen ergänzendes Niederschlagsmessnetz. Rutenberg/Lychen Je größer der Abstand einer ÖUB-Fläche zur Wetterstation ist, desto unzuverlässiger werden die Messwerte. Außerdem existieren innerhalb der Eberswalde einzelnen Biosphärenreservate z.T. erhebliche Niederschlagsgradienten. Pozlow In der Region des Biosphärenreservates Schorfheide-Chorin wurden beispielsweise für das Gebiet zwischen Joachimsthal und Altenhof durchschnittlich etwa 635 mm N/a und für das Gebiet um Liepe und Oderberg ca. 525 mm N/a im Zeitraum 1961-1990 ermittelt (GRÄNITZ & GRUNDFürstenberg/Havel MANN 2002; vgl. auch AUTORENKOLLEKTIV 1981). 144 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Meteorologische Daten Dies bedeutet ca. 110 mm N/a Differenz auf einer Distanz von nur 20-25 km. Insbesondere lokal begrenzte, sommerliche Starkregenereignisse (Gewitter), die z.T. eine erhebliche erosive Wirkung besitzen, können ohne direkte Messung vor Ort nicht genau erfasst werden. Aus diesem Grund ist die Verwendung der Daten des oben genannten, ergänzenden Niederschlagsmessnetzes (Tabelle 17) für das BR SchorfheideChorin sinnvoll. 3.7.2 Parameterbegründung und Methodenbeschreibung Für die ÖUB werden die Daten des Deutschen Wetterdienstes verwendet. Diese werden regelmäßig veröffentlicht und stehen sowohl in Form täglicher als auch aggregierter, monatlicher Messwerte zur Verfügung. Daten der Wetterstationen können so auf täglicher Basis in die ÖUB-Datenbank übernommen werden und je nach Bedarf unterschiedlich aggregiert werden. Im Moment wird die Übernahme von Tageswerten, trotz des hohen Aufwandes bei der Datenpflege favorisiert. Vom DWD werden folgende Daten für die ÖUB bereitgestellt (gegen Erstattung der Bereitstellungskosten): z Niederschlag (sowie die Art des Niederschlages): Tagessummen, aggregierbar zu Dekaden-, Monatsund Jahressummen. Wesentlicher, alle Ökosysteme und ihre Kompartimente (abiotisch und biotisch) steuernder Parameter. Hieraus können ebenfalls wichtige, die abiotischen und biotischen Teile des Ökosystems beeinflussenden Daten wie Niederschlagsextreme, längere Trockenheitsphasen in verschiedenen Jahreszeiten, längere Feuchtephasen etc. abgeleitet werden. z Relative Luftfeuchte (%): Ergänzend zum Niederschlag wird der Wasserhaushalt eines Gebietes durch die relative Luftfeuchte gesteuert. Insbesondere ist die Verdunstungskraft der Luft von der relativen Luftfeuchtigkeit abhängig (WOHLRAB et al. 1992) z Temperatur: Tagesmittel, aggregierbar zu Dekaden-, Monats- und Jahresmittel. Wesentlicher, alle Ökosysteme und ihre Kompartimente (abiotisch und biotisch) steuernder Parameter. Hieraus können ebenfalls wichtige, insbesondere die biotischen Teile des Ökosystems beeinflussende Daten wie Jahresschwankungen, Jahreshöchst- und Tiefsttemperatur, Spätfröste etc. abgeleitet werden. z Tägliche Schneehöhe und Art der Schneedecke: Sinnvoll u.a. für die Beurteilung des Wasserhaushaltes von Einzugsgebieten, Seen, Söllen etc. Gerade im niederschlagsarmen Brandenburg, das in den Sommermonaten in der Regel ein Wasserdefizit aufweist, kommt der winterlichen Wasserversorgung eine große Bedeutung zu. z Windrichtung und Windstärke (Tagesmittel): Aus der Kenntnis der Windrichtung kann das Niederschlagsgeschehen in den Biosphärenreservaten besser interpretiert werden (die oben erwähnten starken Unterschiede in der Niederschlagsverteilung im BR Schorfheide-Chorin hängen z.B. wesentlich von der Lage der Endmoränen (Stauwirkung!) und den überwiegend westlichen Winden zusammen, siehe BRAMER et al. 1991). Zusätzlich haben Windrichtung und –stärke z.B. großen Einfluss auf die Durchmischung des Wasserkörpers von Seen. z Tägliche Sonnenscheindauer: Die Sonnenscheindauer fließt u.a. in die Berechnung der Verdunstung nach verschiedenen Formeln ein (SCHRÖDTER 1985). Zudem ist sie ein indirektes Maß für die Stärke der UV-Strahlung. 145 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Meteorologische Daten z Potenzielle Evapotranspiration (PET): Die potenzielle Evapotranspiration beschreibt die Verdunstungshöhe von Oberflächen bei gegebenen meteorologischen Bedingungen bei unbegrenzt zur Verfügung stehendem Wasser. Übernommen werden Tagessummen, diese sind aggregierbar zu Dekaden-, Monatsund Jahressummen. z Potenzielle Klimatische Wasserbilanz (PKWB): Rechenwert, der sich aus der Differenz zwischen Niederschlag und potentieller Evapotranspiration ergibt. Wesentlicher Parameter für die Einschätzung der Wasserbilanz eines Gebietes. Übernommen werden Tageswerte, die jedoch mindestens zu Dekadenwerten aggregiert werden sollen. Die Bereitstellung von Verdunstungsdaten wird inzwischen (Stand 2001) als Spezialdienstleistung des Geschäftsfeldes Landwirtschaft des DWD eingestuft und ist daher kostenpflichtig. Aus diesem Grund wurden bisher für die Stationen Angermünde, Zehdenick, Cottbus und Lübben-Blumenfelde ausschließlich die Tagessummen der nach HAUDE errechneten Potenziellen Evapotranspiration über Gras (ETP) übernommen. Aus dieser ist die potentielle Klimatische Wasserbilanz errechenbar. Aufgrund der zusätzlich entstehenden Kosten und dem Problem der Zuordnung der vom DWD berechneten Werte für die individuellen Monitoringflächen (das vom jeweiligen Standort angebotene Wasser unterscheidet sich z.B. erheblich zwischen Mooren und Trockenrasen), werden Daten zur aktuellen Evapotranspiration nicht mit in die Datenbank aufgenommen. 146 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Phänologische Daten 3.8 Phänologische Daten 3.8.1 Allgemeines Vorgehen Die Phänologie befasst sich mit dem im Jahresverlauf periodisch wiederkehrenden Wachstums- und Entwicklungserscheinungen der Pflanzen. Es werden die Eintrittszeiten charakteristischer Vegetationsstadien (Phasen) beobachtet und festgehalten. Sie stehen in enger Beziehung zur Witterung und zum Klima. Daher zeichnet es sich ab, dass phänologische Daten in Zukunft verstärkt für Trendanalysen zur Klimadiagnostik herangezogen werden, da sich die Eintrittsdaten vieler phänologischer Phasen sehr gut in Beziehung zu Temperatur-Trends setzen lassen. Sie sind somit gut für die Aufgaben der ÖUB, u.a. im Hinblick auf die Dokumentation der Ökosystementwicklung und die Frühwarnfunktion geeignet. Dauer der jährlichen Vegetationsperiode Die Dauer der Vegetationsperiode des Jahres ist ein wichtiger ökosystemar wirkender Faktor. Für die Flächen der ÖUB in Brandenburg wurden die folgenden zwei wildwachsenden Pflanzen als Zeiger für die Vegetationsperiode ausgewählt. Zum einen die Sal-Weide (Salix caprea), welche mit ihrem Blühbeginn den Vorfrühling (Ende Februar bis Ende März) einleitet und zum anderen die Stiel-Eiche (Quercus robur), deren Blattfall den Beginn der Vegetationsruhe ankündigt (vgl. auch SCHNELLE 1955). Beide Arten sind gut bestimmbar und werden im Beobachtungsprogramm des DWD regelmäßig mit einer relativ hohen Datendichte untersucht. Tabelle 18: Pflanzenauswahl zur Bestimmung der Vegetationsperiode Jahreszeit in den Biosphärenreservaten Brandenburgs Pflanze Sal-Weide (Salix caprea) Stiel-Eiche (Quercus robur) Entwicklungsstadium (Phase) Phasenkennung 1951-1990 ab 1991 (Ostdeutschland 1961-1991) (Ostdeutschland ab 1992 Beginn der Blüte B Blattfall BF X X X Herkunft der Daten Die phänologischen Daten für die Untersuchungsflächen werden vom Deutschen Wetterdienst abgerufen. Dieser unterhält derzeit ein phänologisches Grundnetz, das ca. 1550 Stationen im gesamten Bundesgebiet umfasst (siehe www.dwd.de). Die Beobachtungen werden einmal jährlich per Meldebogen von 400 Beobachtern übermittelt (Jahresmelder). Die Beobachtungen richten sich nach der Anleitung für die phänologischen Beobachter des Deutschen Wetterdienstes (VuB 17 / Vorschriften und Betriebsunterlagen Nr. 17). Auswahl der Stationen Für die Flächen der ÖUB wurden diejenigen Stationen des DWD ausgewählt, die den Rechts- und Hochwerten der Flächen in den drei Biosphärenreservaten Brandenburgs am nächsten liegen. Die ausgewählten Stationen sind in Tabelle 19 dargestellt. Die dort erfassten Werte werden als Mittelwerte in der Datenbank vorgehalten. Beobachtungszeitraum 147 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Phänologische Daten Für die ÖUB wurden die Daten kontinuierlich ab dem Jahre 1998 bis 2005 abgerufen (Stand Jan. 06). In der Datenbank sind unter dem gesonderten Abfragebutton „Phänologische Daten“ folgende Informationen abgelegt: • Tagesanzahl zwischen dem Blütenbeginn der Sal-Weide und dem Blattfall der Stiel-Eiche (Mittelwerte der aufgelisteten Stationen) • Grafische Darstellung der Dauer der Vegetationsperiode (siehe Abbildung 4) • Auflistung der Stationen mit Angabe der Koordinaten, der Hoch- und Rechtswerte nach GaußKrüger, der Höhenlage über NN, des Naturraums und der Naturraumgruppe Spreewald - Vegetationszeit Anzahl der Tage zwischen 'Sal-Weide - Beginn der Blüte' und 'Stiel-Eiche Blattfall' 2004 227 2003 224 2002 243 2001 228 2000 226 1999 228 1998 240 0 30 Jan. 60 Feb. 90 März 120 Apr. 150 Mai 180 Juni 210 Juli 240 Aug. 270 Sep. 300 Okt. 330 Nov. 360 [Tag im Jahr] Dez. Copyright Deutscher Wetterdienst Abbildung 4: Beispiel für die grafische Darstellung der Vegetationsperioden im BR Spreewald in den Jahren 1998-2004 148 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Phänologische Daten Tabelle 19: Phänologische Meßstationen des DWD in den Biosphärenreservaten, die den ÖUBFlächen am nächsten liegen BR Spreewald Geographische Koordinaten Breite Länge 5227 5223 5223 5226 5222 5222 5217 5212 5205 5209 5203 5223 5213 5221 5221 5215 5158 5153 5201 5147 5137 1317 1303 1304 1302 1259 1257 1302 1320 1325 1322 1331 1337 1407 1417 1338 1354 1434 1439 1352 1419 1437 5144 5137 Höhe ü. NN Gauß-Krüger-Koordinaten (m) RW Naturraum HW Kennz. 50 35 80 40 35 38 50 40 50 45 55 45 100 40 40 37 65 55 57 70 140 4587 4571 4573 4570 4567 4564 4571 4591 4597 4594 5398 5406 5440 5451 5407 5425 5470 5476 5422 5453 5473 5814 5807 5807 5812 5805 5805 5795 5787 5774 5781 5770 5807 5788 5803 5803 5790 5760 5751 5766 5740 5721 811 812 812 812 812 812 814 815 816 816 817 820 820 820 820 822 826 829 830 831 841 1435 80 5471 5734 1443 130 5480 5721 5147 1337 115 5405 5134 1429 140 5139 1253 5132 Naturraumgruppe Bezeichnung Kennz. Bezeichnung 81 81 81 81 81 81 81 81 81 81 81 82 82 82 82 82 82 82 83 83 84 841 Teltowplatte Brandenburger-Potsdamer Havelgebiet Brandenburger-Potsdamer Havelgebiet Brandenburger-Potsdamer Havelgebiet Brandenburger-Potsdamer Havelgebiet Brandenburger-Potsdamer Havelgebiet Beelitzer Heide Nuthe-Notte Niederung Luckenwalder Heide Luckenwalder Heide Baruther Tal Berlin-Fürstenwalder Spreetalniederung Berlin-Fürstenwalder Spreetalniederung Berlin-Fürstenwalder Spreetalniederung Berlin-Fürstenwalder Spreetalniederung Dahme-Seengebiet Lieberoser Heide/Schlaubegebiet. Guben-Forster Neissetal Malxe-Spree-Niederung Cottbuser Schwemmsandfächer Cottbuser Sandplatte Cottbuser Sandplatte 84 Mittelbrandbrandenburgische Platten/Nieder Mittelbrandbrandenburgische Platten/Nieder Mittelbrandbrandenburgische Platten/Nieder Mittelbrandbrandenburgische Platten/Nieder Mittelbrandbrandenburgische Platten/Nieder Mittelbrandbrandenburgische Platten/Nieder Mittelbrandbrandenburgische Platten/Nieder Mittelbrandbrandenburgische Platten/Nieder Mittelbrandbrandenburgische Platten/Nieder Mittelbrandbrandenburgische Platten/Nieder Mittelbrandbrandenburgische Platten/Nieder Ostbrandenburgisches Heide- und Seengebiet Ostbrandenburgisches Heide- und Seengebiet Ostbrandenburgisches Heide- und Seengebiet Ostbrandenburgisches Heide- und Seengebiet Ostbrandenburgisches Heide- und Seengebiet Ostbrandenburgisches Heide- und Seengebiet Ostbrandenburgisches Heide- und Seengebiet Spreewalde Spreewalde Lausitzer Becken-und Heidelandschaft Lausitzer Becken 841 Cottbuser Sandplatte 84 Lausitzer Becken 5740 842 Lausitzer Grenzwall 84 Lausitzer Becken 5464 5715 842 Lausitzer Grenzwall 84 Lausitzer Becken 80 4561 5725 842 Lausitzer Grenzwall 84 Lausitzer Becken 1434 145 5470 5712 842 Lausitzer Grenzwall 84 Lausitzer Becken 5135 1349 135 5418 5718 843 Kirchhain-Finsterwalder Becken 84 Lausitzer Becken 5134 1333 95 5399 5716 844 Beobachtungsort Landkreis Niederlausitzer Randhügel 84 Höhe ü. Geographische Koordinaten Gauß-Krüger-Koordinaten NN Breite Länge (m) RW HW Lausitzer Becken Naturraum Kennzeichen Bezeichnung BR Schorfheide-Chorin 5313 1423 10 5459 5899 800 5244 5248 1413 1410 5 5 5447 5444 5845 5853 802 802 Uckermärkisches Hügelland Uckermärkisches Hügelland Uckermärkisches Hügelland Uckermärkisches Hügelland Uckermärkisches Hügelland Eberswalder-Tal Untere OdertalNiederung Oderbruch Oderbruch 5233 1433 10 5469 5825 802 Oderbruch 5315 5302 5319 1212 1205 1156 100 60 80 4513 4506 4496 5903 5878 5910 770 770 771 5319 1214 81 4516 5910 772 Prignitz Prignitz Ruhner Berge Parchim-Meyenburger Sandflächen 5256 1225 40 4528 5867 773 Kyritzer Platte 5259 5259 1207 1204 45 40 4508 4504 5873 5873 773 774 Kyritzer Platte Perleberger Heide 5304 1233 50 4537 5882 775 Dosseniederung 776 Wittstock-Ruppiner Heide Gellmersdorf Uckermark 5258 1405 35 5438 5871 744 Passow Uckermark 5309 1407 15 5441 5892 744 Steinhöfel Uckermark 5306 1353 75 5425 5886 744 Joachimsthal Barnim 5258 1346 75 5417 5872 744 Prenzlau Uckermark 5319 1354 40 5426 5911 744 Eberswalde-Finow Barnim 5250 1350 40 5421 5857 759 Gartz Uckermark Altwriezen-Beauregard Neuküstrinchen Barnim Barnim MärkischManschnow Oderland BR Flusslandschaft Elbe-Brandenburg Gerdshagen Prignitz Hoppenrade-Garz Prignitz Marnitz Parchim Meyenburg Kyritz Schrepkow Kletzke Fretzdorf Katerbow Neuruppin Schulzendorf Tangerhütte Cröchern-Blaetz Wiesenburg Guesen Klitsche Rathenow Jerichow Prignitz OstprignitzRuppin Prignitz Prignitz OstprignitzRuppin OstprignitzRuppin OstprignitzRuppin Oberhavel Stendal Ohrekreis Potsdam Mittelmark Jerichower Land Jerichower Land Havelland Jerichower 5259 1240 55 4545 5254 1249 40 4555 5864 777 Ruppiner Platte 5302 5226 5223 1303 1149 1141 70 35 60 4570 4488 4478 5879 5812 5806 778 870 870 Granseer Platte Tangerhütter Niederung Tangerhütter Niederung 5207 1228 187 4532 5777 872 Genthiner Land 5221 1159 40 4499 5802 872 Genthiner Land 5229 1214 30 4516 5817 872 Genthiner Land 5237 5230 1220 1202 30 20 4523 4502 5832 5819 873 875 Untere Havelniederung Märkische Elbtalniede- 149 5873 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Phänologische Daten Land Schwarzholz Stendal 5246 1200 30 4500 5827 875 Seehausen Stendal 5254 1145 20 4483 5864 875 Kapern LüchowDannenberg 5302 1132 18 4468 5876 876 rung Märkische Elbtalniederung Märkische Elbtalniederung Untere Mittelelbeniederung Die phänologischen Jahreszeiten Das Jahr wird in 10 physiologisch-biologisch begründete "phänologische Jahreszeiten" sowie in spezielle Phasen von sogenannten Zeigerpflanzen eingeteilt. Die Jahreszeiten beginnen mit dem Vorfrühling und enden mit der Vegetationsruhe. Die Benennung der phänologischen Jahreszeiten einschließlich der Zeigerpflanzen, mit denen sie bestimmt werden, sind der Tabelle 20 zu entnehmen. Diese Daten werden derzeit nicht in der Datenbank geführt, sind aber beim DWD abrufbar. Tabelle 20: Phänologische Jahreszeiten und ihre Zeigerpflanzen nach dem Deutschen Wetterdienst (www.dwd.de) Jahreszeit Vorfrühling Erstfrühling Vollfrühling Frühsommer Hochsommer Spätsommer Frühherbst Vollherbst Spätherbst Winter-Vegetationsruhe Zeigerpflanze Haselnuss (Blüte) Schneeglöckchen (Blüte) Forsythie (Blüte) Stachelbeere (Blattentfaltung) Apfel (Blüte) Stiel-Eiche (Blattentfaltung) Schwarzer Holunder (Blüte) Sommer-Linde (Blüte) Johannisbeere (Fruchtreife) Frühapfel (Fruchtreife) Eberesche (Fruchtreife) Schwarzer Holunder (Fruchtreife) Stiel-Eiche (Fruchtreife) Rosskastanie (Fruchtreife) Stiel-Eiche (Blattverfärbung) Rosskastanie (Blattverfärbung) Winterweizen (Auflaufen) Apfel, spätreifend (Blattfall) Stiel-Eiche (Blattfall) 150 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Immissionsdaten 3.9 Immissionsdaten 3.9.1 Allgemeines Vorgehen Erhöhte Konzentrationen von Luftschadstoffen können die verschiedenen Kompartimente der beobachteten Ökosysteme beeinflussen, so dass sie für die ÖUB mit betrachtet werden müssen. Das Landesumweltamt unterhält z. Zt. zur kontinuierlichen Überwachung der Luftqualität im Land Brandenburg ein automatisches Luftgütemessnetz mit 26 automatischen Stationen, davon fünf Messstellen für verkehrsbezogene Messungen (LUA 2001) (siehe Abbildung 5). Dabei werden mit mehr als 150 Messgeräten die Konzentrationen von Schwefeldioxid (SO2), Stickstoffoxiden (NO, NO2), Ozon (O3), Kohlenmonoxid (CO) und Schwebstaub gemessen. An ausgewählten Standorten werden Schwefelwasserstoff (H2S) und meteorologische Parameter erfasst. Die Messgeräte liefern je Tag ca. 12.000 Messwerte, die automatisch in die Messnetzzentrale nach Potsdam und in die Subzentrale nach Cottbus übertragen werden. (siehe http://www.mluv.brandenburg.de/cms/detail.php?id=lbm1.c.209332.de&_siteid=700, Stand 28.02.2006). Es ist nicht geplant, das Landesmessnetz auszubauen. Der aktuelle Stand des stationären telemetrischen Landes-Luftgütemessnetzes kann über die genannte Internetadresse kontinuierlich abgefragt werden. Darüber hinaus werden innerhalb des Landes Brandenburg vom Umweltbundesamt Messstationen zur Ermittlung der Luftqualität in Neuglobsow, der Schorfheide sowie Falkenberg (beide nur bis Oktober 2005) betrieben (LUA 2001). Die dem BR Schorfheide-Chorin nächst gelegenen stationären telemetrischen Messstellen sind im Süden Bernau, im Norden Prenzlau sowie im Nordosten Schwedt. Die telemetrische Messstelle Eberswalde wurde am 7.10.1999 stillgelegt. Die dem BR Spreewald nächst gelegenen Stationen sind im Südosten von Cottbus (LUA), im Norden des BR die Stationen Falkenberg (UBA) und KönigsWusterhausen (LUA) sowie im Westen die Station Luckau. Innerhalb des BR Spreewald befindet sich außerdem eine kontinuierliche Station in Burg sowie im BR Flusslandschaft Elbe in Wittenberge. Die Messstellen des UBA sind nur eingeschränkt für die ÖUB nutzbar. Zusätzlich erfasste das Landesumweltamt im Jahr 2000 (bzw. 2001) an 134 (136) nichttelemetrischen Messstellen im Land Brandenburg den Staubniederschlag . 56 % (53 %) dieser Proben wurden auf anorganische Staubinhaltsstoffe untersucht. Das nichttelemetrische Messnetz wurde in den vergangenen Jahren stärker eingeschränkt. Wurden 1998 noch 271 Messstellen betrieben, so gab es 1999 222, 2000 134 und 2001 136 nichttelemetrische Messstellen, an denen der Staubniederschlag erfasst wurde (LUA 1999, 2000, 2001, 2002). Die dem BR Schorfheide-Chorin nächstgelegenen nichttelemetrischen Messstellen zur Erfassung des Staubniederschlages befinden sich in Eberswalde (2 Messstellen), Schwedt (6 Messstellen) und Bad Freienwalde (4 Messstellen). Die dem BR Spreewald nächstgelegenen Messstellen sind Burg (1 Messstelle) und Cottbus (4 Messstellen). Für das BR Flusslandschaft Elbe eignen sich die nichttelemetrischen Stationen in Wittenberge (2 Messstellen) sowie in Cumlosen. Eingeschränkt sind zudem die Stationen in Schrepkow (2 Messstellen), Löckstädt (2 Messstellen) und Demerthin geeignet. Teilweise fließen Daten der genannten Stationen des nichttelemetrischen Messnetzes in die Integrierte ökologische Dauerbeobachtung (IÖDB) des Landesumweltamtes ein (Vierraden und Zützen, beide bei Schwedt). Neben der oben genannten laufenden Aktualisierung der Luftgütedaten im Internet, werden vom Landesumweltamt jährlich detaillierte Jahresberichte zur Luftqualität in Brandenburg herausgegeben, denen u.a. zahlreiche Immissionskennwerte entnommen werden können (LUA 1995-2002). 151 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Immissionsdaten Abbildung 5: Messstellen des Luftgütemessnetzes Land Brandenburg (Stand: 27.02.2005), Quelle: http://www.mluv.brandenburg.de/cms/detail.php?id=lbm1.c.209332.de&_siteid=700, (01.03.2006) 152 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Immissionsdaten 3.9.2 Parameterauswahl Innerhalb der ÖUB werden keine eigenen Immissionsmessungen durchgeführt. Zum einen erscheint die Dichte des Landesmessnetzes ausreichend, um für die ÖUB hinreichend genaue Daten zu erhalten, zum anderen wären sie aufgrund der hohen Kosten innerhalb der ÖUB nicht tragbar. Aus diesem Grund wird auf ausgewählte und aggregierte Daten des Landesumweltamtes zurückgegriffen. Bis 1998 liegen die gemessenen Depositionsdaten als Jahres-Mittelwerte vor. Ab 2001 werden die erhobenen Immissionsdaten als interpolierte Rasterdaten bereitgestellt (vgl. Tabelle 21). Tabelle 21: Übersicht der erfassten Immissionsparameter des LUA Brandenburg (1998 – 2005) Gemessene Parameter Von 1998 – 2000 als Einzeldaten vorliegend (Jahres-Mittelwerte) Für 2001 Ab 2001 als interpolierte Rasterda- als interpolierte Rasterdaten vorliegend ten vorliegend As + - - Cd + - - Co + - - H2S + - - Mn + - - Ni + - - NO + - - NO2 + + - NOX + - - Ozon + + - 30 + + + SO2 + + - PM (Schwebstaub) Das ursprünglich geplante Vorgehen, die Einzeldaten der jeweiligen Stationen abzufragen, wurde 2002 in folgender Weise geändert. Vom Landesumweltamt wurden mit Hilfe eines in jüngerer Zeit entwickelten Verfahrens (vgl. MATTICK 1997) für jedes Jahr interpolierte Immissions-Jahresmittelwerte in Form von Rasterdaten auf Basis des Messtischblatt-Quadranten (TK 1:10000) herausgegeben. Für jede ÖUBMonitoringfläche konnten die Jahresmittel folgender Immissionswerte abgelesen werden: z SO2 (Grenzwert des Jahresmittelwertes zum Schutz von Ökosystemen: 20 µg/m³) z NOx (Grenzwert des Jahresmittelwertes zum Schutz der Vegetation: 30 µg/m³) z Ozon z Schwebstaub (Grenzwert des arithmetischen Jahresmittelwertes: 15 mg/m³) [In Klammern: spezifische Jahres-Grenzwerte, siehe LUA (2002)] 30 Als Schwebstaub gelten alle festen und flüssigen Teilchen in der Außenluft, die nicht sofort zu Boden sinken sondern eine gewisse Zeit in der Atmosphäre verweilen. Schwebstaub oder das atmosphärische Aerosol werden auch als Particulate Matter (PM) bezeichnet (UBA 2005) 153 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Immissionsdaten Tabelle 22: Klassenstufen der interpolierten Immissions-Jahresmittelwerte des LUA Brandenburg (Angaben jeweils in µg/m³). SO2 0-2 4-6 6-8 8-10, ... NOx ..., 9-11 11-13 13-15 15-17, ... Ozon ..., 48-52 52-56 56-60 60-64, ... Schwebstaub ..., 19-22 22-25 25-28 28-31, ... Die im Unterschied zu den Werten der einzelnen Stationen etwas geringere Genauigkeit wird für die ökosystemare Analyse als ausreichend betrachtet. Zudem besteht der Vorteil eines direkten Flächenbezuges. Nach Möglichkeit werden die Daten mittels der Hoch- und Rechtswerte flächenscharf digital vom LUA abgefordert. Da H2S und CO vom LUA nicht interpoliert bearbeitet werden, wird auf diese Daten verzichtet. In einer gesonderten Tabelle (Immissionsdaten_Mittelwerte) der Datenbank konnten zusätzlich die genaueren Werte zur Ozonbelastung folgender den BR nächstgelegenen Stationen aus dem Landesmessnetz des Landesumweltamtes Brandenburg abgefragt werden (Messung bis 2000): Cottbus-Süd Cottbus-LUA Königs-Wusterhausen Falkenberg (UBA-Messstelle) Luckau Neuglobsow (UBA-Messstelle) Prenzlau sowie Schwedt - Burg Zusätzliche Abfragen für Ozon: 1. Zahl der Tage während des Kalenderjahres, an denen der 8-Stundenmittelwert von 110 µg/m³ (Schwellenwert) bzw. 120 µg/m³ (Leitwert) an den genannten Stationen überschritten wurde. 2. Zahl der Tage während des Kalenderjahres, an denen der 1-Stundenmittelwert von 200 µg/m³ (Mittelwert als Schwellenwert zum Schutz der Vegetation) an den genannten Stationen überschritten wurde. 3. Zahl der Tage während des Kalenderjahres, an denen der Tagesmittelwert von 65 µg/m³ (Mittelwert als Schwellenwert zum Schutz der Vegetation) an den genannten Stationen überschritten wurde. 4. AOT 40 P-Wert für die genannten Stationen (6000 µg/m³*h AOT 40-Wert für die Zeitspanne von Mai bis Juli als Langfristziel zum Schutz der Pflanzen) 5. AOT 40 W-Wert für die genannten Stationen. (20000 µg/m³*h AOT 40-Wert für die Zeitspanne von Mai bis Juli als Langfristziel zum Schutz der Wälder). Weitere Leit-, Schwellen-, Richt- und Grenzwerte können den Jahresberichten des LUA (LUA 1995-2002) zur Luftqualität entnommen werden. 154 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Ansprechpartner auf Seiten des LUA: (Stand 2006) Leiter der Abteilung T3 Landesumweltamt Brandenburg Herr Dr. Kühne Am Nordrand 45 03044 Cottbus 03355-8762140 Mitarbeiter: Frau Mattick Am Nordrand 45 03044 Cottbus 03355-8762210 [email protected] 155 Immissionsdaten ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Depositionsdaten 3.10 Depositionsdaten 3.10.1 Allgemeines Vorgehen Die nasse und die trockene Deposition als Austrag von Stoffen aus der Atmosphäre haben erheblichen Einfluss auf die verschiedenen Kompartimente der beobachteten Ökosysteme und stellen einen wesentlichen Eintrittspfad der Nähr- und Schadstoffe in die Ökosysteme dar. Zumindest die indirekte Erfassung der Deposition ist daher in den Konzepten zur ÖUB (siehe VAHRSON et al. 1997) für alle Ökosystemkomplexe vorgesehen. Im M3-Programm des Waldmonitoring-Programmes waren ursprünglich (HOFMANN 1997, HOFMANN et al. 1999) eigene Depositionsmessungen geplant, die jedoch aus Kostengründen bisher nicht durchgeführt werden konnten. Das Landesumweltamt betreibt aktuell 4 und das Umweltbundesamt 1 Messstation zur Erfassung der Deposition im Land Brandenburg. Zusätzlich werden im Rahmen des Level-II-Programms durch die LFE (Landesforstanstalt Eberswalde) an 6 Stationen Depositionsmessungen im Wald sowie auf einer zugeordneten Freifläche durchgeführt. Es werden Niederschlagssammler nach Grimmeisen mit 314 cm2 Auffangfläche eingesetzt. 5 Sammler in einer Reihe mit 2 m Abstand in 1 m Höhe wurden an der Freifläche aufgestellt. Im Bestand wird der Bestandesniederschlag in drei Reihen von jeweils 5 Sammlern im 1,3fachen mittleren Baumabstand gemessen. Um die Deposition von Spurenstoffen getrennt erfassen zu können, werden zusätzlich sauer konditionierte PE-Dosen eingesetzt (EINERT et al. 2001). 3.10.2 Parameterbegründung und Methodenauswahl Da derzeit keine räumliche Zuordnung bzw. Gültigkeit der Messwerte zu den einzelnen ÖUB-Flächen des Offenland-Monitoring möglich ist und im Gegensatz zu den Immissionswerten noch keine Module vorliegen, die eine landesweite Interpolation der gemessenen Werte ermöglichen, werden die Depositionsdaten nicht in der Datenbank geführt. Die für den Zeitraum 1999-2000 bereits aufbereiteten Einzeldaten zur Deposition der Messstationen Schwenow (BR-SW) und Kienhorst (BR-SC) sind im „Container“ abgelegt. Zukünftig wird für Auswertungen bzw. ökosystemare Interpretationen jeweils auf die verallgemeinernden Berichte des LUA 31 (nur bis 2003), der LFE 32 (alle drei Jahre) und des UBA 33zurückgegriffen. 31 (http://www.mluv.brandenburg.de/cms/media.php/2320/luft_04.pdf) Da die Ergebnisse der Depositionsmesssungen im Rahmen der forstkundlichen Berichterstattung (jährlicher Waldzustandsbericht) in umfassender Form publiziert werden, wird fortan auf eine jährliche Publikation verzichtet (LUA 2004) 32 (http://www.mlur.brandenburg.de/cms/detail.php/lbm1.c.312415.de) 33 (http://www.umweltbundesamt.de/uba-info-daten/daten/mbm/monatsberichte05.htm) 156 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 4 Benötigte Geräte und Materialien Benötigte Geräte und Materialien 4.1 Geräte und Materialien zur Flächeneinrichtung und Vermarkung - Maßband Topographische Karte und Orthofoto mit entsprechendem Flächendesign Markierungsstangen / Fluchtstangen Doppelpentagon und Kompass Markierungsband Fotoapparat Notizblock für Geländeskizzen und Notizen GPS-Ausrüstung: Die Punktmessung wurde in der Ersteinrichtung mit GPS-Empfängern und Software der Firmen TRIMBLE sowie Leica durchgeführt. Zu dem verwendeten Equipment gehören: Vermarkung Rundblockmagnete Erdbohrer, Spaten, Handschaufel Magnetsuchgerät - Holzpflöcke zur dauerhaften Markierung in ungenutzten Monitoringflächen (∅ 10-20 cm, Länge ca. 120 cm). Um eine möglichst lange Haltbarkeit der Markierungspflöcke zu erreichen, sind möglichst Robinie, Eiche, Riesen-Lebensbaum, Lärche oder Schwarz-Erle zu verwenden. TRIMBLE-Ausrüstung im Gelände: 2 GPS-Empfänger 4000SSE mit Akku-Fach und Koffer 1 TDC1-Handgerät für die RTK-Messung mit Kabel 2 Antennen (Compact L1/L2) mind. eine davon mit Grundplatte 2 Antennenkabel (je 5 m lang) 2 Feststative mit Gewindeadapter (Optik und Libelle) 1 Rundstab (3-teilig) mit cm-Einteilung 1 Schnellstativ mit Antennenadapter 1 Rucksack für den Rover 1 Adapterkabel für den Anschluss der Akkus im Rover-Rucksack 2 Funkgeräte (derzeit von der Firma SATEL) mit Kabel 1 Gewindestange zur Befestigung des Funkgerätes am Rover-Rucksack 8 Blei-Akkus 1 Autobatterie mit Holzadapter für das Akkufach des Empfängers (Marke: EIGENBAU durch Herrn GROSSMANN vom ZALF Eberswalde, Herzlichen Dank!) 2 Akku-Ladegeräte (OSM = Office Support Module) im Büro - Post Processing: derzeitige Software TRIMBLE GEOMATICS OFFICE 1.0 1 Verbindungskabel TDC1 - serielle Schnittstelle 157 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Benötigte Geräte und Materialien 1 Verbindungskabel Empfänger - serielle Schnittstelle Für die Auswertung empfiehlt sich eine leistungsfähige Hardware (Minimum: Pentium 150 MHz, 32 MB RAM und 1GB Festplatte). Die Software läuft unter WINDOWS NT 4.0 oder späteren Versionen und MS WINDOWS 95/98. Außerdem ist es für einige Software-Funktionen günstig auch den MS INTERNET EXPLORER installiert zu haben. Leica-Ausrüstung im Gelände: 1 Minipack-Rucksack zum Tragen des GPS-Empfängers und des Korrekturdatenempfängers sowie der zugehörigen Bauteile 1 GS50 Einfrequenz Code-Empfänger (ab 2006: GS 20) 1 AT501 Einfrequenz-Antenne 2 1,2 m Antennenkabel 1 Teleskopstab mit 5/8 Zoll Schraube, passt in Rucksack 1 Auslegerarm 15 cm zur Befestigung der Korrekturdaten-Antenne an der GPS-Antenne 1 TR500-Terminal mit Anzeige und Tastatur für GPS-Empfänger 1 1,8 m Kabel, verbindet TR500-Terminal mit dem GPS-Empfänger 1 Handriemen mit Clip für TR500-Terminal 2 aufladbare Camcorder Batterien GEB121, NiMH, 6V/3,6 Ah für GS50 1 Ladegerät GKL111 BASIC (Europa-Ausführung) 1 PCMCIA-ATA Flash Karte (Datenspeicherkarte mit mind. 8 MB) 1 Bosch AMDS-dGPS-Box 2 (Datenempfänger für Korrekturdaten) 1 Antenne für den Empfang der Korrekturdaten 1 Datenkabel 1 Batteriekabel mit Clip-Stecker 2 Panasonic-Blei-Akkus (passend für Clip-Stecker) im Büro - Post Processing: 1 GS50 mit Speicherkarte 1 Datenübertragungskabel oder 1 Speicherkartenlesegarät zum Ausladen der Daten von der Speicherkarte 1 GISDataPro-Software (PC-Anforderungen wie oben) 4.2 Geräte und Materialien zur Fotodokumentation Generelle Fotoausrüstung: Spiegelreflex-Kleinbild-Kamera mit verschiedenen Objektiven Diafilme (z. B. Fuji-Sensia 100) oder: Digitalkamera mit Speicherkarte Notizheft, Stifte Kompass und evtl. Maßband Diascanner und Fotobearbeitungs-Software - 158 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Benötigte Geräte und Materialien für QTVR-Panoramen: Geländeaufnahmen Stativ (z.B. Manfrotto 055 CB) Dreiwegeneiger 410 zum Aufsetzen auf Stativ Stativkopf (QTVR –Panoramakopf der Firma Kaidan, Leihgabe des Zentrum für Agrarlandschaftsund Landnutzungsforschung ZALF) Analoge Kamera (herkömmlichen Spiegelreflexkamera z.B. Canon EOS 3) oder Digitalkamera (z.B. Nikon Coolpix 990 mit einer Brennweite von 8 bis 24 mm, entspricht einem Brennweitenbereich von 38 bis 115 mm beim Kleinbildformat). Objektiv für Spiegelreflex (z.B. ein 24 mm von SIGMA) mit Streulichtblende Weitwinkeladapter für Digitalkamera (damit lässt sich Brennweite auf 24 mm reduzieren) Filme (z.B. Dia-Filmmaterial Fuji Sensia 100 II) bzw. leere Speicherkarte (z.B. passen auf eine 16 MB Compact Flash Speicherkarte 21 Bilder mit der höchsten Auflösung und normaler Kompression. Kabelfernauslöser Kompass, Maßband, Aufnahmeblatt, Stift, Absperrband, Fluchtstangen Büro - Diascanner (z.B. Canon Canoscann 2700) Bildbearbeitungsprogramm (vorzugsweise Adobe Fotoshop) CD-Brenner zur Ablage der digitalen Bilder Klarsichthüllen zur Ablage der analogen Dias zum Zusammensetzen der Panoramen: - Apple Power PC mit mind. 64 MB RAM (besser mehr!) im ZALF Müncheberg QTVR Authoring Studio Software 4.3 Geräte und Materialien für die bodenkundliche Geländearbeit Geräte zur Anlage der Profilgrube bzw. für Bodenbohrungen: - Spaten - Klappspaten Schaufeln Spitzhacken (1m) - Pürckhauer-Bohrstock sowie Bohrstockhammer und Drehgriffe + Hebevorrichtung Moorklappsonde mit Griff und meterweisen-Verlängerungsstangen Folien für Bodenaushub (2 x 3 m) ggf. Kompass Markierungsband (rot-weiß) Eimer (um ggf. Wasser schöpfen zu können) - Ausrüstung zur Profilansprache: - Zollstock / Messlatte Geologenhammer 159 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme - Eimer Feldtasche mit: Benötigte Geräte und Materialien Schreibgeräten 10 %ige Salzsäure Bodenkundlicher Kartieranleitung (KA 5 (2005)) / Munsell – Farbtafeln TGL 24300/04 für Moorbodenansprache im Gelände Neigungsmesser Klemmrahmen mit Aufnahmebögen nach KA 5 (2005) Taschenmesser / Spachtel / Pinsel Lappen Sprühflasche mit dest. Wasser Filmdosen oder ähnlichem für besondere Fundstücke Ausrüstung für die Dokumentation: - Aufnahmeformulare und Bohrpunktformulare Fotoapparat + Diafilme Notizzettel und ggf. Zeichenkarton für Profilzeichnung Probenahme - Eimer kleine Gärtner-Schaufel Stechzylinder von 100 cm3 Inhalt (z.B. numerierte mit je 2 Verschlussdeckeln aus Plastik) ggf. auch passende Metalldeckel, wenn Zylinderinhalte in Beutel umgefüllt werden sollen passende Treibgeräte und kleine Hämmer Probenstecher für Torfproben Raspelmesser und Spachtel saubere PE-Tüten (z.B. preiswerte Gefrierbeutel) + Eddingstifte bzw. Kugelschreiber vorbereitete kleine Kärtchen, zur Probenbeschriftung (s. Kap. 3.1.4) Kisten (für Probenbeutel) gepolsterte Transportkästen für Stechzylinder in ungestörter Lagerung Reinigungslappen zum Säubern der Entnahmewerkzeuge Materialien zur Schurfsicherung - Holzpflöcke Markierungsband (rot-weiß) Infozettel zum ÖUB-Projekt mit Telefonnummer in Klarsichthüllen Unterlagen und Geräte für die Erosionskartierung - - Feldkarten (topografische Karten) am besten auf 1: 5000 vergrößert Feldblätter (siehe ANHANG) Aufnahmebögen für das Ausmessen von Erosionsformen (siehe ANHANG) Tafeln zur Abschätzung des Bodenbedeckungsgrades (DVWK 1996) und vorbereitete 15 m-Schnur mit 100 Knoten in 15 cm Abstand Legende der Kartieranleitung (DVWK 1996) Diktiergerät Maßband 160 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme - Zollstock Markierungsstäbe Kompass Hangneigungsmesser Bleistifte, Radiergummi, Zirkel, Tipp-Ex Schreibunterlage Fineliner in roter, schwarzer, blauer, grüner Farbe ggf. Zahlenschilder od. Etiketten Fotoausrüstung Notizbuch Taschenrechner Klappspaten oder Handschaufel - Minibohrstock - Benötigte Geräte und Materialien 4.4 Geräte und Materialien für die Grundwasser-Beprobung Geräte und Materialien für die Messung des Grundwasserstandes - Pegelmessgerät (Lichtlot) Zollstock für Grundwasserstände < 200 cm unter Pegeloberkante, Umrechnung des Grundwasserstandes aus cm unter Pegeloberkante in cm unter Geländeoberfläche (GOF) Geräte und Materialien für die Bestimmung der Temperatur und des Sauerstoffgehaltes - Oximeter (z. B. WTW Profile Oxi 196) Reinigungslösung und Elektrolytlösung für die Sauerstoffmembran Tuch zum Reinigen der Sauerstoffmembran Spritzflasche mit destilliertem Wasser zum Reinigen der Elektrode kleiner Kanister mit destilliertem Wasser zum Nachfüllen der Spritzflasche Geräte und Materialien für die Bestimmung des pH-Wertes - pH-Meter (z. B. WTW Profile pH 197) Eichlösungen pH 4,01 und pH 7,0 Ersatzlösung (Kaliumchlorid) für Elektrode Spritzflasche mit destilliertem Wasser zum Reinigen der Elektrode kleiner Kanister destilliertes Wasser zum Nachfüllen der Spritzflasche Geräte und Materialien für die Bestimmung der elektrischen Leitfähigkeit - Standard-Leitfähigkeitsmeßzelle (z. B. WTW Profile LF 197) Spritzflasche mit destilliertem Wasser zum Reinigen der Elektrode kleiner Kanister destilliertes Wasser zum Nachfüllen der Spritzflasche Geräte und Materialien für Probenahme und Transport - Pegelpumpe (Zubehör vom Penetrograph o. ä.) schmaler Holzstab zum Nachschieben des Schlauches Stecknadel zum Beseitigen von Verstopfungen der Schlauch-Verbinder 250 ml – Plastikflaschen 161 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme - Benötigte Geräte und Materialien wasserfester Stift zum Beschriften der Plastflaschen Kühlbox zum Transport der Grundwasserproben 4.5 Geräte und Materialien für die floristische Geländearbeit Materialien für die Erfassung der Gesamtartenliste - Topografische Karte / Orthofoto mit Abgrenzung der Monitoringfläche vorhandene Artenlisten der Monitoringfläche Geländeliste der „Floristischen Kartierung Brandenburg“ (Abstreichliste) - Bestimmungsliteratur - Geräte und Materialien für die Aufnahme des Vegetationstransektes - - - ca. 10 Fluchtstangen sowie Doppelpentagon zum Abstecken des Transektes 5 Eisenstangen, davon 3 mit 2 m langer Wäscheleine versehen sowie die beiden übrigen Eisenstangen mit 10 m bzw. 20 m langer Wäscheleine kleiner Hammer zum Eintreiben der Fluchtstangen und Eisenstangen bei ausgetrocknetem Boden Maßband zum Einmessen des ersten und letzten Aufnahmepunktes, wenn diese vor bzw. nach dem letzten 20 m Transekt-Stop liegen Kompass zur Bestimmung der Marschzahl des Transektes Topografische Karte / Orthofoto mit eingezeichnetem Transektverlauf Leica - GPS und Hoch- und Rechtswerte Magnetsuchgerät Zollstock zur Ermittlung der Vegetationshöhe Bestimmungsliteratur Signierfarbe zum Auftragen / Erneuerung der Farbmarkierung der Transekt-Anfangs- und Endpfähle Materialien zur Durchführung der Vegetationsaufnahme nach BRAUN-BLANQUET - - Topografische Karte / Orthofoto mit Abgrenzung der Monitoringfläche und eingezeichnetem Flächendesign Leica-GPS und Hoch- und Rechtswerte Magnetsuchgerät 4 Stäbe / Pfähle pro Aufnahme zu deren Abgrenzung Aufnahmebogen Bestimmungsliteratur Kompass mit Winkelmesser (Neigung, Exposition) Zollstock (Höhe der Vegetation, Dicke der Streuschicht) Materialien zur Aufnahme der Vegetationszonierung - - Topografische Karte und Orthofoto mit Abgrenzung der Monitoringfläche in GIS im Maßstab 1 : 1000 oder 1 : 2500 erstellte Karten der Monitoringfläche zum Einzeichnen der Vegetationseinheiten ggf. Rucksack-GPS (z.B. LEICA GS 50) Schreibutensilien (feiner Bleistift, Geodreieck, Radiergummi) Geräte und Materialien für die Wasserstufenkartierung 162 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme - Benötigte Geräte und Materialien Topografische Karte und Orthofoto mit Abgrenzung der Monitoringfläche Kopie der TK im Maßstab 1 : 5000 (Geländeskizze) Literatur zu den Wasserstufenamplituden der Arten ca. 20 Fluchtstangen bzw. Rucksack-GPS (z.B. LEICA GS 50) Schreibutensilien (feiner Bleistift, Zirkel, Geodreieck, Radiergummi) Geräte und Materialien zur Bestimmung der oberirdischen Phytomasse - Ortho-Foto mit eingezeichnetem Flächendesign Rahmen zur Abgrenzung der 1 m² großen Probeflächen Schere bzw. Handsichel Waage (möglichst mit Eignung bis zu 5 kg) 5 Säcke (z.B. ”Gelber Sack”) zum Wiegen und Transport ggf. Rucksack-GPS (z.B. LEICA GS 50) zur Zerkleinerung im Labor: Tüten, Filmdöschen, Etiketten, Edding sowie Staubschutzmaske 4.6 Geräte und Materialien für die faunistische Geländearbeit Geräte und Materialien für die Heuschreckenkartierung - - - Topografische Karte / Orthofoto mit Lage und Abgrenzung der Monitoringfläche sowie der Transekte ggf. Rucksack-GPS zum Wiederauffinden der Transekte (z.B. LEICA GS 50) Magnetsuchgerät Fangkescher Vegetationshürde (Bestimmung der horizontalen Durchsicht in höherwüchsigen Vegetationsbeständen) Ultraschallfrequenzmodulator (Bat-Detektor) Thermometer (aktuelle Witterungsbedingungen) Kompass Maßband, Zollstock und Markierungsstangen (Fluchtstangen) Bestimmungsliteratur Kamera (Beleg- und Habitataufnahmen) und ggf. Tonband-Aufnahmegerät ggf. Isolationsquadrat mit 1 m² Fangfläche (quantitative Erfassung) Geräte und Materialien für die Tagfalter- u. Widderchenkartierung - - Topografische Karte / Orthofoto mit Lage und Abgrenzung der Monitoringfläche sowie der Probefläche/n Fangkescher Thermometer (aktuelle Witterungsbedingungen) Kompass Bestimmungsliteratur Kamera (Beleg- und Habitataufnahmen) Geräte und Materialien für die Libellenkartierung - Topografische Karte / Orthofoto mit Lage und Abgrenzung der Untersuchungsgewässer bzw. Imagines- und Exuvien-Probefläche/n 163 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme - Benötigte Geräte und Materialien ggf. Rucksack-GPS zum Wiederauffinden der Probeflächen (z.B. LEICA GS 50) Fangkescher mit Teleskopstiel Maßband, Zollstock Thermometer (aktuelle Witterungsbedingungen) Fernglas (mit geringer Naheinstellgrenze) Bestimmungsliteratur Kamera (Beleg- und Habitataufnahmen) Gummistiefel, ggf. Wathose Aufbewahrungsbehältnisse für Exuvien (Filmdosen, Schraubdeckelgläser u. a.) Magnetsuchgerät Geräte und Materialien für die Laufkäfererfassung mittels Bodenfallen - Topografische Karte mit Lage und Abgrenzung der Messfeld-Probeflächen bzw. Vegetationsdauer- - quadrate als Bodenfallenstandorte in den Monitoringflächen ggf. Rucksack-GPS und Magnetsuchgerät zum Wiederauffinden (z.B. LEICA GS 50) Installation: HT-Rohre (Regenwasserabflussrohre von 7,0 cm Durchmesser) Fangbecher (250 g Joghurtbecher mit 6,8 cm Durchmesser) Regenabdeckung (z. B. flexible ! Plexiglasdächer) mit je 3 Metallspießen / Dach Handschaufel, Erdbohrer Maßband, Zollstock Fangflüssigkeit (Isopranol-Glycerin-Gemisch) + Detergenz (z. B. einige Tropfen Spülmittel) ggf. Baueisen und Hammer (2-4 Eisen / Falle als Beweidungsschutz) Evtl. Flatterband zur Markierung besonders in unübersichtlichem Gelände Wasserfester Stift zur Beschriftung Leerungen: Wechsel-Fangflüssigkeit (s. oben) Ersatzbecher, HT-Rohre und -Abdeckungen PE-Frischhaltefolien oder Schraubdeckelgläser (Fänge / Bodenfalle) - Zollstock bzw. Vegetationshürde (zur Bestimmung der horizontalen Durchsicht) Wasserfester Stift zur Beschriftung Große Pinzette zur Entfernung von Fremdkörpern Spritzflasche Korb oder Kiste für Transport der Fänge Geräte und Materialien für die Amphibienkartierung - - Topografische Karte / Orthofoto mit Lage und Abgrenzung der Untersuchungsgewässer bzw. der Probeflächen ggf. Rucksack-GPS (z.B. LEICA GS 50) Fangkescher mit Teleskopstiel Taschenlampe Gummistiefel, ggf. Wathose Bestimmungsliteratur Kamera (Beleg- und Habitataufnahmen) und ggf. Tonband-Aufnahmegerät 164 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Benötigte Geräte und Materialien Geräte und Materialien für die Regenwurmerfassung - - Topografische Karte / Orthofoto mit Lage und Abgrenzung der Monitoringfläche und der MessfeldProbeflächen (Standard-Flächendesign) GPS und Magnetsuchgerät zum Wiederfinden Probenahme: Stechrahmen, Maßband, Zollstock, Spaten, 0,2%ige Formalinlösung (Tiefenaustreibung). Für Aussortierung: Bodenplane, Arbeitsplatte (ggf. Tisch), Stühle Begleituntersuchungen: Bodenthermometer, Handschaufel (Bodenfeuchte-Probe) Aufbewahrung der Tiere: Kühlbox, Wasser 34 (Abspülen der Individuen von Formalinaustreibung), PE-Beutel (Individuen von - 34 1/16 m²-Probe + Erdmaterial, Bodenstreu vom Standort; ggf. + Zellulose) Wasserfester Stift bzw. Kugelschreiber Bei umgehender Bestimmung (spätestens 24 Stunden nach Probennahme) dient das Wasser bei kühler Lagerung auch als Aufbewahrungsmedium mit dem Vorteil, dass die Tiere bereits gesäubert sind. 165 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme 5 Literaturverzeichnis Literaturverzeichnis ABRAHAM, R. (1991): Fang und Präparation wirbelloser Tiere. - Gustav Fischer Verlag, Stuttgart - New York, 132 S. AG BODEN (1994): Bodenkundliche Kartieranleitung. - 4. verbesserte Aufl., KA4, Ad-hoc-Arbeitsgruppe Boden der Geologischen Landesämter und der Bundesanstalt für Geowissenschaften und Rohstoffe, Hannover, 392 S. AG BODEN (1997; Hrsg.): Labormethoden-Dokumentation Bodenkunde (Entwurf), Arbeitsanleitung für die Untersuchung von Böden der Ad-hoc-Arbeitsgruppe Boden der Bundesanstalt für Geowissenschaften und Rohstoffe, Hannover, ? S. AG BODEN (2005): Bodenkundliche Kartieranleitung. 5. verbesserte Aufl., KA5, Ad-hoc-Arbeitsgruppe Boden der Geologischen Landesämter und der Bundesanstalt für Geowissenschaften und Rohstoffe, Hannover, 438 S. ALBRECHT, L. (1990): Grundlagen, Ziele und Methodik der waldökologischen Forschung in Naturwaldreservaten. - Reihe: Naturwaldreservate in Bayern, Band 1, Schriftenreihe des Bay. STMELF Band 1, 221 S. ALEF, K. (1991): Methodenhandbuch Bodenmikrobiologie. - ecomed-Verlagsgesellschaft, Landsberg / Lech, 284 S. ANDERSON, J.P.E. & K.H. DOMSCH (1978): A physiological method for the quantitative measurement of microbial biomass in soils. - Soil Biol. Biochem. 10: S. 215-221 ANDERSON, T.-H. & K. H. DOMSCH (1993): The metabolic quotient for CO2 (qCO2) as a specific activity parameter to assess the effects of environmetal conditions, such as pH, on the microbial biomass of forest soils. - Soil Biol. Biochem. 25: S. 393-395 AUTORENKOLLEKTIV (1981): Um Eberswalde, Chorin und den Werbellinsee. - Werte unserer Heimat 34, Akademie Verlag, Berlin: 209 S. BAEHR, M. (1987): Laufkäfer als Indikatoren für die Bewertung von Biotoptypen, dargestellt am Beispiel der Erhebungen im Landkreis Weißenburg-Gunzenhausen. – Schr.-R. Bayr. Landesamt f. Umweltschutz, 77: S. 17-23. BASEDOW, T. (1998): Langfristige Bestandsveränderungen von Arthropoden in der Feldflur, ihre Ursachen und deren Bedeutung für den Naturschutz, gezeigt an Laufkäfern (Carabidae) in SchleswigHolstein, 1971-96, S. 215-227 - In: DRÖSCHMEISTER, R. (1998): Die Bedeutung ökologischer Langzeitforschung für den Naturschutz. - Schriftenreihe für Landschaftspflege und Naturschutz, 58, Bonn-Bad Godesberg, 435 S. BECK, T. (1984): Mikrobiologische und biochemische Charakterisierung landwirtschaftlich genutzter Böden. Z. Pflanzenernährung und Bodenkunde, 147, S. 456-742. BELLMANN, H. (1993a): Heuschrecken - beobachten, bestimmen. - 2. Aufl. - Naturbuch Verlag, Augsburg; 166 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Literaturverzeichnis 349 S. BELLMANN, H. (1993b): Die Stimmen der heimischen Heuschrecken. - CD; Weltbildverlag, Augsburg. BfN [(Bundesamt für Naturschutz Hrsg.)] (2000): Konzepte und Methoden zur Ökologischen Flächenstichprobe – Ebene II: Monitoring von Tieren und Pflanzen. – Schriftenreihe Angewandte Landschaftsökologie 33, 262 S. BMELF / BUNDESMINISTERIUM FÜR ERNÄHRUNG, LANDWIRTSCHAFT UND FORSTEN (1994): Bundesweite Bodenzustandserhebung im Wald (BZE) – Arbeitsanleitung. - 2. Aufl., Bonn. BODE, M & H.-P. BLUME (1995): Einfluss von Bodenbearbeitung und Düngung auf die biologische Aktivität und die mikrobielle Biomasse. - Mitt. Deut. Bodenkundl. Gesellsch. 76: S. 596-572 BRAMER, H., HENDL, M., MARCINEK, J., NITZ, B., RUCHHOLZ, K. & S. SLOBODDA (1991): Physische Geographie. Mecklenburg-Vorpommern, Brandenburg, Sachsen-Anhalt, Sachsen, Thüringen. - Hermann Haack Verlagsgesellschaft mbH, Geographisch-Kartographische Anstalt Gotha: 627 S. BROCKSIEPER, R. (1978): Der Einfluss des Mikroklimas auf die Verbreitung der Laubheuschrecken, Grillen und Feldheuschrecken im Siebengebirge und auf dem Rodderberg bei Bonn (Orthoptera: Saltatoria). - Decheniana-Beihefte (Bonn) Nr. 21, 141 S. BRUCKHAUS, A. & P. DETZEL (1997): Erfassung und Bewertung von Heuschreckenpopulationen. - Naturschutz und Landschaftsplanung 29 (5), S. 138-145 DETZEL, P. (1998; Hrsg.): Die Heuschrecken Baden-Württembergs. - Ulmer Verlag, Stuttgart, 580 S. DIERSCHKE, H. (1994): Pflanzensoziologie. – Stuttgart: Verlag Eugen Ulmer, 683 S. DINKELBERG, W., RITSCHEL, J. & R., SCHULTZ-STERNBERG: Problematik der Stoffbelastung von Überschwemmungsböden. Tag.ber. LUA , 24, S. 26 - 30. DIVERSE AUTOREN (1999): Themenheft zur Ökosystemaren Umweltbeobachtung: Beitr. Forstwirtschaft u. Landschaftsökologie, 33 (2), 47 S. DORDA, D. (1995): Heuschreckenzönosen als Bioindikatoren auf Sand- und submediterranen KalkMagerrasen des saarländisch-lothringischen Schichtstufenlandes. - Diss. Universität des Saarlandes, 253 S. DUNGER, W. & H. J. FIEDLER (Hrsg.) (1989): Methoden der Bodenbiologie. - VEB Gustav Fischer Verlag Jena, 432 S. DÜLGE, R., ANDRETZKE, H., HANDKE, K., HELLBERND-TIEMANN, L. & RODE, M. (1994): Beurteilung nordwestdeutscher Feuchtgrünland-Standorte mit Hilfe von Laufkäfergesellschaften (Coleoptera: Carabidae). Natur und Landschaft 69 (4), S. 148-156. DVWK / DEUTSCHER VERBAND FÜR WASSERWIRTSCHAFT UND KULTURBAU E.V. (1996): Bodenerosion durch Wasser - Kartieranleitung zur Erfassung aktueller Erosionsformen, DVWK- 167 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Literaturverzeichnis Fachausschuß “Bodenerosion”. - Merkblätter zur Wasserwirtschaft 239/1996, 62 S. EBERT, G. & E. RENNWALD (1991; Hrsg.): Die Schmetterlinge Baden-Württembergs, Band 1: Tagfalter I. Ulmer Verlag, Stuttgart, 522 S. EHRENDORFER, F. (1973) (Hrsg.): Liste der Gefäßpflanzen Mitteleuropas. – 2. erw. Aufl., Gustav Fischer Verlag, Stuttgart XII + 318 S. EIJKELKAMP (1990): Sandbox and pressure membran apparaturs for soil moisture characteristics determination. - Brochure no: 08.01-08.03/90/E, Eijkelkamp Agrisearch Equipment, Giesbeek (Netherlands). EIJKELKAMP (1992): Betriebsanleitung 08.03.03. - Kompressor, M1.08.03.03.92.D, Eijkelkamp Agrisearch Equipment, Giesbeek (Netherlands). EINERT, E. & R. BARTH (2001): Deposition von Luftschadstoffen in Waldbeständen Brandenburgs. – In: LANDESFORSTANSTALT BRANDENBURG (Hrsg.) (1998): Forstliche Umweltkontrolle. Ergebnisse aus zehnjährigen Untersuchungen zur Wirkung von Luftverunreinigungen in Brandenburgs Wäldern. Eberswalde, Potsdam, 264 S. ELLENBERG, H., H.-E. WEBER, R. DÜLL, V. WIRTH, W. WERNER, & D. PAULIßEN (1992): Zeigerwerte von Pflanzen in Mitteleuropa. - 2. Auflage, Scripta Geobotanica, Bd. 18, Göttingen 258 S. ESSER, T. (1997): Artenvielfalt in der modernen Agrarlandschaft: Der Feldrain rekultivierter Anbauflächen als Lebensraum für Spinnen (Arachnida, Aranae) und Asseln (Isopoda, Oniscoidea). - Acta Biologica Benrodis, Supplementband 6, Solingen, 132 S. FARTMANN, T. (1997): Biozönologische Untersuchungen zur Heuschreckenfauna auf Magerrasen im Naturpark Märkische Schweiz (Ostbrandenburg), S. 1-62- In: MATTES, H. (Hrsg.) Ökologische Untersuchungen zur Heuschreckenfauna in Brandenburg und Westfalen. - Arbeiten aus dem Institut für Landschaftsökologie Westfälische Wilhelms-Universität, Band 3, Münster, 188 S. FILSER, J., FROMM, H., MOMMERTZ, S., NAGEL, R. F. & K. WINTER (1995): Einsatzmöglichkeiten von Regenwürmern, Collembolen und Mikroorganismen als Indikatoren für Bodenzustände. - Mitteilung der Deutschen Bodenkundlichen Gesellschaft.: 75: S. 31-34. FINCK, P., HAMMER, D. KLEIN, M (1992): Empfehlungen für faunistisch-ökologische Datenerhebungen und ihre naturschutzfachliche Bewertung im Rahmen von Pflege- und Entwicklungsplänen für Naturschutzgroßprojekte des Bundes. - Natur und Landschaft 67 (7/8): S. 329-340. FRIELINGHAUS, M. (Hrsg.) (1997): Merkblätter zur Bodenerosion in Brandenburg. - ZALF-Bericht Nr. 27, Zentrum für Agrarlandschafts- und Landnutzungsforschung (ZALF) e.V., Müncheberg, 52 S. FROEHLICH, C. (1989): Freilanduntersuchungen an Heuschrecken (Orthoptera: Saltatoria) mit Hilfe des Fledermausdetektors - Neue Erfahrungen. - Articulata 4: S. 6-10 GELBRECHT, J., EICHSTÄDT, D., GÖRITZ, U., KALLIES, A., KÜHNE, L., RICHERT, A., RÖDEL, J.,SOBCZYK, T. & M., WEIDLICH (2001): Gesamtartenliste und Rote Liste der Schmetterlinge („Macrolepidop- 168 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Literaturverzeichnis tera“) des Landes Brandenburg. – Naturschutz und Landschaftspflege in Brandenburg 10 (3) Beilage, 62 S. GERKEN, B. & K. STERNBERG (1999): Die Exuvien europäischer Libellen (Insecta: Odonata). - Verlag und Werbeagentur, Höxter, 354 S. GOLDSCHMIDT, B. & W.-G. VAHRSON (1997): Abschlußbericht des Forschungsprojektes „Entwicklung und Erprobung eines Monitoring-Konzeptes im Gartzer Bruch“. - unveröff. Bericht, Eberswalde, 88 S. XX GRAFF, O. (1953): Die Regenwürmer Deutschlands. - Verlag M. & H. Schaper, Hannover, 81 S. GRAFF, O. (1983): Unsere Regenwürmer: Lexikon für Freunde der Bodenbiologie. - Verlag M. & H. Schaper, Hannover, 112 S. GRÄNITZ, F. & L. GRUNDMANN (2002; HRSG.): Um Eberswalde, Chorin und den Werbellinsee: eine landeskundliche Bestandsaufnahme im Raum Eberswalde, Hohenfinow und Joachimsthal. – Werte unserer Heimat, Bd. 64, Böhlau Verlag, Köln, 390 S. GRIMM, J. & BORK, H. R. (1996): Bodendauerbeobachtung zur Bodenzustandsbeschreibung und überwachung im Land Brandenburg, Abschlußbericht Dez. 1996, Hrsg.: Zentrum für Agrarlandschafts- und Landnutzungsforschung e.V. (ZALF), Müncheberg. 154 S. GRIMM, J. & WIRTH, S. (1995): Bodendauerbeobachtung in Brandenburg - Untersuchungen zur mikrobiellen Biomasse. - Mitteilungen der Deutschen Bodenkundlichen Gesellschaft, 76: S 605-608 GRIMM, J. & WIRTH, S. (1998): Long-term soil observation in the German County of Brandenburg: soil microbiological characteristics. Proceeding, 16th World Congress of Soil Sciencs, Montpellier, Frankreich (CD ROM, symp25/1455-t.pdf). GUNN, A. (1992): The use of mustard to estimate earthworm populations. - Pedobiologia 36: S. 65-67 GÜNTHER, R. (1996; Hrsg.): Die Amphibien und Reptilien Deutschlands. - Gustav Fischer Verlag, Jena, 825 S. HANDKE, K. & K. MENKE (1995): Laufkäferfauna von Röhrichten und Grünlandbrachen - NaturschutzBedeutung feuchter Brachflächen in der Bremer Flußmarsch. - Naturschutz und Landschaftsplanung 27 (3): S. 105-114 HÄNGGI, A. (1989): Erfolgskontrollen in Naturschutzgebieten - Gedanken zur Notwendigkeit der Erfolgskontrolle und Vorschlag einer Methode anhand der Spinnenfauna. - Natur und Landschaft, 64 (4): S. 143-146 HARTER, A. & V. LUTHARDT (1996): Untersuchungen zur Reaktion von Boden und Vegetation auf Wiedervernässung von degradierten Niedermoorböden an zwei Beispielsgebieten verschiedenen Moortyps im nordostdeutschen Tiefland. – Abschlußbericht 1996 A8/68009/5 – 7(A8-3/93), im Auftrag des Landesumweltamtes Brandenburg, Band 1, Ergebnisteil, 220 S., Eberswalde. HARTER, A. & V. LUTHARDT (1998): Monitoring in wiedervernässten Niedermooren Brandenburgs – Reak- 169 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Literaturverzeichnis tionen, Entwicklungen, Perspektiven. S. 139-154. In VAHRSON, W.G. (Hrsg.) (1998): Naturschutzbezogenes Monitoring von Landschaften, Eberswalder wissenschaftliche Schriften, (2): Deutscher Landwirtschaftsverlag, Berlin, 165 S. HARTER, A. (1998): Renaturierungsversuche auf degradierten Niedermoorböden – Untersuchungen zur Reaktion von Boden und Vegetation auf Wiedervernässung in zwei Niedermoorgebieten Brandenburgs. – Diss., Humboldt Uni Berlin, Landwirtschaftl.-Gärtnerische Fakultät, 191 S. HEIDEMANN, H. & R. SEIDENBUSCH (1993): Die Libellenlarven Deutschlands und Frankreichs. - Handbuch für Exuviensammler. - Erna Bauer, Keltern, 391 S. HEINEMEYER, O., H. INSAM, E.A. KAISER & WALENZIK (1989): Soil microbial biomass and respiration measurements: An automated technique based on infra-red gas analysis. - Plant Soil, 116: S. 191-195 HERMANN, G. (1992): Tagfalter und Widderchen. Methodisches Vorgehen bei Bestandsaufnahmen zu Naturschutz- und Eingriffsplanungen, S. 219-238. In: TRAUTNER, J. (Hrsg.) (1992): Arten- und Biotopschutz in der Planung: Methodische Standards zur Erfassung von Tierartengruppen (BVDL-Tagung Bad Wurzach 9.-10. Nov. 1991); Ökologie in Forschung und Anwendung, 5, 254 S. HERMANN, G. (1998): Erfassung von Präimaginalstadien bei Tagfaltern. - Naturschutz und Landschaftsplanung 30 (5): 133-142. HERR, S. & J. BAUCHHENSS (1987): Einfacher Bestimmungsschlüssel für Regenwürmer. - Schule und Beratung (2): III-15 - III-19. HOFMANN, G. (1997): Konzept zur ökosystemaren Umweltbeobachtung für die Ökosystemtypen Wälder und Forsten der Biosphärenreservate Schorfheide-Chorin und Spreewald. - Gutachten im Auftrag der Fachhochschule Eberswalde, 122 S. HOFMANN, G., JENSSEN, M. & S. ANDERS (1999): Umweltbeobachtung in Wäldern und Forsten auf der Grundlage von Ökosystemtypen. - Beitr. Forstwirtschaft u. Landschaftsökologie 2, S. 55-63. INGRISCH, S. & G. KÖHLER (1998): Die Heuschrecken Mitteleuropas. - Die Neue Brehm-Bücherei; Bd. 629, Westharp-Wiss., Magdeburg, 460 S. KÄMMERER, A. (1996): Erhebung der Regenwurmfauna im Finowtal (Kreis Eberswalde) und in der Sernitzniederung (Kreis Angermünde) mit ökologischer Bewertung III - 1995. Gutachten im Auftrag der Fachhochschule Eberswalde, 18 S. KIECHLE, J. (1992): Die Bearbeitung landschaftsökologischer Fragestellungen anhand von Spinnen, S. 119134. In: TRAUTNER, J. (Hrsg.) (1992): Arten- und Biotopschutz in der Planung: Methodische Standards zur Erfassung von Tierartengruppen (BVDL-Tagung Bad Wurzach 9.-10. Nov. 1991); Ökologie in Forschung und Anwendung, 5, 254 S. KLAFS, G., JESCHKE, L. & H. SCHMIDT (1973): Genese und Systematik wasserführender Ackerhohlformen in den Nordbezirken der DDR. – Archiv für Naturschutz u. Landschaftsforschung 13 (4): S. 170 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Literaturverzeichnis 280-307 KLATT, R., BRAASCH, D., HÖHNEN, R., LANDECK, I., MACHATZI, B., VOSSEN, B.(1999): Rote Liste und Artenliste der Heuschrecken des Landes Brandenburg. Hrsg. Landesumweltamt Brandenburg. Naturschutz und Landschaftspflege in Brandenburg 8 (1): Beilage, 19 S. KLAWITTER, J., RÄTZEL, S. & SCHAEPE, A. (2002): Gesamtartenliste und Rote Liste der Moose des Landes Brandenburg. - Naturschutz und Landschaftspflege in Brandenburg 11 (4), Beilage KLEINERT, H. (1991): Heuschrecken als Bioindikatoren?. - Articulata 6 (2): S. 149-153. KOEPKE, V. (1989; Hrsg.): Bodenwasserregulierung. Anleitung zur Standortkennzeichnung und Anlagendiagnose. – Müncheberg: AdL, FZB Müncheberg: S. 48 – 55 KOEPKE, V., MENNING, P., REINHOLD, A., SUCCOW, M. STÜDEMANN, O. & E. VETTERLEIN (1985): Anleitung zur hydrologischen Standortaufnahme. - VEB Ingenieurbüro für Meliorationen, Bad Freienwalde, 71 S. KRATZERT, G. (1998): Die Trockenrasen der Gabower Hänge am Oderbruch. – unveröff. Dipl.-Arb. Bot. Inst., Math.-Naturwiss. Fakultät, Univ. Kiel, 104 S. LABO (1999): Boden-Dauerbeobachutng, Ad-hoc-Arbeitsgruppe Boden-Dauerbeobachtung der Bund / Länder – Arbeitsgemeinschaft Bodenschutz (LABO), Arbeitskreis 2 – Bodeninformationssysteme, Sitzungsunterlage für die 15. Sitzung am 09./10.02. 1999 in Potsdam. LAUßMANN, H (1999): Die mitteleuropäische Agrarlandschaft als Lebensraum für Heuschrecken (Orthoptera: Saltatoria). – Bern; Hannover: vaö-Verlag Agrarökologie, 215 S. LUA / LANDESUMWELTAMT BRANDENBURG (Hrsg.) (1995): Luftqualität in Brandenburg. Jahresbericht 1994, 129 S. LUA / LANDESUMWELTAMT BRANDENBURG (Hrsg.) (1996): Luftqualität in Brandenburg. Jahresbericht 1995, 119 S. LUA / LANDESUMWELTAMT BRANDENBURG (Hrsg.) (1997): Luftqualität in Brandenburg. Jahresbericht 1996, 80 S. LUA / LANDESUMWELTAMT BRANDENBURG (Hrsg.) (1998): Luftqualität in Brandenburg. Jahresbericht 1997, 84 S. LUA / LANDESUMWELTAMT BRANDENBURG (Hrsg.) (1999): Luftqualität in Brandenburg. Jahresbericht 1998, 62 S. LUA / LANDESUMWELTAMT BRANDENBURG (Hrsg.) (2000): Luftqualität in Brandenburg. Jahresbericht 1999, 76 S. LUA / LANDESUMWELTAMT BRANDENBURG (Hrsg.) (2001): Luftqualität in Brandenburg. Jahresbericht 2000, 57 S. LUA / LANDESUMWELTAMT BRANDENBURG (Hrsg.) (2002): Luftqualität in Brandenburg. Jahresbericht 171 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Literaturverzeichnis 2001, 51 S. LUA / LANDESUMWELTAMT BRANDENBURG (Hrsg.) (2004): Biotopkartierung Brandenburg. Band 1: Kartieranleitung und Anlagen. Potsdam. 312 S. LUTHARDT, V. & BRAUNER, O. (2002): Biodiversität ausgewählter Ökosystemtypen der Offenlandschaft – Analyse mittels Dauerbeobachtungen. - Beitr. Forstwirtschaft u. Landschaftsökologie, 36 (2002) LUTHARDT, V. (1993): Ist-Zustand sowie Sanierungs-und Bewirtschaftungsvorschläge für landwirtschaftlich genutzte Niedermoore am Beispiel des Finowtalmoores bei Eberswalde und der Sernitzniederung bei Greifenberg. FO.Bericht im Auftrag des MUNR Brandenburg, Potsdam, unveröffentlicht, 214 S. LUTHARDT, V. (2003): Konzeption der Ökosystemaren Umweltbeobachtung (ÖUB) des Offenlandes für das UNESCO-Biosphärenreservat Flusslandschaft Elbe-Brandenburg. - Projektbericht i. A. der LAGS, FH Eberswalde, FB 2, 93 S.+ Anhang LUTHARDT, V. (2005): Lebensräume im Wandel - Bericht zur ökosystemaren Umweltbeobachtung (ÖUB) in den Biosphärenreservaten Brandenburgs. Fachbeiträge des LUA (94), Eigenverlag Potsdam, 188 S. LUTHARDT, V., VAHRSON, W.-G. & F. DREGER (1999): Konzeption und Aufbau der Ökosystemaren Umweltbeobachtung für die Biosphärenreservate Brandenburgs. - Natur und Landschaft 74 (4): 135-143 MATTICK, S. (1997): Verfahren zur Berechnung von Immissionen für beliebige Orte aus den Daten des Luftgütemessnetzes, S. 141-145 - In: LANDESUMWELTAMT BRANDENBURG (Hrsg.) (1997): Berichte aus der Arbeit 1996. Potsdam,184 S. MAUERSBERGER, R. (2000): Artenliste und Rote Liste der Libellen (Odonata) des Landes Brandenburg. – Naturschutz und Landschaftspflege in Brandenburg 9 (4): Beilage 23 S. MEIWES, K.J.(1984): Chemische Untersuchungsverfahren zur Charakterisierung und Bewertung der Versauerung in Waldböden, Ber. Forsch. Waldöko., Band 7, Göttingen 142 S. MICHAELIS, D. (1996): Standort- und vegetationskundliche Untersuchungen im Naturschutzgebiet „Plagefenn“. – unveröff. Dipl.-Arb., Math.-Naturwiss. Fakultät, Univ. Greifswald, 136 S. MÜHLENBERG, M. (1993): Freilandökologie. – Heidelberg; Wiesbaden: Verlag Quelle und Meyer, 512 S. MÜLLER, J. (1984): Die Bedeutung der Fallenfang - Methode für die Lösung ökologischer Fragestellungen. - Zool. Jb. Syst., 111: S. 281-305. MÜNCH, D. (1991): Erfassung von Amphibien-Populationen - Hinweise und Kriterien zur UVP bei Straßenbau-Vorhaben. - Naturschutz und Landschaftsplanung 23 (6): S. 232-237. NIETFELD, A. (1994): Dauerbeobachtungen als Bestandteil ökosystemorientierter Umweltbeobachtung. – Technische Universität Berlin, FB Umwelt und Gesellschaft, Schriftenreihe Landschaftsent- 172 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Literaturverzeichnis wicklung und Umweltforschung, Nr. 92, Berlin, 213 S. NOWAK, E., BLAB, J. & R. BLESS (1994): Rote Liste der gefährdeten Wirbeltiere in Deutschland. - Sch. R. f. Landschaftspflege u. Naturschutz, 42, Kilda-Verlag, Grieven, 190 S. OPPERMANN, R. (1989): Ein Meßinstrument zur Ermittlung der Vegetationsdichte in grasig-krautigen Pflanzenbeständen. - Natur und Landschaft. 64 (7/8): S. 332-338. OPPERMANN, R. (1987): Tierökologische Untersuchungen zum Biotopmanagement in Feuchtwiesen. - Natur und Landschaft 62 (6): S. 235-241. PASSARGE, H. (1996): Pflanzengesellschaften Nordostdeutschlands. Band 1. Hydro- und Therophytosa, Hirth in der Gebr.-Borntraeger-Verl.-Buchh, Berlin, Stuttgart, 298 S. PASSARGE, H. (1999): Pflanzengesellschaften Nordostdeutschlands. Band 2. Helocyperosa und Caespitosa, Cramer in der Gebr.-Borntraeger-Verl.-Buchh, Berlin, Stuttgart, 451 S. PLATEN, R., BLICK, T., BLISS, P., DROGLA, R., MALTEN, A., MARTENS, J., SACHER, P. & J. WUNDERLICH (1995): Verzeichnis der Spinnentiere (excl. Acarida) Deutschlands (Arachnida: Araneida, Opilionida, Pseudoscorpionida). - Arachnol. Mitt. Sonderband 1: S. 1-55. PLATEN, R., BROEN, v. B., HERMANN, A., PRATSCHKER, U.M. & P. SACHER (1999): Gesamtartenliste und Rote Liste der Webspinnen, Weberknechte und Pseudoskorpione des Landes Brandenburg (Arachnida: Aranae, Opiliones, Pseudoscorpiones) mit Angaben zur Häufigkeit und Ökologie. Naturschutz und Landschaftspflege in Brandenburg 8 (2): Beilage 79 S. POTT, R. (1995): Die Pflanzengesellschaften Deutschlands. Ulmer, Stuttgart 622 S. RECK, H. (1990): Zur Auswahl von Tiergruppen als Biodeskriptoren für den zoologischen Fachbeitrag zu Eingriffsplanungen, S. 99-119- In: RIECKEN, U. (Hrsg.) (1990): Möglichkeiten und Grenzen der Bioindikation durch Tierarten und Tiergruppen im Rahmen raumrelevanter Planungen. Schr. R. f. Landschaftspfl. u. Natursch., 32:, Bonn-Bad Godesberg, 228 S. RECK, H. (1992): Arten- und Biotopschutz in der Planung - Empfehlungen zum Untersuchungsaufwand und zu Untersuchungsmethoden für die Erfassung von Biodeskriptoren. - Naturschutz und Landschaftsplanung 24 (4): S. 129-135. REINHARD, U. (1992): Methodische Standards für Amphibien-Gutachten, S. 39-52 - In: TRAUTNER, J. (Hrsg.) (1992): Arten- und Biotopschutz in der Planung: Methodische Standards zur Erfassung von Tierartengruppen (BVDL-Tagung Bad Wurzach 9.-10. Nov. 1991); Ökologie in Forschung und Anwendung, 5: Verlag Josef Margraf, Weikersheim, 254 S. RIECKEN, U. (1992a): Planungsbezogene Bioindikation durch Tierarten und Tiergruppen – Grundlagen und Anwendung. - Schr.-Reihe für Landschaftspflege und Naturschutz 36, Bonn-Bad Godesberg, 187 S. RIECKEN, U. (1992b; Hrsg.): Möglichkeiten und Grenzen der Bioindikation durch Tierarten und Tiergruppen im Rahmen raumrelevanter Planungen. - Schr.-Reihe für Landschaftspflege und Natur- 173 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Literaturverzeichnis schutz 32, Bonn-Bad Godesberg, 228 S. RUMP, H.H. & H. KRIST (1992): Laborhandbuch für die Untersuchung von Wasser, Abwasser und Boden. 2. korr. Aufl., VCH Verlagsgesellschaft, Weinheim, 206 S. SAG (1991): Konzeption zur Einrichtung von Boden-Dauerbeobachtungsflächen : Bericht der Unterarbeitsgruppe "Boden-Dauerbeobachtungsflächen" / Hrsg. von der Sonderarbeitsgruppe "Informationsgrundlagen Bodenschutz" (SAG), Arbeitshefte Bodenschutz 1 der Sonderarbeitsgruppe "Informationsgrundlagen Bodenschutz" der Umweltministerkonferenz, München, 56 S. + Anhang. SÄNGER, K. (1977): Über die Beziehungen zwischen Heuschrecken (Orthoptera: Saltatoria) und der Raumstruktur ihrer Habitate. - Zool. Jb. Syst., Jena 104: S. 433-488 SAUERBREI, R. & W. SCHMIDT (1995): Bodenentwicklung auf entwässerten und landwirtschaftlich genutzten Niedermooren. - In: Naturschutz und Landschaftspflege in Brandenburg – Sonderheft Niedermoore, S. 5-11 SCHACHTSCHABEL, P. (1956): Der Magnesiumversorgungsgrad nordwestdeutscher Böden und seine Beziehungen zum Auftreten von Mangelsymptomen an Kartoffeln. Zeitschrift Pflanzenernährung und Bodenkunde 74, S. 202-219. SCHEFFLER, I., K.-H. KIELHORN, D.W. WRASE, H. KORGE & D. BRAASCH (1999): Rote Liste Laufkäfer des Landes Brandenburg (Coleoptera: Carabidae). – Naturschutz und Landschaftspflege in Brandenburg 8 (4). Beilage, 27 S. SCHLICHTING, E. (1995): Bodenkundliches Praktikum. - aus der Reihe Pareys Studientexte 81, 2. neubearb. Aufl., Blackwell Wissenschafts-Verlag, Berlin – Wien, 295 S. SCHMIDT, R., MONSE, M., ALBERT, J. & B. SCHOLZ (1998): Regionalisierung von Bodenschutzdaten auf Auenstandorten. FO- Bericht im Auftrag des LUA Brandenburg, FH Eberswalde, 76 S. + Anhang. SCHMIDT, W. (1981): Kennzeichnung und Beurteilung der Bodenentwicklung auf Niedermoor unter besonderer Berücksichtigung der Gegradierung. - Abschlußbericht 12/1981, Inst. f. Futterproduktion Paulinaue, ? S. SCHMIDT, W. (1986): Zur Bestimmung der Einheitswasserzahl von Torfen. - Arch. Acker-Pflanzenbau Bodenkd., Berlin, Band 30, Heft 5: S. 251-257 SCHNELLE, F. (1955): Pflanzen-Phänologie. Akademische Verlagsgesellschaft Geest & Portig, Leipzig, 299 S. SCHÖNTHALER, K., SCHULLER, D. & MEYER, U. (1998): Methodenband - Modellhafte Umsetzung und Konkretisierung der Konzeption für eine ökosystemare Umweltbeobachtung am Beispiel des länderübergreifenden Biosphärenreservates Rhön. - Umweltforschungsplan des Bundesministeriums für Umwelt, Naturschutz und Reaktorsicherheit F+E-Vorhaben 10902076/01, i.A. des Bayrischen Staatsministeriums für Landesentwicklung und Umweltfragen und des UBA, Federführung Bosch & Partner GmbH, Königsdorf. 174 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Literaturverzeichnis SCHRÖDTER, H. (1985): Verdunstung. - Springer Verlag. Berlin, Heidelberg, New York, Tokio: 186 S. SCHUBERT, R., HILBIG, W. & S. KLOTZ (1995): Bestimmungsbuch der Pflanzengesellschaften Mittel- und Nordostdeutschlands. – Gustav Fischer Verlag, Jena, 403 S. SCHUSTER, R. (2001): Erfassung und Bewertung von Regenwurmzönosen (Lumbricidae) auf Grünland im Rahmen der ökosystemaren Umweltbeobachtung – Untersuchungen in den Biosphärenreservaten Spreewald und Schorfheide-Chorin / Brandenburg. – unveröff. Dipl.-Arb., FH Eberswalde, FB 2, 88 S. + Anhang. SCHWARTZ, R., NEBELSIEK, A. & A. GRÖNHÖFT (1999): Das Nähr- und Schadstoff-dargebot der Elbe im Wasserkörper sowie in den frischen schwebstoffbürtigen Sedimenten am Meßort Schnackenburg in den Jahren 1994-1997. Hamburger Bodenkdl. Arb. 44, S. 65-83. SETTELE, J., FELDMANN, R. & R. REINHARDT (1999): Die Tagfalter Deutschlands – Ein Handbuch für Freilandökologen, Umweltplaner und Naturschützer. – Ulmer Verlag, Stuttgart, 452 S. SIEDLE, K. (1992): Libellen, Eignung und Methoden, S. 97-109. In: TRAUTNER, J. (Hrsg.) (1992): Artenund Biotopschutz in der Planung: Methodische Standards zur Erfassung von Tierartengruppen (BVDL-Tagung Bad Wurzach 9.-10. Nov. 1991); Ökologie in Forschung und Anwendung, 5, 254 S. SIMS, R.W. & B.M. GERARD (1985): Earthworms : keys and notes for the identification and study of the species, No. 31. E.J. Brill / Dr. W. Backhuys, London, Leiden, Köln, Kopenhagen, 170 S. STEFFNY, H. (1982): Biotopansprüche, Biotopbindung und Populationsstudien an tagfliegenden Schmetterlingen am Schönberg bei Freiburg. - unveröff. Dipl.-Arb. Universität Freiburg, 180 S. STERNBERG, K. & R. BUCHWALD (1999) (Hrsg.): Die Libellen Baden-Württembergs - Band 1: Allgemeiner Teil; Kleinlibellen (Zygoptera). - Ulmer Verlag, Stuttgart, 486 S. STERNBERG, K. & R. BUCHWALD (2000) (Hrsg.): Die Libellen Baden-Württembergs - Band 2: Großlibellen (Anisoptera). - Ulmer Verlag, Stuttgart, 712 S. SUCCOW, M. & H. JOOSTEN (2001) (Hrsg.): Landschaftsökologische Moorkunde. – Stuttgart: E. Schweizerbart‘ sche Verlagsbuchhandlung, 622 S. SUCCOW, M. (1988): Landschaftsökologische Moorkunde. – Jena: VEB Gustav Fischer Verlag, 340 S. TGL (1985a): Aufnahme landwirtschaftlich genutzter Standorte - Moorstandorte, Fachbereichsstandard 24300/04 der Deutschen Demokratischen Republik. TGL (1985b): Physikalische Bodenuntersuchungen – Bestimmung der Korngrößenzusammensetzung nach Köhn, Fachbereichsstandard 31222/02 der Deutschen Demokratischen Republik. THIELEMANN, U. (1989): Untersuchungen zur Regenwurmfauna mit neu entwickelten Methoden in erosionsgefährdeten Gebieten des Kraichgaus. Diss. Ruprecht-Karls-Universität Heidelberg, 134 S. TIMMERMANN, T. (1992): Vegetationskundliche und stratigraphische Untersuchungen in der Meelake 175 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Literaturverzeichnis (Nordostbrandenburg), unveröff. Dipl.-Arbeit, Freie Universität Berlin, 87 S. TRAUTNER, J. (1992): Laufkäfer - Methoden der Bestandsaufnahme und Hinweise für die Auswertung bei Naturschutz- und Eingriffsplanungen, S. 145-162. In: TRAUTNER, J. (Hrsg.): Arten- und Biotopschutz in der Planung: Methodische Standards zur Erfassung von Tierartengruppen (BVDLTagung Bad Wurzach 9.-10. Nov. 1991); Ökologie in Forschung und Anwendung, 5, 254 S. TROSIEN, F. (2001): Ökosystemares Monitoring mit Hilfe terrestrischer Fotografie – Ein Vorschlag zur Methodik am Beispiel der Ökosystemaren Umweltbeobachtung in den Biosphärenreservaten Schorfheide-Chorin und Spreewald, unveröff. Dipl.-Arb., FH Eberswalde, FB 2, 72 S. UBA / Umweltbundesamt (2005): Hintergrundpapier zum Thema Staub / Feinstaub (PM). http://www.umweltbundesamt.de/uba-info-presse/hintergrund/feinstaub.pdf, 28.02.2006) ULRICH, R. (1995): Gewässerrandstreifenprogramm III - Floristische, faunistische und gewässerökologische Bestandserhebung im Kerngebiet - Bd. 3: Tagfalter. - Dr. Maas, Büro für Ökologie und Planung, Saarlouis, i. A. des Zweckverbandes Ill-Renaturierung, 78 S. + Anhang. VAHRSON, W.-G., LUTHARDT, V. & F. DREGER (1997): Konzeption und Aufbau der Ökosystemaren Umweltbeobachtung in den UNESCO-Biosphärenreservaten Schorfheide-Chorin und Spreewald, Projektbericht i. A. der LAGS, FH Eberswalde, FB 2, 118 S. VDLUFA (1991 & 1997): Methodenhandbuch Bd.I (1. und 2. Teillieferung) „Die Untersuchung von Böden“. - 4. Aufl., Verband Deutscher Landwirtschaftlicher Untersuchungs- und Forschungsanstalten), VDLUFA-Verlag Darmstadt. VETTER, F. (1996): Methoden zur Regenwurmextraktion - Vergleich der Formalin-, Senf- und Elektromethode. - Umwelt-Materialien Nr. 62, Hrsg.: Bundesamt für Umwelt, Wald und Landschaft (BUWAL), Bern, 46 S. WACHMANN, E., PLATEN, R., & D. BARNDT (1995): Laufkäfer: Beobachtung, Lebensweise. - Naturbuch Verlag, Augsburg, 295 S. WEIDEMANN, H.J. (1995): Tagfalter. Naturbuch-Verlag, Augsburg, 659 S. WILDE, T. (2000): Regeneration von Ackerböden nach starker landtechnischer Belastung. Forschungsbericht Agrartechnik des Arbeitskreises Forschung und Lehre der Max-Eyth-Gesellschaft Agrartechnik im VDI (349), Selbstverlag, Diss. Christian-Albrecht Universität Kiel, 169 S. WILMANNS, O. (1989): Ökologische Pflanzensoziologie. – Heidelberg: Verlag Quelle & Meyer, UTB 269, 4. Aufl., 378 S. WIRTH, S. (1997): Spatial variability of soil microbial and biochemical parameters across a northern and a southern exposed summit-slope-peat gradient within a typical agricultural tract of landscape in NE Germany, S. 58-65. In: WENDROTH, O. & D.R. NIELSEN (Hrsg.) (1997): Land Surface Process - Sampling the Landscape and Analyzing and Modeling Spatio-Temporal Patterns, ZALF-Bericht 31, 102 S. 176 ÖUB Methodenkatalog Teil A terrestrische Ökosysteme Literaturverzeichnis WIRTH, S. (1998): Regional-scale analysis of spatial continuity of soil microbial biomass (Cmic) and soil basal CO2 respiration across the north-east German agricultural landscape - first results. ‘Land Surface Process II - Monitoring, Analysing and Modeling Spatial and Temporal Patterns in Landscape Research’- workshop at ZALF Müncheberg, 15. April 1998. WISSKIRCHEN, R. & HAEUPLER, H. (1998): Standardliste der Farn- und Blütenpflanzen Deutschlands. – Stuttgart: Verlag Eugen Ulmer, Bundesamt für Naturschutz (Hrsg.), 765 S. WOHLRAB, B., ERNSTBERGER, H., MEUSER, A. & V. SOKOLLEK (1992): Landschaftswasserhaushalt. - Verlag Paul Parey. Hamburg, Berlin: 352 S. ZUCCHI, H. (1990): Gedanken zur Erstellung faunistisch-ökologischer Gutachten – Bewertung aus freilandbiologischer Sicht, LÖLF-Mitteilungen 3/90: S. 13-21. 177 ÖUB Methodenkatalog Teil A Anhang 6. Anhang ÖUB Methodenkatalog Teil A 178 ÖUB Methodenkatalog Teil A 1. Anhang Standard-Flächendesign - Acker hängig mit Catena (Je nach Hanglänge wird eine 3-bzw. 5-stufige Catena installiert) 179 ÖUB Methodenkatalog Teil A Anhang 4. Kuppe W # 5. 7. 1. 10. Oberhang 6. 8. # W 1. 9. 2. W # 3. 11. 2. 10. 4. 12. 10 m 7. # 3. 11. 5. 7. 12. W # 1. 6. 8. 8. 2. 10. 9. # # # W # W 4. 9. 5. 10. W# 3. 11. 4. 11. 5. 7. 12. 6. 9. 3. 2. 1. 12. 6. 8. # W# # # 4. Mittelhang # W 5. 7. 1. 6. 8. 9. 2. 10. 1. # W 3. 11. 2. 10. 4. 12. 11. 5. 7. # 7. 3. 12. # W 1. 6. 8. 8. 2. 10. 4. 9. 9. 5. 10. W# 3. 11. 4. 11. 5. 7. 12. 6. 1. 12. 6. 8. 2. 9. 3. # Unterhang # W # W # W # # 5. 4. Senke # W 7. 1. 6. 8. 2. 10. 3. 11. # W # 4 2. 10. 4. 8 3. 11. 5. 7. 12. Maßstab: 0 # # 1. 9. W# 7. 12. 6. 8. # W 9. 1. 8. 2. 10. 4. 9. 3. 11. 5. 12. 6. 10. W# 4. 11. 5. 7. 1. 12. 6. 8. 2. 9. 3. 1:400 12 16 Meter GPS-Messpunkte Leitprofil mit Angabe der Verschiebungsrichtung der Profilwand (im 12-jährigen Turnus) Beprobungsfeld für Oberbodenproben (siehe dazu Anlage II) Beprobungsfeld für Regenwurm-Erfassung (Zahlen: Turnus der Beprobungsflächen) Fluchtachsen # Bodenfallen für Laufkäfer-Erfassung (genaue Lage nicht definiert vorgegeben; in Abhängigkeit von den spezifischen Standortgegebenheiten gleichmäßige räumliche Verteilung im Abstand von etwa 10 m von Falle zu Falle in Kuppen-, Mittelhang- und Senken-Position; Mindestabstand zu Feldsollkante 5 m) W ' Dauermagnete # 180 erstellt von FH Eberswalde im Rahmen des Projektes ÖUB in Zusammenarbeit mit PEPGIS Stand: 03/2003 ÖUB Methodenkatalog Teil A 2. Anhang Standard-Flächendesign - Acker hängig mit Catena, Detailansicht Acker Catena 181 ÖUB Methodenkatalog Teil A Anhang ## 4. 5. 7. W# 1. 6. 8. 2. 10. 1. 9. W# 3. 11. 2. 10. 4. 12. 3. 11. 5. 7. 7. 12. 1. W# 10. 6. 8. 8. 4. 9. 11. 5. 10. 9. 3. 2. W# 4. 12. 11. 5. 7. 1. 6. 12. 6. 8. 2. 9. 3. ## 1m 1m < Maßstab 1:100 # 0 2 Maßstab: 1:200 4 6 8 10 Meter GPS-Messpunkte Leitprofil mit Angabe der Verschiebungsrichtung der Profilwand (im 12-jährigen Turnus) Beprobungsfeld für Oberbodenproben (siehe dazu Anlage II) Beprobungsfeld für Regenwurm-Erfassung (Zahlen: Turnus der Beprobungsflächen) Lage der zwei 1/16 m²-Probeflächen (je 25 x 25 cm) frei wählbar innerhalb des 1 m²-Rasters für die Regenwurm-Erfassung Fluchtachse # # W ' Bodenfallen für Laufkäfer-Erfassung (Lage auf Höhe des Catena-Abschnitts; Abstand zueinander jeweils etwa 10 m; Mindestabstand zu Feldsollkante 5 m) erstellt von FH Eberswalde im Rahmen des Projektes ÖUB in Zusammenarbeit mit PEPGIS Stand: 03/2003 Dauermagnete 182 ÖUB Methodenkatalog Teil A 3. Anhang Standard Flächendesign - Acker eben 183 ÖUB Methodenkatalog Teil A Anhang # W W# ## 1. 2. 3. 10. 9. 5. 6. # 12. 11. 5. 8. 6. 1. 7. 8. 10. 2. ## 14. 11. 3. 15 m # 14. # # 2. 13. 3. 7. 12. 4. 8. ## 15 m 12. 13. # # 14. 1. # 2. 5. # 6. 12. # 3. 10. 9. 7. 13. # # 12. 4. 11. 5. 8. 13. 6. 1. 2. W# Maßstab: 1:200 8 10 12 14 14. 7. 10. 9. 14. # W 6 5. # 1. # 4 12. 9. 8. 2 6. 2. 11. 13. 10. 7. 4. 7. 3. 10. # W 14. 11. 6. 3. 1. 8. 4. 9. 2. 2. 9. 5. ## W# 5. 1. 3. 10. 6. 11. # W 11. 7. 10. 14. 4. 8. 9. 6. 0 # 4. 1. 5. 13. 13. 9. 14. # 12. 12. 4. 7. 13. # W # 8. 11. 3. 4. ## # W 16 Meter GPS-Messpunkte Hilfspunkte Leitprofil mit Angabe der Verschiebungsrichtung der Profilwand (im 12-jährigen Turnus) Beprobungsfeld für Oberbodenproben (siehe dazu Anlage II) Bereich für Bohrstockeinschläge im 12-jährigen Turnus Bereich für Eindringwiderstand Beprobungsfeld für Regenwurm-Erfassung (Zahlen: Turnus der Beprobungsflächen) Fluchtachsen # # W ' Bodenfallen für Laufkäfer-Erfassung (genaue Lage nicht definiert vorgegeben; in Abhängigkeit von spezifischen Standortgegebenheiten gleichmäßige räumliche Verteilung ohne Überschneidung mit Bodenbeprobungsfeld; Abstand von Falle zu Falle mindestens etwa 10 m) Dauermagnete 184 erstellt von FH Eberswalde im Rahmen des Projektes ÖUB in Zusammenarbeit mit PEPGIS Stand: 03/2006 ÖUB Methodenkatalog Teil A Anhang 4.Standard-Flächendesign - Mineralisches Grasland 185 ÖUB Methodenkatalog Teil A Anhang 4. W# # 11. 3. 14. 7. 10. 2. 13. 6. 9. 12. 5. 12. 5. 13. 6. 9. 14. 7. 10. 2. 8. 11. 3. # 1. 1. 10 m 8. ## 4. # W W# 10 m 10 m # W W# 4m # W 4m # W W# ## ## 1. 2. 8. 14. 11. 7. 13. 3. 10. 6. 12. 2. 9. 5. 5. 9. # 4. 3. 4. 11. # 8. 10. 7. Leitprofil mit Angabe der Verschiebungsrichtung der Profilwand (im 12-jährigen Turnus) 12. 6. 13. W# 14. Trimble-GPS-Messpunkte Beprobungsfeld für Oberbodenproben (siehe dazu Anlage II) # Beprobungsfeld für Regenwurm-Erfassung (Zahlen: Turnus der Beprobungsflächen) Beprobungsfläche jeweils 2 x 2 m (4 m²) 1. Fluchtachsen Vegetationsaufnahme Maßstab 1:125 0 2 4 6 8 10 Meter ## Bodenfallen für Laufkäfer-Erfassung (jeweils 3 Fallen im Umfeld der Vegetationsaufnahme (bei unübersichtlichen Gelände Anordnung in Flucht), Abstand zueinander jeweils etwa 10 m) W ' Dauermagnete erstellt von FH Eberswalde im Rahmen des Projektes ÖUB in Zusammenarbeit mit PEPGIS Stand: 03/2003 186 ÖUB Methodenkatalog Teil A 5. Anhang Standard-Flächendesign - genutzte und aufgelassene Niedermoore, einschließlich wiedervernässter Flächen 187 ÖUB Methodenkatalog Teil A Anhang 4. W# # 11. 3. 14. 7. 10. 2. 13. 6. 9. 12. 5. 12. 5. 13. 6. 9. 14. 7. 10. 2. 8. 11. 3. # 1. 1. 10 m 8. ## 4. # W W# 10 m # W W# 4m W# 4m 10 m # W W# ## ## 1. 2. 9. 5. 10. 6. 12. 4. 3. 4. # 11. 7. 8. 14. 8. 14. 11. 7. 13. 3. 10. 6. 12. Moorpeilung (einmalig) und Flachschurf mit Angabe der Verschiebungsrichtung der Profilwand (im 12-jährigen Turnus) 2. 9. 5. Beprobungsfeld für Oberbodenproben (siehe dazu Anlage II) # 13. W# Trimble-GPS-Messpunkte # Beprobungsfeld für Regenwurm-Erfassung (Zahlen: Turnus der Beprobungsflächen) 1. Fluchtachsen Vegetationsaufnahme Maßstab: 1:125 0 2 4 6 8 # Bodenfallen für Laufkäfer-Erfassung (jeweils 3 Fallen im Umfeld der Vegetationsaufnahme (bei unübersichtlichen Gelände Anordnung in Flucht), Abstand zueinander jeweils etwa 10 m) W ' Dauermagnete # 10 Meter erstellt von FH Eberswalde im Rahmen des Projektes ÖUB in Zusammenarbeit mit PEPGIS Stand: 03/2003 188 ÖUB Methodenkatalog Teil A 6. Anhang Standard-Probenahmeschema für Oberbodenbeprobung und Bohrstockeinschläge 189 ÖUB Methodenkatalog Teil A 7. Anhang Felddatenblätter zur Erosionskartierung (nach FRIELINGHAUS 1996) Dauerbeobachtungsfläche:_____________________________________ Kartierdatum: _____________ Kartierer: ________________________ Blatt 1: Grunddaten Block 1: Landnutzung Code 1.1 Wald WAD 1.2 Grünland GRL 1.2.1 intensiv (Weiden, Mähweiden, mehrschnittige Wiesen) GRI 1.2.2 extensiv (Sukzession, Wiesen, Hutungen) GRE 1.3 Ackerland ACK 1.3.1 intensiv (Wintergetreide, Reihenkulturen) ACI 1.3. extensiv (mehrjähriges Feldfutter, Ackerbrache, beginnende Sukzession) ACE 1.4 Sonderkulturen SKU Block 2: Angrenzende Landschaftsformationen Code 2.1 Hohlform mit Gewässer WA 2.2 Hohlform mit Vorflut V 2.3 Soll SO 2.4 Feuchtbiotop FB 2.5 Magerrasen MR 2.6 Siedlungsflächen (Straßen, Wege, versiegelte Flächen) SF 2.7 Ackerfläche ACK 2.8 Grünland GRL 2.9 Wald WAD 2.10 Sonstiges SON ja nein Lage* ja nein Lage* Bemerkungen: * o = oberhalb der kartierten Fläche bzw. u = unterhalb der kartierten Fläche 190 ÖUB Methodenkatalog Teil A Anhang Blatt 2: Erosionssystem Kartierdatum: _____________ Nr. des Erosionssystems:____________ MAßSTAB DER KARTIERUNG: BLOCK 1 ABTRAGSFORMEN 1.1 1.2 1.3 1:2.000 Code vorhanden 1:5.000 Länge [m] ÖUB 1:10.000 Breite [m] 1:25.000 Tiefe [m] Fläche [m2] Volumen [m3] F - - kleinflächige Verspülungen F/V - - flächenhafte Abspülung in Gefällerichtung F/F - - flächenhafte Abspülung in Bearbeitungsspuren F/L - - flächenhafte Formen lineare Formen L Rille L/RL Rinne L/RN Graben L/G Abtragsform in Tiefenlinien von Dellen oder Talwegen L/TL Abtragsform in künstlich angelegten Talwegen L/AB Abtragsform mit Seitenerosion L/S Abtragsform mit Auskolkung L/K Flächenhaft lineare Formen FL - flächenhaft parallele lineare Abtragsformen FL/P - flächenhaft fächerartige lineare Abtragsform FL/F - flächenhaft konvergierendedivergierende lineare Abtragsform FL/K-D - BLOCK 2 AUFTRAGSFORSedimentation Code A/V Akkumulation in Reliefverflachung im Verlauf von Abtragsformen A/M Akkumulation am Ende von Abtragsformen A/E Akkumulation in Straßengräben, Hohlwegen usw. A/A Emission MEN flächenhaft Code Tiefe [m] Fläche [m2] Volumen [m3] vorhanden Länge [m] Breite [m] Tiefe [m] Fläche [m2] Volumen [m3] vorhanden Länge [m] Breite [m] Tiefe [m] Fläche [m2] Volumen [m3] E E/FL linear als Graben E/G Code Imission I Wasser W Wasser/Sediment Breite [m] E/F flächenhaft linear BLOCK 4 EINTRAGSFORMEN / ÜBERTRITTSTEL Länge [m] A kleinflächige Akkumulation variabler Mächtigkeit BLOCK 3 AUSTRAGSFOR- vorhanden W/S Bemerkungen: 191 ÖUB Methodenkatalog Teil A 8. Anhang Aufnahmebögen zur Messung bzw. Schätzung von Abtrags- bzw. Auftragsformen (nach DVKK 1999, modifiziert) Aufnahmebogen 1 - zur Messung bzw. Schätzung linearer Abtragsformen ID-Nr. des Erosionssystems: Kartierer: Datum: ÖUB-Monitoringfläche: Streckenabschnitt lfd. Nr. Länge (L) [m] Summe: mittlere Tiefe (T) [cm bzw. m] mittlere Breite (B) [cm bzw. m] mittlere Querschnittsfläche 2 [m ] Gesamtvolumen: Volumen 3 [m ] Bemerkungen: ÖUB Methodenkatalog Teil A Anhang Aufnahmebogen 2 - zur Messung bzw. Schätzung flächenhaft linearer Abtragsformen ID-Nr. des Erosionssystems: lfd. Nr. Länge (L) [m] Anzahl der linearen Formen Kartierer: ÖUB-Monitoringfläche: Datum: Summe aller QuerVolumen der repräsentativen linearen Abschnittsflächen tragsformen (Bestimmt nach Bogen 3) (Bestimmt nach Bogen 1) [m2] [m3] *Berechnung des Gesamtvolumens der flächenhaft linearen Abtragsform: Traversenmethode: Summe aller Querschnittsflächen x Länge / Anzahl der Traversen Extrapolationsmethode: Volumen der repräsentativen linearen Abtragsformen x Anzahl der linearen Formen Gesamtvolumen der flächenhaft linearen Abtragsform* [m3] ÖUB Methodenkatalog Teil A Anhang Aufnahmebogen 3 - zur Messung bzw. Schätzung flächenhaft linearer Abtragsformen nach Traversenmethode (Hilfsbogen zu Bogen 2) ID-Nr. des Erosionssystems: lfd. Nr. der Schnittpunkte der Erosionsformen mit der Traverse Nr. der flächenhaft linearen Erosionsform (entspr. Nr. aus Bogen 2): ÖUB-Monitoringfläche: mittlere Tiefe der Erosionsform am Schnittpunkt mit Traverse mittlere Breite der Erosionsform am Schnittpunkt mit Traverse Querschnittsfläche (Tiefe x Breite) [cm bzw.m] [cm bzw. m] [m2] Anzahl der Schnittpunkte Summe aller Querschnittsflächen: (in Bogen 2 einsetzen) ÖUB Methodenkatalog Teil A Anhang Aufnahmebogen 4 - zur Messung bzw. Schätzung von Auftragsformen ID-Nr. des Erosionssystems: Kartierer: ÖUB-Monitoringfläche: Datum: AKKUMULATIONSFLÄCHE lfd. Nr. Länge (L) [m] mittlere Tiefe (T) [cm bzw. m] mittlere Breite (B) [cm bzw. m] Akkumulationsfläche 2 Volumen 3 [m ] [m ] Gesamtfläche Gesamtvolumen Bemerkungen: ÖUB Methodenkatalog Teil A 9. Anhang Dokumentationsblätter zur Erosionskartierung (nach DVWK 1996, modifiziert) ID-Kürzel für Erosionssys- Kartier-Datum: tem (ES): Datum u. Art des erosionauslösenden Ereignisses: Bearbeiter / Institution: gesonderte Aufnahmebögen zu einzelnen Abtrags- bzw. Auftragsformen liegen vor ( ) ja ( ) nein ÖUB ID der Monitoring-fläche: ( ) Mit den folgenden Blöcken wird das Gesamtareal des ES behandelt (siehe beigefügte Skizze u./o. Beschreibung) ( ) Mit den nachfolgenden Blöcken wird ein Teilareal des ES behandelt (siehe Skizze und/oder Karte) -Nutzungsart auf dem von Erosion betroffenem Areal u. ggf. Fruchtart:........................................... ........................................................................................................................................................ -Bearbeitungsrichtung ( ) quer ( ) längs ( ) schräg bzw. wechselnd -Bearbeitungszustand: ................................................................................................................... -Oberflächenrauhigkeit: ................................................................................................................. -nutzungsbedingte erosionsrelevante Verdichtungen und Strukturschäden des Bodens: ................ ........................................................................................................................................................ -Grad der Bedeckung durch Steine u. Pflanzenreste [%]............................................................... -Grad der Bedeckung durch Pflanzen [%].............aktuelle Höhe der Pflanzen: .......................... -ggf. phänologisches Entwicklungsstadium: .................................................................................. Nutzungsart angrenzender Flächen: Vorhandener Erosionsschutz im Bereich des ES (mit Hinweis auf welchen Teilfläche) -ackerbaulich:................................................................................................................................... -sonstiges (Hangterrassen, Dämme, Sträucher etc.):.......................................................................... ........................................................................................................................................................ Relief der Bodenoberfläche -Reliefformen im Bereich des ES:..................................................................................................... -durchschnittl. Neigung des Abtragsbereiches [%]:............................................................................ -erosionswirksame Hanglängen bis zum Beginn der dominierenden Akkumulation:............................ ........................................................................................................................................................ Erosion in einer Tiefenlinie ( ) ja ( ) nein Allgemeine bodenkundl.-hydrolog. Bemerkungen: Dominierende Erosionsformen (Abtrag / Akkumulation): Lokale Erosionsbasis: ( ) +/- gestreckt ( ) halboffene Hohlform 196 ÖUB Methodenkatalog Teil A Anhang ( ) geschlossene Hohlform ( ) oberflächenhafter od. künstlicher Anschluss an Vorflut vorhanden ( ) sonst. (z.B. Durchlass, Weg, künstl. Entwässerungsrinne)............................................................................. Durch die Bodenerosion in ihrer Funktion beeinträchtigte Bereiche: -Umfang:.......................................................................................................................................... -Lage:.............................................................................................................................................. ........................................................................................................................................................ -Charakterisierung:........................................................................................................................... ................................................................................................................................................................................................... ............................................................................................................. Abtrag: ( ) Abtragsformen sind Fortsetzung von Abtragsformen auf oberhalb liegenden Nachbarareal ( ) ausschließlich ( ) überwiegend Ausmaß des Abtrags (KÜRZEL nach DVWK-Kartieranleitung) -gesamte von EWF, EWL und EWFL betroffene Fläche [m2] :......................................................... -von EWF betroffene Fläche [m2]:.................................................................................................... -Gesamtbetrag der Formen EWL und EWFL, mindestens [m3] :........................................................ -bei einzelnen Abtragsformen: -Art der Form: ................................. .......................................... .......................................... -Flächenumfang: .............................. .......................................... .......................................... -Abtrag (mindestens):....................... ......................................... .......................................... Akkumulation (KÜRZEL nach DVWK-Kartieranleitung): -Akkumulation insgesamt Fläche: ........... m2 Volumen: ................. m3 -differenziert AW/V- Fläche: ........... m2 AW/M- Fläche: ........... m2 Volumen: ................. m3 AW/E- Fläche: ........... m2 Volumen: ................. m3 AW/A -Volumen: ................. m3 / Örtlichkeit der Ablagerung: ........................................................ davon unmittelbar oberhalb eines zu schützenden Areals bzw. einer Übertrittsstelle liegend: -Art der Akkumulation : ................................................................................................................... -Fläche: .............. m2 -Volumen: ................. m3 Wasseransammlung infolge Erosion zum Zeitpunkt der Kartierung - Fläche: ........... m2 Akkumulation bzw. Wasseransammlung sind eine Folge von Erosion auf oberhalb liegendem Areal ( ) ausschließlich ( ) überwiegend Bodenart von Sedimenten in Akkumulation, z.B. des am Unterhang zuletzt liegengebliebenen Sedimentes (Fingerprobe) -lateral (ggf. Abfolge) ...................................................................................................................... -vertikal (ggf. schichtweise) ............................................................................................................. -räumliche Lage der auf Bodenarten untersuchten Akkumulation im ES (siehe Skizze bzw. Karte) .................................................................................................................................... ........................................................................................................................................................ Bioindikatoren, jeweils mit Angabe der Position (ggf. zur Beschreibung von Stoffpfaden) ( ) erosionsbedingter Kontrast in Vegetationsdecke: ......................................................................... 197 ÖUB Methodenkatalog Teil A Anhang ( ) Artenkontrast:........................................................................................................................ ( ) Entwicklungskontrast:............................................................................................................ ( ) qualitativer Kontrast :............................................................................................................ ( ) verschleppte Pflanzen: ................................................................................................................ ( ) freigelegte Wurzeln: ................................................................................................................... ( ) sonstiges:.................................................................................................................................... Schäden an Kulturpflanzen: ( ) mechanische Schäden durch Oberflächenabfluss ( ) Schäden durch Sedimentation ( ) Luftmangelerscheinungen ( ) freigelegte Wurzeln ( ) sonstiges: Fläche: Fläche: Fläche: Fläche: Fläche: m2 m2 m2 m2 m2 Erosionshemmende Elemente im Bereich einer kartierten Übertrittsstelle (z.B. zwischen Acker als Herkunftsfläche u. Gewässer als zu schützendes Areal) ( ) nicht vorhanden ( ) vorhanden -Art:................................................................................................................................................. -Breite in Erosionsrichtung: ....................m -Neigung in Erosionsrichtung:..................% -Bewuchs:........................................................................................................................................ -Bewertung der sichtbaren Filterwirksamkeit: ( ) Filterung nur punktuell möglich ( ) Filterung diffuser Einträge auf größerer Breite möglich ( ) vorgezeichnete Abflusswege vorhanden ( ) Erosionshemmung durch bauliche bzw. kulturtechnische Anlage: ................................................ ........................................................................................................................................................ ( ) sonstiges:.................................................................................................................................... Angaben zu Off-site-Wirkungen ( ) Das betrachtete Areal / Teilareal ist durch Erosion auf oberhalb liegendem Areal beeinträchtigt ( ) ausschließlich ( ) überwiegend Art und Funktion dieses oberhalb liegenden Areals:........................................................................ ..................................................................................................................................................... ( ) Vom betrachteten Areal / Teilareal verlaufen Erosionserscheinungen weiter auf unterhalb liegendes Areal. Art und Funktion dieses unterhalb liegenden Areals: ...................................................................... ..................................................................................................................................................... ( ) Das betreffende ( ) oberhalb ( ) unterhalb liegende Areal / Teilareal wird in eigenen ( ) Blöcken ....... ( ) Dokumentationsblättern behandelt. 198 ÖUB Methodenkatalog Teil A 10. Anhang Aufnahmeformblatt für Bohrstockeinschläge Bohrstockeinschläge Aufnahmedatum: Bearbeiter: ÖUB Fläche: PROBEPUNKT: Tiefe Horizont Farbe in cm Bodenart CaCO3Gehalt Humusgehalt Hydromorphie Aktuelle Feuchte Sonstiges / Bemerkungen Bodenart CaCO3Gehalt Humusgehalt Hydromorphie Aktuelle Feuchte Sonstiges / Bemerkungen Bodenart CaCO3Gehalt Humusgehalt Hydromorphie Aktuelle Feuchte Sonstiges / Bemerkungen Probepunkt: Tiefe Horizont Farbe in cm Probepunkt: Tiefe Horizont Farbe in cm 199 ÖUB Methodenkatalog Teil A 11. Anhang Formblatt für die bodenkundliche Profilaufnahme nach AG BODEN (2005) ÖUB Methodenkatalog Teil A Anhang ÖUB Methodenkatalog Teil A 12. Anhang Aufnahmebogen für Moorbodenprofile (nach der Arbeitsanweisung zur Moorbodenaufnahme des Institutes für Grünland- und Moorbodenforschung - Bodenkartierung, Paulinaue, modifiziert) Aufnahmebogen für Moorbodenprofile ÖUB-Fläche: Aufschlussart: Flachschurf ÖUB ÖUB- Flächenident: Hochwert: Höhe NN: Profil - Ident: Rechtswert: Anthropogene Veränderungen: Moormächtigkeit: Bodentyp (TGL): Wasserstufe: Hydrologischer Moortyp: Bodensubtyp (KA4): Wasserregimetyp: Nutzungsart: Substrattyp (TGL): GW-Stand: Vegetation: Mikrorelief: Witterung: Ökologischer Moortyp: Bearbeiter: Aufnahmedatum: □ Bohrung □ Nr. Leitprofil: □ Begleitprofil: □ cm u Flur Bemerkungen: Horizont Untergrenze in cm Horizont nach TGL nach KA4 Torfart, Muddeart bzw. Bodenart Zersetzungsgrad bzw. Konsistenz nach POST in TGL nach POST in TGL Beimengungen und / oder Besonderheiten Durchwurzelung Farbe Feuchte Proben Nr. ÖUB Methodenkatalog Teil A Anhang ÖUB Methodenkatalog Teil A 13. Anhang Probenbegleitliste für die Entnahme von Bodenproben P r o b e n a h m e l i s t e (Boden) ÖUB Monitoringfläche:........................................................................................................................................ Datum der Probenahme:............................... Probepunkt Entnahmetiefe in cm Probenehmer:.............................. Beschreibung Horizont Probenbezeichnung Stechzylinder Nr.: Beutelprobe Nr.: ÖUB Methodenkatalog Teil A 14. Anhang Probenahmeprotokoll Mikrobiologie (nach LABO 1999) Probenahmeprotokoll Mikrobiologie Bei Angabe von Abkürzungen nach KA4 3in ÖUB Probenahme-Datum: Nr. der Monitoringfläche: ................... ................... Name der Monitoringfläche: ................................................................... Probenahme-Uhrzeit: ............Uhr Witterung: ..................................................................................... Probenehmer: ............................... Vortage ohne Frost: ....................Tage Angabe der Zeitspanne geschätzt Lufttemperatur: recherchiert Feuchte des Oberbodens: ............................................................ .........°C Bodentemperatur: .........°C Wasserüberstau: ................................................................................................................ Landnutzungsform: .............................................................................................................. Kulturart: ...................................................................................................... Bei Acker: Vorausgegangene Bodenbearbeitung: Bearbeitungstiefe: ....................................................................................................... .................... cm Vegetationszustand: ruhend aktiv Düngung vor der Probenahme: ....................................................................................................... Beweidung vor / bei der Probenahme: ....................................................................................................... Bemerkungen zu Aufnahme: ÖUB Methodenkatalog Teil A 15. Anhang Schlag-/BodenSchlag und Betrieb beschreibung MF Landwirtschaftliche Betriebsdaten Erntejahr: Hauptfrucht: Name: Betriebsgröße (ha LF): Vorjahr Saat Hauptfrucht Melioration Schlagnummer: Schlaggröße (ha): Straße: Ort: Telefon: Ackerfläche (ha): Grünland (ha): viehlos: ja Getreide (ha): Zuckerrüben (ha): Mais (ha): Bodenart: Krumentiefe (cm): Pflugsohle: ja Bodenuntersuchung: ÖS-Gruppe: Acker Schlagbezeichung: Ackerzahl (Reichsbodenschätzung): nein Steine: keine Nährstoffe (mg/100g): P ( N-min-Werte (kg/ha): cm) im Jahr: ( cm) ( Mist (dt/ha): Gülle (m /ha): Stroh/Rübenblatt eingepflügt: ja nein Zwischenfrucht: ja Aussaat am: nein Saatverfahren: Drillsaat Bandsaat Entwässerung: keine Bewässerung: ja Breitsaat nein Zeitraum: nein gut Unkrautbesatz: gering mittel . . Arten: nein Saatdichte: . . nein Stauhaltung: ja nein . gewogen . schlecht hoch Auffällige Schädigungen (auch partiell): keine Schlagkartei nach SAG (1999) verändert wenn ja, welche: Ertrag: geschätzt mittel nein . Untersaat: ja bei Feldfutter: Zahl der Schnitte: Wildschäden: ja nein Beurteilung des Bestandes: sehr gut Staunässe: ja cm) TKG des Saatgutes (g): Ertrag (dt/ha): nein stark wechselnd . Drainage Menge: wechselnd C-Gehalt (%): Saatmenge (kg/ha): Fahrgassen: ja Gräben Ernte am: Lager: ja Mittel: viele Mg K2O (kg/ha): Vorfrucht organisch gedüngt mit: . . P2O3 (kg/ha): 3 . Viehbesatz (GV/ha LF): wenige K Vorfruchtertrag (dt/ha): Vorfrucht mineralisch gedüngt mit: N (kg/ha) Beizung/Inkrustierung: ja nein Bodeneigenschaften: einheitlich pH-Wert: Vorfrucht: Beobachtungen Ernte zutreffendes bitte ankreuzen Aufnahmeformular Landwirtschaftliche Betriebsdaten für die Ökosystemgruppe Acker Pilzbefall Nematodenbefall Insektenfraß Virosen Datum......................................................Unterschrift............................................................................. . Bemerkung ÖUB Methodenkatalog Teil A Anhang ergänzung zu Schlag und Betrieb: Organische Düngung Mist, Gülle, Jauche u.a. Stroh, Rübenblatt Geflügel Rind Schwein Tierart Sonstiges Jauche Mist zu naß Gülle Form Datum der Ausbringung ideal zu trocken (cm) Bearbeitungstiefe z.B. Kreiselegge gänge wicht) eingesetztes Gerät Zahl der Arbeits- Bodenzustand Bereifung Datum Zugmaschine (Ge- Bodenbearbeitung (einschl. mechanischer Pflege und Handhacke) Stroh: Zwischenfrucht/Untersaat zur Haupt- abgefahren eingearbeitet verbrannt Pflanzenart:......................... Saatzeit:.............................. Menge Wuchshöhe:........................ dt/ha abgefahren oder Rübenabgefahren eingearbeitet m3/ha blatt: eingearbeitet Zerkleinerung keine keine vor oder bei Zerkleinerung geringe vor oder bei geringe Einarbeitung starke Einarbeitung starke eingearbeitet am: Gerät zur Einarbeitung: eingearbeitet am: ............................................ Gerät zur Einarbeitung: ............................................ Bemerkungen (z.B. Ausbringung): Schlagkartei nach SAG (1999) verändert Datum......................................................Unterschrift............................................................................. schlecht mittel Wirkung gut Handelsname / Wirkstoff stark CaO mittel Bor gering Mg Besatz / Befall bei Spritzung kein K GF = Gesamtflächenspritzung BA = Bandspritzung UB = Unterblattspritzung RA = Randspritzung TF = Teilflächenspritzung Menge (kg/ha oder l/ha) P Art des PSM / Präparates (Herbi,Fungi...) N Entwicklungs stadium Düngemitteltyp Spurenelemente Unterfußdüngung mit "U" kennzeichnen Datum Reinnährstoffe (kg/ha) Menge (dt/ha) Entwicklungs stadium Datum Wirkstoff konzentration Pflanzenschutz (chemisch oder / und durch organische Präparate) Mineralische Düngung zur Haupt- und Zwischenfrucht ÖUB Methodenkatalog Teil A Schlagkartei nach SAG (1999) verändert Anhang Datum......................................................Unterschrift............................................................................. ÖUB Methodenkatalog Teil A zutreffendes bitte ankreuzen Aufnahmeformular Landwirtschaftliche Betriebsdaten für die Ökosystemgruppe Grünland Landwirtschaftliche Betriebsdaten Name: Schlagnummer: Straße: Ort: Schlaggröße (ha): Telefon: . Schafe (GV): Sonstige: . Bodeneigenschaften: einheitlich wechselnd Betriebsgröße (ha LF): Ackerfläche (ha): Grünland (ha): Hauptfutterfläche (ha): Rinder (GV): Schweine (GV): Geflügel (GV): Staunässe: ja ( Entwässerung: keine Gräben Winterüberstau: von Nährstoffe (mg/100g): P cm) ( Art: termin Nachsaat Neuansaat zu naß ideal zu trocken Bereifung (Gewicht) Zugmaschine Saat . Mg stark wechselnd bis C-Gehalt (%): nein Stauhöhe: . . Intensität: . Saat Organische Düngung Saatverfahren Mist, Gülle, Jauche u.a. Form Tierart Menge Datum der dt/ha Ausoder bringung m3/ha Saatmischung . cm) Stauhaltung: ja Zeitraum: Bodenzustand Schlagkartei nach SAG (1999) verändert ( Sommerüberstau: von eingesetztes Gerät K Drainage bis ja cm) . nein Rind pH-Wert: N-min-Werte (kg/ha): Bewässerung: nein . Jauche Bodenuntersuchung: ungünstig Gülle mittel Schlitzsaat Wasserführung: günstig Bodenart: Mist Grünlandzahl (Reichsbodenschätzung): Pflege und Bodenbearbeitung Datum ÖS-Gruppe: Grünland Schlagbezeichnung: Bemerkungen Geflügel Hauptnutzung (z.B. Weide): Schwein Erntejahr: Drillsaat Melioration Schlag-/Bodenbeschaffenheit Schlag und Betrieb MF Breitsaat 16. Anhang Datum......................................................Unterschrift............................................................................. Anhang Mineralische Düngung Pflanzenschutz Nutzung Schnittnutzung Aufwuchs 1 2 Schlagkartei nach SAG (1999) verändert 3 4 Beweidung (incl. Nachweide) Weidenutzung 5 6 1 2 3 4 5 Datum......................................................Unterschrift............................................................................. 6 schlecht mittel gut oder l/ha) Handelsname / Wirkstoff Wirkung Menge (kg/ha = Gesamtflächenspritzung = Einzelspritzung = Randspritzung = Teilflächenspritzung zentration GF E RA TF etc.) Bor CaO (Herbi, Fungi, Mg Art des PSM K stadium P Aufwuchs N Datum Entwicklungs- Reinnährstoffe (kg/ha) Menge (dt/ha) Düngemitteltyp Aufwuchs Datum Wirkstoffkon- ÖUB Methodenkatalog Teil A ÖUB Methodenkatalog Teil A Ertrag (dt/ha): Anhang . . . . . . Verwertung: 1=Heu, 2=Silage, 3= Cobs, 4= Eingrasen . . . . . . mittlere Bestandshöhe bei Nutzung (cm): . . . . . . . . . . . . Nutzungszeitpunkt(Datum): Kräuteranteil (%): . . . . . . . . . . . . . . . . . . . . . . . . Seggenanteil (%): Lückigkeit: 1= keine, 2= gering, 3= mittel, 4= stark Fahrschäden: 1= gering, 2= mittel, 3= stark Schnitthöhe (cm): 2= im Schossen, 3= vor Blüte, 4= nach Blüte Auftriebstag (Datum): Verunkrautung: 1= keine, 2=gering, 3=mittel, 4=stark Gräser: 1= vor Schossen, 2= im Schossen, 3= vor Blüte, 4= nach Blüte mittlere Bestandshöhe bei Nutzung (cm): Gräser: 1= vor Schossen, . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Besatz: mit 1= Milchkühen, 2= Jungvieh, 3= Bullen, 4= Mutterkühen Anzahl der Tiere (Stück): Auftriebsdauer (Tage): Ganztagsweide: 1=ja, 2= nein Tag- und Nachtweide: . . . . . . 1=ja, 2= nein . . . . . . Trittschäden: 1= gering, 2= mittel, 3= stark Nachmahd (Datum): Art der Zufütterung: Menge der Zufütterung: Futterrest abgefahren: 1=ja, 2=nein Fladen verteilt: 1=ja, 2=nein Schlagkartei nach SAG (1999) verändert . Datum......................................................Unterschrift............................................................................. ÖUB Methodenkatalog Teil A 17. Anhang Vegetationonsaufnahmebogen Bearbeiter: Datum: Fläche: Vegetationsaufnahme Nr.: Kartenblatt: Kurzbeschreibung: Rechtswert: Hochwert: Größe [m2]: Exposition: Hangneigung: Bewirtschaftung: Dicke der Streuschicht [cm]: Schicht: Höhe: Deckung: Artenzahl: Gesamtartenzahl: K Deckung der Streuschicht [%]: Gesamtdeckung [%]: K M ÖUB Methodenkatalog Teil A 18. Floristische Kartierung Brandenburg - Geländeliste / Gesamtarteninventar Rasterfeld TK-25-Nr. Nr. Anhang BearbeiterIn: 1/4 Datum/Zeitraum 1/16 Begehungsgebiete (mit kennzeichnenden Lokalitätsnamen) a b c d e f g h i j k l Nr. St Hb Sippe Fundpunkt, Pflanzengesellschaft, Bestandsgröße, Gefährdung Sonstige Arten, Bemerkungen Legende zu den Symbolen der Geländeliste # Aggregat mit mehreren Kleinarten im Gebiet () Art mit mehreren Unterarten/Varietäten im Gebiet 0 Verschollen + Kleinart 1 Vom Aussterben bedroht (...) Unterart oder Varietät 2 Stark gefährdet = Synonym 3 Gefährdet h Herbarbeleg zur weiteren Bearbeitung erwünscht R Potenziell gefährdet Angaben zur Gefährdung (nach Rote Liste Brandenburg, BENKERT & KLEMM 1993) ÖUB Methodenkatalog Teil A H Herbarbeleg erforderlich 1 Abies alba 3 Acer camp negun plat ps’plat Achil mill # h Anthox arist odor+ Anthr caucal ceref()h (ceref) (trichosp) mill+ 3 pann+h 2 ptarm 2 salic H Acinos arv Acorus calam Actaea spic 1 Adonis aest Aegop pod Aesc hipp Aethu cyn Agrim eup proc 1 Agrostem gith Agrostis can() cap=ten() castel H stolon # gigant+ stolon+ vin=stric sylv() Anthy vulner()h (vulner) H (polyph) H Anthirr majus Apera spic Aphan arv austr=micro H Apium grav inund rep Aquil vulg # vulg+ vulg cv+ Arabid thal Arabis glab hirs#h hirs+H nem+H sag+H Arcti lappa 3 2 3 1 1 2 0 1 Ailan alt minus 3 Aira caryo+ nem H praec tom 3 Ajuga genev 1 Arcto uva rept # Arena serp# 3 rept atro+ ? leptocl+H Alchem vulg # h serp+() 2 acuti=vulg+H Aristo clem 2 glab+ Armer elong 1 glaucesc+H Armor rust 1 2 Anhang mican=grac+H montic+H ? pend x pub h pub()h Bidens cern conn frond() (frond) briz 1 buxbaum#H buxbaum+H hartm+H 3 canes 3 caryo (anomal) 1 radi H tripar 3 Blech spic 2 Blysm compr 3 Bolbo marit#h Borago off 2 Botry luna 1 matri 1 multi Brach pinn+ sylv Brass elong() nap() nigr H oler rapa 3 Briza media 2 Bromus arv()H carinat h ? commut H 2 cesp 1 chord 2 diand H digit 1 dioc 3 distans disticha 3 echi elat()h (elat)H (omsk)H elat x nigr H elong ericet 3 flacc flava#h demi+H 2 flava+H 1 lepid+H serot=oed+h hirta erect() hord() (hord) (pseudoth)H inerm jap H 2 racem+H ramo#h benek+H ramo+H 1 secal()H 1 host H 3 humilis 2 lasioc liger H 2 limosa ? mont muri#h guest=leer+H muri+()H (muri)H Chrysos altern 1 oppo Cicerb macro Cicho inty Cicuta viros 3 Circaea alp ? int H lut 3 Cirsi acau arv 3 (pair)H spic+ 2 canum 1 hele 1 Arnica mont 3 Arnos mini ster tect submer Cerin minor Chaen minus 1 Chaer arom 1 aur bulb ? 2 3 ? 2 3 3 temu Cheli majus Cheno albun#h album+ opul+H stric+ suec+H bonus botrys fici glauc hybr mura H poly rubr# botryo+H rubr+ vulv H Chima umb Chond junc Chrysan seget Gefährdung nicht bewert 3 1 3 1 2 1 2 2 2 R R Cynogl off Cynos crist Cyperus flav H fusc Cypri calc Cystop frag+ Cytisus scop Dact’lis glom# glom+ poly+h Dact’rhiza inc() (incar) (ochro) macu#h maja# (brevi)H (maja) Danth decum Datura stram() (stram) (tatula) Daucus caro() Denta bulb Desch cesp() flex setac H Descu sophia 2 Diant aren 1 armer barb 3 carth 3 delt 1 gratia 1 segu 2 super 3 Dig’lis grand purp Dig’ria isch sang 2 1 subcren+H xanthoch+H Alisma pl’-aq# 1 gram+H 2 lanc+ pl’-aq+ Alliar pet Arrhe elat()h Artem absint ann austr biennis H camp() dracunc h Bryon alba dio Buddl davi Bunias orient 3 Butom umb Calama aru canes() 3 nigra 0 obtus H oval=lepo pall 3 panicea panicula piluli oler palu 1 rivu vulg 3 Cladium maris Clayt perf 1 Clema recta (pect)H (sang) Diph compl# 3 compl+ 3 trist+ 2 zeill+ Diplo mura 3 Allium angu carin() 3 oler parad rotund vulg# verlot+H vulg+# Arum macu Arunc dio epig 2 stric R vill H Calend off 3 Calla palu praec# ? curv+H praec+ ps’briz H ps’cyp vit Clinop vulg 2 Cnidium dubi 2 Colch aut Colut arbo tenuif Dipsa full R pilo=Virg pil Doron pard 1 Doryc herb schoen scorodo 2 senes=mont 1 urs Asarum euro() Asclep syria Aspar off 3 Asperugo proc ? Callit herma H palu#h coph+H hamu+H 1 pulic remot ripar 3 rostr Conium macu Conso ajac H hisp=orient H 3 reg 3 3 3 2 palu+H ? plat+H ? stag+H Calluna vulg 3 Caltha palu()h 3 sup sylv 1 tom 3 vesi vulpina#h Conva maja Convo arv Conyza canad sumatr H 1 Coral trif Draba nem 2 Dros int 1 longif=angl ? longxrot=obov H 3 rot Dryop carth# carth+ dilat+ expa+H vin+ Alnus glut incana Alopec aeq genic+ genic x prat H ? myos H prat() R Althaea off 3 Alyss alyss R mont Amara albus blitoid blitum=liv # h blitum+H emar+()H hybr # h bouche+H powe=chio+H retro Ambros artem’f H coron’f=psilo trif Amela alnif lamarc spic Amorpha frut Anaga arv Anchusa arv Asperula cyn tinct Aple ruta-m trichom virid 1 Aster amell 3 lino laevis H novi-belg#h lanc+H novi-belg+H 3 2 2 1 x salig H trad tripol Atrag aren cicer dani glyc 1 Astran major Athyr filix-fem Atrip hort 2 glom h 1 ltif H 3 patul pers rap’oid rap’us H rot+ 3 sib trach Cannab sta#h 1 Catab aqu H Cent’ea cyan diff H jacea()h (angustif)H 3 (jacea)H nigra()H nigresH scab solst micr=hete H oblong patul prostr+ rosea H sag=nite tatar Atropa bell rud+H sat+() Capse burs 3 Cardam amara 3 flex hirs impat 3 parv 3 1 2 2 2 1 2 1 2 3 R Calyst pulch H sep+ Camel micr()h sat()H Campan bonon H cerv H otrub+H vulpina+H Carli vulg Carpi betu 2 Carum carv Casta sat stoe=rhen Cent’um eryt lit h pulch Centunc min Ceph’an dam longif rubr 3 2 3 R ? 2 hell# alb+H hell+ micr palu purp H Equis arv arv x fluv=lit H fluv hyem#h hyem+H x moo+H palu R prat sylv R telm varieg Eragr alb H minor multi H tef H 2 Erica tetr Erige acris#h acris+ droeb+H ann()h 3 Erioph angu() ? 1 1 ? 1 R 3 3 2 3 lati vag Erod cicu Eroph vern()h Eruca sat H ? Erucast gall H 3 Eryng camp R planum Erysi cheira cheiri=Cheir chei virg=hier#h marsch=dur+H 3 virg+H Eschholz cali Euony euro Eupat cann Eupho cyp R dulc esula#h 2 esula+ virg+ exig helio lathyr Friti mele Fumar off()h (off) parv H vaill()h Gagea boh()h lut mini prat#h pom+H prat+ sax spartha vill=arv Galan nival elwe H Galega off Galeop lada# ang’fol+H lada+H pub() (murr)H (pub) spec tetr#h bifi+ tetr+ ? 2 ? ? 3 Galin cil parv Galium apar# apar+ spur+H bore moll#h album+() moll+H moll# x ver lach h 1 lactu h laevig h ? macu H muro=sylv h pilo’la h pilo’oid h sab h stolon H umb h odor palu#h 2 Hieroc odor#h Hippoph rham() 2 Hippo vulg Hirsch inc Holcus lana moll Holost umb Hordel euro Hordeum juba H muri 3 Hotto palu Humul lupu 1 Huper sela 3 Hydrocha mors Hydrocot vulg Hyosc niger Hyper elot hirs elong+ palu+ pus#H ? pum+H sax=harc sylv ulig 1 2 2 3 tub#h Helich aren Helict prat pub() Heleb foet Hemero fulva h Hepat nob Herac mant h sphond()h (flav)h (sphond)h Herni glab hirs H Hespe matr Hiera aura h bauh H caes H caesp#h caesp+H flori+H glom+H cymo#H cymo+H zizy+H echio h fallax H glaucinum H verum# verum+ virtg+H Genista angl germ 2 cap compr# compr+ 2 gera+H congl h effu 3 filif infl 3 squa 2 subnod 2 tenag H ten 3 Junip comm 1 Jurin cyan 2 Kickx elat Knaut arv Kochia scop()h (densifl)h (scop)h 3 Koel glauc macr=cris#h 3 macr+H Labur anag Lact serr Lamium album ampel confer=moluc H galeo#h argent+ endtm H galeo+H macu purb() ? (incis=hybr)H (purb) Lapp squa Laps comm Larix deci Lastr limbe Latre squam Lathy hirs lati lini R niger H niss h 3 palu prat sylv h tub vern 3 Ledum palu R luc 2 palu 3 pepl 1 Euphr off=rost#h 1 pilo tinct Gentiana cruc pneum 3 micr+H ? nem+H 2 rost+H 3 stric+H Fagop escu Gent’ella ama#h humi minusc ama+H macu#h tris ulig+H dubi+H turio H Geran colu 3 macul+H Leontod aut diss macul x perf 3 hisp H luc 1 majus 3 sax=tara macr mont Leon cart()h moll perf h (cart) palu 1 pulch (vill)H prat tetr marr pus h 2 Hypoch glab Lepit camp Corisp lept Cornus mas sang()h seric#h Coronil varia Coronop didy H squam Corrig lit Coryd cava clav=Ceratoc cl int lutea pum solida Coryl avel Coryn canes 3 crist filix+ Echinochl crus muricata H Echinocy loba Echinops exal H tatar H Fagus sylv Falc vulg Fallop aube conv h dumet h sphaer H Echium vulg Elat alsin hex hydr triand Eleoch acic mami H mult ovat Fest alt aru() gigant heter’la H ovin#h brev=trac+ fil=tenu+ guest+()H ovin+ poles+H Crat laevig H laev x rhip H laev x mon H mono h mono x rhip H rhip=curv ()H Crepis bien cap palu#h palu+H vulg+H 1 quin unigl h Elodea canad nutt H Elymus can 2 2 2 2 3 ? 1 2 1 2 3 psamm+ ps’ovin+H prat rubr#h nigres+H rubr+() (junc)H (rubr) 1 1 3 3 1 1 ? 2 Leersia oryz 2 Lembo niger Lemna gibba minor pyren rob sang sylv Gerum riva urb Glaux marit Glech hed+ Glyc fluid# decl+H 2 macu radi Iberis amara R Ilex aqui 3 Ille vert Impat gland noli parv 3 Innula brit conyz dens h lati rude sativ virg 3 Leuca vulg#h ircut+H vulg+H R Leuco aest 1 vern fluid+h fluid x not H plic=not+h max striata H Gnaph lut sylv ulig 0 germ hel 1 hirta 2 sali Iris germ# ps’ac sambuc# 1 sib Leymos aren Ligustrum vulg Lili bulb h 2 mart 3 Limos aqu 1 Lina arv H spart H vulg ÖUB Methodenkatalog Teil A off 2 Androm pol Anemo nem ranu() 3 sylv Angel arch 1 pal sylv() 2 Anten dio Anthem arv cotula ruth tinct 3 Anther lil 3 ramo 1 temu+H Lonic peri tar xylo Lotus corn ()h (corn) 2 (hirs)H 2 tenuis H 1 ? R 3 2 2 3 3 R 2 ? ? 3 2 1 3 ? ? ulig Luna ann rediv Lupi angu poly Luro nata H Luzu camp#h camp+ mult+h pall+H luz’oid pilo Lychnis coron flos visc Lycium barb chin H Lycopa escu Lycop’la inund Lycop’um anno clavat Lycopus euro Lysi nem H numm punct thyrs vulg Lythr hyss port=Pepi port sali Maho aqui Maian bifo Malus sylv#h dom+ sylv+H Malva alcea mosch H negl pus H sylv()h (mauri) (sylv) Matri disc recut=cham Matteo struth Medic lupu mini h sat# falc+H sat+ varia+ Melamp arv()h crist()h nem#h nem+h polo+H prat()h Melica nut unifl Melilo albus alt H ? dent H off 1 Melittis meliss Mentha aqu()h arv()h x pip#H 3 puleg h spic#h Avena fatua h Azolla filic 1 Bald ranu Ballo nigr+ Barba stric vulg()h (arcuata)H 2 1 2 1 2 3 ? ? 1 2 2 3 ? 2 2 2 1 (vulg)H Bellis per Berb thunb vulg Berte inc Berula erect Beton off Betula pend (ampori)H (chond)H (variab)H Musca arm botr com negl=racem#H negl+H Myce mura Myosot arv()h disc H ramo scorp=palu#h laxa=ces+h scorp+h spars stric sylv#h sylv+H Moysoton aqu Myosur mini Myrica gale Myrioph altern H heter H spic vert H Najas marin()h Narzi ps’narc Nardu stric Nast off#h micr+H off+H Neot nidu Nepeta cata()h (citr)h Neslia panic Nica phys Nigel arv dama Nonea pulla Nupha lut h Nymph alba h 2 Nymphoi pelt 3 Odon vul=rub#h vern+H vulg=rub+h Oenan aqu+ 3 fist Oenot bien#h bien+h chick=pycno+h coronif+H depress+h fallax+h glaz=eryt+H jueter+H renn=canov+h rubic+h parv#H ammo+H parv+H subter=siles+H Omphar vern Onob vici Onon arv H rep()h 3 spin+H Onopo acant 3 Ophio vulg 2 1 1 1 1 3 Orchis mili morio palu purp trid Origa vulg() Orn’gal nut#h bouch+ Anhang prat#h dent=palu+ prat+ Card’op aren Cardar draba Cardu acant crisp Cerast arv() 3 brach H 3 dubi font# holo+ ? lucor=macr+H glom ? foetida H 3 palu 1 praem setos H tect Crocus vern#h Cruci laev rep() 1 Empet nigr Epilob angu cil=adeno coll hirs mont nut Carex acuta=gra acuta x nigra H ac’for approp aren+ ather H bohem nili h Papa arge dubi rhoe somn() Parie off pens Paris quadr 1 Cucu bacc Cusc camp H 3 epithy() euro()h gron 3 lupu Cymb mura Cynodon dact Rapis rug H Reseda lutea luteola Reynou jap sachal Rhamn cath 3 Rhin ang=ser#h 3 minor()H 3 obsc H 3 palu parv ros tetr() ? (lamyi) H (tetr) R Epipac atro (arge)H (rep)H (rosm)H triand ()h (disc)h (triand)h triand x vimi H vimi 2 Parna palu Parth quin#h inse+H quin+H Past sat 1 Pedi palu 1 sylv Petas hybr spur Petror prol 3 Petuc cerv oreo palu Phac tanac Phala aru pum#H ? glut=pal+H ? pum+H semi tom()h Cer’phyll dem()h (dem)H ? (plat)H 2 comp H crisp 1 fil H 2 fries H 2 gram 3 luc nata 1 x nit=gram x per H ? nodo H 2 obtu H pect 3 perf 2 poly H 1 prael H pus#h 1 ruti H 2 tric H 2 Poten alba angl#h angl+H angl x rept+H anse arge#h canar 3 Phleum phle prat#h bert+H prat+ Phrag austral() Physal alke#h Physoc opul Phyteu spic Phytol escul H 1 Picea abies Picris hier 3 Pilul glob 3 Pimp major saxi#h nigr+H saxi+H ? coll#H erect int H norv 3 palu rect()h rept 1 rupest ster sup h verna h# 3 hept+H 3 incan=aren+h incan x tab H ? pusilla+H tab=neum+h 1 Prim elat 1 Ping vulg Pinus sylv Plant aren=indi lanc 3 veris#h 2 Prunella gran 1 lacin vulg 3 3 1 3 3 ? 2 1 1 1 2 1 3 3 3 major()h (int)H (major)h (vint)H media Platanus x hybr H Plat’ra bifo() chlor Poa ann+ bulb h chai comp nem palu prat# angu+ prat+ subcaer+ remot H triv Polygal amar#H amarel+H como h serp H vulg()h Rhus typh 2 Rhynch alba 1 fusc ? Ribes alp nigr rubr#h rubr+()H spic+H uva Robin ps-acac Rori amph x ance H ? x armo H ? austr palu 3 3 1 3 1 ? sylv Rosa can#h can+h duma+H subcan+h chorym#h caes+H chorym+h subcol+h elipt#H agr+H inod+H ellipt+H glauc=rubr jundz H rubic#h column+H nigre+H rubig+h rug H 3 tom’la=obtu H ? 3 1 1 3 3 2 3 1 0 0 R 1 Sapon off Saxi gran trid Scab canes colu ochro Scheu palu Schoen lacu#h lacu+ tab+ sub Scilla amoe H bifo H luc=Chion luc#h luc+H siehei+H sard=Chion sa H sib Scirpo holo Scirp radi sylv oler palu Sorbus aucup int tormen Sparg emers erect()h (erect)H (negl)H (oocarp)H nata=mini Spergula arv() moriso pent H Sperg’ria rubr Spiraea alba H billar H 3 (oxypt)H (vulg)H Polyg’tum mult odor Polyg’um amph# amph+ amph terr+ comm+()h comm x pyr h ? pyr+H Querc petr h pub H robur h rubr obtu()h palu sang h ? sten H thyrs triang ? Sagina apet#H 1 errat+H ? congest 2 erocif()H inaeq jakob ovat=fuchs+h 3 palud avic#()h 2 Radiola lino 2 nodo 3 sarr=fluv H 2 3 2 1 3 3 2 2 0 2 3 vulg Frag x anan mosch H vesca virid h Frang alnus Fraxi excel penn vulg Silyb mar Sinap alba() arv Sisym alt irio loesel off volg Sium latif Solan dulc nigr()h (nigr) (chult) phys=niti H villos#H Solid canad gtigant virg Sonch arv()h (arv) (ulig) asp tomen#h ps’scabr+H sher+H 3 tom+H vill+h Rubus cas frut#h armen+ chory#h lacin+ idae sax Rudb hirta lacin Rumex acetosa ac’ella()h (ac’ella) (tenuif)h 2 aqu H aqu x hydro H congl crisp crisp x obtu H hydr marit 3 2 1 ? X Fest loli H Filag arv mini vulg H Filip ulm (denu) (ulm) Salso coll H kali() (trag0ruth) Salvia nem# prat vert Salvin nat Sambu nigr racem Samul valer Sang minor() (minor)h (muric)h off Sanic euro Prunus avium cerasi cerasus dom (dom) (insi)H maha padus sero spin()h (fru’ans)H (spin)h virgin Ps’tsuga menz Pteri aqui()h Pucci dist h Pulic dyse vulg Pulmo obsc+h Puls prat() vulg Pyrola chlor minor rot Pyrus comm#h 3 2 3 ? Sclera an#h ann+h polyc+H ann#x per H per Scleroch dura Scolu fest#H Scorz humi purb Scroph nodo umbr Scut gale hast minor Sedum acre album rupest=refl+ sex spur tele#h max+h tele+H Selin carv Senec aqu#h aqu+H 2 2 0 1 1 1 3 3 2 2 1 2 2 3 1 1 dougl H spec Spiro polyrh Stach annua arvensis germ palu() rect sylv Stell alsin=ulig gram holost media# pall+ media+ negl+H nem h palu Stipa cap penn# boryst+()H (boryst) (german)H joann+H pulch+H Strat aloid Succisa prat Swert per Sympho albus Symphy off x upl Syrin vulg Tanac cory parth vulg Tarax laev=Ery#h lacist+H 3 1 1 Isolep fluid 3 setac H Iva xanth 3 Jasio mont 2 1 Jovi sobol 3 Jugl regia 3 Juncus acutifl h perf H 3 alp H sorz h arctic() 1 Hamm palut 1 atrat H Hedera helix bufo#h 2 Helia’um num#h bufo+ num+h mino+H ovat+h ? rana+H Helia’us ann bulb()h perv peregr H Thymus panno H pers puleg 3 polit serp 3 praec H serp x puleg 3 prostr Tilia cord 3 scut R plat()H serp 1 Toril arv H 3 spic 3 1 3 3 3 3 3 1 1 3 2 3 1 1 3 3 3 2 1 2 3 3 2 3 ? 0 3 1 1 Grati off Gymnad conop h Gymnoc dryo rob Gypso fast mural panic jap Trago dubi prat#h minor+H orient+ prat+ Trapa nata Trien euro Trif alpe arv aur H camp dubi+ fragif hybr 3 teucr h triph 3 vern Vibur opul Vicia angu()h (angu) (sat)H (seget) cassub cracc 1 dumet grandifl()h hirs lathyr lutea inc medium mont prat() rep resup rubens striat H Trigl marit palu Tripi perf=inod Trise flav() Troll euro Tube gutt Tulipa sylv Tuss farf Typha angu pann()h 1 pisi sep() (erioc)H (mont)H (sep)H R sylv tenuif H tetr vill()h (dasyc)H (vill) Vinca minor Vincet hirund Viola arv()h can hirta lati Ulmus glab H laev minor H R mira odor# odor+ suavis+H spec(excl laev) Urtica dio()h (dio) (galeops)H kiov urens Utric int#h int+H ocho+H stygia+H minor vulg#h austr+H vulg+H Vaccin myrth oxyc+ ulig vitis Valer’ana dio off#h off+H procurr+H samb’f+H tenuif=valrr+H Valer’ella carin H dent loc rimos H Verba blat dens lych nigr palu 2 pers=stag H rivin# reich H reich x riv rivin 3 rupest H tricol Viscum album abiet H laxum 0 Vulpia brom H myuros 3 Wolff arrh Xanth albi()h (albi)H (ripari)H struma+H 3 Zanni palu()h (pedicell)H phoen 3 Linnaea ore R Linum austr 3 cat usit 1 Lipa loesel 3 List ovat Litho arv#h arv+H 2 caer+H 3 off 2 Litto unifl Lobul marit Lolium mult per 1 remot H ÖUB Methodenkatalog Teil A x rot=nili+H spic+H villosa+H x vert#h x vert+ 3 Menya trif Mercu ann nut+ umb#h angust+H umb+H Orn’pus perp sativ 0 Orob alba per 1 Meum atha Mili effu Mimu gutt 1 aren=laev 2 caryo het 1 lut mosch 2 Misop oront Moehr triner purp 1 reti Orthi sec 1 Moench erec 2 Orthan lutea Molin caer#h 2 Osmu reg car+ Oxalis ace 3 Mones unifl corn Monot h’pitys#h dill h’pheg+H font h’pitys+ 2 Oxyt pilo Monita font()h Pani cap#H aren()H avic()H (avic)H (ruri)H 2 bist hydr lapa()h (lapa)H minus mite H pers Anhang 3 3 3 1 Ranun acris h aqu#h aqu+H pelt+H penic+H trichoph+H arv 3 auri#h bulb 3 circ ficar (bulb) Polyp vulg#H 1 Polyst acul ? Popu alba flamm 2 fluit H lanug H balsam#h x canad h x canes 1 nigr H trem Portu oler 2 Potam acut H 2 alp 2 lingua 1 polya’os#H rep 3 sard scel Raph raph#h raph+h sat+h xang=ziz=gr x lu H proc() Sagit lati H sag Salix alba h auri H auri x cin h capr sylv vern visc vulg 2 Serra tinct 3 Seseli ann 1 liban=Liban mont ciner+h Setar ital h daph pum=glau x dasi#H vert’ata+H cap x cin x virid vim+ cin x vim+H 2 Shera arv frag #h 3 Silaum sil alb x Silene arm frag=rube frag+H 2 chloran frag x pent H coni frag x trian H dioica 3 myrs=nigr H latifolia=alba pent h 3 noct purp nut()h purp x vimi H 3 otites 3 rep()h 3 tatar 1 1 0 1 2 1 1 3 1 § scanic+H siles+H off=Ruder#h 2 palu=Palu#H subalp+H spec tab=Celt#H nordst+H 3 phlom thaps Verbe off Veron acre an’-aqua#h an’-aqua+ caten+H Taxus bac Teesd nudi Tetragon marit Toicr scordium arv beccab cham#h cham+ scorodonia Thall aqui H flav 0 3 vindob+H dillen filif luc H minus()h Thelypt palu pheg Thes ebrag H lino Thlas arv car het#h het+H sublob+ 1 jacqu H 3 longif h R mont off H 2 opaca H ÖUB Methodenkatalog Teil A 20. Anhang Formblatt Vegetationsstruktur bei der Heuschrecken- und Laufkäfererfassung begleitend zur Heuschreckenerhebung an zwei Terminen im Zeitraum Juli bis September sowie zur Laufkäfererfassung auf Ackerflächen im Frühjahr- und Herbstaspekt Kartierer: Mineralisches Grasland / Moore Acker Monitoringfläche / ÖUB-Ident. Transekt-Nummer: Lage I II MF1 MF2 III IV Oberhang Mittelhang Mittelhang Aufnahme-Datum: bei Acker: Anbaufrucht Krautschicht-Gesamtdeck. (%): anteilig Gras (%): anteilig Kraut (%): Moosschicht (%): Gehölzschicht (%) / Höhe (cm): Streuschicht (%): Streuschicht: mittlere Höhe (cm) Offenboden (%): Altgras, stehend (I-III): Verfilzung (I-III): mittlere Vegetationshöhe (cm) Horizontale Durchsicht (%): in 10 cm in 30 cm in 50 cm in 100 cm Die Deckungsanteile werden mit Hilfe eines visuellen Schätzverfahrens in 5 %-Schritten erhoben. Für geschätzte Deckungsanteile zwischen 0-5 % bzw. 95-100 % erfolgt die Angabe mit 2 % bzw. mit 98 %. Altgras- und Verfilzung: I: nicht bis gering vorhanden (< 5% Deckung) II: mittlere Anteile (5 - 25% Deckung) III: hohe Anteile (> 25% Deckung) ÖUB Methodenkatalog Teil A Kartierer: Transekt-Nr.: Lage: Aufnahme-Datum: Fläche (m²): Witterungsbedingungen: Exposition: Neigung: Hauptvorkommen / Status Monitoringfläche / ÖUB-Ident. Häufigkeit MessfeldProbefläche Erfassungsbogen Heuschrecken (Gesamtarteninventar, Transekt, Isolationsquadrat) Häufigkeit Monitoringfläche 21. Anhang I II MF1 MF2 100 100 III 100 Krautschicht-Gesamtdeckung (%): Grasanteil (%): Krautanteil (%): Moosschicht (%): Gehölzschicht (%) / Höhe (cm): Offenboden (%): Streuschicht (%): Streuschicht: Höhe (cm) Altgras: Verfilzung: mittlere Vegetationshöhe (cm) Horizontale Durchsicht (%): in 10 cm in 30 cm in 50 cm in 100 cm Artenzahl: Leptophyes albovittata Leptophyes punctatissima Meconema thalassinum Conocephalus discolor Conocephalus dorsalis Tettigonia cantans Tettigonia viridissima Decticus verrucivorus Platycleis albopunctata Metrioptera roeselii Metrioptera bicolor Pholidoptera griseoaptera Gryllus campestris Tetrix subulata Tetrix undulata Tetrix tenuicornis Oedipoda caerulescens Stethophyma grossum Chrysochraon dispar Omocestus viridulus Omocestus haemorrhoidalis Stenobothrus lineatus Myrmeleotettix maculatus Chorthippus apricarius Chorthippus biguttulus Chorthippus brunneus Chothippus mollis Chorthippus albomarginatus Chorthippus dorsatus Chorthippus montanus Chorthippus parallelus für Isolationsquadratfänge: Chorthippus sp. (Larven) Ch. biguttulus agg. (Larven) Ch. montanus/ parallelus (Larven) zusätzl. indet. Individuen Individuenzahlenzahl / Isolationsquadrat Häufigkeitsklassen für Transekt-Methode (Individuendichte / 100 m²) nach BRUCKHAUS & DETZEL (1997) I: Einzelfund, II: 2-5 Ind., III: 6-10 Ind., IV: 11-20 Ind., V: 21-50 Ind., VI: > 50 Ind. 1: sehr selten, 2: selten, 3: zerstreut, 4: verbreitet, 5: häufig (eudominant); (zur genauen Def. vgl. Kap. 3.5.2.4) Angaben zum Hauptvorkommen bzw. Status IV 100 Isolationsquadrat Isolationsquadrat MF1 MF2 20 20 ÖUB Methodenkatalog Teil A Anhang t: flächentypisch a: Hochstaudenfluren, b: Trockenstandorte c: Feuchtflächen auf Gebüsche, Waldsäume auf Feuchtwiesen Trockenstandorten d: Torfmoosrasen e: Gast (Einzelexemplare, zugewandert, z. Teil makropter) ÖUB Methodenkatalog Teil A 22. Anhang Erfassungsbogen Libellen (Odonata) Kartierer: Gesamt / Monitoringperiode RL-BB Monitoringfläche/ ÖUB-Ident Aufnahme-Datum: Status Exuv. Imag. Witterungsbedingungen: Calopteryx splendens - Calopteryx virgo 2 Sympecma fusca - Lestes barbarus G Lestes dryas V Lestes sponsa - Lestes virens 3 Lestes viridis - Platycnemis pennipes - Pyrrhosoma nymphula - Erythromma najas - Erythromma viridulum - Ischnura elegans - Ischnura pumilio G Coenagrion hastulatum V Coenagrion lunulatum 3 Coenagrion puella - Coenagrion pulchellum - Enallagma cyathigerum - Brachytron pratense - Aeshna affinis - Aeshna cyanea - Aeshna grandis - Aeshna isosceles V Aeshna mixta - Aeshna subarctica 2 Aeshna viridis 2 Anax imperator - Anax parthenope 3 Gomphus flavipes 3 Gomphus vulgatissimus V Ophiogomphus cecilia 2 Cordulia aenea - Somatochlora flavomaculata V Somatochlora metallica - Epitheca bimaculata 3 Libellula quadrimaculata - Libellula depressa - Libellula fulva V Orthetrum cancellatum - Leucorrhinia albifrons 2 Leucorrhinia caudalis 2 Leucorrhinia pectoralis 3 Sympetrum danae V Symp. depressiusculum 2 Sympetrum flaveolum 3 Sympetrum pedemontanum 3 Sympetrum sanguineum - Sympetrum vulgatum - Artenzahl / Begehung Gesamtartenzahl Logarithmische Abundanzklassen (nach SIEDLE 1992), verändert 1 (Imagines)/A (Exuvien): 1 Ind., 2/B: 2-5 Ind., 3/C: 6-10 Ind., 4/D: 11-30 Ind., 5/E: 31-50 Ind., 6/F: 51-100 Ind., 7/G: 101-300 Ind., 8/H: 301-500 Ind., 9/I: 501-1000 Ind., 10/J: 1001-3000 Ind., 11/K: 3001-5000 Ind., 12/L: 5001-10000, 13/M: > 10000 Ind. Angaben zum Status a: bodenständig, b: vermutlich bodenständig, c: möglicherweise bodenständig, d: vermutlich nicht bodenständig (Gast); (zur genauen Def. vgl. Kap. 3.5.2.6) Exuvien-PF (X m Uferlänge) ÖUB Methodenkatalog Teil A 23. Anhang Erfassungsbogen Tagfalter und Widderchen (Rhophalocera & Zygaenidae) Monitoringfläche / ÖUB-Ident. Kartierer: Aufnahme-Datum: Witterungsbedingungen: Probefläche: Heteropterus morpheus Carterocephalus palaemon Thymelicus lineola Thymelicus sylvestris Thymelicus aceton Hesperia comma Ochlodes venata Papilio machaon Leptidea sinapis/ reali Anthocharis cardamines Aporia crataegi Pieris brassicae Pieris rapae Pieris napi Pontia daplidice Colias hyale Gonepteryx rhamni Lycaena phlaeas Lycaena dispar Lycaena virgaureae Lycaena tityrus Lycaena alciphron Thecla betulae Callophrys rubi Satyrium pruni Satyrium spini Cupido minimus Celastrina argiolus Aricia agestis Polyommatus semiargus Polyommatus amandus Polyommatus icarus Polyommatus coridon Argynnis paphia Argynnis adippe Issoria lathonia Brenthis ino Boloria selene Boloria dia Vanessa atalanta Vanessa cardui Inachis io Aglais urticae Polygonia c-album Araschnia levana Nymphalis antiopa Melitaea diamina Melitaea athalia Parage aegeria Lasiommata megera Coenonympha glycerion Coenonympha pamphilus Aphantopus hyperanthus Maniola jurtina Melanargia galathea Hipparchia semele Jordanita chloros Adscita statices f. statices Zygaena minos Zygaena carniolica Zygaena loti Zygaena viciae Zygaena ephialtes Zygaena filipendulae Zygaena trifolii Artenzahl / Probefläche: Gesamtartenzahl: Häufigkeitsschlüssel für die Probeflächen nach ULRICH (1995) 1: 1 Ind., 2: 2-5 Ind., 3: 6-10 Ind., 4: 11-20 Ind., 5: 21-50 Ind., 6: 51-100 Ind., 7: 101-250 Ind., 8: 251-500 Ind., 9: > 500 Ind. Einschätzung der relativen Siedlungsdichte innerhalb der Probeflächen (Individuendichte / 100 m²) nach HERMANN (1992) E: Einzelfund, I: 1-4 Ind., II: 5-10 Ind., III: > 10 Ind. Häufigkeitsklassen für die auf der gesamten ÖUB-Monitoringfläche nachgewiesenen Arten E: Einzelfund/ sehr selten, s: selten, z: zerstreut, v: verbreitet, h: häufig (eudominant); (zur genauen Def. vgl. Kap. 3.5.2.5) RL-BB (1999) 3 V 2 2 V V 2 3 2 3 V 3 1 2 V 3 3 2 2 2 2 1 V 1 V 2 2 3 V 3 2 ÖUB Methodenkatalog Teil A ANHANG Eingabemasken für die Datenbank Laufkäfer (Carabidae) Barberfalle Erfassungszeitraum Aufnahme Car_Code cf Anzahl Ex coll INST_CODE det rev SC_A1_C01 SC_1999_1c I. C005010 Nein 8 Nein 1 CM Regenwürmer I (Lumbricidae) Erfassungs-Ident Teil_Pf METH_CODE SC_A1_LF01_T1 -1 Meth0101 Lum_Code cf Ad/Juv Aufnahme Anzahl Gewicht gem/gesch L007080 Nein 1 I. 1 5,09 gemessen Regenwürmer II (Lumbricidae) RW_DF Erfassungs-Ident Termin Aufnahme Bodenfeuchte SC_A1_LF01 SC_A1_LF01_T1 02.11.1999 I. 4,4 BT (5cm) BT (10cm) 10,6 10,2 Lurche (Amphibia) Ident Bezugsfläche Amph_CODE SC_G1 Flächenbezug R03011 Termin Aufnahme Status Häufigkeit 25.03.1999 I. 1 außerhalb GeBemerkung Kartierer wässer/Graben II Aus OB Vegetationstransekt I OEUB_Transektpunkt Aufnahme SC_A1TR1001 I. Taxon Artcode cf Deckung Deckung detailliert korm ARENSER* Nein 1 1 Bemerkungen Vegetationstransekt II Ident TransektNr OEUB_Transektpunkt Aufnahme SC_A1 Transekt1 SC_A1TR1001 I. Datum 05.05.1999 Höhe Höhe Deckung Deckung KrautDistanz Ge- KrautBemerkung Gehölze schich hölze schicht t 10 -9999 -9999 Ho