SILP GY 7-8
Werbung
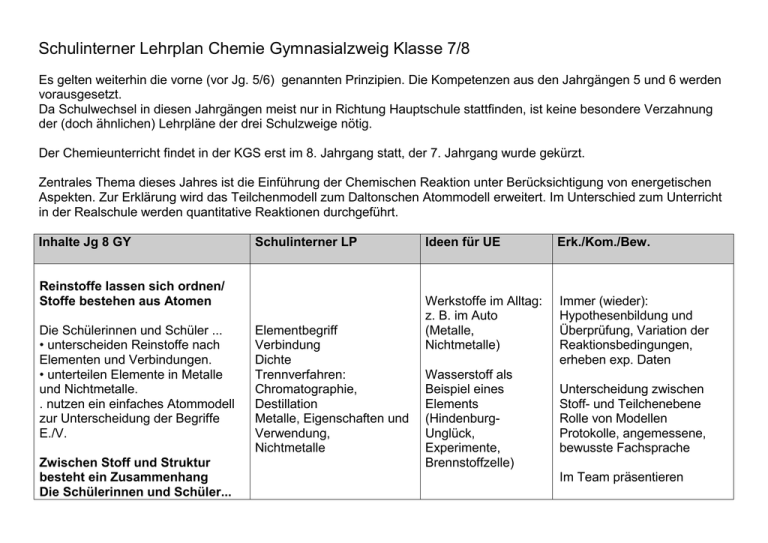
Schulinterner Lehrplan Chemie Gymnasialzweig Klasse 7/8 Es gelten weiterhin die vorne (vor Jg. 5/6) genannten Prinzipien. Die Kompetenzen aus den Jahrgängen 5 und 6 werden vorausgesetzt. Da Schulwechsel in diesen Jahrgängen meist nur in Richtung Hauptschule stattfinden, ist keine besondere Verzahnung der (doch ähnlichen) Lehrpläne der drei Schulzweige nötig. Der Chemieunterricht findet in der KGS erst im 8. Jahrgang statt, der 7. Jahrgang wurde gekürzt. Zentrales Thema dieses Jahres ist die Einführung der Chemischen Reaktion unter Berücksichtigung von energetischen Aspekten. Zur Erklärung wird das Teilchenmodell zum Daltonschen Atommodell erweitert. Im Unterschied zum Unterricht in der Realschule werden quantitative Reaktionen durchgeführt. Inhalte Jg 8 GY Schulinterner LP Reinstoffe lassen sich ordnen/ Stoffe bestehen aus Atomen Die Schülerinnen und Schüler ... • unterscheiden Reinstoffe nach Elementen und Verbindungen. • unterteilen Elemente in Metalle und Nichtmetalle. . nutzen ein einfaches Atommodell zur Unterscheidung der Begriffe E./V. Zwischen Stoff und Struktur besteht ein Zusammenhang Die Schülerinnen und Schüler... Elementbegriff Verbindung Dichte Trennverfahren: Chromatographie, Destillation Metalle, Eigenschaften und Verwendung, Nichtmetalle Ideen für UE Erk./Kom./Bew. Werkstoffe im Alltag: z. B. im Auto (Metalle, Nichtmetalle) Immer (wieder): Hypothesenbildung und Überprüfung, Variation der Reaktionsbedingungen, erheben exp. Daten Wasserstoff als Beispiel eines Elements (HindenburgUnglück, Experimente, Brennstoffzelle) Unterscheidung zwischen Stoff- und Teilchenebene Rolle von Modellen Protokolle, angemessene, bewusste Fachsprache Im Team präsentieren • beschreiben die Aggregatzustände auf der Teilchenebene. • beschreiben das Vorhandensein identischer und für einen Stoff charakteristischer Teilchen/ Bausteine als ein wesentliches Merkmal für die Eigenschaften eines Stoffes. Experimentieren zum Thema Aggregatzustände Chemische Reaktion auf submikroskopischer Ebene Die Schülerinnen und Schüler... • beschreiben die Entstehung neuer Stoffe und den Energieumsatz als ein Kennzeichen einer chemischen Reaktion. • Erkennen die grundsätzliche Umkehrbarkeit der CR • beschreiben den Bau von Stoffen mit einem ausgewählten Stoffnachweise (Sauerstoff, Kohlenstoffdioxid, Wasserstoff) Atommodell. • erklären chemische Reaktionen als Neugruppierung von Atomen. • erläutern die Erhaltung der Anzahl und der Masse der Atome bei chemischen Reaktionen. - entwickeln das Gesetz von der Erhaltung der Masse Oxidbildung, Oxidspaltung, Redoxbegriff Korrosion, Oxidationsreihe der Metalle, Elementbegriff Analyse und Synthese Hochofen Wasser/ Wasserstoff Daltonsche Atomhypothes Daltonsches Atommodell Größe und Masse von Atomen Atommasseneinheit u Anwendung der Bewertung von Korrosionsschutzmaßnahmen und der wirtschaftlichen Bedeutung der Metalle/-oxide Die Schülerinnen und Schüler... • stellen Bezüge zwischen chemischen Reaktionen und innovativen Produkten (z.B. Holz/Holzkohle Wärmekissen) her. Wasserstoff s. o. • stellen Bezüge zu Physik Brände löschen (verschiedene Kalkkreislauf Energieformen) und Biologie (Fotosynthese, Atmung, ) her. C-Kreislauf (Kresse..) Bezüge zur Biologie erkennen Kohlenstoffkreislauf) her. • b(ewerten Umweltschutzmaßnahmen unter dem Aspekt der Atomerhaltung. Atome als Kugeln veranschaulichen, Modellreaktionen mit den Kugeln legen • entwickeln und lassen vergleichen Verbesserungsvorschläge Boyle-Versuch von Versuchsdurchführungen. • erstellen Reaktionsgleichungen unter Anwendung der Kenntnisse über die Erhaltung der Atome und die Bildung konstanter Atomverhältnisse in Verbindungen. Atommasseneinheit [u], . Molekül Atomanzahlen lassen sich berechnen Die Schülerinnen und Schüler... • stellen die proportionale Zuordnung zwischen der Masse einer Stoffportion und der Anzahl an Teilchen/Bausteinen und Atomen her. • zeigen die Bildung konstanter Atomanzahlverhältnisse in chemischen Verbindungen auf. - planen und machen einfache quantitative Experimente Die Schülerinnen und Schüler... • beschreiben Beispiele für einfache Atomkreisläufe („Stoffkreisläufe") in Natur und Technik als Systeme chemischer Reaktionen. Chemische Reaktionen unterscheiden sich im Atomhypothese zur Erklärung der chemischen Reaktion, chemischer Grundgesetze und der Stoffklassen Wortgleichungen und einfache Symbolgleichungen Energiegehalt Exotherm/ endotherm Die Schülerinnen und Schüler... Aktivierungsenergie • beschreiben, dass der Aggregatzustand eines Stoffes von der Temperatur abhängt und • beschreiben, dass sich Stoffe in ihrem Energiegehalt unterscheiden. • beschreiben den Zusammenhang zwischen chemischen Reaktionen und Energieumwandlung. • erklären den Begriff Aktivierungsenergie. • unterscheiden Energie abgebende (exotherm) und Energie aufnehmende (endotherm) Reaktionen. Die Schülerinnen und Schüler... • erstellen Energiediagramme. • deuten Prozesse der Energieübertragung mit dem einfachen Teilchenmodell. • führen experimentelle Untersuchungen zur Bestimmung einer Energieübertragung zwischen System und Umgebung durch.