SILP RS 7-8 - KGS Schneverdingen
Werbung

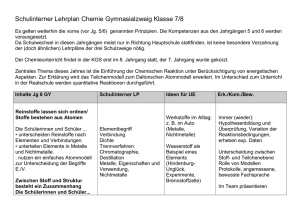
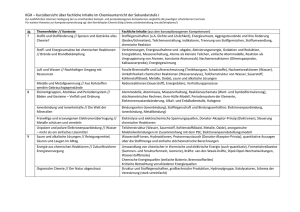
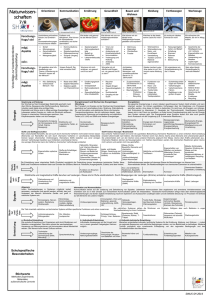
Schulinterner Lehrplan Chemie Realschulzweig Klasse 7/8 Es gelten weiterhin die vorne (vor Jg. 5/6) genannten Prinzipien. Die Kompetenzen aus den Jahrgängen 5 und 6 werden vorausgesetzt. Da Schulwechsel in diesen Jahrgängen meist nur in Richtung Hauptschule stattfinden, ist keine besondere Verzahnung der (doch ähnlichen) Lehrpläne der drei Schulzweige nötig. Der Chemieunterricht findet in der KGS erst im 8. Jahrgang statt, der 7. Jahrgang wurde gekürzt. Zentrales Thema dieses Jahres ist die Einführung der Chemischen Reaktion unter Berücksichtigung von energetischen Aspekten. Zur Erklärung wird das Teilchenmodell zum Daltonschen Atommodell erweitert. Inhalte Jg 8 RS Schulinterner LP Ideen für UE Erk./Kom./Bew. Elementbegriff Verbindung Werkstoffe im Alltag: z. B. im Auto (Metalle, Nichtmetalle) Immer (wieder): Hypothesenbildung und Überprüfung, Variation der Reaktionsbedingungen, erheben exp. Daten Reinstoffe lassen sich ordnen/ Stoffe bestehen aus Atomen Die Schülerinnen und Schüler ... • unterscheiden Reinstoffe nach Elementen und Verbindungen. • unterteilen Elemente in Metalle und Nichtmetalle. . nutzen ein einfaches Atommodell zur Unterscheidung der Begriffe E./V. Chemische Reaktion auf submikroskopischer Ebene Die Schülerinnen und Schüler... Metalle, Eigenschaften und Verwendung, Nichtmetalle Stoffnachweise (Sauerstoff, Kohlenstoffdioxid, Wasserstoff) Daltonsche Atomhypothes Wasserstoff als Beispiel eines Elements (HindenburgUnglück, Experimente, Brennstoffzelle) Unterscheidung zwischen Stoff- und Teilchenebene Protokolle, angemessene, bewusste Fachsprache Im Team präsentieren • beschreiben die Entstehung neuer Stoffe als ein Kennzeichen einer chemischen Reaktion. • lernen verschiedene Arten chemischer Reaktionen kennen. • beschreiben den Bau von Stoffen mit einem ausgewählten Atommodell. • erklären chemische Reaktionen als Neugruppierung von Atomen. • erläutern die Erhaltung der Anzahl und der Masse der Atome bei chemischen Reaktionen. . Molekül • erstellen Reaktionsgleichungen unter Anwendung der Kenntnisse über die Erhaltung der Atome Atommasseneinheit [u], Daltonsches Atommodell Größe und Masse von Atomen Atommasseneinheit u Anwendung der Atomhypothese zur Erklärung der chemischen Reaktion, chemischer Grundgesetze und der Stoffklassen Atome als Kugeln veranschaulichen, Modellreaktionen mit den Kugeln legen lassen Bewertung von Korrosionsschutzmaßnahmen und der wirtschaftlichen Bedeutung der Metalle/-oxide Boyle-Versuch Die Schülerinnen und Schüler... • stellen Bezüge zwischen chemischen Reaktionen und innovativen Produkten (z.B. Wärmekissen) her. • stellen Bezüge zu Physik (verschiedene Energieformen) und Biologie (Fotosynthese, Atmung) her. Bezüge zur Biologie erkennen KohlendioxidKreislauf Oxidbildung, Oxidspaltung, Korrosion, Oxidationsreihe der Metalle, Elementbegriff Analyse und Synthese Hochofen Wasser/ Wasserstoff Wortgleichungen und einfache Symbolgleichungen Chemische Reaktionen unterscheiden sich im Energiegehalt Die Schülerinnen und Schüler... • beschreiben den Zusammenhang zwischen chemischen Reaktionen Exotherm/ endotherm und Energieumwandlung. Aktivierungsenergie • erklären den Begriff Aktivierungsenergie. • unterscheiden Energie abgebende (exotherm) und Energie Holz/Holzkohle Wasserstoff s. o. Brände löschen Kalkkreislauf aufnehmende (endotherm) Reaktionen. Elemente lassen sich ordnen Die Schülerinnen und Schüler... • ordnen Elemente anhand ihrer Eigenschaften bestimmten Elementfamilien zu. • vergleichen die Elemente innerhalb einer Elementfamilie. • gelangen zu Aussagen über die Eigenschaften und den Atombau ihnen unbekannter Elemente. • nutzen das PSE zur Ordnung der ihnen bekannten Elemente. • schließen von der Stellung eines Elements im PSE auf seine Eigenschaften. • begründen den Zusammenhang zwischen der Stellung eines Elements im PSE und seinen Eigenschaften. Massenzahl, Ordnungszahl Atome besitzen einen differenzierten Aufbau Schülerinnen und Schüler... • beschreiben den Bau von Atomen aus Protonen, Neutronen und Elektronen. • erklären den Schalenaufbau der Elementfamilie Charakteristische Eigenschaften und Reaktionen Vergleiche innerhalb der Elementfamilie Alkalimetalle Halogene Periodisches System der Elemente Periodensystem als Ordnungs- und Klassifikationsschema Kern-Hülle Modell des Atoms Proton, Neutron, Kern, Kernladungszahl, Ordnungszahl, Isotop, Elektron Das Salzprojekt Wo kommt Salz her, wie ist es aufgebaut, kann man es zerlegen, kann man es herstellen Als Einstieg in das Thema Elementfamilien Danach weitere Alkalimetalle und typische Reaktion mit Wasser, Anwendung bei Erdalkalimetallen Halogene im Alltag PSE/ Atombau als Elektronenschalen-Modell kurzer, anschaulicher Theorieblock Energiestufen, Elektronenschalen Valenzelektronen Die Schülerinnen und Schüler... • recherchieren zielgerichtet in unterschiedlichen Quellen Daten zu Elementen. • erkennen Grenzen von Atommodellen und zeigen diese auf Veranschaulichung in verschiedenen Darstellungsformen Atomhülle. Edelgaskonfiguration, Oktettregel