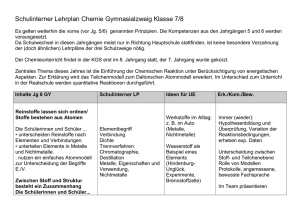
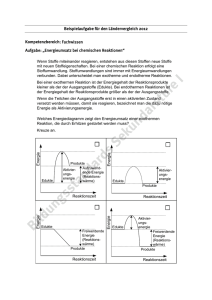
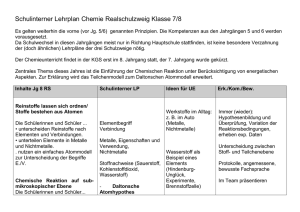
Merkmale chemischer Reaktionen
Werbung

Merkmale chemischer Reaktionen Es gibt einige Merkmale, die für alle chemischen Reaktionen gelten: 1. In chemischen Reaktionen entstehen neue Stoffe mit neuen Eigenschaften. Die stofflichen Veränderungen sind häufig – aber nicht immer – mit dem menschlichen Auge erkennbar. Auf der Ebene der Atome, Ionen und Moleküle spricht man von der Umgruppierung von Teilchen. 2. Prinzipiell sind alle chemischen Reaktionen umkehrbar. In der Praxis ist dies jedoch häufig nicht oder nur mit extrem grossem Aufwand möglich (Beispiel: Umkehr der Verbrennung von Holz). 3. Massenerhaltung: Die Produkte haben exakt die gleiche Masse wie die Edukte. In chemischen Reaktionen (Ausnahme: Kernreaktionen) geht Materie weder verloren, noch wird neue Materie erzeugt. 4. Konstante Massenverhältnisse: Die Edukte einer chemischen Reaktion reagieren in einem konstanten Massenverhältnis (z. B. Experiment Kupfersulfid). 5. Energieumsatz: Chemische Reaktionen sind von einem Energieumsatz begleitet. Sie sind exotherm (Wärme wird an die Umgebung abgegeben) oder endotherm (Wärme wird von der Umgebung aufgenommen). 6. Aktivierungsenergie:Jede chemische Reaktion – ob exotherm oder endotherm – braucht Aktivierungsenergie, um die Bindungen der Edukte (= Ausgangsstoffe) zu spalten. Bei vielen Reaktionen liefert die Umgebung bei Raumtemperatur genügend Aktivierungsenergie, es muss nicht zusätzlich geheizt werden. Exotherme Reaktionen (z. B. Verbrennen einer Kerze) müssen nur zu Beginn aktiviert werden. Die freigesetzte Reaktionsenergie (=Reaktionswärme) wird (teilweise) für die Aktivierung weiterer Moleküle verwendet. Reaktionsschema einer exothermen Reaktion mit und ohne Katalysator. Der Katalysator bewirkt eine Abnahme der Aktivierungsenergie, wodurch die Reaktion schneller abläuft. Der Katalysator wird in der Reaktion nicht verbraucht. 75881485 14.05.2016 / Zy