Chemische Reaktionen
Werbung

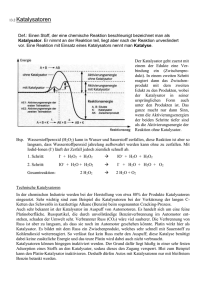
65 Chemische Reaktionen Wann läuft eine chemische Reaktion freiwillig ab? Wie viel Energie wird dabei abgegeben oder aufgenommen? Mit diesen Fragen befasst sich die Reaktionsenergetik. Sie ist ein Teilgebiet der Thermodynamik. In der Reaktionskinetik wird untersucht, wie schnell Reaktionen ablaufen und welche Faktoren die Reaktionsgeschwindigkeit beeinflussen. Viele Reaktionen, vor allem Reaktionen in Lebewesen, würden bei Körpertemperatur unendlich langsam ablaufen. Um sie zu beschleunigen, verwendet man Katalysatoren. Lebewesen produzieren ihre eigenen Katalysatoren: die Enzyme. Enthalpie [H] Die Reaktionsenthalpie (H) gibt an, wieviel Wärme bei einer Reaktion frei wird oder zugeführt werden muss (bei konstantem Druck - Luftdruck). Ist die Enthalpie negativ (H < 0), bedeutet dies, dass bei der Reaktion Energie frei wird (Die reagierenden Stoffe verlieren Energie). Solche Prozesse nennt man exotherm . Ist H > 0, muss dem System Energie zugeführt werden, die Reaktion ist endotherm. Betrachtet man die Reaktion eines Mols eines Stoffes bei Standardbedingungen (25°C = 298 K, 1013 mbar = 101,3 kPa), erhält man die Standard-Reaktionsenthalpie H°: H2 + ½ O 2 H2 O H° = –286 kJ/mol Die Reaktion von Wasserstoff und Sauerstoff, also die Bildung von Wasser aus den Elementen, ist stark exotherm. Sie läuft bei Zündung eines Sauerstoff-Wasserstoff-Gemisches schlagartig mit einem lauten Knall ab, man bezeichnet sie daher als "Knallgasreaktion". Für die Rückreaktion, also die Zerlegung von Wasser in die Elemente, ist eine Energie von +286 kJ/mol nötig; da die Hinreaktion exotherm ist, ist die Rückreaktion endotherm. Merke: Bei exothermen Reaktionen werden aus unpolaren Stoffen polare Stoffe gebildet (Zunahme von EN) Satz von Heß Der Satz von Heß (Heßscher Wärmesatz) besagt, dass die Reaktionsenthalpie nur vom Zustand der Edukte und Produkte abhängt, nicht vom Reaktionsverlauf und der Anzahl der Schritte. Durch Anwendung des Satzes von Heß können Reaktionsenthalpien indirekt bestimmt werden, die experimentell nicht direkt gemessen werden können, beispielsweise die Bildungsenthalpie von Kohlenmonoxid (CO): 66 C + O2 CO 2 H°1 = –393,5 kJ/mol experimentell bestimmt CO + ½ O2 CO 2 H°2 = –283,0 kJ/mol experimentell bestimmt C + ½ O2 CO H° = –110,5 kJ/mol berechnet aus H° 1 – H° 2 Entropie [S] Die Entropie S kann vereinfacht als Maß für die Unordnung eines Systems betrachtet werden. Mit zunehmender "Unordnung" in einem System steigt die Entropie. Festkörper, besonders Kristalle, haben daher eine kleinere Entropie als Flüssigkeiten und Flüssigkeiten eine kleinere als Gase. SFeststoff < S Flüssigkeit < SGas Reinstoffe besitzen eine kleinere Entropie als Stoffgemische. Verteilt sich ein Stoff in einem Gefäß, beispielsweise indem sich ein Salz löst, nimmt die Entropie zu. SReinstoff < SGemisch 67 Entropieänderung : S Die Entropie des gesamten Systems bleibt bei völlig reversiblen Prozessen konstant, bei irreversiblen Prozessen nimmt sie zu. Die Simulation zeigt schematisch zwei irreversible Vorgänge, die von der Entropiezunahme angetrieben werden: S > 0 1. Wärmeaustausch zwischen zwei Körpern, bis diese die gleiche Temperatur besitzen; 2. 2. Diffusion = Konzentrationsausgleich zwischen Lösungen. http://www2.chemie.uni-erlangen.de/projects/vsc/chemie-medizinerneu/kinetik/entropieaenderung.html Freie Enthalpie [G] nach Gibbs Die Reaktionsenthalpie (H) gibt an, ob ein Prozess exotherm oder endotherm abläuft. Sie sagt jedoch nichts darüber aus, ob die Reaktion freiwillig abläuft. Es gibt zahlreiche endotherme Reaktionen, die spontan ablaufen, wobei sich das Reaktionsgemisch abkühlt. Die Triebkraft einer Reaktion wird von der freien Enthalpie (G) angegeben. Sie wird über die Gibbs-Helmholtz-Gleichung: G = H – T·S aus der Enthalpie und der Entropie (S) berechnet. Der Einfluss der Entropie wird dabei von der Temperatur mit bestimmt. Eine Reaktion läuft freiwillig ab, wenn G < 0 ist = exergone Reaktion. Ist G > 0 bezeichnet man die Reaktion als endergon. T ist die absolute Temperatur , gemessen in Kelvin (K). Sie wird bezogen auf den absoluten Nullpunkt bei –273°C = 0 K. Somit erhält man für 0°C = 273 K Übungsaufgabe 68 Chemisches Gleichgewicht Im 1. Kapitel wurde das chemische Gleichgewicht bereits durch das Massenwirkungsgesetz beschrieben. Die Gleichgewichtskonstante K steht in Beziehung freien Enthalpie G. In der Grafik ist die Veränderung von G im Laufe einer Gleichgewichtsreaktion aufgetragen. A+B C+D Hat G das Minimum erreicht, hat sich das Gleichgewicht eingestellt (in unserem Beispiel bei etwa 80%igem Umsatz). Ausgehend von den Edukten A + B wurde als Energie Ghin frei. Würde man von den Produkten C + D ausgehen, würde sich das gleiche Gleichgewicht einstellen, es würde aber weniger Energie frei: G rück. G° bezeichnet die Gibbs freie Standardenthalpie, die bei vollständiger Umsetzung je eines Mols A + B C + D freigesetzt würde: G° = Ghin – Grück Zusammenhang zwischen G° und Gleichgewichtskonstante (ohne Ableitung): G° = – RT · ln K Mit dieser Gleichung kann aus der freien Standardenthalpie auf die Lage des Gleichgewichts geschlossen werden - oder umgekehrt, nach Berechnung der Gleichgewichtskonstanten K über das Massenwirkungsgesetz, G° berechnet werden. Gekoppelte Reaktionen In der Biochemie sind meist mehrere Reaktionen miteinander gekoppelt. Die Verbindungen sind dabei in mehrere verschiedene Umsetzungsprozesse eingebunden. Sind alle Reaktionen im Gleichgewicht, können die Massenwirkungsgesetze zusammengefasst werden. A B G°1 B C G°2 A C G°ges = G°1 + G°2 69 Reaktionsgeschwindigkeit Die Reaktionskinetik befasst sich mit der Geschwindigkeit von Reaktionen und den Faktoren, die die Reaktionsgeschwindigkeit beeinflussen. Die Reaktionsgeschwindigkeit ist definiert als die Ableitung der Konzentration nach der Zeit: AP Man kann hierbei die Konzentrationsänderung (pro Zeiteinheit) der Produkte [P] oder die der Edukte [A] betrachten. Während der Reaktion nimmt [P] zu (positives Vorzichen), [A] ab (negatives Vorzeichen). Sind Edukte und Produkte gefärbt, kann man den Reaktionsverlauf auch direkt beobachten. Reduktion von Methylenblau durch Glucose Experiment des Monats: August 1998 Reaktionsordnungen Die Reaktionsgeschwindigkeit hängt in der Regel von den Konzentrationen der beteiligten Stoffe ab. Die allgemeine Gleichung (das sogenannte Geschwindigkeitsgesetz) lautet: a Reaktion erster Ordnung: Die Reaktionsgeschwindigkeit ist proportional zur Konzentration [A]. Viele Zerfallsreaktionen verlaufen 1. Ordnung. Reaktionen zwischen zwei Molekülen sind meist von zweiter Ordnung. k bezeichnet die Reaktionsgeschwindigkeitskonstante. 1. Ordnung A+B P 2. Ordnung 70 Reaktionen pseudo-erster Ordnung Bei Reaktionen, die in Lösung ablaufen, stimmen die beobachteten Reaktionsordnungen oft nicht mit den erwarteten überein. Betrachten wir als Beispiel die Hydrolyse von Saccharose ("Rohrzuckerinversion"). Bei dieser Reaktion wird Saccharose (Rohrzucker) in Gegenwart einer Säure in Glucose (Traubenzucker) und Fructose (Fruchtzucker) gespalten. Formal reagiert je ein Molekül Saccharose mit je einem Wassermolekül. Die Protonen der Säure nehmen an der Reaktion zwar teil, werden aber nicht verbraucht. (Sie sind ein Katalysator.) Man würde daher eine Reaktion 2. Ordnung vermuten. Untersucht man die Konzentrationsabhängigkeit dieser Reaktion, findet man nur einen Einfluss der Saccharose-Konzentration, die experimentelle Reaktionsordnung ist 1. Die Ursache hierfür liegt in dem großen Überschuss des Lösungsmittels Wasser (von 1 : 100 oder mehr). Während die Hälfte der Saccharose bereits gespalten wurde, ist bei unserem Beispiel nur ein sehr kleiner Teil des Wassers verbraucht worden. Die Wasserkonzentration hat sich fast nicht geändert, die Reaktion scheint die Wasserkonzentration nicht zu beeinflussen. Man nennt solche Reaktionen pseudo-erster Ordnung. Kinetische Herleitung des Massenwirkungsgesetzes Hin- und die Rückreaktion besitzen unterschiedliche Geschwindigkeitskonstanten, die hier mit khin und krück bezeichnet werden. Für jede Teilreaktion kann ein eigenes Geschwindigkeitsgesetz formuliert werden: Das Gleichgewicht ist erreicht, wenn Hinreaktion und Rückreaktion gleich schnell ablaufen, also RGhin = RGrück ist. Die Geschwindigkeitsgesetze können dann gleichgesetzt werden: Im Gleichgewicht: RGhin = RGrück: khin·[A]·[B] = krück·[C]·[D] 71 Durch Umformen erhält man eine dem Massenwirkungsgesetz entsprechende Gleichung, der Quotient aus den beiden Geschwindigkeitskonstanten ergibt die Gleichgewichtskonstante K. Übungsaufgabe zur Gleichgewichtskonstante Folgereaktionen Wenn das Produkt einer Reaktion sofort eine neue Reaktion eingeht, bezeichnet man den Prozess als Folgereaktion. Wenn es sich bei allen drei Stufen (Edukt A, Zwischenprodukt B und Produkt C) um stabile Verbindungen handelt, können deren Konzentrationen im Laufe der Gesamtreaktion unabhängig voneinander verfolgt (gemessen) werden. Zu Beginn der Folgereaktion liegt nur Substanz A vor, die zunächst zu B reagiert. B reagiert weiter zu C. Da es keine Rückreaktionen gibt, nimmt die Konzentration von A beständig ab, die Konzentration von C zu. [B] durchläuft ein Maximum. Erst wird B aus A gebildet, ab dem Schnittpunkt der Kurven [A] und [C] überwiegt dann aber der Verbrauch von B unter Bildung von C. Die Konzentration von B nimmt nach diesem Punkt wieder ab. Die Konzentration des Endproduktes C nimmt zunächst sehr langsam zu. Dieser Verlauf ist charakteristisch für Reaktionen, bei denen ein Zwischenprodukt auftritt. 72 Halbwertszeit Als Halbwertszeit bezeichnet man den Zeitraum, in dem die Konzentration des Eduktes auf die Hälfte abnimmt. In der Medizin versteht man unter Halbwertszeit jene Zeit, die vergeht, bis durch Ausscheidung die Menge des Wirkstoffs (Medikamentes) im Organismus auf die Hälfte abgenommen hat. Halbwertszeit bei Reaktionen 1. Ordnung Die Halbwertszeit kann aus dem Geschwindigkeitsgesetz berechnet werden. Wir betrachten wieder eine einfache Reaktion: AB Diese Reaktion läuft 1. Ordnung ab: Durch Umstellung ("Variablentrennung") erhält man daraus: Die Gleichung wird nun integriert, wobei als Nullpunkt die Ausgangssituation vor Beginn der Reaktion gewählt wird. [A] o bezeichnet die Anfangskonzentration von A bei t = 0. oder A = A0 . e -kt Diese Gleichung gilt für den gesamten Verlauf einer Reaktion 1. Ordnung. Wir betrachten jetzt die Halbwertszeit (t½ ). Nach einer Halbwertszeit hat die Konzentration von A um die Hälfte abgenommen: [A] = ½[A]o . Dies wird nun in die Gleichung eingesetzt Es gilt ln ½ = – ln 2. Durch Umformung erhalten wir einen Ausdruck für die Halbwertszeit: Die Halbwertszeit ist also unabhängig von der Konzentration des Eduktes. Dies ist charakteristisch für Reaktionen 1. Ordnung. Auch der radioaktive Zerfall gehorcht einem Geschwindigkeitsgesetz 1. Ordnung. Man nutzt dies aus bei der Altersbestimmung, beispielsweise nach der C14-Methode . 73 Aktivierungsenergie Damit die Teilchen überhaupt reagieren, müssen sie erst angeregt werden. Man muss jedem Teilchen eine bestimmte Energiemenge, die Aktivierungsenergie EA, zuführen. Dadurch wird es in einen instabilen Übergangszustand versetzt, von dem aus die Reaktion zum Produkt weiterläuft. Im Schaubild ist ein Energieprofil für eine exotherme Reaktion aufgetragen. Die Energiedifferenz zwischen Edukten und Produkten ist die Reaktionsenthalpie HR. Bevor diese frei werden kann, muss erst die Aktivierungsenergie EA hin zugeführt werden. Ausgehend vom Übergangszustand wird dann die Summe HR+EAhin abgegeben. In diesem Diagramm sieht man weiterhin, dass für die Rückreaktion als Aktivierungsenergie ein höherer Betrag nötig ist. Aktivierungsenergie und chemisches Gleichgewicht Die Lage des Gleichgewichts hängt von der Größe der freien Reaktionsenthalpie (GR) ab. Ist die Reaktion exergon (G R < 0), liegt das Gleichgewicht auf der Seite der Produkte, ist sie endergon (GR > 0) auf der Seite der Edukte. Die Aktivierungsenergie beeinflusst die Geschwindigkeit der Reaktion, sie bestimmt also die Zeit, die bis zur Einstellung des Gleichgewichts vergeht. Auf die Lage des Gleichgewichtes hat die Aktivierungsenergie keinen Einfluss! In der folgenden Simulation können Sie die energetische Lage der Edukte und Produkte, sowie die Aktivierungsenergie im Energiediagramm (linke Abbildung) verschieben. In der rechten Grafik sehen Sie die davon abhängigen Konzentrationsverläufe der Edukte (rot) und Produkte (grün). Das Gleichgewicht ist erreicht, wenn sich die Konzentrationen von Edukt und Produkt nicht mehr ändern, die Kurven also parallel verlaufen. Übungsaufgabe zu Energieprofilen 74 Katalyse Ein Katalysator beschleunigt eine Reaktion, ohne dabei selbst verbraucht zu werden. Viele exotherme und exergone Reaktionen laufen bei Raumtemperatur extrem langsam ab, sie sind gehemmt. Durch Katalysatoren läßt sich diese Hemmung aufheben, die Reaktion kann stattfinden. Wichtig: Der Katalysator beeinflusst nicht die Lage eines Gleichgewichts, das Gleichgewicht wird durch den Katalysator nur schneller erreicht. Verschiedene Katalysatoren haben dabei eine unterschiedliche Wirksamkeit. Am Beispiel des Zerfalls von Wasserstoffperoxid (H2O 2 ) wird die Wirkung von verschiedenen eisenhaltigen Katalysatoren schematisch gezeigt. Der nicht katalysierte Zerfall ist sehr langsam, es kann keine Bildung von Gasblasen beobachtet werden. Schon die Zugabe eines Millimols/l Fe3+Ionen beschleunigt die Reaktion um das 1000-fache. Wird statt Fe3+ Häm zugegeben, läuft die Reaktion nochmals deutlich schneller. Die Katalase, ein Häm-haltiges Enzym, ist auf die Zersetzung von H2 O2 spezialisiert. Entsprechend heftig wird die Reaktion bei deren Zugabe. Übungsaufgabe zur Katalyse Energieprofil bei der Katalyse Im Schaubild ist anhand eines Energieprofils die Wirkungsweise eines Katalysators dargestellt. Der Katalysator bildet mit dem Edukt eine Zwischenstufe, wobei die Aktivierungsenergie für deren Bildung deutlich geringer ist, als die Aktivierungsenergie für den Reaktionsweg ohne Katalysator. Zur Bildung des Produktes ist nur noch wenig Energie zur Überwindung des zweiten Übergangszustandes nötig. Da der "Energieberg" für die Gesamtreaktion bei der katalysierten Reaktion deutlich kleiner ist, kommen mehr Teilchen schneller über diese Barriere, die Reaktionsgeschwindigkeit steigt. 75 Übungsaufgabe zur Katalyse homogene – heterogene Katalyse Der Katalysator kann in der gleichen Phase vorliegen (homogene Katalyse ), also im Reaktionsmedium gelöst sein, oder als getrennte Phase auftreten (heterogene Katalyse). Bei der heterogenen Katalyse liegen Reaktionsgemisch und Katalysator in verschiedenen Phasen vor. Die Katalyse kann daher nur an der Phasengrenzfläche, also an der Oberfläche eines festen Katalysators oder an der Grenzschicht zwischen zwei Flüssigkeiten bzw. Flüssigkeit und Gas, ablaufen. Als Experiment wird hier die durch Braunstein (MnO 2) katalysierte Zersetzung von Wasserstoffperoxid gezeigt: 2 H2 O2 2 H2 O + O2 Eine Spatelspitze pulverisierten Braunsteins wird zu einer 10%igen wässrigen Wasserstoffperoxid-Lösung gegeben. Es erfolgt sofort eine heftige Gasentwicklung. Das entstehende Gas wird durch die Glimmspanprobe als Sauerstoff identifiziert. Bei heterogenen Katalysatoren spielt die Größe der Oberfläche eine entscheidende Rolle, denn nur an der Oberfläche (bzw. Phasengrenzfläche) kann die Reaktion ablaufen. Feste Katalysatoren werden daher fein pulverisiert oder als dünne Schicht auf ein besonders poröses Material aufgebracht. 76 Kfz-Abgas-Katalysator Benzin- und Dieselmotoren produzieren schädliche Abgase. Ein warmgelaufener Motor eines Mittelklassewagens emittiert im Schnitt pro Kilometer Fahrstrecke 2 g Stickoxide und 9 g Kohlenmonoxid. Außerdem gibt er diverse unverbrannte Kohlenwasserstoffe ab. Für Otto-Motoren wird seit den 1980er Jahren der "DreiwegeKatalysator" zur Abgasreinigung eingesetzt. Die Bezeichnung rührt daher, dass durch den Katalysator die drei wichtigsten Schadstoffgruppen durch unterschiedliche Prozesse in ungiftige Stoffe umgewandelt werden. Kohlenwasserstoffe und Kohlenmonoxid werden durch Stickoxide und Sauerstoff oxidiert, wobei die Stickoxide zu Stickstoff reduziert werden: CH4, CO, NO 2 (+ O2) CO2 , N2 , H2O Die katalytisch aktive Substanz ist eine Legierung aus Platinmetallen, meist Platin + Rhodium. Diese Legierung befindet sich als dünner Überzug auf einem feinporigen Träger, meist aus einer Keramik. Der abgebildete Katalysator enthält in einem Stahlmantel drei platinbeschichtete Keramik-Einheiten, die hinterste ist freigelegt und halbiert. aufgeschnittener KfzAbgaskatalysator Enzyme Die Reaktionen in lebenden Organismen laufen bei verhältnismäßig kleinen Temperaturen, in der Regel unter 40°C ab. Damit sie ausreichend schnell ablaufen, sind hochaktive Katalysatoren, die Enzyme, am Werk. Die Enzyme sind Proteine, in die teilweise Metallkomplexe oder organische Cofaktoren eingelagert sind. Enzyme arbeiten nicht nur schnell, sondern auch sehr selektiv, d.h. sie besitzen (in der Regel) eine hohe Substratspezifität. Dies ist in biochemischen Systemen sehr wichtig, da in den Zellen ein Gemisch sehr ähnlicher Verbindungen vorliegt, von denen oft nur eine in einer speziellen Weise umgesetzt werden soll. Ein weiteres Charakteristikum der Enzyme ist die vielseitige Regulationsmöglichkeit ihrer Aktivität. Auch bei den Enzymen kommen homogene und heterogene Katalyse vor: Die Proteine können im Cytoplasma gelöst vorkommen (homogen) oder in eine Membran eingebunden sein (heterogen). Die Amylase kommt im Mundspeichel vor. Sie gehört zu den Verdauungsenzymen und spaltet die Glucose-Ketten der Stärke in das Disaccharid Maltose. Die Succinat-Dehydrogenase befindet sich in der inneren Mitochondrien-Membran. Sie ist Teil des Citrat-Cyclus und der Atmungskette. Im Citrat-Cyclus spaltet das Enzym zwei Wasserstoffatome unter Bildung einer Doppelbindung aus Succinat (Bernsteinsäure) ab, wobei Fumarat (Fumarsäure) entsteht. Die Wasserstoffatome werden auf das Coenzym FAD übertragen. 77 Amylase Succinat-Dehydrogenase Enzymtest: Urin-Teststreifen Enzyme arbeiten hoch spezifisch. Enzymatische Prozesse werden daher auch in der Diagnostik eingesetzt, beispielsweise in den Teststreifen zur Harnanalyse auf Glucose. Diese Stäbchen werden zur schnellen Untersuchung auf eine Glucoseausscheidung mit dem Urin eingesetzt. Hiermit läßt sich ein Verdacht auf Diabetes bestätigen oder (bei nachgewiesener und behandelter Diabetes) eine ausreichende Insulin-Gabe überprüfen. Bei den hier gezeigten Teststreifen ist neben dem Glucose-Testfeld (links) noch ein Test auf Ketonkörper (vor allem Aceton und Acetessigsäure) angebracht. Ketonkörper werden bei übermäßigem Fettabbau oder mangelhafter Kohlenhydrat-Verwertung (beispielsweise im Zuge einer Diabetes) ausgeschieden. Keto-Diastix®-Teststreifen der BAYER Diagnostics GmbH Der Glucose-Teststreifen enthält zwei Enzyme: Glucoseoxidase und Peroxidase, sowie weitere Reagenzien. Der Glucose-Nachweis erfolgt durch eine gekoppelte Enzymreaktion. Die Glucose wird von der Glucoseoxidase unter Bildung von Wasserstoffperoxid zu Gluconsäure oxidiert. Die Peroxidase oxidiert mit dem gebildeten Wasserstoffperoxid einen Redoxindikator, der hierbei von grün nach gelb-braun umschlägt. Aus der Farbe kann mit Hilfe einer Vergleichstabelle auf die Glucose-Konzentration in der Prüflösung geschlossen werden. Während mit dem Glucose-Test nur eine Verbindung nachgewiesen werden soll, eben die Glucose, muß der Ketonkörper-Test auf verschiedene Verbindungen ansprechen. Hierfür wird daher kein Enzym eingesetzt, sondern ein anorganischer Komplex: Nitroprussidnatrium. Bei 78 Anwesenheit von aliphatischen Ketonen bildet sich ein violetter Komplex, bei aromatischen (vgl. Phenylketonurie ) ein orangeroter. Enzym-Klassen & Nomenklatur von Enzymen Mit Ausnahme von einigen, bereits seit längerer Zeit bekannten Enzymen wie Pepsin, Trypsin oder Renin, setzt sich der Name eines Enzyms aus der Bezeichnung des jeweiligen Substrates und der Endung -ase zusammen; das Enzym Urease setzt also Harnstoff (engl. urea) um. Die international einheitliche Klassifizierung der Enzyme erfolgt auf der Basis der von ihnen katalysierten Reaktionen. Insgesamt sind sechs Reaktionsklassen definiert worden, in die jedes Enzym eingeordnet wird. In diesem System erhält jedes Enzym eine vierzahligen Klassifizierungscode, die sogenannte Enzyme-Classification-Number (EC) und eine systematische Bezeichnung. Beis piel für die Namensgebung bei EnzymKlasse Subklassen Reaktionstyp Oxidoreduktasen Dehydrogenasen Oxidasen Elektronentransfer Kinasen Acetyl-, Methyl-, Aminotransferasen Polymerasen Transfer chemischer Gruppen Proteasen Esterasen Nukleasen Glucosidasen ATPasen Hydrolyse Lyasen Decarboxylasen Aldehydlyasen Hydrolyasen Synthasen Hinzufügen zu oder Abspalten von Gruppen von Doppelbindungen Isomerasen Racemasen Epimerasen Isomerasen Transfer von Gruppen innerhalb von Molekülen Retinalisomerase Triosephosphatisomerase Synthetasen Bildung von C-C-, C-S, C-O oder C-N Bindungen durch Kondensation unter ATPSpaltung Glutamin-Synthetase Argininosuccinat-Synthase DNA-Ligase Transferasen Hydrolasen Ligasen Beispiele Alkoholdehydrogenase (ADH) Lactatdehydrogenase (LDH) Phenylalanin-Monooxygenase Transaminasen Hexokinase Glykogen-Phosphorylase) Acetylcholinesterase (AChE) Lysozym ATPasen Carboanhydrase Fumarat-Hydratase Adenylatkinase 79 Hemmung von Enzymen Im Organismus müssen die verschiedenen Stoffwechselprozesse aufeinander abgestimmt und reguliert werden. Es gibt daher unterschiedliche Steuermechanismen für die Enzymaktivität. Hier sollen nur zwei Hemmechanismen vorgestellt werden: Bei der kompetitiven Hemmung konkurriert ein Inhibitor mit dem Substrat um einen Platz im aktiven Zentrum. Bei einer großen Inhibitor-Konzentration sind die aktiven Zentren der meisten Enzymmoleküle blockiert, die Reaktion kommt zum Erliegen. Steigt die Substratkonzentration an, verdrängen Substratmoleküle den Inhibitor aus dem aktiven Zentrum, die Reaktion kann stattfinden. Greift ein Inhibitor außerhalb des aktiven Zentrums an, wird die Struktur des Enzyms verändert. Die Enzyme werden deaktiviert, es kommt zur nicht kompetitiven Hemmung. Diese Hemmung kann durch eine große Substratkonzentration nicht überwunden werden. Die Hemmung kann reversibel oder irreversibel erfolgen. Im folgenden Experiment wird die irreversible nicht kompetitive Hemmung der Katalase durch Quecksilberionen demonstriert. Katalase, ein H2 O2 spaltendes Enzym, kommt unter anderem auch in Kartoffeln vor. Gibt man ein frisch ausgeschnittenes Stück einer Kartoffel (im Bild links) in eine 3%ige H2 O 2-Lösung, tritt eine heftige Sauerstoffentwicklung ein. Legt man ein entsprechendes Kartoffelstück zunächst für einige Sekunden in eine HgCl 2-Lösung und gibt das so "vergiftete" Stück in die H 2O 2-Lösung (rechts), bleibt die Gasentwicklung aus. Die Quecksilberionen haben die Enzymfunktion zerstört. Quecksilber als Enzymgift Experiment des Monats: Oktober 1998