Herr Menzel ab nächster Woche - Institut für Biologie
Werbung

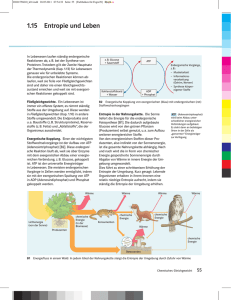
Björn Brembs (Herr Menzel ab nächster Woche) Lehrbücher der Tierphysiologie Roger Eckert Tierphysiologie 3. Auflage Thieme Verlag, Stuttgart 2000 Rüdiger J. Paul Physiologie der Tiere, Systeme und Stoffwechsel Thieme Verlag, Stuttgart, 2001 Einige Abbildungen von: Moyes & Schulte Tierphysiologie Pearson Verlag München, 2008 Katarina Munk Grundstudium Biologie, Zoologie Spektrum Akademischer Verlag Gustav Fischer Heidelberg, Berlin 2002 Sie finden die Abbildungen der Vorlesung unter: www.neurobiologie.fu-berlin.de/ menu/lectures-courses/winter-0708/ Wissenschafts-Podcasts Englisch: • • • • • • • • • • Nature, Science, Cell, etc. (Primär-Zeitschriften) Science Update (AAAS) Wissenschaftl. Gesellschaften Science & the City (NYAS) This week in science (twis.org) The naked scientists (BBC) Radio Science Friday (NPR) Science Talk (Scientific American) Populärwiss. Zeitschr. The Week (The Scientist) Science Weekly (Guardian) Tageszeitungen Science Times (NYTimes) Deutsch: • • DRadio Wissenschaft und Forschung Wanhoff‘s wunderbare Welt der Wissenschaften Vorlesung: Einführung in die Biologie, 2. Teil – Physiologie, Neurobiologie, Verhalten Wintersemester 2007/2008 -- Lehrveranstalter: Menzel/Brembs Programmübersicht Mi 9.01. Metabolismus heterotropher Organismen: Energiegewinnung (aerob, anaerob, freie Energie, Aktivierungsenergie, Rolle der Enzyme, Allosterischer Effekt, kompetitive Hemmung, Multienzymkomplexe, ATP) Fr 11.01. Nahrungsaufnahme und Verdauung: Ziel: Gewinnung von Material und Energie; Kohlenhydrate, Fette, Proteine (Art der Bausteine, der Bindungen); Prinzipien enzymatischer Verdauung (Beispiel Trypsin aus Trypsinogen; Substrate und Reaktionen von Proteasen, Karbohydrasen, Esterasen, Nukleasen); Essentielle Aminosäuren, Mineralien, Vitamine (Beriberi, Skorbut, Pellagra, Kropf); Ernährungstypen mit Beispielen (Allesfresser, Fleischfresser, Pflanzenfresser, Abfallfresser, Filtrierer); Aufbau des Verdauungstraktes des Menschen mit den Verdauungsenzymen; Widerkäuermagen. Mi16.01. Exkretion, Exkretionsorgane (Protonephridien, Malphigische Gefäße, Metanephridien, Nephron); Exkretionsprodukte (Ammonium, Harnstoff, Harnsäure, Guanin); Bau und Funktion der Wirbeltierniere, Wasserhaushalt (ökologische Extremsituation und Anpassungs-strategien) Fr 18.01. Gasaustausch:O2-Bedarf, Grundumsatz, O2-Angebot in verschiedenen Lebensräumen; Körpergröße; Atmungsorgane: Kieme (Gegenstromprinzip), Lunge (Amphibien, Vögel, Säuger)Transportsysteme:Offene und geschlossene Blutkreislaufsysteme (Beispiele); Lage und Bau des Herzens: Blut-kreislauf der Säuger; Funktion und Bau des Herzens (Kontraktionsrhythmus, Druck-verlauf, Erregungsverlauf); Blutbestandteile.O2-Transport: Hämoglobin, Bindungskurve, pH-Abhängigkeit, foetales Hämoglobin, Myoglobin. Zusammenhang zwischen den Energiestufen in der Nahrungskette Sonne Energie grüne Pflanzen Pflanzenfresser Parasiten Fleischfresser Fäulnisbakterien Die Photosynthese der autotrophen Pflanzen ist die Sauerstoff– und Kohlenstoffquelle für alle Organismen auf der Erde -Jährliche C-Fixierung: 1010 t auf dem Land und 1011 t im Wasser - O2 Produktion: alle 2 Jahre wird der gesamte O2 Gehalt der Atmosphäre ausgetauscht Energietransfer zwischen Reduktion und Oxidation Licht Elektronenakzeptor H aus H2O CO2 +CO2 Reduktion Elektronendonator (reduzierte Substanzen) Cn (H2O) + O2 Oxidation Energieaufnahme in Moleküle Energieabgabe aus Molekülen Stoffwechsel (Metabolismus) • Kataboler Stoffwechsel (Katabolismus) – setzt Energie frei durch den Umbau von komplexen reduzierten Molekülen zu einfacheren oxidierten Molekülen. – Die freigesetzte Energie steht zur Verrichtung von Arbeit zur Verfügung – z.B. bei der Zellatmung: Abbau von Glukose zu CO2 und H2O » Betriebsstoffwechsel • Anaboler Stoffwechsel (Anabolismus) – verbraucht Energie, um komplexe Moleküle aus einfachen Molekülen aufzubauen – z.B Synthese von Proteinen aus Aminosäuren » Baustoffwechsel Wie kommen diese Energieflüsse zustande? Energie: Fähigkeit Arbeit zu verrichten Arbeit: Energiemenge die von einem System in ein anderes übertragen wird Mechanik: Arbeit = Kraft (F = m·a) mal Weg (W = F·s) SI-Einheit: Energie kann in verschiedenen Formen auftreten (z.B. Wärmeenergie, elektrische Energie, Strahlungsenergie, chemische Energie). 1. Hauptsatz der Thermodynamik In einem geschlossenen System wird Energie weder erzeugt noch vernichtet. Es gibt lediglich eine Überführung der Energie von einer Form in eine andere. Die Energie in einem geschlossenen System ist konstant (Energieerhaltungsgesetz) . Diese Energie kann sich nur durch Transport von Energie über dessen Grenzen ändern: dU = δQ + δWdiss wobei U: innere (thermische) Energie Q: vom System aufgenommene Wärme-Energie W: vom System geleistete Arbeit Die Veränderung der Energie eines Systems hängt nur vom Anfangs- und Endzustand ab, nicht vom Weg der Umwandlung 2. Hauptsatz der Thermodynamik • • Energie ist nicht in beliebigem Maße in andere Arten umwandelbar (Wärmeverluste). Die gesamte Energie des Universums wird unvermeidlich in Wärme umgewandelt und die Ordnung in der Materie geht verloren (Wärmetod). dS = δQ δWdiss + T T: absolute Temperatur ( 0°= +273 °K) T Die Rate der Energie-Änderung in einem System Die Entropie (Einheit J/K; manchmal auch Grad der Unordnung in einem System) eines geschlossenen Systems wird immer mehr zunehmen und damit die für Arbeit nutzbare Energiemenge wird abnehmen. Entropie als Richtung der Zeit bei irreversiblen Prozessen. Entropieänderungen sind nur sehr schwer zu messen. Daher wurde durch die Kombination beider thermodynamischen Hauptsätze eine andere Größe eingeführt, die Gibbs Energie G (freie Enthalpie, freie Energie). ∆G = ∆H – T · ∆S, mit ∆G: Änderung der Gibbs Energie; ∆H: Änderung der Enthalpie. Enthalpie ist ein Mass für die Gesamtenergie eines thermodynamischen Systems: H = U + p·V („Hupf“), mit p: Druck; V: Volumen Die Enthalpieänderung ∆H ist folglich gegeben durch ∆H = ∆U + p·∆V, wobei ∆V meist vernachlässigt werden kann, also ∆H beinahe gleich ∆U wird. Dann gilt: ∆G ≅ ∆U − T ⋅ ∆S Die Änderung der Gibbs Energie ∆G hängt also von der Änderung der inneren Energie und der der Änderung der Entropie des Systems ab. ∆G ist negativ für spontan ablaufende Reaktionen (die Energieänderung ist geringer als die Entropiezunahme; exergone Reaktionen). Ein Prozess kann nur dann spontan ablaufen, wenn die Summe der Entropieänderungen insgesamt im System zunimmt. In Teilen des Systems kann dabei die Entropie auch abnehmen. Wie wird die nutzbare Energie übertragen? nutzbare Energie Wärmeverlust -Selbst Energie freigebende (exergone) chemische Reaktionen verlaufen bei normaler Temperatur sehr langsam -bei den meisten chemischen Reaktionen muss erst einmal eine Energiebarriere überwunden werden (z.B. durch Erhitzen) Enzyme als Katalysatoren Enzyme wirken als Katalysatoren für chemische Reaktionen im Stoffwechsel. Sie beschleunigen die Reaktionen ohne sich selbst zu verändern und ohne ∆G der gesamten Reaktion, also das Reaktionsgleichgewicht zu beeinflussen. Sie sind große Proteine (Ketten von Aminosäuren), deren dreidimensionale Gestalt, Verteilung von Ladungen und Möglichkeiten von Wasserstoffbrücken Verbindungen zu Substratmolekülen herstellen. L. Stryer, Biochemie, Spektrum Verlag Enzyme katalysieren Serien von Reaktionsschritten, um große Unterschiede in der freien Energie schrittweise in nutzbare (z.B. ATP) Energie zu überführen und um speicherbare Energieformen zu bilden (z.B. Kreatin, Glukose) Schrittweise Energiefreisetzung ist wichtig Monty Python‘s Mr. Creosote Enzyme beschleunigen Reaktionen durch Verminderung der Aktivierungsenergie Die Bildung eines Enzym-Substrat Komplexes ist der erst Schritt bei der enzymatischen Katalyse Schlüssel-Schloss Prinzip: veraltet Induzierte Anpassung L. Stryer, Biochemie, Spektrum Verlag Regulation der Enzymaktivität Die Steuerung der Stoffwechselvorgänge beruht auf folgenden Eigenschaften der Enzyme: • Kompetitive Hemmung/Aktivierung • Allosterischer Effekt • Mobilisierung von inaktiven Vorstufen durch andere Reaktionen • räumliche Nachbarschaft in Multienzymkomplexen • pH Abhängigkeit • Kooperativität Die Bezeichnung der Enzyme erfolgt meist mit der chemischen Reaktion, die sie katalysieren oder der Substrate: z.B. Hydrolasen, Esterasen, Nucleasen, Proteasen Die Verkopplung von enzymatischen Reaktionen kann dazu genutzt werden, dass thermodynamisch ungünstige Reaktion durch begünstigte angetrieben werden (1) Glukose + Pi → Glukose − 6 − P + H 2 O ∆G 'o : 13,8kJ / mol ( 2) ATP + H 2O → ADP + Pi ∆G 'o : − 30,5kJ / mol (1) + (2) : Glukose + ATP → Glukose − 6 − P + ADP ∆G ' o : − 16,7kJ / mol Die Gibbs-Energie aus gekoppelten Reaktionen verhält sich additiv. Energie liefernde Reaktionen ermöglichen dadurch den Ablauf von Energie verbrauchenden Reaktionen. Energiewährung ATP • Bei der Hydrolyse von ATP wird Energie frei gesetzt (30,5kJ/mol pro Phosphatrest) • ATP dient als wichtigster unmittelbarer Überträger von Gibbs Energie, nicht als Speicherform. • Der ATP Durchsatz ist sehr hoch (z.B. beim ruhenden Menschen etwa 40 kg ATP in 24 Std). • Die ATP Hydrolyse verschiebt das Gleichgewicht gekoppelter Reaktionen um einen Faktor von 108 Wieviel Energie hat ATP? Das Gehirn ist unser Energie-hungrigstes Organ • Das Gehirn macht lediglich 2% des Körpergewichts aus. • Sogar ruhend verbraucht das Gehirn 20% des totalen Energieverbrauchs (75% bei Neugeborenen). ► Das Gehirn verbraucht Energie mit der 10fachen Rate anderer Gewebe. • Der limitierende Faktor bei der Gehirnevolution war Energie The […] energy burden associated with […] the environment may be as little as .5-1.0% of the total energy budget. Marcus Raichle (2006): Science 314, p1249 Das Gehirn ist ständig aktiv Wo geht diese ganze Energie hin? Reizunabhängige Gedanken: Korrelierte Aktivität des menschlichen Gehirns in Ruhe. Homöostase Stabilisierung des inneren Milieus: Die Vielzeller (Metazoa) haben, da viele Zellen ja zum Aussenmilieu keinen Zugang mehr haben, ein ähnliches inneres Milieu, die extrazelluläre Flüssigkeit, oder das Blut, entwickelt, welches in seiner Zusammensetzung konstant gehalten werden soll (gelingt am besten den Vögeln und Säugern). Homöostase Konstant gehalten wird: O2- und CO2- Gehalt, pH-Wert, Nährstoffgehalt (Blutglucose) Körpertemperatur Endprodukte werden entfernt (Entwicklung leistungsfähiger Ausscheidungsorgane). Voraussetzungen: • Regelung (durch Meßfühler, Sinneszellen, rückgekoppelte Regelkreise, im Gegensatz zur direkten Steuerung) • Transportsysteme – passiver Transport: Diffusion, Osmose (Diffusion von Wasser durch eine semipermeable Membran), Ionenkanäle – aktiver Transport: immer unter Energie-Verbrauch (ATPasen), oft mit anderen Transportmechanismen gekoppelt (CoTransport or Countertransport), Carrier, Pumpen – Konvektiver Transport: nutzt Druckdifferenzen aus (z.B. bei Ultrafiltration hydrostatischer Druck und dagegen gerichteter kolloidosmotischer Druck) Beispielfragen: - Was sagen der erste und der zweite Hauptsatz der Thermodynamik aus ? - Welche Aufgabe und welche Eigenschaften haben Enzyme? - Aus welchen Molekülen sind Enzyme aufgebaut? - Wie kann die katalytische Wirkung von Enzymen gesteuert werden? - Welches Molekül ist der universelle Energiespender im Stoffwechsel? - Was versteht man unter Homöostase?