Katalysatoren
Werbung
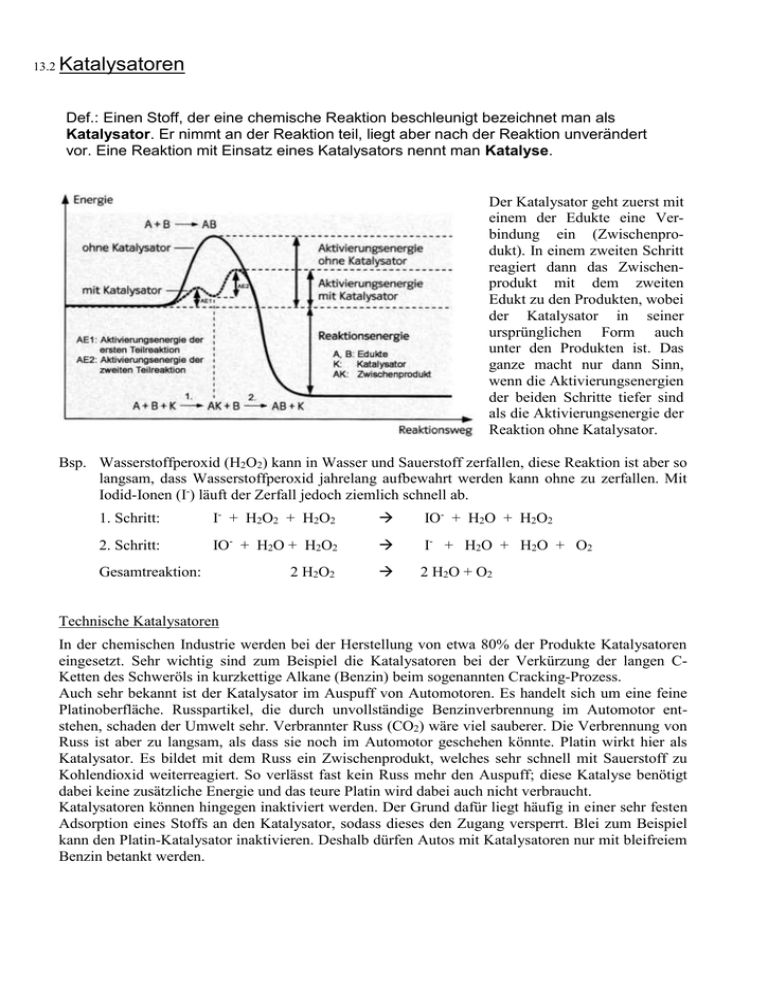
13.2 Katalysatoren Def.: Einen Stoff, der eine chemische Reaktion beschleunigt bezeichnet man als Katalysator. Er nimmt an der Reaktion teil, liegt aber nach der Reaktion unverändert vor. Eine Reaktion mit Einsatz eines Katalysators nennt man Katalyse. Der Katalysator geht zuerst mit einem der Edukte eine Verbindung ein (Zwischenprodukt). In einem zweiten Schritt reagiert dann das Zwischenprodukt mit dem zweiten Edukt zu den Produkten, wobei der Katalysator in seiner ursprünglichen Form auch unter den Produkten ist. Das ganze macht nur dann Sinn, wenn die Aktivierungsenergien der beiden Schritte tiefer sind als die Aktivierungsenergie der Reaktion ohne Katalysator. Bsp. Wasserstoffperoxid (H2O2) kann in Wasser und Sauerstoff zerfallen, diese Reaktion ist aber so langsam, dass Wasserstoffperoxid jahrelang aufbewahrt werden kann ohne zu zerfallen. Mit Iodid-Ionen (I-) läuft der Zerfall jedoch ziemlich schnell ab. 1. Schritt: I- + H2O2 + H2O2 IO- + H2O + H2O2 2. Schritt: IO- + H2O + H2O2 I- + H2O + H2O + O2 2 H2O2 2 H2O + O2 Gesamtreaktion: Technische Katalysatoren In der chemischen Industrie werden bei der Herstellung von etwa 80% der Produkte Katalysatoren eingesetzt. Sehr wichtig sind zum Beispiel die Katalysatoren bei der Verkürzung der langen CKetten des Schweröls in kurzkettige Alkane (Benzin) beim sogenannten Cracking-Prozess. Auch sehr bekannt ist der Katalysator im Auspuff von Automotoren. Es handelt sich um eine feine Platinoberfläche. Russpartikel, die durch unvollständige Benzinverbrennung im Automotor entstehen, schaden der Umwelt sehr. Verbrannter Russ (CO2) wäre viel sauberer. Die Verbrennung von Russ ist aber zu langsam, als dass sie noch im Automotor geschehen könnte. Platin wirkt hier als Katalysator. Es bildet mit dem Russ ein Zwischenprodukt, welches sehr schnell mit Sauerstoff zu Kohlendioxid weiterreagiert. So verlässt fast kein Russ mehr den Auspuff; diese Katalyse benötigt dabei keine zusätzliche Energie und das teure Platin wird dabei auch nicht verbraucht. Katalysatoren können hingegen inaktiviert werden. Der Grund dafür liegt häufig in einer sehr festen Adsorption eines Stoffs an den Katalysator, sodass dieses den Zugang versperrt. Blei zum Beispiel kann den Platin-Katalysator inaktivieren. Deshalb dürfen Autos mit Katalysatoren nur mit bleifreiem Benzin betankt werden. Biokatalysatoren: Enzyme In lebenden Zellen findet man Katalysatoren von ausserordentlicher Wirksamkeit. Sie haben die Aufgabe, die Aktivierungsenergien der Reaktionen in einer Zelle so abzusenken, dass die chemischen Vorgänge bei Körpertemperatur mit ausreichender Geschwindigkeit ablaufen. Diese so genannten „Enzyme“ sind sehr grosse Protein-Moleküle, die nur eine ganz bestimmte chemische Reaktion katalysieren (sie sind also hochspezifisch). Die Enzyme besitzen ein „katalytisches Zentrum“, wo die Reaktion vorgenommen wird. Um das katalytische Zentrum herum muss das Enzym eine ganz bestimmte Form haben, so dass sich nur die richtigen Edukte (Substrat) anlagern können. Aufgaben: 1. Nicht alle Stoffe, die ein Zwischenprodukt innerhalb einer Reaktion bilden können, sind Katalysatoren. Welche zwei zusätzlichen Bedingungen muss ein Katalysator erfüllen? 2. Weshalb kommt beim Beispiel der Wasserstoffperoxid-Zersetzung mit Iodid in der Gesamtreaktion gar kein Iodid vor? 3. Weshalb ist es für die chemische Industrie wichtig, dass die chemischen Reaktionen dank Katalysatoren … a) … auch bei tieferer Temperatur verlaufen? b) … schneller verlaufen? 4. Wenn ein Auto mit Katalysator aus Versehen mit bleihaltigem Benzin gefahren ist. Was muss man dann mit dessen Katalysator machen? (mit Begründung) 5. Was bedeutet „hochspezifisch“? 6. Weshalb sind Enzyme hochspezifisch? 7. Um eine Reaktion zu beschleunigen kann man die Temperatur erhöhen, die Oberfläche vergrössern, mit grösseren Konzentrationen arbeiten oder eben Katalysatoren einsetzen. Der menschliche Körper setzt alle diese vier Methoden ein. Geben Sie für jede Methode ein Beispiel an.