Katalyse
Werbung
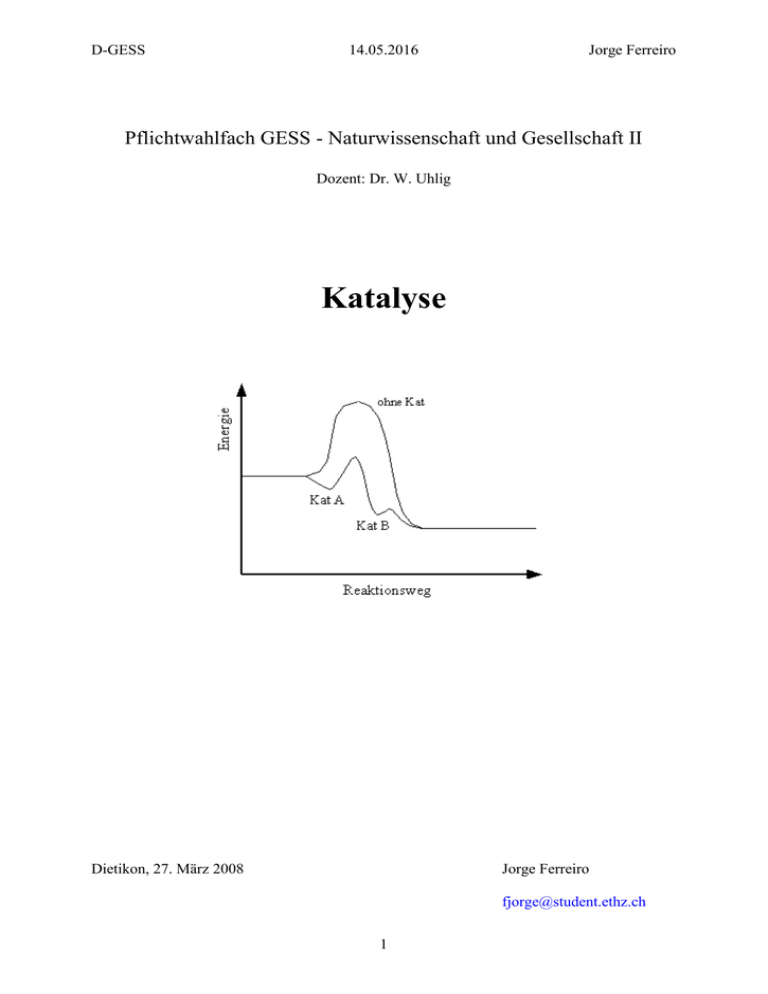
D-GESS 14.05.2016 Jorge Ferreiro Pflichtwahlfach GESS - Naturwissenschaft und Gesellschaft II Dozent: Dr. W. Uhlig Katalyse Dietikon, 27. März 2008 Jorge Ferreiro [email protected] 1 D-GESS 14.05.2016 Jorge Ferreiro 1. Wissenschaftlicher Aspekt der Katalyse Chemische Reaktionen besitzen in der Regel eine Energiebarriere, die überwunden werden muss, damit sich das Edukt bzw. die Edukte zum Produkt bzw. zu den Produkten umsetzt. Betrachten wir die Reaktion A → B, wobei A das Edukt ist und B das Produkt. Die Teilchen A besitzen eine kinetische Energie. Nun werden die Teilchen dann effektiv zu B reagieren, wenn die Wahrscheinlichkeit einer Kollision gross ist. Diese Gesetzmässigkeit ist in der Arrheniusgleichung zusammengefasst. Formel 1: Arrheniusgleichung Man erkennt schnell aus den mathematischen Zusammenhängen, dass je kleiner die Aktivierungsenergie ist, umso grösser wird die Geschwindigkeitskonstante bzw. umso mehr Produkt erhält man. Die Wirkung eines Katalysators liegt also darin, diese Energiebarriere herabzusetzen, so dass weniger Energie aufgewandt werden muss, damit eine Reaktion in Gang kommt. Somit ist die Definition der Katalyse (griech. katálysis = Auflösung) eine Bezeichnung der Geschwindigkeit einer chemischen Reaktion durch die Gewichtung eines Stoffes (= Katalysator), der die Reaktion unverändert übersteht.1 Doch wie kann ein Katalysator die Energiebarriere für eine Reaktion senken? Ein Katalysator eröffnet einen alternativen Reaktionsweg, der den geschwindigkeitsbestimmenden Schritt umgeht und einen alternativen Reaktionsschritt nimmt. Dabei ist wichtig hervorzuheben, dass der Katalysator selber am Schluss der Reaktion unverbraucht vorliegt. Man unterscheidet zwei Arten von Katalysen: die homogene und die heterogene Katalyse. Abb. 1: Energieschema für Reaktion mit/ ohne Katalysator2 1.1. 1 2 Die homogene Katalyse www.roempp.com http://www.uni-oldenburg.de 2 D-GESS 14.05.2016 Jorge Ferreiro Bei der homogenen Katalyse liegen Katalysator und Edukte alle in der gleichen Phase vor. Ein typisches Beispiel sind säurekatalysierte Reaktionen wie z.B. der erste Schritt in der Veresterung. Beispiel 1: Bildung von Essigsäurebutylester aus Essigsäure und 1-Butanol Im ersten Schritt dieser Reaktion wird die Essigsäure durch eine starke anorganische Säure (meistens Schwefelsäure) protoniert, so dass ein mesomeriestabilisiertes Carbokation entsteht, das dann weiterreagieren kann. Ohne den Katalysator würde diese Reaktion gar nicht funktionieren oder nur unter sehr speziellen Umständen, da die Protonierung der Essigsäure energetisch ungünstig ist. Bei den homogenen Katalysen handelt es sich meistens um sehr verwandte Prozesse: Neben der Säurekatalyse gibt es auch noch Basenkatalyse und Katalysen, bei welchen Elektronen verschoben und umgelagert werden. Meistens finden homogene Katalysen in Lösung statt, weil es sich dort am einfachsten bewerkstelligen lässt, dass Reaktanden und Katalysator in der gleichen Phase vorliegen.3 1.2. Die heterogene Katalyse Bei der heterogenen Katalyse liegen Reaktanden und Katalysator in verschiedenen Phasen vor. Meistens handelt es sich bei den Katalysatoren um Metalle – ein häufig verwendeter ist Platin – oder Metallkomplexe. Meistens können solche Katalysatoren die Reaktanden in eine bessere räumliche Lage versetzen, damit diese effektiv kollidieren können. Man sagt auch oft, die Reaktanden werden in einen aktiven Zustand versetzt. Beispiel 2: Döbereiner-Feuerzeug Beim Döbereiner-Feuerzeug oder auch Platinfeuerzeug genannt katalysiert ein Platinschwamm die Knallgasreaktion und durch die freigesetzte Wärme entzündet sich das H2. Im Inneren des Feuerzeugs hat es ein Zinkblech, das in konzentrierter Schwefelsäure eingetaucht ist. Durch die Reaktion entstehet H2. Der Hebel ist an ein kleines Ventil angeschlossen. Bei Betätigung des Hebels strömt O2 in hinein, welches an der Platinoberfläche mit dem Wasserstoffgas zu Wasser reagiert.4 Durch die Adsorption von Gasen an Festkörperoberflächen wird vor allem der Wärmetransport der Aktivierungsenergie deutlich verbessert. Man nimmt an, dass die Valenzelektronen der Katalysatoroberfläche die Bindungselektronen im Molekül so lockern, dass dadurch die Bindungen instabil werden und die Reaktion bei kleinerem energetischen Aufwand auftritt. Man kann vereinfacht sagen, dass zum Beispiel bei der Knallgasreaktion mit Platin als Katalysator die Gasmoleküle geordneter vorliegen, so dass die Zusammenstösse wahrscheinlicher sind. Als Adsorption versteht man das Haften von Teilchen an einer Festkörperoberfläche. In der technischen Chemie bzw. in der Chemieingenieurwissenschaft sind heterogene Katalysen praktisch immer Reaktionen von Gasmolekülen an einer Metalloder Metallkomplexoberfläche. Die meisten technischen Katalysatoren sind Misch- od. Mehrstoffkatalysatoren, d.h., neben der katalytisch wirksamen Substanz enthalten sie noch weitere Zusätze. Bei solchen Zusätzen kann es sich beispielsweise um sogenannte Promotoren handeln, welche die Katalysatorwirkung verstärken (z.B. K2O als Promotor eines 3 4 Peter W. Atkins, Julio de Paula, Physikalische Chemie, 4. Auflage, 930f. http://www.gnegel.de/feudoebereiner 3 D-GESS 14.05.2016 Jorge Ferreiro Eisenoxid/Al2O3-Katalysators bei der Ammoniak-Synthese). Zusätze können auch als oberflächenreiche Trägersubstanz wirken, auf die eine katalytisch wirksame Schicht aufgebracht wird (Trägerkatalysatoren) od. sie verhindern eine Sinterung mit einer damit verbundenen Verkleinerung der Oberfläche (strukturelle Verstärker). 1.3. Biokatalyse In der Biochemie sind Katalysatoren von zentraler Bedeutung, weil im Stoffwechsel praktisch alle Prozesse mit einer katalytischen Reaktion verbunden sind. Man nennt Biokatalysatoren auch Enzyme. Die Katalysen im Körper sind zum grössten Teil homogen und funktionieren nach dem sogenannten Schlüssel-Schloss-Prinzip. Ein Enzym bzw. Biokatalysator ist ein Komplexes Protein, dass wie ein Schloss zu einem bestimmten Schlüssel – dem entsprechenden Substrat – passt. Dadurch wird ermöglicht, dass die Reaktionen bei normaler Körpertemperatur ablaufen. Die Wirkung von Enzymen liegt darin, dass sie die sterische Anordnung der Substrate so verändern können, dass die Wahrscheinlichkeit für einen effektiven Zusammenstoss erhöht wird. Die sterische Änderung des Substrats erfolgt durch elektrostatische Wechselwirkungen mit dem Enzym. 2. Geschichte und Entwicklung von katalytischen Verfahren 5 6 Die wohl älteste Form der Katalyse ist die Herstellung von Alkoholen allen voran die Bierherstellung. Schon die alten Sumerer benutzen vor über 3000 Jahren Fermente um Bier zu brauen. Neben der alkoholischen Gärung was auch die Essigsäureherstellung in der Antike bekannt. 1742 beobachtete der schwedische Chemiker Carl Wilhelm Scheele einer Beschleunigung der Esterbildung in Anwesenheit von Mineralsäuren, wie z.B. Schwefelsäure. Es folgten weitere Meilensteine auf dem Gebiet der organischen Chemie: 1781 entdeckte Parmentier die Spaltung von Stärke durch Mineralsäuren in Traubenzucker. Joseph Priestley (1733-1804) beschrieb im Jahre 1783 die Dehydratisierung von Ethanol an Tonmineralien zu Ethen. Die erste Entdeckung auf dem Gebiet der heterogenen Katalyse gelang L. J. Thénard in den Jahren 1813-1818: Er beschrieb den katalytischen zerfall von Ammoniak und Wasserstoffperoxid an Festkörperoberflächen. Im Jahre 1815 entwickelte der englische Chemiker Sir Humphrey Davy (1778-1829) eine Grubenlampe, die mit Benzin betrieben wurde. Die Flamme war von einem Drahtnetz umgeben. Dadurch wurde die Energie an das Drahtnetz abgegeben. Trat über dem Benzinflämmchen ein leicht bläulicher Saum auf, war der Bergmann gewarnt. Dann bestand die Gefahr einer Methangasexplosion ("schlagendes Wetter"). Die Benzinflamme konnte das Methangas nicht entzünden, da außerhalb des Drahtnetzes die Entzündungstemperatur des Methangases nicht erreicht wurde. Zwei Jahre später veröffentlichte Davy eine Arbeit, in der er über die Oxidation von Grubengasen in Anwesenheit glühender Platindrähte schrieb. Sein Vetter E. Davy berichtete im gleichen Jahr über die Entzündung von Alkoholdämpfen an fein verteiltem Platin Aus dieser Entdeckung wurde "Davys Nachtlampe" entwickelt, bei der Platinschwamm oder draht über einem Spiritusbrenner befestigt war. Der heiße Draht glüht in den Alkoholdämpfen auch nach dem Erlöschen der Flamme weiter. 1823 entwickelte Döbereiner sein Feuerzeug 5 6 www.roempp.com www.seilnacht.ch 4 D-GESS 14.05.2016 Jorge Ferreiro und wies gleichzeitig auch nach, dass sich Alkoholdämpfe an Platin entzünden. Nun wurde das Forschungsgebiet der Katalyse genauer betrachtet. Durch Wilhelm Ostwald wurde die heutige Definition auf die Beine gestellt. Anfangs des letzen Jahrhunderts gelang es der BASF erstmals Schwefelsäure durch das sogenannte Kontaktverfahren grosstechnisch und katalytisch herzustellen. Es wurden sehr viele Verfahren entwickelt, um Stoffe mit katalytischen Reaktionswegen grosstechnisch umzusetzen: Fetthärtung (1901), Haber-BoschVerfahren (1908), Fischer-Tropsch-Synthese (1925), Oxo-Synthese (1938) u.v.m. Zusammenfassend lässt sich also feststellen, dass die Katalyse und die Entwicklung der Verfahren vor allem auf wissenschaftlichen Beobachtungen basieren. Ein wichtiger Meilenstein hat dabei Döbereiner gesetzt, indem er beschrieb wie sich Alkohole an der Platinoberfläche entzünden (Oxidation von Alkoholen). 3. Grosstechnische Prozesse: Zwei bekannte Beispiele Wie schon in den zwei vorangegangen Kapiteln erklärt, ist die Katalyse für die Herabsetzung der Aktivierungsenergie zuständig. Die Entwicklung dieser Theorie hat viele Beobachtungen benötigt, bis dann anfangs des 20. Jahrhunderts Ostwald die heutig noch gültige Definition aufstellte. Nun entstanden im Verlauf der Jahre viele Verfahren, die oben schon genannt worden. In diesem Kapitel geht es nun darum, zwei bekannte und wichtige Verfahren vorzustellen: das Haber-Bosch-Verfahren zur Herstellung von Ammoniak und die FischerTropsch-Synthese zur Herstellung von Kohlenwasserstoffen. 3.1. Haber-Bosch-Verfahren7 8 Nachdem Nernst die theoretische Grundlage mithilfe des dritten Hauptsatzes der Thermodynamik geschaffen hatte, gelang es Haber 1913 die Synthese im Labor katalytisch zu vollbringen. Er merkte bei den verschiedenen Versuchen schnell, dass der optimale Katalysator aus einer Mischung von verschiedenen Metallen (Nickel, Eisen etc.) benötigte. Einige Jahre später gelang es Bosch die Synthese auf einen grosstechnischen Massstab umzusetzen. Beim Haber-Bosch-Verfahren wird aus Stickstoff und Wasserstoff Ammoniak grosstechnisch umgesetzt. Ammoniak ist ein wichtiger Stoff: er dient als Grundlage für die Synthese von Düngern oder in der chemischen Chemie auch als wichtige Base. Die Reaktionsgleichung lautet: 2 N2 + 3 H2 2 NH3 ∆H = -45.93 kJ·mol-1 Wie man erkennen kann läuft die Reaktion exotherm. Um die Ausbeute zu erhöhen arbeitet man bei relativ geringen Temperaturen und sehr hohen Drucken entsprechend dem Prinzip von Le Chatelier. Ausserdem wird oft noch ein Überschuss an Stickstoff dazugegeben. Auf diese Weise verschiebt sich das Gleichgewicht der Reaktion auf die Seite des Ammoniaks. Beim Verfahren wird meistens mit Temperaturen zwischen 400°C und 500°C und bei einem Druck von ca. 30 MPa gearbeitet. Der meist verwendeten Katalysatoren haben einen grossen Eisenanteil bzw. bestehen aus Eisenverbindungen. Einige Anlagen arbeiten auch mit 20 MPa. Das Verfahren besteht im Wesentlichen aus fünf zentralen Schritten: 7 8 www.roempp.com www.chemgapedia.de 5 D-GESS 14.05.2016 Jorge Ferreiro 1. In einer Kompressionskammer wird das Gasgemisch aus N2 und H2 so stark komprimiert, bis der notwendige Druck erreicht ist. 2. Durch Variierung des Druckes und der Temperatur wird in einer zweiten Stufe das Gemisch von Fremdstoffen gereinigt. Zuerst wird das Ammoniak verflüssigt und anschliessend bei 30°C und 30 MPa verdampft. Dieser Wert entspricht dem genauen Dampfdruck von Ammoniak, so dass alle Fremdstoffe zurückbleiben. 3. In einem Eisenrohr wird nun das Gasgemisch auf 500°C erhitzt. Dort findet die eigentliche Reaktion statt. Innerhalb dieses Rohres befindet sich der Eisenkatalysator (meistens eine Mischung aus Eisenoxid und Aluminiumoxid). 4. In einem Kühlturm wird das heisse Ammoniak abgekühlt. 5. Nun wird das Ammoniak noch vom restlichen Stickstoff und Wasserstoff getrennt. 9 Weltweit wird rund 90% des Ammoniaks mittels des Haber-Bosch-Verfahren produziert. Da Stickstoff die wohl stabilste kovalente Verbindung ist, würde man immense Energiemengen benötigen um die Dreifachbindung aufzuspalten. Durch die Katalyse wird ein grosser Energiebetrag gespart, wodurch dieses Verfahren ökonomisch wohl das attraktivste ist. Ökologisch gesehen ist das Haber-Bosch-Verfahren nicht besonders optimal, weil die Ausbeute schlussendlich nur rund 15% beträgt; trotz des Aufwands an Energie, um die Öfen zu erhitzen und die enormen Drucke zu gewährleisten. 3.2. Fischer-Tropsch-Verfahren 10 Das Fischer-Tropsch-Verfahren wurde 1925 durch die beiden Chemiker Franz Fischer und Hans Tropsch 1925 am KWI für Kohleforschung in Mülheim/Ruhr entwickelt. Der Prozess beruht darauf, dass man aus Kohlenmonoxid und Wasserstoffgas höhere Kohlenwasserstoffe aufbauen kann. Die allgemeine Reaktionsgleichung für die Produktion von langkettigen Alkenen lautet: n CO + 2n H2 (CH2)n + n H2O Es entstanden verschiedene Verfahren, die vor allem den Druck variierten und dabei verschiedene Katalysatoren einsetzen. Bei diesen Verfahren entstehen auch noch andere Produkte neben den Alkanen und Alkenen. Beim ursprünglich entwickelten Verfahren wurde bei einer Temperatur von ca. 200°C und Drucken um 20 MPa gearbeitet. Der Prozess basierte auf der Kohleverflüssigung, die bis dahin schon bekannt war. Ausserdem hatte er gewisse Gemeinsamkeiten mit dem Haber-Bosch-Verfahren. Die unterschiedlichen Varianten, die entwickelt bzw. ausgebessert wurden: 9 - Nieder- oder Normaldruckverfahren: In einer exothermen Reaktion wurde das Synthesegas an einen Cobaltkatalysator geleitet. Der Katalysator war porös und mit einer riesigen inneren Oberfläche. Bei diesem Verfahren entstanden ausschliesslich Alkene in verschiedener Zusammensetzung. - Mitteldruckverfahren: Das später entwickelte Mitteldruckverfahren arbeitete mit Drucken von ca. 27 MPa. Neben den langkettigen Alkanen entstand auch ein Anteil an Alkoholen. www.seilnacht.ch www.roempp.com 10 6 D-GESS 14.05.2016 Jorge Ferreiro Das Fischer-Tropsch-Verfahren war für das Nationalsozialistische Deutschland von grosser Bedeutung. Dadurch konnte nämlich der Treibstoffbedarf mit de heimischen Kohle des Ruhrgebiets gedeckt werden. Nach Ende des 2. Weltkriegs wurde das Verfahren jedoch zu teuer, da das importierte Benzin aus den USA und Nahost viel günstiger war. Somit wird das Fischer-Tropsch-Verfahren heute fast nicht mehr verwendet. Im Gegensatz zum HaberBosch-Verfahren ist es ökonomisch völlig ungünstig. Das Verfahren erlebte während der Ölkrise in den 70er Jahren nochmals ein grosses Comeback; doch nach deren Beendigung wurde die Forschung wieder eingestellt. Heute besteht das Problem, dass uns das Erdöl ausgeht, also sucht man fieberhaft nach alternativen Kraftstoffen. Das Fischer-TropschVerfahren (vor allem Mitteldruckverfahren) könnte wieder ein sehr aktuelles und eventuell auch für die Zukunft sehr zentrales Thema werden, vor allem wenn es um die Produktion von Biomethanol bzw. Bioethanol als Treibstoff geht. 4. Wie sieht die Zukunft aus? Eine persönliche Stellungsnahme Schon heute sind wir mit tausenden von Problemen konfrontiert, die alle direkt oder indirekt auf einen zentralen Begriff zusteuern: Energie. Ohne Energie funktioniert heute in den hochindustrialisierten Staaten nichts mehr: keine öffentlichen Verkehrsmittel, keine Maschinen, keine Versorgungsmittel, keine Wirtschaft u.v.m. Doch die Energie bzw. die Energieträger sind knapp, das Erdöl schwindet und die Kohle ist ungünstig, weil sie die Erderwärmung und somit die zweite zentralste Problematik der heutigen Welt anspricht. Nun muss gewährleistet sein, dass die Energieversorgung ohne finanzielle oder technische Einschränkungen frei zugänglich ist; die Umwelt jedoch einen minimalen Schaden davon trägt. Nun scheint das paradox? Ich denke durch intensive Forschung auf dem Gebiet der Katalyse lässt sich viel unternehmen. Wenn man für zentrale grosstechnische Prozesse optimale Katalysatoren findet (z.B. für die sehr energieraubende Chloralkalielektrolyse), dann lässt sich dort ein grosser Betrag sparen. Nun müssen die Katalysatoren bzw. katalytischen Prozesse der Zukunft neben der Senkung der Energie auch noch klimaschonend arbeiten. Dies ist jedoch schon heute durch viele Katalysatoren gegeben. Somit werden Katalysatoren wohl direkt oder indirekt einen wichtigen Beitrag zur klimabewussten und energiesparenden Industriegesellschaft beitragen müssen. 7