Uebung 4
Werbung

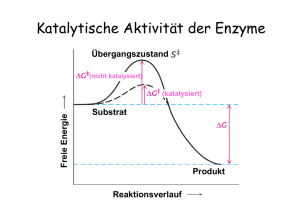
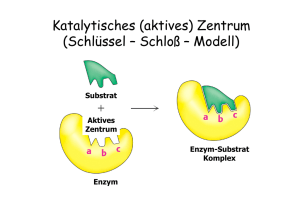
Biochemie Übungsblatt Nr. 4 04.12.2003 Grundlegende Konzepte und Enzymkinetik 1) Enzyme: meist Proteine, können aber auch Ribozyme (RNA) sein Biokatalysatoren, die die Aktivierungsenergie von Reaktionen herabsetzen und somit die Reaktionsgeschwindigkeit erhöht. Sie gehen aus der Reaktion unverändert hervor. Sie beeinträchtigen nie das Gleichgewicht einer Reaktion. Sie sind wirkungsspezifisch, substratspezifisch, pH – und temperaturabhängig. Sie besitzen ein Aktives Zentrum und bilden einen Übergangszustand, den Enzym-Substrat-Komplex. 2) Oxidoreduktasen, Transferasen, Hydrolasen, Lyasen, Isomerasen, Ligasen 3) 4) siehe Buch 5) KM bedeutet: Die Michaelis-Menten-Konstante ist ein Maß für die Effizienz eines Enzyms. Sie entspricht der Substratkonzentration, bei der die Geschwindigkeit die Hälfte der Maximalgeschwindigkeit erreicht hat. Eine hohe Affinität zwischen Enzym und Substrat wird durch eine kleine KM-Konstante ausgedrückt. 6) Wechselzahl: Unter der Wechselzahl versteht man die Substratmenge, die innerhalb einer Sekunde von einem Enzym-Molekül umgesetzt wird. Kcat = Vmax / [E]T [E]T = [E] + [ES] (Max. Enzymkonzentration) kcat = k2 (bei Michaelis-Menten-Kinetik) 7) Kcat – KM: 8) Hemmungen: Kompetitive Hemmung (Maximal-V bleibt unverändert) Nicht-kompetitive Hemmung (KM-Konstante bleibt unverändert) (Allosterische Hemmung) Irreversible Hemmungen macht eine Aussage über die katalytische Wirksamkeit, katalytische Effizienz, großes Kcat und kleiner KM-Wert Æ sehr gut, da Kcat / KM -1- Biochemie Übungsblatt Nr. 4 04.12.2003 9) Allgemeine Formel: Katalytische Strategien 1) Metallionenkatalyse (Zink), Säure- bzw. Basenkatalyse, kovalente Katalyse, elektrostatische Katalyse, Katalyse durch Annäherung 2) Hauptenzymklassen: Metalloproteasen, Serinproteasen, Thiolproteasen, Asparatproteasen 3) Bsp.: Chymotypsin (Serinprotease): im Akt. Zentrum: His, Ser, Asparaginsäure bestimmte Reaktionsreihenfolge: kovalente Katalyse elektrostatische Katalyse Allgemeine Basenkatalyse 2x Näheres dazu Buch oder Übung! 4) Carboxypeptidase: Was macht das Zink? Es aktiviert Wasser Æ nukleophiler Angriff des H-Atoms an das Carboxykohlenstoffatom! -2- Biochemie Übungsblatt Nr. 4 04.12.2003 Regulatorische Strategien 1) - Feedback-Hemmung (Allosterische Hemmung), negativ und positive Isoformen von Enzymen Umgebungsbedingungen reversible kovalente Modifikationen (Phosphat-Gruppe) protolytische Aktivierung inaktiver Vorstufen (Verdauungsenzyme) Genexpression Regulatorproteine, Calcium - Ionen 2) Allosterische Enzyme besitzen meist mehrere Untereinheiten (UE) Ohne Inhibitor: sigmoidaler Kurvenverlauf bedingt durch Kooperation) Mit Inhibitor: der Tense-Zustand des Enzyms wird bevorzugt, Verlauf eher linear Mit Aktivator: der Relaxed –Zustand wird bevorzugt, Verlauf eher hyperbolisch -3-