Carboxypeptidase
Werbung
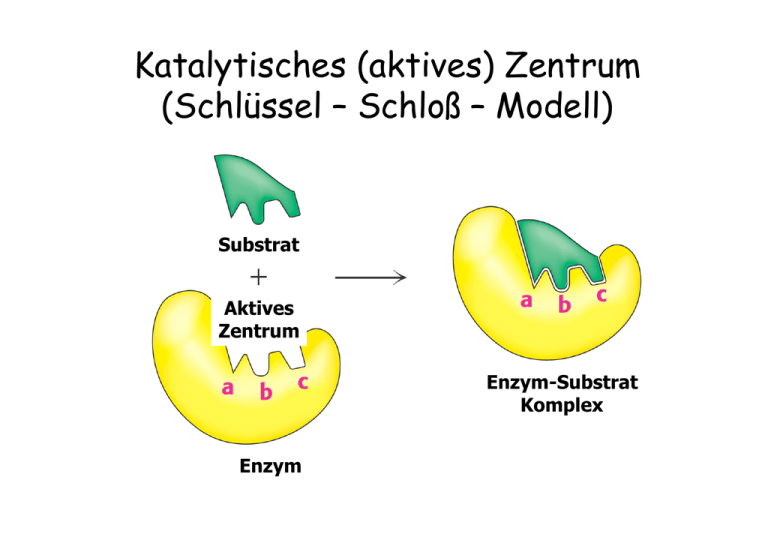
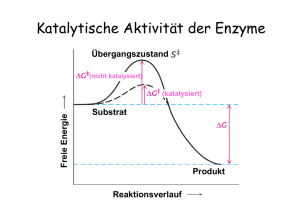
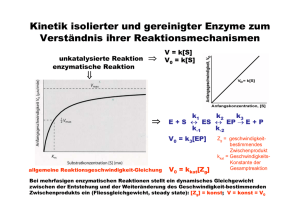
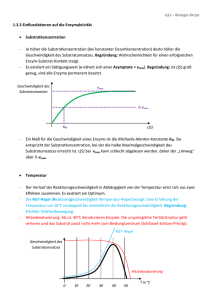
Katalytisches (aktives) Zentrum (Schlüssel – Schloß – Modell) Substrat Aktives Zentrum Enzym-Substrat Komplex Enzym Enzyme stabilisieren den Übergangszustand der Reaktion Substratbindung mit „Induced Fit“ Geschwindigkeit einer Enzym-katalysierten Reaktion als Funktion der Substratkonzentration Enzymkinetik E+S k1 k-1 ES k2 k-2 P+E • k-2 kann zu Beginn der Reaktion ignoriert werden, da [P] noch sehr niedrig ist. • Bestimmung der Anfangsgeschwindigkeit v0 Abhängigkeit der Reaktionsgeschwindigkeit von der Substratkonzentration V0 = Vmax [ S ] [ S ] + KM Michaelis – Menten Gleichung (KM Michaelis Konstante) Grundlagen Erste Untersuchungen: Adrian Brown 1902 β-Fructofuranosidase Saccharose + H2O E+S k1 k-1 Glucose + Fructose ES k2 P+E d[P] v= = k2 [ES] dt d[ES] = k1 [E][S] – k-1[ES] – k2[ES] dt 1. Annahme eines Gleichgewichts L. Michaelis u. M. Menten, 1913 E+S k-1 ›› k2 k1 k-1 k2 ES k-1 Ks = k1 = P+E [E][S] [ES] Verlauf einer Enzym-katalysierten Reaktion (Fließgleichgewicht) 2. Annahme eines Fließgleichgewichts G.E. Briggs u. B.S. Haldane, 1925 d[ES] =0 dt d[ES] = k1 [E][S] – k-1[ES] – k2[ES] dt k1 [E][S] = k-1[ES] + k2[ES] [E]T = [E] + [ES] ( [E]T - [ES] ) [S] [ES] = k-1 + k2 k1 = KM ( [E]T - [ES] ) [S] [ES] = k-1 + k2 k1 = KM KM [ES] = ( [E]T - [ES] ) [S] [ES] = d[P] v0 = ( dt [E]T [S] KM + [S] )t=0 = k2 [ES] vmax = k2 [E]T = k2 [E]T [S] KM + [S] vmax [S] v0 = KM + [S] Abhängigkeit der Reaktionsgeschwindigkeit von der Substratkonzentration V0 = Vmax [S] [ S ] + KM Michaelis – Menten Gleichung (KM Michaelis Konstante) Doppelt-reziproke Darstellung der Michaelis Menten Gleichung Michaelis – Menten Gleichung V0 = Vmax 1/v0 [S] [ S ] + KM 1 1 + = V0 Vmax KM Lineweaver - Burk Diagramm . 1 Vmax [ S ] Bedeutung der KM- und vmax-Werte Katalytische Konstante kkat (Wechselzahl oder „Turnover Number“) kkat = vmax [E]T kkat/KM („katalytische Wirksamkeit“) „Perfekte“ Enzyme Wie funktionieren Enzyme ? Aktive Zentren werden von Aminosäuren gebildet, die in der Primärstruktur oft weit entfernt sind Mechanismen der Enzymkatalyse • Kovalente Katalyse • Säure-Base Katalyse • Metall-Ionen Katalyse • Katalyse durch Orientierungseffekte • Katalyse durch Stabilisierung des Übergangszustandes Kovalente Katalyse Bildung einer kovalenten Bindung zwischen Enzym und Substrat durch nukleophile Substitution Kovalente Katalyse Beispiel: Protease Chymotrypsin Katalytische Triade: Stabilisierung des tetraedrischen Zwischenprodukts durch die „Oxyaniontasche“ Katalytische Triade von Proteasen Carboxypeptidase Subtilisin Cystein Proteasen Aspartat Proteasen Homodimere Aspartat-Protease: HIV - Protease Structure based drug design Metalloproteasen Metall-Ionen Katalyse Beispiel Carboanhydrase Kohlensäure Hydrogencarbonat Struktur der Carboanhydrase des Menschen Das Zn2+ Ion erniedrigt den pKa Wert des gebundenen Wassermoleküls von 15,7 auf 7 Carboanhydrase von Methanosarcina thermophila Enzym - Inhibitoren • Wie wirkt Penicillin ? • Wie wirkt Aspirin ? • Welche Rolle spielt Methotrexat in der Chemotherapie ? • Welche Wirkstoffe werden gegen HIV entwickelt ? Hemmung der Enzym-Aktivität Substrat Kompetitiver Inhibitor Enzym Enzym Substrat Nichtkompetitiver Inhibitor Enzym Irreversibler Inhibitor Enzym Enzym - Kinetik Michaelis – Menten Gleichung V0 = Vmax [ S ] [ S ] + KM KM 1 1 1 . + = V0 Vmax Vmax [ S ] Lineweaver - Burk Diagramm 1/v0 Kompetitive Enzym-Inhibitoren Kompetitive Inhibitoren Dihydrofolat Reduktase und Chemotherapie - blockiert ThyminBiosynthese - Bindet 1000x fester an die Dihydrofolat Red. Nichtkompetitive Enzym-Inhibitoren