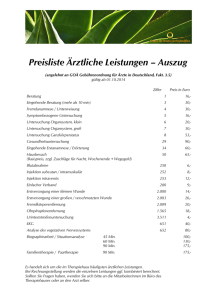
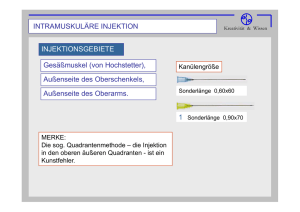
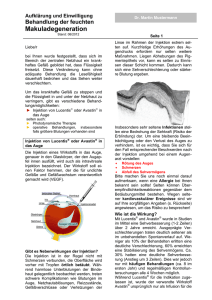
ausgabe 3 - Herzzentrum
Werbung

DAS KÖLNER HERZZENTRUM FACHZEITSCHRIFT FÜR DEN ARZT • Einblicke in das Labor für kardiale Regeneration • Derzeitige Verfahren der Herzunterstützung – ab wann bis wann? • Injektion von Biomaterialien zur Verbesserung nach Myokardinfarkt • Chirurgie der Atrioventrikularklappen im Erwachsenenalter AUSGABE 3 01/2010 INHALTSVERZEICHNIS Vorwort 5 Einblicke in das Labor für kardiale Regeneration der Klinik und Poliklinik für Herz- und Thoraxchirurgie 7 – Yeong-Hoon Choi, Klaus Neef – Derzeitige Verfahren der Herzunterstützung – ab wann bis wann? 13 – Thorsten Wittwer – Injektion von Biomaterialien zur Verbesserung des Remodelings nach Myokardinfarkt 17 – Marcel Halbach, Jochen Müller-Ehmsen – Chirurgie der Atrioventrikularklappen im Erwachsenenalter 23 – Jens Wippermann, Parwis Rahmanian, Navid Madershahian, – Schariah Salehi-Gelani, Thorsten Wahlers – Angeborene Pulmonalklappenerkrankungen 27 – Mathias Emmel, Narayanswami Sreeram, Markus Khalil, – Konrad Brockmeier – Neuer Hochleistungs-Computertomograph im Herzzentrum 29 – Carsten Zobel, Henning Bovenschulte – Der transapikale Aortenklappenersatz Therapie der Wahl bei der kardialen Reoperation? 35 – Justus Strauch – Alternativen zur Therapie des Vorhofflimmerns mit Vitamin K-Antagonisten 37 – Erland Erdmann – Chronisch thromboembolische pulmonale Hypertomie (CTEPH): Welchen Stellenwert haben heute die Perfusions- (Q) und Ventilations- (V) Szintigraphie? 39 – Matthias Schmidt – Herzchirurgische Intensivmedizin am Herzzentrum Köln 43 – Georg Langebartels – Hypersensitivitäts-Myokarditis 47 – Tobias Plenge – Koronaranomalien – Wann besteht eine Indikation zur Intervention? 51 – Jochen Müller-Ehmsen, Erland Erdmann – Neue klinische Studie: Psychotherapie bei depressiven Koronarpatienten 54 – Christian Albus, Frank Lambertus, Frank Vitinius – Verein der Freunde und Förderer des Herzzentrums des Universitätsklinikums Köln e.V. 55 Impressum 58 3 VORWORT v.l.n.r.: Konrad Brockmeier, Erland Erdmann, Thorsten Wahlers, Jan Brunkwall Sehr geehrte Kolleginnen und Kollegen, die Nachbarschaft unserer vier Fachdisziplinen unter einem Dach hat sich in den nun mehr als zwei Jahren des Zusammenlebens nicht nur als angenehm, sondern auch als überaus erfolgreich erwiesen. Der organzentrierte Ansatz im Herzzentrum, hier auf dem Campus der Kölner Universität bietet unseres Erachtens die beste Voraussetzung für effiziente klinische Zusammenarbeit verwandter Disziplinen mit gemeinsamer Nutzung von Räumlichkeiten, Großgeräten und Organisationsstrukturen, in unmittelbarer Nachbarschaft zu allen anderen medizinischen Disziplinen mit ihren Spezialisten. Die attraktive Architektur des Gebäudes scheint eine Art von motivierender Kraft auf die im Herzzentrum arbeitenden Mitarbeiterinnen und Mitarbeiter zu haben - nicht zuletzt wahrscheinlich auch auf unsere Patienten. Die Zeitschrift „Das Kölner Herzzentrum“ liegt Ihnen jetzt in der dritten Ausgabe vor. In dieser Ausgabe haben wir Wert darauf gelegt, in der Form noch einheitlicher zu werden und sie kurz und knapp über aktuelle Themen zu informieren. Wir gehen davon aus, dass wir in Ihrem Interesse gehandelt haben, wenn wir die Beiträge auf typischerweise 3 Seiten Länge konzentriert haben. Sollte Ihnen der Umfang jedoch nicht ausreichend sein und Sie den Wunsch nach ausführlicherer Information zu den angesprochenen Themen haben, so lassen Sie uns das wissen. Zum Zweck einer besseren und schnelleren Kommunikation haben wir in dieses Heft heraustrennbare Seiten einbinden lassen, die Ihnen über FaxKontakt eine rasche Kommunikation mit uns ermöglichen können. Mit den besten Wünschen für ein erfolgreiches Neues Jahr, in weiterhin guter Zusammenarbeit im Interesse unserer Patienten mit herzlichen kollegialen Grüßen Prof. Dr. med. Konrad Brockmeier Direktor der Klinik und Poliklinik für Kinderkardiologie 5 EINBLICKE IN DAS LABOR FÜR KARDIALE REGENERATION Einblicke in das Labor für kardiale Regeneration der Klinik und Poliklinik für Herz- und Thoraxchirurgie Doktoranden: Florian Drey, Birgit Ewert, Suresh Kumar, Anne Pierick, Jung-Min Pyun, Maike Reher, Arne Tenbrock, Philipp Treskes, Angelika Weichel, – Yeong-Hoon Choi, Klaus Neef – MTA: Das Labor für kardiale Regeneration der Klinik und Poliklinik für Herz- und Thoraxchirurgie (Direktor: Univ.-Prof. Dr. Th. Wahlers) wurde 2006 begründet und seitdem kontinuierlich ausgebaut. Neben grundlagenwissenschaftlichen Fragestellungen mit hoher klinischer Relevanz im Gebiet der Stammzelltherapie zur Regeneration des Herzens konzentriert sich die Arbeitsgruppe um Dr. Yeong-Hoon Choi auf die Entwicklung von innovativen und hochsensitiven Diagnostikverfahren zur Früherfassung myokardialer Schädigungen. Das Team Dr. med. Yeong-Hoon Choi - Arbeitsgruppenleiter Kardiale Regeneration Facharzt für Herzchirurgie, Medizinstudium: Johannes GutenbergUniversität Mainz, klinische Ausbildung in Mainz, Rostock und Köln, Postdoc: Children's Hospital Boston/Harvard Medical School Dr. rer. nat. Klaus Neef - Laborleitung Biologiestudium: Universität zu Köln, Postdoc: Nanyang Technological University, Singapore Von links nach rechts: S. Kumar, Dr. K. Neef, M. Brenkmann, A. Tenbrock, M. Schink, P. Treskes Meike Brenkmann, Laura Wilden, Mareike Schink Struktur Das Labor für kardiale Regeneration befindet sich im 5. OG des LFI-Gebäudes (Lehre, Forschung, Information). Neben der eigenen Einrichtung, die vor allem zell- und molekularbiologisch ausgerichtet ist, hat das Labor im Rahmen der Kooperationen mit anderen Arbeitsgruppen und dem Zentrum für Molekulare Medizin Köln (ZMMK) Zugriff auf die modernsten Analyseverfahren. Als Gründungmitglied der Arbeitsgruppe für kardiale Zelltherapie steht das Labor in enger Kooperation mit den Forschungslabors der Medizinischen Klinik III Kardiologie (PD Dr. J. Müller-Ehmsen), Kinderkardiologie (Prof. Dr. Brockmeier), Neurophysiologie (Prof. Dr. J. Hescheler, Dr. Tomo Saric). Ein aus dieser Zusammenarbeit entstandenes Projekt wird aktuell vom Bundesministerium für Bildung und Forschung (BMBF) gefördert. Weiterhin werden die Projekte des Labors vom Zentrum für Molekulare Medizin Köln, der Deutschen Forschungsgemeinschaft (DFG), der Else Kröner Fresenius Stiftung, Köln Fortune und der Elisabeth und Rudolf Hirsch Stiftung gefördert. Labor für Kardiale Regeneration im 5. Obergeschoss des LFI-Gebäudes 7 PRESSEINFORMATION European Society of Cardiology (ESC), München, 30. 08. – 03. 09. 2008 Hochdosisbehandlung mit Atorvastatin reduziert das Risiko für erneute kardiovaskuläre Ereignisse Post-hoc-Analyse der TNT-Studie bestätigt den Nutzen einer Behandlung mit Atorvastatin 80 mg (Sortis®) Eine Post-hoc-Analyse der TNT-Studie (Treating to New Targets)1 bei Patienten mit klinisch manifestierter KHK zeigt, dass durch eine intensive LDL-Cholesterinsenkung mit 80 mg Atorvastatin/Tag im Vergleich zu einer moderaten Behandlung mit 10 mg Atorvastatin nicht nur das Risiko für ein erstes kardiovaskuläres Ereignis, sondern auch die Inzidenz weiterer Ereignisse reduziert werden kann. Um auch den Langzeitnutzen einer Behandlung bewerten zu können, wurde in einer Post-hoc-Analyse der TNTStudie untersucht, ob auch hinsichtlich des Auftretens wiederholter Ereignisse ein Unterschied zwischen den beiden eingesetzten Therapien bestand. Diese Analyse ist insofern bemerkenswert, da alle kardiovaskulären Ereignisse berücksichtigt wurden, die während des fast 5-jährigen Studienzeitraums aufgetreten waren, so Professor Heiner Greten (Hamburg) bei der Präsentation der Daten in München. In der 2005 publizierten TNT-Basisstudie2 konnte die kumulierte Inzidenz des primären Endpunktes (tödliche KHK, nicht tödlicher Herzinfarkt oder Herzstillstand mit Wiederbelebung und tödlicher oder nicht tödlicher Schlaganfall) durch 80 mg Atorvastatin im Vergleich zu Atorvastatin 10 mg statistisch hochsignifikant um 19 % reduziert werden. Im Verlaufe der Beobachtungsdauer von durchschnittlich 4,9 Jahren traten unter der Behandlung mit 10 mg Atorvastatin insgesamt 1677 erstmalige Ereignisse auf während unter 80 mg Atorvastatin 1405 Ereignisse registriert wurden. Dies entspricht einer statistisch hochsignifikanten relativen weiteren Risikoreduktion durch die Intensivbehandlung um 19 %. Dieser Unterschied ist umso bemerkenswerter, als auch die Patienten in der 10-mgGruppe bereits auf einen LDL-Wert von 100 mg/dl eingestellt waren und die durch die Hochdosisbehandlung erzielten Unterschiede daher einen Zusatznutzen der Behandlung widerspiegeln. Die Verträglichkeit – ein wichtiges Kriterium in der Dauertherapie – war in beiden Gruppen gut. Eine Erhöhung der Leberenzymwerte wurde in der 80-mg-Gruppe bei 1,2 % der Patienten dokumentiert, ein Wert, der vergleichbar ist mit den Ergebnissen aus anderen Studien mit Atorvastatin und anderen Statinen in verschiedenen Dosierungen. In der mit 10 mg Atorvastatin behandelten Gruppe wurde in der TNT-Studie eine niedrige Rate von nur 0,2 % beobachtet. Auch die beobachteten muskulären Nebenwirkungen lagen in der auch in anderen Studien beobachteten Größenordnung. Rhabdomyolysen, die auf den Einsatz von Atorvastatin zurückzuführen waren, traten in keiner der beiden Gruppen auf. Nutzen von Atorvastatin bei der Reduktion wiederholter Ereignisse Während der medianen Gesamtdauer der Untersuchung von 4,9 Jahren trat bei 1.516 Patienten ein zweites kardiovaskuläres Ereignis auf. Dabei zeigte sich, dass die mit Atorvastatin 80 mg behandelten Patienten gegenüber den mit Atorvastatin 10 mg behandelten Patienten ein um 21 % signifikant geringeres relatives Risiko für das Auftreten eines solchen zweiten kardiovaskulären Ereignisses aufwiesen (p < 0,0001). 698 Patienten erlitten im Laufe der Studie ein drittes kardiovaskuläres Ereignis und auch hier wiesen die mit Atorvastatin 80 mg behandelten Patienten gegenüber den Patienten in der 10-mg-Gruppe eine signifikante (p = 0,0004), um 24 % geringere Inzidenz auf. Auch bei den 345 Patienten mit einem vierten und den 197 Patienten mit einem fünften Ereignis lagen die Unterschiede bei 28 % und 29 % zugunsten der Hochdosisbehandlung mit Atorvastatin und auch hier konnte noch eine Signifikanz von p = 0,003 bzw. 0,018 erzielt werden. Evidenz basierte Behandlung von KHK-Patienten mit Atorvastatin Diese neue Post-hoc-Analyse bestätigt nicht nur die Daten der TNT-Basisstudie2 sondern sie zeigt auch einen Weg auf, das nach einem Herzinfarkt bestehende hohe Risiko für das Auftreten weiterer kardiovaskulärer Ereignisse zu senken. Die Daten unterstreichen darüber hinaus den klinischen Nutzen einer Atorvastatin-Hochdosisbehandlung zur dauerhaften Senkung von LDL-Cholesterin, um das Risiko für das Auftreten weiterer kardiovaskulärer Ereignisse bei KHK-Patienten auch langfristig zu reduzieren. Ein Ergebnis, das auch in der Hochdosisgruppe nicht mit einem Anstieg schwerwiegender Nebenwirkungen erkauft werden musste. Die Ergebnisse dieser Subgruppenanalyse der TNT-Studie gehen konform mit den nationalen3 und internationalen Leitlinien4, nach denen KHK-Patienten als Therapie der ersten Wahl ein Statin erhalten sollten, mit dem die Zielwerte erreicht werden können und dessen klinische Wirksamkeit in Endpunktstudien nachgewiesen ist. Erst wenn die Maximaldosis des effektivsten Statins nicht ausreicht oder nicht vertragen wird, sollten Kombinationen mit anderen Substanzen in Erwägung gezogen werden. Leider ist diese Empfehlung in Deutschland schwieriger als in anderen Ländern umzusetzen, da die Verordnung des effektivsten in Deutschland zugelassenen Statins Atorvastatin – in vielen Fällen mit einer Zuzahlung für gesetzlich versicherte Patienten verbunden ist. * TNT = Treating to New Targets LaRosa, John C. et al., European Heart Journal 2008; 29 (Abstract suppl) 657, p4065 LaRosa, John C. et al., N Engl J Med 2005; 352: 1425-1435 Böhm, M. et al., Clin. Res. Cardiol. Suppl. 2007;2:8-15 4 Van de Werf, F. et al., European Heart Journal 2003; 24: 28-66 1 2 3 EINBLICKE IN DAS LABOR FÜR KARDIALE REGENERATION Projekte Das Labor für kardiale Regeneration beschäftigt sich, wie dem Namen schon zu entnehmen ist, mit der Regeneration des insuffzienten Herzens durch Zelltransplantation. Neben den grundlagenwissenschaftlichen Ansätzen wurden auch adäquate Tiermodelle der ischämischen sowie der nicht-ischämischen Kardiomyopathie entwickelt um die Effekte und die Effizienz der Zelltransplantation auf die Wiederherstellung der Pumpfunktion des Herzens zu untersuchen. Im Rahmen der engen Zusammenarbeit mit den Kooperationspartnern konnte ein starkes Netzwerk zur Bearbeitung dieser Fragestellungen aufgebaut werden. Abb.: Exemplarische Darstellung von aufgereinigten murinen Kardiomyozyten, die aus embryonalen Stammzellen (ESC, obere Reihe) und induzierten pluripotenten Stammzellen (iPS, untere Reihe)abgeleitet wurden (Mit freundlicher Genehmigung von Dr. T. Saric, Institut für Neurophysiologie). Zirkulierende Endothelzellen (CEC) und Endotheliale Progenitorzellen (EPC) Der Einsatz der Herz-Lungenmaschine im Rahmen von herzchirurgischen Eingriffen führt zu einer systemischen Inflammationsreaktion, die durch eine Zytokinausschüttung und Induktion von Knochenmarkstammzellen charakterisiert ist. Weiterhin kommt es zu einer Integritätsstörung des Endothels, die zu einer Freisetzung von Endothelzellen in die Blutstrombahn führt. Die Quantifizierung der zirkulierenden Endothelzellen zur Evaluation der Verbesserung von kardioprotektiven Maßnahmen im Rahmen von kardiochirurgischen Eingriffen sowie die Regenerationsfähigkeit des Endothels durch die Induktion von endothelialen Progenitorzellen aus dem Knochenmark sind Gegenstand von aktuellen Projekten. Abb.: Darstellung einer mit zirkulierenden Endothelzelle (CEC), hier mit Rhodamin fluoreszierend markiert und per paramagnetischer, Antikörper-beschichteter Mikrosphären detektiert. Repräsentative Darstellung der Reduktion der Größe des Myokardinfarkts nach LAD-Ligatur durch kardiale Stammzelltherapie in der NOD-scid Maus. Deutlich zu erkennen ist die signifikante Reduktion der Infarktgröße nach Transplantation von humanen CD133+ mononukleären Nabelschnurblutzellen (A) im Vergleich zu Herzen, bei denen kein Stammzellhoming stattfand (B). In dem aktuellen iPS/MSC Projekt werden vor allem die Optimierung der sehr vielversprechenden Zelltherapie und eine genauere Erfassung der zu Grunde liegenden Mechanismen untersucht. Kardiale Regeneration durch Ko-Transplantation von induzierten pluripotenten Stammzellen (iPS) und mesenchymalen Knochenmarkstammzellen (MSC) Die Transplantation von Kardiomyozyten, die aus pluripotenten Stammzellen gewonnen werden, stellt einen attraktiven therapeutischen Ansatz für die Behandlung von Herzinsuffizienzen dar. Ein wesentliches Hindernis auf dem Weg zur klinischen Anwendung ist der Zellverlust während und nach der Transplantation, wodurch die positiven Effekte auf die Pumpfunktion des geschädigten Herzens deutlich reduziert werden. Das Hauptziel des vorliegenden Antrages ist es, die langfristige funktionelle Integration der transplantierten Zellen, durch Erhöhung ihrer Fähigkeit im Zielgewebe zu verbleiben und zu überleben, zu verbessern. Die experimentellen Ansätze hierzu umfassen die Prä-Konditionierung der zu transplantierenden Zellen, die Ko-Transplantation von Kardiomyozyten und adulten Stammzellen aus dem Knochenmark und die Art der Zell-Administration. Der Verbleib der transplantierten Zellen und ihre therapeutische Effizienz werden durch in vivo MRT- Nachverfolgung (tracking), sowie funktionelle und histologische 9 EINBLICKE IN DAS LABOR FÜR KARDIALE REGENERATION Analysen ermittelt. Dieses Projekt trägt dazu bei, das Potential und die Anwendbarkeit von zellbasierten Therapien zur kardialen Regeneration zu bestimmen und eröffnet eine mögliche zukünftige klinische Anwendung. der myokardialen Angiogenese bearbeitet. Neuartige Therapiekonzepte durch Stammzelltransplantation zu den o. g. Problemstellungen sowie zur Therapie von Rhythmusstörungen zum Teil in Verbindung mit Tissue EngineeringKonzepten stellen einen weiteren wichtigen Aspekt der laufenden Projekte dar. Myokardhypertrophie und ihre Spätfolgen - Evaluation von klinisch-relevanten zellbasierten Therapieansätzen Die Myokardhypertrophie, die durch eine Druckbelastung induziert wird, repräsentiert einen signifikanten Risikofaktor für herzchirurgische Patienten, die mit einer erhöhten perioperativen sowie erhöhten Langzeitmorbidität und -mortalität assoziiert ist. Dieses gilt insbesondere für pädiatrische Patienten, da in nahezu allen Fällen angeborene Herzfehler mit einer Myokardhypertrophie eines oder beider Ventrikel vergesellschaftet sind. Als Konsequenz der Hypertrophie zeigen sich folgende Effekte an Myokard: • Gestörte intrazelluläre Calciumhomöostase • Verminderte Glukoseaufnahmefähigkeit Angiogenese durch Zelltransplantion bei linksventrikulärer Myokardhypertrophie (Kardiomyozyten (rot), Nuclei (blau), Kapillaren (grün) • Mangel an intrazellulären energiereichen Phosphatverbindungen Publikationen: • Kapillarinsuffizienz mit relativer Minderperfusion Induktion der linksventrikulären Myokardhypertrophie durch aortales Banding in der Maus und deren bildgebende Diagnostik mittels Magnetresonanz-Tomographie (MRT) Diese pathophysiologischen Effekte wiederum resultieren in einer progressiven kontraktilen Dysfunktion, die im weiteren Verlauf durch eine ventrikuläre Dilatation charakterisiert ist. Im Weiteren ist das hypertrophierte Myokard durch eine deutlich verminderte Toleranz gegenüber einem Ischämie-Reperfusionsschaden sowie eine gesteigerte Apoptoseinduktion und Rhythmusstörungen gekennzeichnet. Die aktuell laufenden Projekte konzentrieren sich auf die mangelnde Anpassung des Myokards an den erhöhten Substratbedarf des hypertrophierten kontraktilen Apparates, die zugrunde liegenden Pathomechanismen und deren Auswirkungen auf das Herz. Im Speziellen werden dabei die Mechanismen der Kapillarinsuffizienz, der alterierten intrazellulären Calciumhomöostase und dessen Effekte auf die Apoptoseinduktion im Herzen untersucht. Weiterhin werden mögliche Therapieoptionen zur Inhibition der Apoptose im Herzen und zur Induktion Choi YH, Stamm C, Hammer PE, Kwaku KF, Marler JJ, Friehs I, Jones M, Rader CM, Roy N, Triedman JK, Walsh EP, McGowan FX, del Nido PJ, Cowan DB. Cardiac conduction through engineered tissue. Am J Pathol. 2006; 169:72-85. 6,243 Ma N, Ladilov Y, Moebius JM, Ong L, Piechaczek C, David A, Kaminski A, Choi YH, Li W, Egger D, Stamm C, Steinhoff G. Intramyocardial delivery of human CD133+ cells in a SCID mouse cryoinjury model: Bone marrow vs. cord bloodderived cells. Cardiovasc Res. 2006 Jul 1;71(1):158-69 IF 5,662 Kaminski A, Kasch C, Zhang L, Kumar S, Sponholz C, Choi YH, Ma N, Liebold A, Ladilov Y, Steinhoff G, Stamm C. Endothelial nitric oxide synthase mediates protective effects of hypoxic preconditioning in lungs. Respir Physiol Neurobiol. 2007 Mar 15;155(3):280-5 IF 2,145 Skrabal CA, Choi YH, Kaminski A, Steiner M, Kundt G, Steinhoff G, Liebold A. Circulating endothelial cells demonstrate an attenuation of endothelial damage by minimizing the extracorporeal circulation. J Thorac Cardiovasc Surg. 2006 Aug;132(2):291-6 IF 3,505 Choi CY, Reimers K, Allmeling C, Choi YH, Kall S, Vogt PM: Inhibition of T-cell-induced apoptosis by expression of anti-apoptotic proteins in recombinant human keratinocytes Cell Transplant 2007;16(6):663-74. IF 3,109 Stamm C, Kleine HD, Choi YH, Dunkelmann S, Lauffs JA, Lorenzen B, David A, Liebold A, Nienaber C, Zurakowski D, Freund M, Steinhoff G. Intramyocardial delivery of CD133+ bone marrow cells and coronary artery bypass grafting for chronic ischemic heart disease: safety and efficacy studies. J Thorac Cardiovasc Surg. 2007 Mar;133(3):717-25 IF 3,505 11 EINBLICKE IN DAS LABOR FÜR KARDIALE REGENERATION Choi YH, Cowan DB, Nathan M, Poutias D, Stamm C, del Nido PJ, McGowan FX Jr. Myocardial hypertrophy overrides the angiogenic response to hypoxia. PLoS ONE. 2008;3(12):e4042. Epub 2008 Dec 29. Choi YH, Cowan DB, Moran AM, Colan SD, Stamm C, Takeuchi K, Friehs I, del Nido PJ, McGowan Jr FX. Myocyte apoptosis occurs early during the development of pressure-overload hypertrophy in infant myocardium J Thorac Cardiovasc Surg. 2009 Jun;137(6):1356-62, 1362.e1-3. Epub 2009 Mar 17 IF 3,505 Choi YH, Cowan DB, Wahlers T, Hetzer R, del Nido PJ, Stamm C. Calcium sensitization impairs diastolic relaxation in postischemic myocardium: Implications for the use of Ca2+ sensitizing inotropes after cardiac surgery Eur J Cardiothorac Surg 2009 10.1016/j.ejcts.2009.05.030 IF 1,974 Choi YH, Neef K, Reher M, Liakopoulos OJ, Zeriouh M, Wittwer T, Stamm C, Madershahian N, Teschendorf P, Wahlers T The influence of preoperative risk on the number of circulating endothelial progenitor cells during cardiopulmonary bypass Cytotherapy 2009 accepted, in press, IF 3,471 12 Choi YH, Bovenschulte H, Neef K, Liakopoulos OJ, Wittwer T, Krug KB, Lackner KJ, Tenbrock A, Weichel A, Stamm C, Wahlers T. Magnetic resonance imaging of progressive cardiomyopathic changes in mice using a clinical 3-T MR scanner J Surg Res 2009 in submission Choi YH, Neef K, Liakopoulos OJ, Wittwer T, Tenbrock A, Weichel A, Stamm C, Wahlers T. Concentration of Bone Marrow Total Nucleated Cells by a Point-of-Care Device Improves their Regenerative Potential in Cardiomyopathic Hearts Circ Res 2009 in submission Choi YH, Weichel A, Neef K, Liakopoulos OJ, Wittwer T, Weichel A, Tenbrock A, Stamm C, Wahlers T. The influence of cardiovascular risk factor on the proliferation characteristics of mesenchymal stem cells Transfusion 2009 in submission DERZEITIGE VERFAHREN DER HERZUNTERSTÜTZUNG – AB WANN BIS WANN? Derzeitige Verfahren der Herzunterstützung – ab wann bis wann? – Prof. Dr. med. Thorsten Wittwer, M.A. – Klinik für Herz- und Thoraxchirurgie – Herzzentrum Universitätsklinikum Köln Aufgrund der abnehmenden Zahl an Spenderherzen bei gleichzeitigem stetigen Anstieg der Zahl potentieller Organempfänger ist in den letzten Jahren eine zunehmende Zahl von Herzinsuffizienzpatienten zu verzeichnen, deren Zustand sich während der Wartezeit auf eine Transplantation dramatisch verschlechtert und zum „Tod auf der Warteliste“ führen kann (Abb 1). Abbildung 1: Tod auf der Warteliste Diesen Patienten kann nach Ausschöpfung aller konservativen Möglichkeiten nur durch den Einsatz mechanischer Kreislaufunterstützungssysteme das Leben bis zu einer Transplantation gerettet werden. Eine weitere Indikation für derartige Systeme stellen Notfallsituationen dar, in denen ein höchst akutes Pumpversagen Abbildung 2: Kurzzeit-Herzunterstützungssystem Levitronix Centrimag Abbildung 3: Biventrikuläres extrakorporales Kreislaufunterstützungssystem, Typ „Berlin Heart“ des Herzens, z. B. aufgrund eines Herzinfarktes, einer Herzmuskelentzündung oder im Rahmen der dilatativen Kardiomyopathie eintritt. Auch bei Patienten, die sich während eines herzchirurgischen Eingriffs nicht von der HerzLungen-Maschine entwöhnen lassen, kann der Einsatz eines künstlichen Herzunterstützungssystems angezeigt sein. Unterscheiden lassen sich die verschiedensten Systeme insbesondere durch die Dauer der möglichen Anwendungszeit. Wenn von einer nur vorübergehenden Funktionseinschränkung mit möglicher vollständiger Erholung des Herzens ausgegangen werden kann, so können „Kurzzeitsysteme“ wie z. B. das System „Levitronix Centrimag“ in der Absicht der sog. „bridging to recovery“ für einen Zeitraum von bis zu 3-4 Wochen eingesetzt werden (Abb. 2). Ist von einem längerfristigen Pumpversagen auszugehen bzw. von einer fehlenden Regenerationsfähigkeit des patienteneigenen Herzens, so müssen längerfristige Unterstützungspumpen als Überbrückungsmaßnahme bis zu einer Herztransplantation („bridge to transplant“) zur Anwendung kommen. Hierbei ist es entscheidend, ob die Pumpschwäche lediglich eine, in der Regel die linke, Herzhälfte betrifft, oder ob beide Herzhälften unterstützt werden müssen. Im letzteren Fall haben sich als sog. biventrikuläre extrakorporale Unterstützungssyteme das sog. Berlin Heart sowie das Thoratec System (Abb. 3.) bewährt. Diese Herzunterstützungssysteme können in Einzelfällen ein Überleben des Patienten bis zu 2 Jahre ermöglichen (1, 2). Die Limitierung der Systeme liegt in der Einschränkung der Mobilität des Patienten durch die Notwendigkeit, ausserhalb des Körpers elektrischen Strom in pneumatische Energie umwandeln zu müssen, so dass eine biventrikuläre Unterstützung fast zwangsläufig mit einem stationären Daueraufenthalt verbunden ist. Hier liegt ein wesentlicher Vorteil der implantierbaren isoliert linksventrikulären Systeme (LVAD), die elektrisch angetrieben werden und es dem Patienten ermöglichen, während der Wartezeit nach Hause und in Einzelfällen sogar in das Berufsleben zurückzukehren. Etwas ältere, jedoch immer noch verwendete Gerätetypen sind das Novacor-System (Fa. Baxter 13 DERZEITIGE VERFAHREN DER HERZUNTERSTÜTZUNG – AB WANN BIS WANN? Abbildung 5: Implantation eines linksventrikulären Unterstützungssystems (LVAD), Typ TCI-HeartMate Healthcare Corp., Oakland, USA) sowie das TCIHeartMate-System (ThermoCardiosystems Inc., Woburn, USA) (Abb. 5). Bei beiden Systemen erfolgt die Drainage des Blutes aus der Spitze des linken Ventrikels in die Pumpe sowie der Auswurf über eine Gefäßprothese in die Aorta ascendens. Die Pumpe ist dabei in eine Tasche im Bereich der linken Bauchwand implantiert Abbildung 6: TCI-LVAD in situ; eine implantierte Dacron-Gefäßprothese stellt die Verbindung zwischen System-Ausflussstutzen und Aorta ascendens her. 14 und steht mit einer elektrischen Energiequelle über ein dünnes Kabel in Verbindung (Abb. 6). Im Laufe der technischen Weiterentwicklung der letzten Jahre konnten diese Systeme auch durch Änderungen im Arbeitsprinzip erheblich verkleinert werden, so dass die heutigen sog. „Axialpumpen“ wie z. B. das Modell „Incor“ der Firma BerlinHeart in der Regel erheblich schonender bzw. leichter zu implantieren sind (Abb. 7). Mit kleinen externen Batterien sind die Patienten auch mit diesen Geräten über viele Stunden frei beweglich. Der wesentliche Nachteil dieser prinzipbedingt nur univentrikulären Systeme ist, dass sie lediglich den linken Ventrikel unterstützen und auf eine im Wesentlichen uneingeschränkte Funktion des rechten Herzens angewiesen sind. Die Funktionsdauer der verschiedenen Gerätetypen liegt in der Langzeitbeobachtung im Bereich von einigen Jahren, was in den meisten Fällen die Wartezeit auf ein menschliches Spenderherz ermöglicht. In den letzten Jahren konnten zwei hochmoderne Neuerungen in die klinische Praxis überführt werden. So ist es bei ausgewählten Patienten mit lediglich mittelgradig ausgepägter Herzschwäche, die (noch) keine Herztransplantation bzw. ein „richtiges“ Herzunterstützungssytem benötigen, möglich, die reduzierte Herzleistung und somit die Leistungsfähigkeit der Patienten durch eine sogenannte „Mini„Herzunterstützungspumpe“ dauerhaft wieder auf annähernde Normalwerte zu verbessern, ohne den Brustkorb eröffnen zu müssen. Der große Vorteil dieses „CircuLite Mini-LVAD“ ist die Tatsche, dass die Implantation in sog. minimal-invasiver „Schlüsselloch“-OP-Technik sowohl am rechtsseitigen Brustkorb als auch der rechten Schlüsselbeinregion erfolgt, ähnlich der Implantation eines Herzschrittmachers (Abb. 8). Bei der dann nach mehreren Monaten bis Jahren erfolgenden Herztransplantation existieren keine Limitationen durch schwere Verwachsungen wie bei Einpflanzung der herkömmlichen Unterstützungspumpen in den Herzbeutel. Abbildung 7: BerlinHeart “Incor”-LVAD: Das komplette System lässt sich in den Herzbeutel implantieren, “Bauchschnitte” sind nicht mehr erforderlich DERZEITIGE VERFAHREN DER HERZUNTERSTÜTZUNG – AB WANN BIS WANN? Abbildung 8: CircuLite Mini-LVAD: CT-Bild (links) bzw. Röntgen-Thorax (rechts): Anschluss der Pumpe an die Schlüsselbeinarterie sowie über einen „Schlüsselloch“-Schnitt in der erchten Brustwand an den linken Herzvorhof Die zweite Neuerung betrifft Patienten, die eine derartig ausgeprägte Schädigung des gesamten Herzens erleiden, dass das Organ an sich nicht mehr wie bei den bisher beschriebenen Herzunterstützungspumpen erhalten werden kann. In diesen Fällen erfolgt nach vollständiger Entfernung des patienteneigenen Herzens die Implantation eines kompletten Kunstherzsystems, z. B. in Form des „Total artificial heart“ der Firma Syncardia (Abb. 9). Die Patienten sind auch nach dieser eingreifenden Methode vollständig mobilisierbar und können die Wartezeit auf ein Spenderherz bis zu 2-3 Jahre in häuslicher Umgebung verbringen. Weite Verbreitung haben alle genannten Unterstützungs- bzw. Ersatzsysteme bisher überwiegend als zeitweilige Überbrückung bis zu einer Transplantation gefunden. In diesem Zusammenhang ist zu betonen, dass die Überlebensrate von transplantierten Patienten nach vorheriger LVAD-Unterstützung deutlich besser sind als bei Patienten, die als Notfall oder im Schockgeschehen notfallmäßig transplantiert wurden (3). In Anbetracht der in den letzten Jahren deutlich verbesserten Ergebnisse nach LVAD-Implantation erscheint es zunehmend gerechtfertigt, bei bestimmten Patienten, für die eine Herztransplantation z. B. wegen hohen Alters oder schwerwiegender Nebenerkrankungen nicht mehr möglich ist, derartige Systeme auch als permanente Unterstützung einzusetzen. In diesem Sinne konnte eine renommierte Studie zeigen, daß LVADs unter bestimmten Voraussetzungen durchaus als Alternative zur rein medikamentösen Therapie bei schwerst herzinsuffizienten Patienten über 65 Jahren dienen können. Ausblick Die mechanische Kreislaufunterstützung hat in den letzten Jahren zunehmende Bedeutung gewonnen, und es ist davon auszugehen, dass zukünftig eine wachsende Zahl von Patienten mit diesen Systemen unterstützt werden wird. Die Erfahrung zeigt, dass ein frühzeitiger Einsatz dieser Systeme die Ergebnisse eindeutig verbessert, so dass eventuell auch die Zahl derer steigen wird, deren myokardiale Funktion sich am LVAD-System soweit erholt, dass eine Explantation ohne Transplantation möglich wird (5). Weiterhin ist zu vermuten, dass mit wachsender Zuverlässigkeit der LVADs eine dauerhafte Implantation als Alternative zur Transplantation möglich ist, was durch die beschriebene technische Weiterentwicklung der Geräte hin zu vollständig implantierbaren Systemen weiter unterstützt würde. Abbildung 9: Total Artificial Heart (Syncardia); eigentliches Kunstherz (linkes Bild) bzw. mobile Antriebskonsole (rechtes Bild) 15 DERZEITIGE VERFAHREN DER HERZUNTERSTÜTZUNG – AB WANN BIS WANN? Literatur 1. Loebe M, Potapov E, Drews T, Weng Y, Ngo W, Gräfin zu Dohna R, Müller J, Sodian R, Hetzer R. Fortschritte unf´d Perspektiven des mechanischen Herzersatzes. Z Kardiol 2000; 89 (Suppl 7): 91-98 4. Rose EA, Moskovitz AJ, Packer M, Sollano JA, Williams DL, Tierney AR, Heitjan DF, Meier P, Acheim DD, Levitan RG, Weinberg AD, Stevenson LW, Shapiro PA, Lazar RM, Watson JT, Goldstein DJ, Gelijns AC. 2. Alba AC, Delgado DH. The future is here: ventricular assist devices for the failing heart. Expert Rev Cardiovasc Ther. 2009 Sep;7(9):1067-77. The REMATCH trial: rationale, design, and end points. Randomized Evaluation of Mechanical Assistance for the Treatment of Congestive Heart Failure. Ann Thorac Surg 1999; 67: 723-30 3. El-Banayosy A, Deng M, Loisance DY, Vetter H, Gronda E, Loebe M, Vigano M. The European experience of Novacor left ventricular assist (LVAS) therapy as a bridge to transplant: a retrospective multicentre study. Eur J Cardiothorac Surg 1999; 15: 835-41 16 5. Loebe M, Potapov E, Drews T, Weng Y, Ngo W, Gräfin zu Dohna R, Müller J, Sodian R, Hetzer R. Fortschritte unf´d Perspektiven des mechanischen Herzersatzes. Z Kardiol 2000; 89 (Suppl 7): 91-98 INJEKTION VON BIOMATERIALIEN NACH MYOKARDINFARKT Injektion von Biomaterialien zur Verbesserung des Remodelings nach Myokardinfarkt – Marcel Halbach, Jochen Müller-Ehmsen – Klinik III für Innere Medizin, – Herzzentrum der Uniklinik Köln Morbidität und Mortalität des Myokardinfarktes werden nicht nur durch den akuten Gewebeuntergang bestimmt, sondern auch durch sich anschließende chronische Umbauprozesse, die als ventrikuläres Remodeling bezeichnet werden [1]. Das Remodeling betrifft sowohl das Infarktgebiet als auch das nichtischämische Myokard. In den ersten Tagen nach dem Infarkt, bevor das infarzierte Gewebe durch eine stabile Narbe ersetzt ist, kommt es zunächst zur sogenannten Infarkt-Expansion. Diese Ausdehnung ist nicht durch zusätzliche Nekrosen bedingt, sondern durch ein Auseinanderscheren und -reißen von Herzmuskelzellen. Eine entscheidende Rolle für diesen Vorgang spielt nach neueren Erkenntnissen eine Degradierung der extrazellulären Matrix, durch die die Ventrikelwand im Bereich des Infarktes destabilisiert wird [6]. Aus der Expan- sion des Infarktes resultiert eine verringerte Wanddicke bis hin zu einer aneurysmatischen Aussackung oder Ventrikelruptur. Die Ausdehnung des Infarktes führt auch zu einer Dehnung und Abnahme der kontraktilen Funktion des benachbarten, noch perfundierten Myokards. Darüber hinaus kommt es durch die fehlende Kontraktilität des Infarktgebietes zu einer Mehrbelastung des nicht-ischämischen Myokards, die langfristig in einer globalen Dilatation des Ventrikels und einer globalen Hypertrophie der Herzmuskelzellen resultiert. Ob die kompensatorische Hypertrophie des nicht-infarzierten Myokards für die globale Pumpfunkion von Vorteil ist oder als eine Komponente des schädlichen Remodelings zur Herzinsuffizienz-Problematik beiträgt, ist nicht geklärt. Eine medikamentöse Inhibition des ReninAngiotensin-Aldosteron-Systems und eine Revaskularisierung tragen zwar zu einer Verminderung des Remodelings bei, die aus dem Remodeling resultierende chronische Herzinsuffizienz stellt aber immer noch die bedeutendste Komplikation des Infarktes dar. Daher zielen neue Therapieansätze darauf ab, das Remodeling noch weiter zu supprimieren und die chronische Herzinsuffizienz zu verhindern. Große Beachtung hat in den vergangenen Jahren insbesondere die Stammzelltherapie erlangt, bei der eine Regeneration des Myokards durch proangiogenetische und antiapoptotische Effekte der transplantierten Zellen [12] oder durch eine exogene Implantation kontraktiler Zellen [9] erreicht werden soll. Basierend auf der zentralen Bedeutung der Matrix-Degradierung für das ventrikuläre Remodeling ist während der letzten Jahre ein weiterer, weitaus weniger beachteter, aber inzwischen in klinischer Erprobung befindlicher Therapieansatz entwickelt worden, der ein großes Potential besitzt, dem Remodeling entgegen zu wirken: die Injektion von Biomaterialien in das Infarktareal als artifizielle extrazelluläre Matrix. Rationale der Injektion von Biomaterialien Abbildung 1. Verminderung der Wandspannung durch die Injektion von Biomaterialien. A: Schematische Darstellung des linken Ventrikels. Nach dem LaplaceGesetz ist die Wandspannung (K) proportional zum Druck im Ventikel (P) sowie zum Radius des Ventrikels (r) und umgekehrt proportional zur Wanddicke (d). B: Die Infarkt-Expansion im Rahmen des Remodelings führt zu einer Dilatation des linken Ventrikels, wodurch die Wandspannung erhöht wird (links). Die Erhöhung der Wanddicke und die Stabilisierung der Infarktnarbe durch die Injektion von Biomaterialien wirken der Infarkt-Expansion und der Erhöhung der Wandspannung entgegen (rechts). Das Einbringen einer artifiziellen extrazellulären Matrix soll die Infarktdicke erhöhen und der durch die Degradierung der originären Extrazellulärmatrix bedingten Destabilisierung des Infarktbereiches entgegenwirken [7]. Dies führt in der Theorie zu einer Verminderung der akuten Infarkt-Expansion. Außerdem wird die chronische Dilatation des Ventrikels verringert, da die Belastung des gesamten Ventrikels reduziert wird. Biophysikalisch kann dieser Effekt durch das Laplace-Gesetz erklärt werden (Abb. 1): Wandspannung = Druck x Radius / Wanddicke x 2. Eine Erhöhung der Wanddicke durch die Implantation von Biomaterialien reduziert die 17 INJEKTION VON BIOMATERIALIEN NACH MYOKARDINFARKT Wandspannung im Infarkt und vermindert dadurch die Infarktexpansion und die Zunahme des Ventrikelradius. Dadurch wird wiederum die Wandspannung im verbliebenen Myokard reduziert, d. h. eine geringere Kontraktionskraft der Herzmuskelzellen ist ausreichend, um einen vergleichbaren systolischen Druckanstieg im Ventrikel zu erzeugen. Diese Effekte können theoretisch nicht nur durch die Implantation von Biomaterialien erreicht werden, sondern auch durch eine Transplantation von Zellen. Die beobachtete Verbesserung der Ventrikelfunktion nach Zelltransplantation könnte daher zumindest teilweise durch eine Stabilisierung der Infarktnarbe durch die Zellen bedingt sein, und nicht nur durch deren regenerative Effekte. Im Vergleich zur Zelltransplantation bietet die Implantation von Biomaterialien eine Reihe von Vorteilen. Biomaterialien können leicht in großer Menge produziert und gelagert werden, sie stehen damit „aus dem Regal“ zur Verfügung und könnten sogar im Rahmen der Akutversorgung Verwendung finden. Die Gewinnung, Aufreinigung und ggf. Kultivierung von Stammzellen ist hingegen ein aufwendiger und oftmals zeitraubender Prozess, der nach der akuten Intervention einen Zweiteingriff für die Transplantation erforderlich macht. Außerdem gibt es Hinweise darauf, dass die Qualität adulter Stammzellen in Abhängigkeit vom Alter des Patienten abnimmt [4], wodurch der Erfolg einer Zelltherapie bei älteren Patienten – also bei einem bedeutenden Anteil der Zielgruppe – eingeschränkt sein könnte. Biomaterialien sind hingegen unabhängig vom Patientenalter verwendbar. Ein weiterer Vorteil der Biomaterialien, im Vergleich zu einem möglichen Einsatz allogener Stammzellen, ist ihre fehlende Immunogenität. Abbildung 2: Wirkmechanismus der Alginat-Injektion. A: Die zur Therapie des Myokardinfarktes klinisch eingesetzte Substanz (Bioline 1040®) ist eine Lösung aus 1% Natrium-Alginat und 0,3% Kalzium-D-Glukonat. Der Grad der Quervernetzung der Alginat-Moleküle ist gering, die Substanz wird in flüssigem Zustand injiziert. Durch die hohe Kalzium-Konzentration im Infarktgebiet nimmt die Quervernetzung des Alginats zu, die Substanz nimmt einen gelartigen Zustand an und stabilisiert die Infarktnarbe. Während des Heilungsprozesses verringert sich die Kalzium-Konzentration in der Infarktnarbe, die Kalzium-Ionen werden durch Natrium-Ionen ersetzt. Das Alginat wird flüssig und renal ausgeschieden. In gesundem Gewebe ist die Kalzium-Konzentration von vornherein gering, das Kalzium in Bioline 1040® wird durch Natrium ersetzt und es findet keine gelartige Verformung statt. B: Alginat 2 Stunden nach Injektion in ein infarziertes Schweine-Herz. 18 Diesen Vorteilen steht der Nachteil des Fehlens der potentiellen regenerativen Effekte der Stammzellen (Angiogenese, Verminderugn der Apoptose, exogener oder endogener Ersatz untergegangener Herzmuskelzellen) gegenüber. Ein Beweis dafür, dass der Nutzen der vielfach beschriebenen regenerativen Effekte von Stammzellen über den der passiven Effekte der Narbenstabilisierung hinausgeht, steht aktuell aber noch aus. Ganz im Gegenteil weisen vergleichende Studien darauf hin, dass die Injektion von azellulären Biomaterialien der Zell-Injektion nicht unterlegen ist (s.u.) [2; 7]. Bislang verwendete Biomaterialien und deren Wirkmechanismus In tierexperimentelen Studien zur Therapie des Myokardinfarktes wurde bislang eine Reihe verschiedener Biomaterialien erforscht (Tabelle 1). Diese umfassen Kollagen [3], Fibrinkleber [2], synthetische Hydrogele [5; 13], Kalzium-Hydroxyapatit [10] und Alginat [7; 11]. Alginat ist das Einzige dieser Materialien, das bereits in einer klinischen Pilotstudie zur Therapie des Myokardinfarktes eingesetzt wird (s.u.). Im Folgen- INJEKTION VON BIOMATERIALIEN NACH MYOKARDINFARKT den soll daher insbesondere auf diese Form des Biomaterials eingegangen werden. Alginat ist ein anionisches Polysaccharid, das aus einer Alge gewonnen wird. Die zur Therapie des Myokardinfarktes klinisch eingesetzte Substanz (Bioline 1040®) stellt eine Lösung aus 1% Natrium-Alginat und 0,3% Kalzium-DGlukonat dar (Abb. 2). Diese Lösung ist bei Raumtemperatur flüssig. Durch Kontakt mit Kalzium-Ionen, die im Infarktbereich in hoher Konzentration vorliegen [14], wird das Alginat vernetzt und nimmt eine gelartige Struktur an, die die Narbe stabilisiert. Nach dem Heilungsprozess nimmt die Konzentration der KalziumIonen deutlich ab, die Vernetzung des Alginats wird dadurch wieder aufgehoben. Das gelöste Alginat diffundiert in die Zirkulation und wird renal ausgeschieden. In gesundem Gewebe ist die Kalzium-Konzentration für eine Vernetzung des Alginats generell zu niedrig, so dass es nicht zur Vernetzung und gelartigen Veränderung kommt. Die Alginat-Injektion zur Stabilisierung der Infarktnarbe kann intrakoronar über das wiedereröffnete Gefäß oder intramyokardial erfolgen. Nach intrakoronarer Injektion penetriert das Alginat das Endothel im Infarktgebiet und verformt sich dort unter Einfluss der erhöhten Kalzium-Konzentration gelartig. Der Anteil des Alginats, der nicht in das Infarktgebiet, sondern über die Koronarvenen in den Lungenund Körperkreislauf gelangt, liegt weiterhin in der wasserlöslichen Form vor und wird renal ausgeschieden. Dadurch wird gewährleistet, dass keine Ablagerung des Alginats im nichtinfarzierten Myokard oder in anderen Organen stattfindet. Tierexperimentelle Studien zur Injektion von Biomaterialien nach Myokardinfarkt Alginat Die Injektion von Alginat zur Stabilisierung der Infarktnarbe wurde in mehreren tierexperimentellen Studien untersucht. Im RattenModell konnte gezeigt werden, dass nach intramyokardialer Injektion (Injektion sieben Tage nach dem akuten Infarkt) ca. 50% des Infarktgebietes von Hydrogel eingenommen wurden [7]. Das gelartige Alginat wurde innerhalb von sechs Wochen durch Bindegewebe ersetzt. Echokardiographisch konnte nach acht Wochen eine signifikante Zunahme der Dicke 19 INJEKTION VON BIOMATERIALIEN NACH MYOKARDINFARKT der Infarktnarbe nachgewiesen werden (diastolische Dicke 1,6 mm vs. 1,2 mm in der Kontrollgruppe). Der linksventikuläre enddiastolische Durchmesser war bei den mit Alginat behandelten Tieren signifikant verringert (8,6 mm vs. 10,4 mm). Außerdem zeigte sich eine geringere Abnahme der linksventrikulären Pumpfunktion bei den mit Alginat behandelten Tieren im Vergleich zur Kontrollgruppe (29%->24% vs. 27%->18%), dieser Effekt war jedoch nicht signifikant. In einer weiteren Gruppe wurde die AlginatInjektion zwei Monate nach dem akuten Infarkt vorgenommen. Hier zeigten sich eine signifikante Zunahme der Infarktdicke und eine Verringerung des sogenannten Expansions-Index (Abb. 3). Die Abnahme der linksventrikulären Funktion war in der Therapiegruppe geringer (Signifikanz grenzwertig). Der linksventrikuläre Durchmesser wurde durch die späte Alginat-Injektion jedoch nicht signifikant beeinflusst. In einer nachfolgenden Studie untersuchte dieselbe Arbeitsgruppe die intrakoronare Alginat-Injektion im Großtier-Modell (Schwein und Hund), die Ergebnisse wurden bei der Jahrestagung des American College of Cardiology im März 2009 vorgestellt. In der AlginatGruppe zeigten sich nach 30 bis 60 Tagen eine signifikant dickere Infarktnarbe, eine signifikante Verminderung der linksventrikulären systolischen und diastolischen Fläche und eine signifikant gesteigerte linksventrikuläre Ejektionsfraktion. Außerdem konnte nachgewiesen werden, dass die Mortalität in der Alginat-Gruppe im Vergleich zur Kontrollgruppe (Injektion einer Kochsalz-Lösung) signifikant reduziert war. Eine weitere Studie im Schweine-Modell verglich die Injektion eines Fibrin-AlginatGemisches mit der Injektion von KochsalzLösung [8]. Die Infarkt-Expansion war in der Fibrin-Alginat-Gruppe signifikant verringert, die Wanddicke war signifikant erhöht. Das linksventrikuläre enddiastolische Volumen und die Ejektionsfraktion waren hingegen nicht signifikant unterschiedlich. Andere Biomaterialien Neben Alginat wurden auch andere Biomaterialien erfolgreich in tierexperimentellen Studien eingesetzt, um das ventrikuläre Remodeling zu verringern. Die erste Studie dieser Art wurde 2004 veröffentlicht [2]. Durch die Injektion eines Fibrin-Klebers in infarzierte Herzen der Ratte konnte eine Abnahme der Wanddicke und der echokardiographisch gemessenen linksventrikulären Pumpfunktion, die in der Kontrollgruppe beobachtet wurde, verhindert werden. Dieses Ergebnis sollte aus unserer Sicht jedoch vorsichtig interpretiert werden, da in der genannten Studie sowohl die Wanddicke als auch die Pumpfunktion deutlich höhere Ausgangswerte in der Kontrollgruppe aufwiesen als in der Therapiegruppe. Eine 2005 publizierte Studie zur Injektion von Kollagen (95% Kollagen I, 5% Kollagen III) in infarzierte Ratten-Herzen ergab, dass die linksventrikuläre Ejektionsfraktion, die Dicke der Infarktnarbe und die Infarkt-Expansion in der Kollagen-Gruppe im Vergleich zur Kontrollgruppe signifikant verbessert waren [3]. Das linksventrikuläre enddiastolische Volumen war hingegen in der Therapiegruppe größer als in der Kontroll-Gruppe (nicht signifikant). Die Injektion eines auf Kalzium-Hydroxyapatit basierenden Biomaterials in infarzierte Schafherzen (Injektion 45 Minuten nach Infarkt) führte 15 Minuten nach Injektion zu einer Abnahme des globalen und regionalen ventrikulären Volumens im Vergleich zu den Volumina 30 Minuten nach Infarkt-Induktion [10]. Nach vier Wochen waren das linksventrikuläre endsystolische Volumen und die Ejektionsfraktion signifikant verbessert verglichen mit der Kontrollgruppe, die postmortal bestimmte Infarktdicke war signifikant erhöht. Die Effekte der synthetischen Hydrogele Dex-PCL-HEMA/PNIPAAm und alpha-CD/MPEGPCL-MPEG wurden an infarzierten KaninchenHerzen untersucht [5; 13]. Durch die Injektion konnten, verglichen mit der Kontrollgruppe, die linksventrikuläre Ejektionsfraktion gesteigert und die linksventrikuläre Dilatation verringert werden. Abbildung 3: Therapeutischer Effekt der Alginat Injektion. Postmortale morphometrische Analyse nach Alginat-Injektion in infarzierte Ratten-Herzen. Im Vergleich zur Kochsalz-Injektion erhöht die AlginatInjektion die Infarktdicke und verringert die InfarktExpansion signifikant. Modifiziert nach [7]. 20 Die bislang publizierten Studien zur Injektion von Biomaterialien nach Myokardinfarkt konnten also durchweg einen positiven Effekt auf das ventrikuläre Remodeling nachweisen. Die vorliegenden tierexperimentellen Daten belegen wissenschaftlich fundiert, dass durch die Injektion azellulärer Biomaterialien die Infarkt- INJEKTION VON BIOMATERIALIEN NACH MYOKARDINFARKT Expansion und Ventrikeldilatation verringert und die linksventrikuläre Pumpfunktion verbessert werden können. Vergleich der Injektion azellulärer Biomaterialien mit der Zelltherapie In zwei der oben genannten Studien wurde die Injektion der Biomaterialien nicht nur mit der Injektion von Kochsalz-Lösung als Kontrollgruppe verglichen, sondern auch mit einer Injektion von Zellen. Die Alginat-Injektion in Ratten-Herzen war hinsichtlich der Verminderung des Remodelings einer Injektion neonataler Kardiomyozyten nicht unterlegen, die diastolische und systolische Wanddicke war in der Alginat-Gruppe sogar signifikant höher als in der Zell-Gruppe [7]. Die Injektion von Fibrin-Kleber wurde mit einer Injektion von Myoblasten und einer kombinierten Injektion von Fibrin-Kleber plus Myoblasten verglichen [2]. In allen drei Therapiegruppen konnte eine Abnahme der linksventrikulären Pumpfunktion und der Wanddicke, die in der Kontrollgruppe beobachtet wurde, verhindert werden. Ein signifikanter Unterschied zwischen den drei Therapiegruppen wurde nicht gefunden. Erste klinische Studie zur AlginatInjektion nach Myokardinfarkt Aufgrund der vielversprechenden tierexperimentellen Daten wurde 2008 die erste klinische Phase-I-Studie (multizentrisch, nicht kontrolliert) zur Alginat-Injektion nach Myokardinfarkt begonnen (Safety and Feasibility of the Injectable BL-1040 Implant; ClinicalTrials.gov Identifikationsnummer NCT00557531). Das Studienprotokoll sieht eine intrakoronare Alginat-Injektion (Abb. 4) ein bis sieben Tage nach einem ersten, großen Myokardinfarkt vor (CK >2000 U/l, Ejektionsfraktion <45% oder mittels MRT bestimmte Infarktgröße >25%). Den primären Endpunkt bildet die Sicherheit, einschließlich Tod, Myokardinfarkt, Herzinsuffizienz, ventrikuläre Tachykardien, Hospitalisierung, Nierenversagen und Schlaganfall. Den sekundären Endpunkt bilden funktionelle Parameter, u.a. linksventrikuläre Größe und Ejektionsfraktion. Die Rekrutierungs-Phase wurde kürzlich beendet, mit fünf eingeschlossenen Patienten gehört das Herzzentrum der Uniklinik Köln zu den führenden Zentren der Studie. Eine bei der Jahrestagung des American College of Cardiology präsentierte Zwischenanalyse ergab, dass die Alginat-Injektion sicher ist. Nebenwirkungen oder Komplikationen der Injektion wurden bislang nicht beobachtet. 90 Tage nach Injektion war die linksventrikuläre Ejektionsfraktion leicht erhöht im Vergleich zum Ausgangswert. Die systolischen und diastolischen Volumina waren, ebenso wie das NTproBNP als laborchemischer Herzinsuffi- zienz-Marker, vermindert. Während die beobachteten funktionellen Verbesserungen sicher nur sehr eingeschränkt aussagefähig sind, bestätigt sich zunehmend die Sicherheit der klinischen Alginatapplikation. Unsere Erfahrungen in Köln zeigen darüber hinaus, dass die Applikation der Substanz sehr einfach und schnell über einen intrakoronaren Katheter durchführbar ist. Bisher nicht beobachtete, aber nicht auszuschließende Nebenwirkungen sind allerdings beispielsweise Herzrhythmusstörungen durch die Bindung von Kalzium oder eine gelartige Verformung des Alginats außerhalb des Infarktes, v.a. in Bereichen erhöhter Kalzium-Konzentration. Ein erhöhtes Risiko für eine solche Verformung außerhalb des Infarktes könnte zum Beispiel bei Patienten mit Hyperkalzämie, kalziumhaltigen Nierensteinen oder kalziumhaltigen Gefäß-Plaques bestehen, woraus sich gegebenenfalls eine Kontraindikation für die Alginat-Injektion ergeben könnte. Bei der zurzeit durchgeführten klinischen Studie gibt es diesbezüglich keine Ausschlusskriterien. Fazit für die Praxis Die tierexperimentellen Daten zur Injektion von Biomaterialien nach Myokardinfarkt zeigen überzeugend, dass dieser neue Therapieansatz eine Verbesserung des ventrikulären Remodelings und der linksventrikulären Pumpfunktion bewirken kann. Mit dem Beginn der Phase-I-Studie zur Alginat-Injektion nach Abbildung 4.: lginat-Injektion über einen intrakoronaren Applikationskatheter. A: Koronarangiogramm eines Patienten mit akutem Vorderwandinfarkt bei einem Abbruch (Pfeil) des proximalen Ramus interventricularis anterior (RIVA). B: Koronarangiogramm nach Rekanalisierung des RIVA mittels Angioplastie und Stentimplantation. C: Positionierung des Applikationskatheters (roter Pfeil) distal des Stents über einen Führungsdraht (weißer Pfeil). D: Koronarangiogramm nach Alginat-Injektion. Der Fluss im RIVA ist nicht eingeschränkt (TIMI III). 21 INJEKTION VON BIOMATERIALIEN NACH MYOKARDINFARKT einem akuten Myokardinfarkt ist ein erster Schritt in Richtung eines klinischen Einsatzes erfolgt. An der Sicherheit der Alginat-Injektion haben sich bislang keine Zweifel ergeben, der therapeutische Effekt muss jedoch in weiteren klinischen Studien untersucht werden, bevor ein routinemäßiger Einsatz in Erwägung gezogen werden kann. Sollten zukünftige Phase-IIund Phase-III-Studien die vielversprechenden tierexperimentellen Daten bestätigen, ist mit einer Zulassung in fünf bis zehn Jahren zu rechnen. Korrespondierender Autor Priv.-Doz. Dr. med. Jochen Müller-Ehmsen Klinik III für Innere Medizin Uniklinik Köln Kerpener Straße 62 50937 Köln E-Mail: [email protected] Interessenkonflikt Die Autoren nehmen als Investigatoren an der klinischen Phase-I-Studie zur Exploration von Bioline 1040® bei Patienten mit Myokardinfarkt teil. Zusammenfassung Die Injektion von Biomaterialien nach Myokardinfarkt stellt ein neues Therapiekonzept dar, bei dem durch das Einbringen einer artifiziellen Matrix eine Verbesserung des ventrikulären Remodelings erzielt werden soll. Mehrere tierexperimentelle Studien ergaben, dass Infarkt-Expansion und Ventrikeldilatation im Vergleich zu einer Kontrollgruppe verringert und die Pumpfunktion durch die Injektion von Biomaterialien verbessert werden können. Basierend auf umfangreichen tierexperimentellen Daten wurde 2008 die erste klinische PhaseI-Studie zur Injektion eines Biomaterials begonnen. Bei dieser Studie wird Alginat verwendet, das in flüssigem Zustand intrakoronar injiziert und durch die erhöhte Kalzium-Konzentration im Infarktgebiet in einen gelförmigen Zustand überführt wird. Bislang konnten keine Nebenwirkungen beobachtet werden. Vor einem Einsatz in der klinischen Routine muss der therapeutische Effekt der Alginat-Injektion jedoch in kontrollierten klinischen Studien nachgewiesen werden. Sollten sich die vielversprechenden tierexperimentellen Daten in der Klinik bestätigen, könnte sich die Alginat-Injektion zu einer wichtigen Therapieoption für Patienten mit akutem Myokardinfarkt entwickeln. 22 Referenzen 1. Cantry JMJr (2008) Atherosclerotic Cardiovascular Disease. In: Libby P, Bonow RO, Mann DL, Zipes DP and Braunwald E (eds) Braunwald's Heart Disease - A Textbook of Cardiovascular Medicine, pp 1167-1560. Saunders Elsevier, Philadelphia. 2. Christman KL, Fok HH, Sievers RE, Fang Q and Lee RJ (2004) Fibrin glue alone and skeletal myoblasts in a fibrin scaffold preserve cardiac function after myocardial infarction. Tissue Eng 10: 403-409. 3. Dai W, Wold LE, Dow JS and Kloner RA (2005) Thickening of the infarcted wall by collagen injection improves left ventricular function in rats: a novel approach to preserve cardiac function after myocardial infarction. J Am Coll Cardiol 46: 714-719. 4. Fehrer C and Lepperdinger G (2005) Mesenchymal stem cell aging. Exp Gerontol 40: 926-930. 5. Jiang XJ, Wang T, Li XY, Wu DQ, Zheng ZB, Zhang JF, Chen JL, Peng B, Jiang H, Huang C and Zhang XZ (2008) Injection of a novel synthetic hydrogel preserves left ventricle function after myocardial infarction. J Biomed Mater Res A. 6. Jugdutt BI (2003) Ventricular remodeling after infarction and the extracellular collagen matrix: when is enough enough? Circulation 108: 1395-1403. 7. Landa N, Miller L, Feinberg MS, Holbova R, Shachar M, Freeman I, Cohen S and Leor J (2008) Effect of injectable alginate implant on cardiac remodeling and function after recent and old infarcts in rat. Circulation 117: 1388-1396. 8. Mukherjee R, Zavadzkas JA, Saunders SM, McLean JE, Jeffords LB, Beck C, Stroud RE, Leone AM, Koval CN, Rivers WT, Basu S, Sheehy A, Michal G and Spinale FG (2008) Targeted myocardial microinjections of a biocomposite material reduces infarct expansion in pigs. Ann Thorac Surg 86: 1268-1276. 9. Muller-Ehmsen J, Peterson KL, Kedes L, Whittaker P, Dow JS, Long TI, Laird PW and Kloner RA (2002) Rebuilding a damaged heart: long-term survival of transplanted neonatal rat cardiomyocytes after myocardial infarction and effect on cardiac function. Circulation 105: 1720-1726. 10. Ryan LP, Matsuzaki K, Noma M, Jackson BM, Eperjesi TJ, Plappert TJ, John-Sutton MG, Gorman JH, III and Gorman RC (2009) Dermal filler injection: a novel approach for limiting infarct expansion. Ann Thorac Surg 87: 148-155. 11. Tsur-Gang O, Ruvinov E, Landa N, Holbova R, Feinberg MS, Leor J and Cohen S (2009) The effects of peptidebased modification of alginate on left ventricular remodeling and function after myocardial infarction. Biomaterials 30: 189-195. 12. Vandervelde S, van Luyn MJ, Tio RA and Harmsen MC (2005) Signaling factors in stem cell-mediated repair of infarcted myocardium. J Mol Cell Cardiol 39: 363-376. 13. Wang T, Wu DQ, Jiang XJ, Zhang XZ, Li XY, Zhang JF, Zheng ZB, Zhuo R, Jiang H and Huang C (2009) Novel thermosensitive hydrogel injection inhibits postinfarct ventricle remodelling. Eur J Heart Fail 11: 14-19. 14. Yunice AA, Baxter DJ, Kraikitpanitch S and Lindeman RD (1974) Myocardial calcium in experimental myocardial infarction. Cardiology 59: 367-375. CHIRURGIE DER ATRIOVENTRIKULARKLAPPEN IM ERWACHSENENALTER Chirurgie der Atrioventrikularklappen im Erwachsenenalter „Minimalinvasive Rekonstruktion von Mitralund Trikuspidalklappe“ – – – – – – – PD Dr. med. Jens Wippermann, Dr. med. Parwis Rahmanian, Dr. med. Navid Madershahian, Dr. med. Schariah Salehi-Gelani, Univ.- Prof. Dr. med. Thorsten Wahlers Herz-Thoraxchirurgie, Herzzentrum, Uniklinik Köln Die Mitralklappe Die Mitralklappenstenose ist weltweit eine der häufigsten erworbenen Herzklappenfehler und betrifft Frauen häufiger als Männer. In den Industrieländern konnte die Inzidenz durch den konsequenten Einsatz von Penicillin bei Infektionen mit Streptokokken in der Vergangenheit deutlich abgesenkt werden, so dass sie dort heutzutage seltener auftritt als erworbene Aortenklappenstenosen und Mitralklappeninsuffizienzen. Die mit Abstand häufigste Ursache einer Mitralstenose ist das rheumatische Fieber und die damit verbundene Endokarditis. Sie tritt typischerweise mit einer Latenzzeit von 20 bis 30 Jahren nach der durchgemachten Fiebererkrankung auf. Die Stenose der Mitralklappe ist durch entzündliche und degenerative Veränderungen der Klappensegel und der Chordae tendineae bedingt. Fibrosen und Verkalkungen führen zu einer fortschreitenden Einschränkung der Dehnungs- und Bewegungsfähigkeit des Klappenapparates. Die normale Klappenöffnungsfläche liegt bei 4-6 cm2. Verkleinert sich diese Öffnungsfläche um mehr als die Hälfte, kommt es zu Störungen mit der Ausbildung eines Druckgradienten zwischen linkem Vorhof und der linken Kammer. Daraus resultieren zum einen eine Dilatation des linken Vorhofs, was das Auftreten von Vorhofflimmern begünstigt, und zum anderen eine pulmonale Hypertonie. Diese wiederum führt bei fortschreitender Erkrankung zu einer Druckbelastung des rechten Herzen und infolge einer Rechtsherzdilatation auch zu einer Trikuspidal- und Rechtsherzinsuffizienz. Ein Leitsymptom ist die Dyspnoe bedingt durch den Rückstau von Blut in die Lungen. Die Dyspnoe tritt meist erst bei Belastung auf, wenn das Herzminutenvolumen gesteigert wird. Bei hochgradigen Stenosen kann auch eine Ruhedyspnoe auftreten. Ein weiteres Symptom schwergradiger Mitralstenosen können Hämoptysen sein, die insbesondere nachts bei intensiver Dyspnoe auftreten. Generell ist die körperliche Leistungsfähigkeit betroffener Patienten vermindert. Die Behandlung der Mitralklappenstenose hängt vom Schweregrad dieser ab. Bei leichter Mitralstenose kann eine konservative Therapie durch körperliche Schonung und die Gabe von Diuretika erfolgen. Liegt zusätzlich ein relevanter pulmonaler Hypertonus vor, kann eine Therapie mit Vasodilatantien hilfreich sein. Eine operative Therapie ist in jedem Fall bei starker Symptomatik und einer hochgradigen Mitralstenose sinnvoll. Eine Intervention sollte nicht zu lange hinausgezögert werden, da die Prognose einer Mitralstenose sonst auch nach operativer Therapie verschlechtert wird. Die Mitralklappeninsuffizienz ist beim Menschen ein häufiger Herzklappenfehler. Es handelt sich um eine „Undichtigkeit“ der Mitralklappe des Herzens, die während der Systole zu einem Rückfluss von Blut aus der linken Herzkammer in den linken Vorhof führt. Im Vordergrund stehen heute die Mitralinsuffizienz bei Prolapssyndrom im Zusammenhang mit einem meist angeborenen Mitralklappenprolaps (Abb.1) und die relative Mitralinsuffizienz als Folge einer Vergrößerung des linken Ventrikels, sowie die „postinfarzielle“ Mitralinsuffizienz nach Herzinfarkt. Weiterhin können eine bakterielle und auch eine nicht-bakterielle Endokarditis zu einer Zerstörung oder narbigen Schrumpfung von Klappengewebe und so zu einer Mitralinsuffizienz führen. Abbildung1a: Echokardiografie der Mitralklappe. Die Insuffizienz ist durch einen Prolaps im p2 Segment des posterioren Mitralklappensegels (3). Abbildung 1b: Farbduplex im Echo zeigt einen Regurgitationsjet der einer schweren Mitralklappeninsuffizienz entspricht. 23 CHIRURGIE DER ATRIOVENTRIKULARKLAPPEN IM ERWACHSENENALTER Die akute schwere Mitralinsuffizienz als Komplikation eines Herzinfarktes oder einer Herzklappenentzündung ist ein seltenes, meist aber dramatisches Krankheitsbild, welches einer intensivmedizinischen Behandlung bedarf und häufig nur durch eine notfallmäßige Klappenoperation beherrschbar ist. Die Prävalenz liegt bei ca. 2,4%[1]. Bei allen Patienten mit einer schweren Mitralinsuffizienz (III°) und einem vergrößerten linken Vorhof (LA > 45mm) ist die Indikation für eine Herzklappenoperation indiziert [2]. Dabei sollte bei unauffälliger Klappenmorphologie immer eine Rekonstruktion der Klappe angestrebt werden bevor die Herzklappe durch eine Neue eingesetzt wird. Die Chancen für eine Klappenrekonstruktion lassen sich mit Hilfe der Echokardiografie bereits vorher zuverlässig abschätzen, in Einzelfällen wird die Notwendigkeit einer künstlichen Klappe erst während der Operation deutlich. Postoperativ sind Patienten mit einer rekonstruierten Klappe in der Regel nach einigen Wochen als „herzgesund“ zu betrachten. Seit einigen Jahren liegt der Schwerpunkt der Mitralklappenchirurgie in der erfolgreichen Rekonstruktion dieser Klappe [3], während in den vergangenen Jahrzehnten der Ersatz der Mitralklappe, den größten Anteil an den Mitralklappen-Operationen ausmachte. Die Vorteile der Mitralklappenrekonstruktion liegen in der Erhaltung der Geometrie der linken Herzkammer mit deutlich besseren funktionellen Ergebnissen sowie in der geringen Neigung der rekonstruierten Klappe zur Blutgerinnselbildung, welches eine langfristige Behandlung mit Marcumar überflüssig macht. Die sog. „mediane Sternotomie“ stellt den Hauptzugangsweg bei herzchirurgischen Eingriffen dar. Dabei wird das Brustbein entlang der langen Achse in der Mitte komplett durchtrennt. Dies ermöglicht den Zugang zu allen wichtigen Strukturen des Herzens. Die minimalinvasive Operation an der Mitralklappe erfolgt über einen 5 cm langen Schnitt unterhalb der rechten Brustwarze (Abb.2) Abbildung 2: Zugang zur minimalinvasiven Mitral-/ Trikuspidalklappenoperation In Kombination mit einer Videokamera bietet dieses Verfahren speziell im Rahmen der Mitralklappenrekonstruktion eine ideale Sicht auf das OP-Feld und entsprechend optimale Bedingungen. Auch dieser Eingriff erfolgt mit Hilfe der Herz-Lungen-Maschine. Heutzutage kann unter Einbeziehung verschiedener Techniken und in Abhängigkeit des Klappenschadens sowie der Gewebequalität die Mitralklappe zu einem sehr hohen Prozentsatz (75%) repariert werden. Ein Durchschlagen von Teilen des vorderen bzw. hinteren Mitralsegels mit daraus resultierender Insuffizienz wird in unserer Klinik durch Einziehen künstlicher Sehnenfäden aus Gore-Tex®-Material repariert [4]. Als wesentliche zusätzliche Maßnahme wird routinemäßig ein Kunststoffring (Anuloplastie-Ring) eingesetzt, der die eigentliche Klappe umgibt und der den Klappenring vom Umfang her reduziert (Abb.3). Diese Maßnahme trägt zur Langzeit-Stabilisierung des Rekonstruktions-Ergebnisses wesentlich bei. Der Anuloplastie-Ring erfordert eine vorübergehende dreimonatige Marcumartherapie, bis der Ring eingewachsen ist und kein Embolierisiko mehr darstellt. Aufgrund der durchgeführten Minithorakotomie ist der Patient gut mobilisierbar und oftmals kann der stationäre Aufenthalt nach 7-10 Tagen beendet werden. Die Trikuspidalklappe Die Trikuspidalklappeninsuffizienz bezeichnet eine Undichtigkeit der Trikuspidalklappe des Herzens, die während der Systole zu einem Rückfluss von Blut aus der rechten Herzkammer in den rechten Vorhof führt. Meist ist die Trikuspidalinsuffizienz Folge einer Überdehnung des Halteringes der Trikuspidalklappe oder eines zu hohen Drucks in der rechten Herzkammer, die Klappe selbst ist meist noch ausreichend funktionstüchtig. Die Trikuspidalklappe funktioniert wie ein Ventil zwischen dem rechten Vorhof und dem rechten Ventrikel des Herzens. Eine bakterielle und auch eine nicht-bakterielle Endokarditis können zu einer Zerstörung oder narbigen Schrumpfung von Klappengewebe und so zu einer Trikuspidalinsuffizienz führen. Ein Sonderfall ist das Auftreten einer geringen Trikuspidalinsuffizienz nach Einführung einer Elektrode in den Rechten Ventrikel im Rahmen einer Herzschrittmacherimplantation. Leichtere Formen werden vom Betroffenen nicht bemerkt. Die typischen Symptome der schweren Trikuspidalinsuffizienz sind Beinödeme, Leber- und Halsvenenstauung. Herzrhythmusstörungen, die bei der Trikuspidalinsuffizienz häufiger auftreten, können sich in Form von Herzstolpern oder Herzrasen bemerkbar machen. Daneben können eine Halsvenenstauung und Ödeme festgestellt werden. Nicht selten tastet man eine vergrößerte Leber und teilweise auch einen Aszites. 25 CHIRURGIE DER ATRIOVENTRIKULARKLAPPEN IM ERWACHSENENALTER Eine operative Therapie der Trikuspidalinsuffizienz muss isoliert selten durchgeführt werden, ist aber in Kombination mit einer Mitralklappenoperation häufig [5]. Dabei kann in den meisten Fällen eine Rekonstruktion der Klappe vorgenommen werden. Die Operation wird minimalinvasiv durch einen kleinen Schnitt rechts im 4. oder 5. Zwischenrippenraum durchgeführt (Abb.4). Referenzen: 1. Hayek E, Gring CN, Griffin BP. Mitral valve prolapse. Lancet 2005; 365(9458):507-518. 2. Enriquez-Sarano M. Timing of mitral valve surgery. Heart 2002; 87(1):79-85 3. Carpentier A. Cardiac valve surgery--the "French correction". J Thorac Cardiovasc Surg 1983; 86(3): 323-337. 4. Adams DH, Kadner A, Chen RH. Artificial mitral valve chordae replacement made simple. Ann Thorac Surg 2001; 71(4):1377-1378; discussion 1378-1379. 5. Carpentier A, Deloche A, Dauptain J, Soyer R, Blondeau P, Piwnica A, Dubost C, McGoon DC. A new reconstructive operation for correction of mitral and tricuspid insufficiency. J Thorac Cardiovasc Surg 1971; 61(1):1-13. Abbildung 3: Mitralklappenisuffizienz verursacht durch einen massiven Prolaps des posterioren Segels im mittleren Segment (p2): Rekonstruktion der Klappe mit Implantation einer Neochordae (GoreTex) und anschließender Anuloplastik (geschlossener Ring) 26 Abbildung 4: Implantation eines geöffneten Anuloplastyrings zur Rekonstruktion einer insuffizienten Trikuspidalklappe ANGEBORENE PULMONALKLAPPENERKRANKUNGEN Angeborene Pulmonalklappenerkrankungen – M. Emmel, N. Sreeram, M. Khalil, K. Brockmeier – Klinik und Poliklinik für Kinderkardiologie, – Herzzentrum der Universität zu Köln Pulmonalklappenstenosen zeigen eine Inzidenz von bis zu 15% bei Neugeborenen mit angeborenen Herzfehlern in isolierter Form oder in Kombination mit weiteren Problemen bei komplexen Vitien z. B. der Fallot'schen Tetralogie. Trotz der sehr guten Ergebnisse der herzkathetergestützten interventionellen Behandlung sind bei schweren Klappendysplasien herzchirurgische Maßnahmen unumgänglich. Patienten mit Fallot`sche Tetralogie werden obligat operiert. Eines der hämodynamisch bedeutensten Residualprobleme nach herzchirurgischer Behandlung von Patienten mit Fallot`scher Tetralogie oder auch isolierter Pulmonalstenose ist die Pulmonalklappeninsuffizienz, die in variabler Ausprägung bei notwendiger Erweiterung des Klappenrings gesehen wird. Symptomatische, aber auch asymptomatische Patienten mit einer signifikanten rechtsventrikulären Dilatation aufgrund von Pulmonalklappeninsuffizienz profitieren von einem Pulmonalklappenersatz zur Vermeidung der irreversiblen Rechtsherzinsuffizienz. Dieser Pulmonalklappenersatz wird fast ausnahmslos unter Zuhilfenahme von Allografts vorgenommen (zur Vermeidung der Antikoagulantienbehandlung). Die Indikation zur Operation ist gegeben bevor der rechte Ventrikel irreversibel durch die anhaltende Volumenbelastung geschädigt wird. Allerdings muss der Vorteil des Klappenersatzes gegenüber dem über die Zeit unvermeidlich eintretenden Funktionsverlust der Allograftklappe abgewogen werden. Diese Allograftveränderungen bedingen repetitive Reoperationen bei Kindern, Jugendlichen und Erwachsenen unter Einsatz der HerzLungenmaschine. Die Verläufe bis zur Reoperation nach Allograftimplantation sind variabel und werden für das Erwachsenenalter üblicherweise mit 10-20 Jahren angegeben. Die Patienten erwartet somit eine Serie von Reoperationen mit Herz-Lungen-Maschine alle 10-20 Jahre – in Einzelfällen auch öfter (durchschnittlich alle fünf Jahre in der Arbeit von Twedell et al. Circulation 2000). Im Kindesalter kommt zur unvermeidbaren Allograftdegeneration das Auswachsen infolge des Körperwachstums. Das repetitive chirurgische Vorgehen und noch nicht gelöste Probleme der langfristig befriedigenden Klappenfunktion haben die minimal invasive Pulmonalklappenimplantation über die Femoralvene zu einer attraktiven Alternative gemacht. Auch günstigste Operationsvoraussetzungen bei der Primäroperation erfordern einen Kompromiss aus Vermeidung eines inakzeptablen Restgradienten über Klappe und rechtsventrikulären Ausflusstrakt einerseits und zu ausgeprägter Klappeninsuffizienz mit konsekutiver Volumenbelastung für den rechten Ventrikel und langfristig drohendem Rechtsherzversagen andererseits. Die Volumenbelastung des rechten Ventrikels geht über Jahre mit nur geringer subjektiver Beeinträchtigung einher, bedingt jedoch langfristig eine erhebliche Morbidität mit zunehmender Einschränkung der Leistungsfähigkeit, ventrikulären Herzrhythmusstörungen und Gefahr eines plötzlichen Herztodes für diese Patientengruppe. Strategie der letzten Dekade war daher in der Kinderherzchirurgie und Herzchirurgie für angeborene Herzfehler eine möglichst geringe Pulmonalklappenregurgitation zu akzeptieren - anders als in den 1990-ger Jahren, als eher Reststenosen gefürchtet waren, die kurzfristig im unmittelbar postoperativen Verlauf weniger gut toleriert wurden. Die progressive rechtsventrikuläre Dilatation führt langfristig zu Rechtsherzversagen. Je größer die rechtsventrikuläre Dilatation desto bedeutsamer ist die QRS-Verbreiterung im Ruhe-EKG. Eine QRS-Dauer von 180 ms und mehr wird als ein bedeutender Risikofaktor für ventrikuläre Tachykardien und plötzlichem Herztod nach Fallot-Korrekturoperation angesehen. Um eine rechtsventrikuläre Dilatation und Funktionsstörung zu vermeiden, gilt es rechtzeitig einen Pulmonalklappenersatz zu erwägen. Überwiegende Einstellung seitens der behandelnden Kardiologen ist, das Allograft bis zur fast vollständigen Dysfunktion unoperiert zu belassen. Indikationen für den Pulmonalklappenersatz: • klinisch symptomatische Patienten mit lange nachgewiesener Pulmonalinsuffizienz und rechtsventrikulärer Dilatation • Asymptomatische Patienten mit schwerer Pulmonalinsuffizienz und zunehmender rechtsventrikulärer Dilatation und Dysfunktion • Asymptomatische oder symptomatische Patienten mit mäßiger bis schwerer Pulmonalinsuffizienz und hämodynamisch bedeutsamen assoziierten Problemen, welche chirurgisch zu behandeln sind • Patienten mit schweren ventrikulären Herzrhythmusstörungen bei bedeutsamer Pulmonalinsuffizienz und rechtsventrikulärer Dilatation. Bezüglich des Zeitpunktes des Klappenersatzes gibt es eine Reihe von z. T. kontroverser Stellungnahmen. Die inzwischen überwiegend akzeptierte Arbeit kommt von einer Amsterdamer Gruppe in den Niederlanden. In der Arbeit von Oosterhof und Mitarbeitern (Circulation 2007) konnte gezeigt werden, dass bis zu einem im MRT quantifizierten enddiastolischen 27 ANGEBORENE PULMONALKLAPPENERKRANKUNGEN rechtsventrikulären Volumen von 160 ml/m2 mit einer Normalisierung der Ventrikelgröße nach Klappenersatz zu rechnen ist. Bonhoeffer und Mitarbeiter berichteten als erste über Erfahrungen mit von der Leiste aus perkutan implantierbaren, auf Stents montierten Klappen (Lancet 2000). Diese Pulmonalklappe besteht aus einer bovinen Jugularvenenklappe, welche in einen PlatinIridium Stent eingearbeitet ist, heute vertrieben als Melody-Valve“ (Fa. Medtronic). Seit dem erfolgreichen Einsatz dieser Klappe weltweit an über 500 Patienten nimmt die Bereitschaft zu, weniger lange die Allograftdegeneration zu tolerieren und frühzeitiger zu behandeln, wenn die rechtsseitige Ventrikelbelastung zunimmt. Bei der Implantation in Zentren mit entsprechender Spezialisierung, wie im Herzzentrum der Kölner Universität, wird in Allgemeinanästhesie nach venösem Zugang in der Leiste mit einer 22 Fr. Schleuse die Pulmonalarterie mittels Endlochkatheter sondiert und mittels Kontrastmittel visualisiert. Über einen extrasteifen Führungsdraht kann dann die auf einem Spezialballon liegende Melody-Klappe in die gewünschte Position vorgeschoben werden und durch Balloninflation fixiert werden (Abb. 1). Der Implantation geht obligat eine Magnetresonanzangiographie voraus (bei MRT kontraindikation eine CT-Angiographie), um den rechtsventrikulären Ausflusstrakt einschließlich Klappe und proximaler Pulmonalarterie mit Länge, engstem und weitesten Diameter exakt vermessen zu können. Aneurysmen des rechtsventrikulären Ausflusstraktes und/oder Erweiterungen im beschriebenen Bereich um den Klappenring von über 20 - 21 mm Durchmesser sind nicht für diesen interventionellen Ansatz geeignet, weil die maximale Melody-Klappengröße 22 mm beträgt und anderenfalls keine stabile Lage garantiert werden kann. Des Weiteren wird zur Stabilisierung und zum Verhindern von Stentfrakturen die Region mittels eines Wallstents vorbehandelt: letztlich resultiert daraus ein Bett für eine stabile Klappenposition und -funktion. Weitere minimal-invasiv implantierbare Systeme für den Pulmonalklappenersatz sind auf dem Vormarsch (Schreiber et al. Eur. J. Cardiothor. Surg. 2002; Marianeschi et al. Ann. Thorac. Surg. 2008); Huber et al. J. Thoracic. Cardiovasc. Surg. 2009) Die Ergebnisse der ersten Follow-up Studie an 59 Patienten zeigte einen signifikanten Rückgang des Pulmonalklappenregurgitationsvolumens von initial im Mittel 21 % auf später 3 % bei ebenfalls signifikantem Rückgang der rechtsventrikulären endiastolischen Volumina. Die bisherigen Ergebnisse sind in der Mehrzahl in einem etwa fünfjährigen Follow-up mit nur relativ geringen Komplikationsraten bedeutender Art, unter anderem: Instabilität (4%), Homograftruptur (<1%), Kompression einer Koronararterie (<1%), RPA Obstruktion (<1%) und LPA Ruptur (<1%). Weltweit wurden insgesamt sieben prozedurbedingte Todesfälle beschrieben. Hauptprobleme stellen nach Überwinden der learning-curve der sog. Hammock Effekt – Stentstenose durch Eindringen von Blut zwischen den klappentragenden Stent und dem originären Ausflusstrakt – und Stentfrakturen dar. Limitationen für den perkutanen Pulmonalklappenersatz: • Weiter aneurysmatischer rechtsventrikulärer Ausflusstrakt • (kalzifizierte) Allograftprothese – keine nativ korrigierten Patienten • derzeit nicht unerhebliche Kosten Diese vielversprechende minimal-invasive Technik könnte langfristig Vorteile für Patienten mit rechtsventrikulären Problemen nach Allograftimplantation haben, weil die Reoperationsraten reduziert werden könnten und damit die Lebensqualität verbessert wird. Bei großen rechtsventrikulären Aneurysmen und stark dilatiertem Klappenring ist weiterhin der herzchirurgische Ansatz konkurrenzlos, ebenso wie bei relevanten assoziierten operationsbedürftigen Problemen wie residuelle Ventrikelseptumdefekte und/oder schwere Tricuspidalklappeninsuffizienzen. Literatur: Murphy JG et al. Long-term outcome in patients undergoing surgical repair of tetralogy of Fallot. N. Engl. J. Med. 1993 Gatzoulis MA et al. Risk factors for arrhythmia and sudden cardiac death late after repair of tetralogy of Fallot: a multicentre study. Lancet 2000 Abbildung 1: Röntgenologische Darstellung mit lateraler Projektion eines Patienten mit Homograft-klappenstenose und -insuffizienz. Im linken Bild (A) ist bereits ein Palmaz-Stent® über die defekte Klappe in typischer Position montiert. Im Lumen des Stents kommt die noch nicht geöffnete Melody-Klappe®, auf einem extra starken Führungsdraht geschient, zur Darstellung. Im rechten Bild (B) wird angiographisch der rechtsventrikuläre Ausflusstrakt mit der Melody-Klappe® in idealer Position visualisiert: der Diameter auf Klappenebene beträgt 22 mm. 28 Khabadkone S et al. Percutaneous pulmonary valve implantation in humans: results in 59 consecutive patients. Circulation 2005 Oosterhof T et al. Long-term follow-up of homograft function after pulmonary valve replacement in patients with tetralogy of Fallot. Eur. Heart J. 2006 Frigiola A et al. Percutaneous pulmonary valve replacement. Coron. Artery Dis. 2009 NEUER HOCHLEISTUNGS-COMPUTERTOMOGRAPH IM HERZZENTRUM Neuer Hochleistungs-Computertomograph im Herzzentrum – Carsten Zobel, Henning Bovenschulte Im Herzzentrum der Uniklinik Köln wird ab Januar 2010 gemeinsam von Kardiologen und Radiologen ein neuer, speziell für die Herz- und Gefäßbildgebung geeigneter Computertomograph in Betrieb genommen. Der in diesem Jahr neu auf den Markt gekommene „SOMATOM Definition Flash“ der Firma SIEMENS (Abb. 1) ist ein sogenanntes Dual-Source-CT der neuesten Generation und zeichnet sich durch eine besonders niedrige Strahlenexposition bei gleichzeitig verbesserter Bildqualität aus. Das Gerät wird innerhalb des Herzzentrums vom Radiologie-Zentrum-Köln (RZK) speziell zur kardialen Bildgebung betrieben. Damit erfüllt die Universität die Auflagen des Wissenschaftsrates, der bei der Begutachtung des Herzzentrums die Etablierung bildgebender Verfahren gefordert hatte. Die Aufstellung im Herzzentrum wird eine enge Kooperation zwischen den Zuweisern und den Untersuchern sowie ein verbessertes Behandlungskonzept kardiologischer Patienten erlauben. Durch die simultane Verwendung von zwei statt wie üblich nur einer einzelnen um den Patienten kreisenden Röntgen-Detektor-Einheit erlaubt das Gerät eine extrem schnelle CT-Koronarangiographie. In nur 250 ms, also rund einem Viertel der Zeit eines einzelnen Herzschlages, kann das Gerät mit seinen 2x128 Detektoren das gesamte Herz scannen und die Koronararterien in hoher Qualität abbilden (Abb. 2). Aufgrund der extrem kurzen Unter- CT-Koronarangiographie Definition Flash mit 0,91 mSv (Quelle: Lell et al., Eur Radiol 2009) suchungszeit reduziert sich die notwendige Strahlenexposition um ein Vielfaches. Erste Studien zeigen bei normalgewichtigen Patienten mit Sinusrhythmus eine mittlere Strahlenexposition von ca. 0,9 mSv und somit 10-20 mal weniger als bei herkömmlichen helikalen CTKoronarangiographien an etablierten 64-ZeilenCTs1;2 Neben der reinen Koronarangiographie bietet das Gerät auch die Möglichkeit, linksventrikuläre Funktionsuntersuchungen oder auch quantitative Bestimmungen der koronararteriellen Kalklast durchzuführen. Auch koronararterielle Flussmessungen zur näheren Bestimmung der hämodynamischen Relevanz von Stenosen sind möglich. Der gesamte Thorax einschließlich der Darstellung der Gefäße lässt sich mit dem CT zudem in weniger als einer Sekunde untersuchen, dadurch entfällt für die teils schwer kranken Patienten die Notwendigkeit, über mehrere Sekunden die Luft anzuhalten. Durch die Verwendung der gleichzeitig implementierten sog. „Dual-Energy-Technik“ eignet sich das Gerät zudem insbesondere zur Darstellung der arteriellen Strombahn, wie der extraund intrakraniellen Gefäße sowie der Aorta und der Becken-Bein-Gefäße. Durch die DualEnergy-Technik können z. B. in der Beurteilung womöglich störende Kalkplaques einfach und sicher durch besondere Auswerteverfahren entfernt und somit z. B. die Stenosegradbeurteilung verbessert werden. Indikationen der CT-Koronarangiograpie Abbildung 1: Siemens Somatom Definition Flash (Quelle: Siemens) Vom American College of Cardiology (2006) exisitieren Empfehlungen über die Indikationen, bei denen eine CT-Koronarangiograpie sinnvoll ist („Appropriateness Criteria“)3. Es werden hier folgende Konstellationen beschrieben: 29 NEUER HOCHLEISTUNGS-COMPUTERTOMOGRAPH IM HERZZENTRUM • Symptomatische Patienten mit nicht eindeutigen Belastungsuntersuchungen • Symptomatische Patienten mit mittlerer Vortestwahrscheinlichkeit und unklaren EKG-Befunden oder Unfähigkeit für Belastungstests • Patienten mit akutem Thoraxschmerz ohne EKG-Veränderungen und wiederholt negativen Herzenzymen • Darstellung der Koronarien bei Patienten mit neu aufgetretener Herzinsuffizienz zur Klärung der Ätiologie Die Leitlinien der Europäischen Gesellschaft für Kardiologie zur Behandlung der stabilen Angina pectoris empfehlen die CT-Koronarangiographie bei Patienten mit einer niedrigen Vortestwahrscheinlichkeit und nicht eindeutigen Ergebnissen eines Belastungs-EKG oder eines bildgebenden Belastungstests (Empfehlungs Klasse IIb, Evidenzlevel C)4. In einer neueren wissenschaftlichen Stellungnahme (2008) sieht die American Heart Association den größten potentielle Nutzen der CT-Koronarangiographie für symptomatische Patienten mit einem mittleren Risiko für eine koronare Herzerkrankung, eingeschlossen auch Patienten mit nicht eindeutigen Belastungstests (Empfehlungsklasse IIa, Evidenzlevel B)5. Diagnostische Genauigkeit der CT-Koronarangiographie In einer Metaanalyse die 9 Publikationen mit insgesamt 566 untersuchten Patienten aus den Jahren 2005-2006 berücksichtigt, in denen 64-Zeilen-Geräte verwendet wurden, zeigte sich eine mittlere Sensitivität von 96% und eine Spezifität von 91%. Der positive prädiktive Wert betrug 93%, der negative prädiktive Wert 96%6. In einer aktuelleren Übersicht aus dem Jahre 2008 wurden 28 Untersuchungen (64-ZeilenGeräte) mit insgesamt 1286 Patienten eingeschlossen. Die mittlere Sensitivität war hier mit 99% nochmals besser, bei einer Spezifität von 89%. Der positive prädiktive Wert betrug 93%, der negative prädiktive Wert sogar 100%7. Limitationen der CT-Koronarangiographie Das Vorliegen von erheblichen Kalkablagerungen in den Koronarien beeinträchtigt die diagnostische Genauigkeit der Untersuchungsmethode, dies kann zu falsch negativen und häufiger zu falsch positiven Befunden führen. Ebenfalls ist die Einschätzung des Koronarlumens in Bereich implantierter Stents deutlich erschwert. Bei Patienten mit sehr schneller Ruheherzfrequenz und Kontraindikationen gegen Betablocker oder besonders bei Tachyarrhythmien kann es zu einer Einschränkung der Bildqualität kommen. Allerdings ist die Geräteklasse der Dual-Source-CTs aufgrund ihrer guten zeitlichen Auflösung geeignet, auch bei sehr hohen stabilen Herzfrequenzen eine gute Bildqualität zu erreichen8. Genau wie bei einer klassischen Herzkatheteruntersuchung muss jodhaltiges Kontrastmittel (60-90 ml) injiziert werden. Patienten mit Niereninsuffizienz, Schilddrüsenüberfunktion oder Kontrastmittelallergie sollten also nicht oder nur nach besonderen Vorbereitungen mittels CT-Angiographie untersucht werden. Bei ambulanten Untersuchungen ist diesbezüglich eine im Vorfeld durchgeführte Blutuntersuchung (Kreatinin, TSH) erforderlich. Schlussfolgerungen Die CT-Koronarangiographie ist eine genaue, nichtinvasive Methode zur Diagnostik von Koronararterienstenosen. Symptomatische Patienten mit geringer bis mittlerer Wahrscheinlichkeit für das Vorliegen einer koronaren Herzerkrankung und nicht eindeutigen Ergebnissen von Belastungsuntersuchungen profitieren am meisten von einer CT-Koronarangiographie. Wenn der CT-Befund pathologisch ist, also Koronarstenosen nachweisbar sind, kann die notwendige Herzkatheteruntersuchung und Koronartherapie sofort durchgeführt werden.Trotz der Empfehlungen in den oben genannten Leitlinien werden die Kosten für die Untersuchung derzeit leider noch nicht von den gesetzlichen Krankenkassen übernommen. Literatur 1. Lell M, Marwan M, Schepis T, Pflederer T, Anders K, Flohr T, Allmendinger T, Kalender W, Ertel D, Thierfelder C, Kuettner A, Ropers D, Daniel WG, Achenbach S. Prospectively ECG-triggered high-pitch spiral acquisition for coronary CT angiography using dual source CT: technique and initial experience. Eur Radiol. 2009;19:2576-2583. 2. Hausleiter J, Meyer T, Hermann F, Hadamitzky M, Krebs M, Gerber TC, McCollough C, Martinoff S, Kastrati A, Schomig A, Achenbach S. Estimated radiation dose associated with cardiac CT angiography. JAMA. 2009;301:500-507. 3. Hendel RC, Patel MR, Kramer CM, Poon M, Hendel RC, Carr JC, Gerstad NA, Gillam LD, Hodgson JM, Kim RJ, Kramer CM, Lesser JR, Martin ET, Messer JV, Redberg RF, Rubin GD, Rumsfeld JS, Taylor AJ, Weigold WG, Woodard PK, Brindis RG, Hendel RC, Douglas PS, Peterson ED, Wolk MJ, Allen JM, Patel MR. ACCF/ACR/SCCT/SCMR/ASNC/NASCI/SCAI/SIR 2006 appropriateness criteria for cardiac computed tomography and cardiac magnetic resonance imaging: a report of the American College of Cardiology Foundation Quality Strategic Directions Committee Appropriateness Criteria Working Group, American College of Radiology, Society of Cardiovascular Computed Tomography, Society for Cardiovascular Magnetic Resonance, American Society of Nuclear Cardiology, North American Society for Cardiac Imaging, Society for Cardiovascular Angiography and Interventions, and Society of Interventional Radiology. J Am Coll Cardiol. 2006;48:1475-1497. 31 NEUER HOCHLEISTUNGS-COMPUTERTOMOGRAPH IM HERZZENTRUM 4. Fox K, Garcia MA, Ardissino D, Buszman P, Camici PG, Crea F, Daly C, De Backer G, Hjemdahl P, Lopez-Sendon J, Marco J, Morais J, Pepper J, Sechtem U, Simoons M, Thygesen K, Priori SG, Blanc JJ, Budaj A, Camm J, Dean V, Deckers J, Dickstein K, Lekakis J, McGregor K, Metra M, Morais J, Osterspey A, Tamargo J, Zamorano JL. Guidelines on the management of stable angina pectoris: executive summary: The Task Force on the Management of Stable Angina Pectoris of the European Society of Cardiology. Eur Heart J. 2006;27:1341-1381. 5. Bluemke DA, Achenbach S, Budoff M, Gerber TC, Gersh B, Hillis LD, Hundley WG, Manning WJ, Printz BF, Stuber M, Woodard PK. Noninvasive coronary artery imaging: magnetic resonance angiography and multidetector computed tomography angiography: a scientific statement from the american heart association committee on cardiovascular imaging and intervention of the council on cardiovascular radiology and intervention, and the councils on clinical cardiology and cardiovascular disease in the young. Circulation. 2008;118:586-606. 7. Mowatt G, Cook JA, Hillis GS, Walker S, Fraser C, Jia X, Waugh N. 64-Slice computed tomography angiography in the diagnosis and assessment of coronary artery disease: systematic review and meta-analysis. Heart. 2008;94:1386-1393. 8. Achenbach S, Ropers U, Kuettner A, Anders K, Pflederer T, Komatsu S, Bautz W, Daniel WG, Ropers D. Randomized comparison of 64-slice single- and dualsource computed tomography coronary angiography for the detection of coronary artery disease. JACC Cardiovasc Imaging. 2008;1:177-186. Priv.-Doz. Dr. med. Carsten Zobel Dr. med. Henning Bovenschulte Facharzt für Innere Medizin – Kardiologie – Internistische Intensivmedizin Facharzt für Radiologie Klinik III für Innere Medizin Institut und Poliklinik für Radiologische Diagnostik Herzzentrum des Universitätsklinikums Köln (AöR) Radiologie-Zentrum Köln GmbH Kerpenerstr. 62 50937 Köln Tel.: 47 83 24 01 Fax: 47 83 24 00 Kerpener Str. 62 D-50937 Koeln Email: [email protected] www.uniklinik-herzzentrum.de/kardiologie 32 6. Gopalakrishnan P, Wilson GT, Tak T. Accuracy of multislice computed tomography coronary angiography: a pooled estimate. Cardiol Rev. 2008;16:189-196. Universitätsklinikum Koeln Email: [email protected] ANZEIGE Koronare In-Stent-Restenose: Alternative zum Stent-in-Stent-Ansatz Drug-Eluting-Stents gelten derzeit als bestmögliche Option in der Therapie der In-Stent-Restenose, sind aber mit einigen Nachteilen behaftet. Eine mögliche Alternative stellt die Angioplastie mit einem beschichteten Ballonkatheter dar. Die PEPCAD-II-Studie ergänzt die vorhandene Evidenz, die eine mindestens ebenbürtige Wirksamkeit und Verträglichkeit der Ballonintervention demonstriert. Vergleich mit dem Therapiestandard In diesen ersten klinischen Studien wurden Paclitaxelbeschichtete Ballons nur mit unbeschichteten Ballons und nicht mit DES verglichen. Dies lag darin begründet, dass DES entweder zum Zeitpunkt des Studienstarts noch nicht für die Therapie der In-Stent-Restenose zugelassen waren oder dass sie in den peripheren Arterien keine Wirksamkeit zeigten. Heute gelten DES als Therapiestandard der In-StentRestenose. Der Vergleich eines medikamentenbeschichteten Ballons mit einem zugelassenen und anerkannten DES bildet daher die Grundlage für die Beurteilung des potenziellen Benefits dieser Therapieoption. Das Ziel der randomisierten, nicht geblindeten PEPCAD(Paclitaxel-Eluting PTCA-Balloon Catheter in Coronary Artery Disease)-II-Studie war der Vergleich des SeQuent®-Please-Ballonkatheters, eines Paclitaxelbeschichteten Ballonkatheters der zweiten Generation, mit dem Paclitaxel-Eluting Taxus®-LibertéTM-Stent im Rahmen der Therapie der koronaren In-Stent-Restenose. Die Untersuchung wurde an zehn deutschen kardiologischen Abteilungen durchgeführt. Später Lumenverlust als primärer Endpunkt An der Studie nahmen 131 Patienten teil, von denen 65 dem Stentarm und 66 dem Ballonarm zugeordnet wurden. Die meisten Teilnehmer wiesen eine Mehrgefäßerkrankung auf; die In-Stent-Restenosen zeigten überwiegend ein diffuses Muster. Während die Patienten in der Kontrollgruppe mit dem Paclitaxel-beschichteten DES behandelt wurden, erfolgte im experimentellen Kollektiv eine Intervention mit einem Ballonkatheter, der mit Paclitaxel 3µ g/mm2 beschichtet war. Es wurden Stents und Ballons von ähnlicher Länge und ähnlichem Durchmesser verwendet, da sich die Läsionen in beiden Gruppen diesbezüglich glichen. Im Rahmen einer einzelnen Balloninflation betrug die Freisetzung des Wirkstoffs über 90%. Zusätzlich erhielten alle Teilnehmer eine Dauertherapie mit Aspirin 100mg/d. Clopidogrel 75mg/d wurde im Anschluss an die Ballonangioplastie für drei Monate und nach der DES-Implantation für sechs Monate verabreicht. Das Protokoll sah eine Nachbeobachtung über zwölf Monate vor. Angiographische Kontrollen erfolgten vor und nach allen Interventionen sowie nach sechs Monaten. Die quantitative Beurteilung der Aufnahmen wurde durch ein unabhängiges Labor vorgenommen. Eine Restenose war als Reduktion des Lumendurchmessers von 50% oder mehr definiert. Als primärer Endpunkt galt der späte Lumenverlust. Zu den sekundären Endpunkten zählten die Restenoserate und die Rate kombinierter klinischer Endpunkte über zwölf Monate einschließlich Stentthrombosen, Revaskularisationen von Zielläsionen, Myokardinfarkt und Tod. Alle Endpunkte und Nebenwirkungen wurden von einem unabhängigen Komitee beurteilt. Reduktion der Restenoserate Die Überbrückung der Läsion war bei allen Patienten im Ballonkatheter-Arm erfolgreich, während sie in der Stent-Gruppe trotz Prädilatation bei fünf Patienten nicht gelang. Vier von diesen Teilnehmern erhielten in der Folge eine Intervention mit dem beschichteten Ballon, und bei einem Patienten wurde ein konventioneller Ballonkatheter appliziert. Bei 89% der Patienten wurde nach einem halben Jahr eine Follow-up-Angiographie durchgeführt. Drei verstarben vorher, und zwölf lehnten die Untersuchung aufgrund fehlender Symptome ab. Der mittlere späte Lumenverlust im Segment lag in der Ballongruppe bei 0,17±0,42mm und in der DES-Gruppe bei 0,38±0,61mm (p=0,03). Dementsprechend war die Restenoserate im Ballonarm mit 7% geringer als im mit DES behandelten Kollektiv (20%; p=0,06). Am klinischen Follow-up nach sechs Monaten nahmen alle Patienten teil. Zwischenzeitlich hatte in der DESGruppe ein Myokardinfarkt infolge einer Okklusion eines seitlichen Astes stattgefunden. Ein Patient in der Ballongruppe und drei in der DES-Gruppe waren aufgrund nichtkardialer Ursachen verstorben. Bei einem Patienten im Ballonkollektiv, der aufgrund eines Nierenversagens im Zusammenhang mit einer chronischen Herzinsuffizienz gestorben war, fanden sich keine Hinweise auf eine akute myokardiale Ischämie. Vorteil trotz kürzerer Begleittherapie Der Unterschied in den Ereignisraten zugunsten der Ballonangioplastie (9% vs. 22%, p=0,08) basierte in erster Linie auf der Häufigkeit der Revaskularisationen von Zielläsionen. Vier Patienten in der Ballongruppe (6%) und zehn in der DES-Gruppe (15%) mussten in den ersten sechs Monaten oder während der Follow-upAngiographie einer neuerlichen Revaskularisation unterzogen werden (p=0,15). Im Zeitraum zwischen sechs und zwölf Monaten wurden im DES-Kollektiv zwei dritte Revaskularisationen notwendig. Im Ballonarm erhielten dagegen zwei Patienten eine PCI in einem Non-Target-Gefäß. Unter der Ballonintervention ergab sich im Hinblick auf das ereignisfreie Überleben ein statistischer Vorteil. Bei 41 Patienten wurden insgesamt 58 schwere Nebenwirkungen verzeichnet. 33 traten bei 22 der mit DES behandelten Patienten auf und 25 bei 19 Teilnehmern im Ballonkollektiv. Nach sechs Monaten nahmen in beiden Armen 98,5% der Patienten Aspirin ein, nach zwölf Monaten 86,4% (Ballongruppe) bzw. 89,2% (Stentgruppe). Clopidogrel fand nach sechs Monaten bei 28,8% der Patienten im Ballonkollektiv und bei 64,6% im DES-Arm Verwendung. In ihrer Diskussion weisen die Autoren auf den Vorteil durch die Ballonintervention hin, der manifest wurde, obwohl die Dauer der kombinierten Thrombozytenhemmertherapie in dieser Gruppe geringer war. Insgesamt bestätigt die vorliegende Studie die Ergebnisse von PACCOCATH ISR I und II. DER TRANSAPIKALE AORTENKLAPPENERSATZ Der transapikale Aortenklappenersatz Therapie der Wahl bei der kardialen Reoperation? – PD Dr. med. Justus Strauch Die Klinik für Herz- und Thoraxchirurgie des Herzzentrums der Uniklinik Köln führt seit dem Jahre 2008 den Ersatz einer hochgradig verengten – stenosierten – Aortenklappe auch mittels neuartiger Kathetertechnik minimal-invasiv unter Verzicht des Einsatzes der Herz-Lungenmaschine durch. Dieses sogenannte transapikale Vorgehen, heute international TAVI genannte Verfahren, ist besonders geeignet für ältere teils hochbetagte Patienten mit oftmals nebenbefundlich existenten zahlreichen Begleiterkrankungen, die einen Einsatz der Herz-Lungenmaschine erfahrungsgemäß nur mit deutlich erhöhtem Risiko tolerieren. Bei dem neuartigen Verfahren ist es möglich, die biologische – aus Rinderperikard bestehende – Aortenklappenprothese zu implantieren, ohne das man das Herz für diese Maßnahme stilllegen muss bzw. die menschliche Hauptschlagader eröffnen muss. Die alte Herzklappe wird dabei nicht wie üblich entfernt, sondern von einer zusammenfaltbaren Klappe, die über einen Katheter durch die Herzspitze eingeführt wird, überdeckt. Im engeren Sinne werden alle Verkalkungen sowohl der Klappentaschen als auch des Klappenringes in die Wand der Aortenwurzel gedrückt. Bei dieser Art der Kalk-Überdeckung, eine so genannte „Überstentung”, wird die alte Herzklappe mit einem Ballon an die Seite gedrückt und die neue, dann entfaltete Klappe spannt sich im Bereich der alten Klappe auf. Die Klappe ist in einem Metallgeflecht verankert, welches sich im Bereich der alten Klappe bzw. direkt in der Aortenwand verhakt und auf diese Art einen stabilen Sitz erzielt. Die gesamte Operation wird am schlagenden Herzen des Patienten vorgenommen, die Leistung des Herzens nur für einen kurzen Augenblick von wenigen Sekunden reduziert um einen korrekte Positionierung zu erzielen. Eine vollständige Eröffnung des Brustkorbes ist nicht mehr notwendig, das Einbringen des Katheters erfolgt über einen kleinen, nur 5-7 cm messenden Schnitt am seitlichen Brustkorb unterhalb der linken Brust mit direkter Punktion der Herzspitze. Die Spitze des Herzens ist an dieser Stelle sehr leicht zugänglich. Die Klinik für Herz- und Thoraxchirurgie des Herzzentrums der Uniklinik Köln hat sich im Rahmen dieses transapikalen Aortenklappenersatzes als eines der ersten Zentren in Deutschland in besonderem Maße mit der TAVI-Methodik als Alternative bei Patienten befasst, die schon einmal am Herzen operiert wurden und bei denen man eine Wiedereröffnung des Brustkorbes über das Brustbein vermeiden will. 35 DER TRANSAPIKALE AORTENKLAPPENERSATZ So besitzt die Klinik umfangreiche Erfahrungen bei der Behandlung von Patienten, die sich in der Vergangenheit beispielsweise einer aortokoronaren Bypassoperation, einem konventionellen Ersatz der Mitralklappe oder aber auch einem Ersatz der Aortenklappen mittels Bioprothese unterziehen mussten. Die Kölner Klinik war es auch, die im letzten Jahr erstmals weltweit erfolgreich eine transapikale Aortenklappenprothese bei einer Patientin implantierte, die sich 12 Jahre zuvor einem mechanischen Mitralklappenersatz unterzogen hatte und aufgrund der Risikokonstellation als konventionell inoperabel galt. Gerade bei den oben genannten Patienten, so wissen wir heute, stellt die kardiale Reoperation, die Wiedereröffnung des Brustkorbes über das bereits zuvor eröffnete Brustbein aufgrund ausgedehnter Vernarbungen bei den teils hochbetagten Patienten ein deutliches Risiko dar. Der gesamte, schonende Eingriff über den transapikalen Ansatz in einem sog. Hybrid-Operationssaal, einer Mischung aus Operationssaal und Herzkatheterlabor, mit der Möglichkeit einer Röntgendurchleuchtung und einer Ösophagusechokardiographie dauert nur rund 90 Minuten und ist auch für bereits am Herzen operierte Menschen nur wenig belastend. 21 Patienten ReOP seit März 2008 von insg. 56 Patienten Mittleres Patientenalter 82,4 ± 3,8 Log. EUROscore 38 ± 10 % Mittlere Intensivverweildauer 3,8 ± 2,2 Tage Mittlere Hospitalverweildauer 12,8 ± 5,2 Tage 30 Tage Mortalität n=1 (n=1/21) (5%) Permanentes Neurologisches Defizit n=0 (n=0/21) (0%) Postoperative Schrittmacherpflichtigkeit n=2 (n=2/21) (10%) Tabelle 1: Kölner Ergebnisse für TAVI als kardiale Reoperationsmethode Welcher Patient kommt in Frage, auf wen ist die neue Methode zugeschnitten? • Patienten mit deutlich fortgeschrittenem Patientenalter (derzeit 80 J. und älter) • Patienten mit kardialer Voroperation (Z.n. mech.MKE stellt keine Kontraindikation dar) • Patienten mit deutlich erhöhtem EURO Score (numeric >8, logistic >18%) • Patienten mit Kontraindikationen für die Verwendung der Herz-Lungenmaschine Welche Untersuchungen sind im Vorfeld eines transapikalen Aortenklappenersatzes erforderlich? • Links-Herzkatheteruntersuchung • Transthorakale Echokardiographie, TEE im Herzzentrum (ggfs. Becken-Bein Angiographie) Programmleiter der Klinik für Herz- und Thoraxchirurgie Priv.-Doz. Dr. Justus Strauch Tel. 0221 478 32406, Fax 0221 478 32509 [email protected] Tabelle 2: Voraussetzungen 36 ALTERNATIVEN ZUR THERAPIE DES VORHOFFLIMMERNS MIT VITAMIN K-ANTAGONISTEN Alternativen zur Therapie des Vorhofflimmerns mit Vitamin K-Antagonisten Fig. 1 Auftreten von Schlaganfällen oder peripheren Embolien – Erland Erdmann Patienten mit Vorhofflimmern und einem CHADS2-Score >2 benötigen eine Antikoagulation, weil sie sonst ein hohes Risiko für Thromboembolien bzw. einen Schlaganfall haben. Etwa 10% der Menschen über 75 Jahre leiden an Vorhofflimmern. Viele davon haben eine kardiale Vorerkrankung, eine Hypertonie, einen Diabetes oder bereits einen Schlaganfall durchgemacht. Bislang gab es lediglich Vitamin K-Antagonisten zur oralen Dauertherapie für die Verhütung von Thromboembolien bei diesen Risikopatienten. Die Behandlung mit Vitamin K-Antagonisten (Marcumar®) ist schwierig und aufwendig. Häufige Blutabnahmen zur Bestimmung des INR sind notwendig, Patienten nehmen ihre Medikamente oft nicht den Vorschriften entsprechend, deshalb gibt es sowohl zu niedrige als auch zu hohe INR-Werte mit der Folge fehlender Protektion bzw. der Gefahr von ernsthaften Blutungen. Kürzlich wurde nun an über 18.000 Patienten mit Vorhofflimmern kontrolliert prospektiv und verblindet die Wirksamkeit eines Faktor Xa-Inhibitors (Dabigatran, 2 x 110 bzw. 2 x 150 mg p.o.) gegen einen Vitamin K-Antagonisten (Warfarin) untersucht (1). In allen Aspekten, Thromboembolieprotektion, Blutungskomplikationen oder Überleben war Dabigatran dem Warfarin entweder gleichwertig oder sogar überlegen (s. Abb. 1+2). Ich vermute, dass wir demnächst Patienten statt mit Marcumar mit Dabigatran (Pradaxa®) behandeln werden, da es nicht nur besser sondern auch einfacher in der Handhabung ist. Noch ist es für diese Indikation nicht zugelassen, das dürfte aber bald der Fall sein. Andere Faktor Xa-Inhibitoren, wie das Rivaroxaban (Xarelto®) werden im Augenblick ebenfalls bei Patienten mit Vorhofflimmern getestet. Bei orthopädischen Operationen haben sie sich in Hinsicht auf TVT und Lungenembolien schon als dem Heparin überlegen gezeigt. Aus meiner Sicht wäre es erfreulich, wenn wir demnächst die lästigen Blutabnahmen und ständigen INR-Messungen nicht mehr bräuchten. Literatur: 1. Conolly et al., Dabigatran versus warfarin in patients with atrial fibrillation. NEJM 361 (2009) 1139-1151 Prof. Dr. Erland Erdmann, Tel.022147832511, Fax 022147832512, e-mail [email protected] 37 CHRONISCH THROMBOEMBOLISCHE PULMONALE HYPERTONIE (CTEPH) Chronisch thromboembolische pulmonale Hypertonie (CTEPH): Welchen Stellenwert haben heute die Perfusions- (Q) und Ventilations- (V) Szintigraphie ? – Matthias Schmidt – Klinik und Poliklinik für Nuklearmedizin – Universitätsklinikum Köln Die Abklärung der pulmonalen Hypertonie erfordert die Beantwortung der Frage, ob chronisch-rezidivierende Embolien als eine behandelbare Ursache der pulmonalen Hypertonie vorliegen. Ein hierzu geeignetes Verfahren, das in der aktuellen Leitlinie zur pulmonalen Hypertonie (Galiè et al. 2009) einen zentralen diagnostischen Platz einnimmt, ist die Lungenperfusionsszintigraphie zum Nachweis von Perfusionsdefekten. Die Kombination mit der Lungenventilationsszintigraphie erlaubt die Abgrenzung zu Differentialdiagnosen und hier insbesondere der COPD. Beurteilungskriterium für das Vorliegen einer Lungenembolie ist der Mismatch, d. h. der Perfusionsdefekt bei erhaltener Ventilation, wohingegen bei COPD ein Match-Befund zu sehen ist, d.h. die durch den Euler-LiljestrandMechanismus konsekutiv verminderte Perfusion in Lungenabschnitten mit gestörter Ventilation. Die kombinierte Lungenventilations- und Lungenperfusionsszintigraphie zum Nachweis einer Lungenembolie kann von der Methode her nicht zwischen akuter und chronischer Lungenembolie unterscheiden. Diese Interpretation ergibt sich aus der Anamnese und der Patientenselektion. Es ist aus heutiger Perspektive keine Selbstverständlichkeit, dass der kombinierten Lungenventilations- und Lungenperfusionsszintigraphie zum Lungenembolienachweis wieder eine größere Bedeutung zukommt als noch vor Jahren (Bajc et al. 2009, Freeman et al. 2008, Miniati et al. 2008). Die Ursache für den Ansehensverlust kommt aus den USA und hat einen Namen: PIOPED (The PIOPED Investigators: Prospective Investigation of Pulmonary Embolism Diagnosis), eine Studie, die 1990 autorenlos in einer renommierten Zeitschrift publiziert wurde. Es wurden hier zahlreiche methodische Fehler gemacht, u. a. das Erheben der Blattfilmangiographie zum Goldstandard der LE-Diagnostik. In der Studie wurden lediglich planare szintigraphische Bilder in der Diagnostik herangezogen und die Ventilation erfolgte mit dem radioaktiven Edelgas Xe-133 in meist nur einer einzigen Ansicht (SingleProjection / Single-Breath). Die Ergebnisse wurden nach probabilistischen Kriterien beurteilt, d. h. es wurde eine Wahrscheinlichkeit für das Vorliegen einer Lungenembolie angegeben. Eine Befundung nach PIOPED-Kriterien ist aus heutiger Sicht abzulehnen. Prof. Dr. med. Matthias Schmidt Arzt für Nuklearmedizin, Oberarzt, FEBNM Klinik und Poliklinik für Nuklearmedizin, Universitätsklinikum Köln / Department of Nuclear Medicine, University Hospital of Cologne Kerpener Str. 62 · 50937 Köln / Cologne – GERMANY – Tel.: +49 - 221 - 478 - 4052 · FAX: +49 - 221 - 478 - 6777 E-Mail: [email protected] Erst zehn Jahre nach der PIOPED-Studie wurde im Tierversuch mit artifiziellen Embolie die Sensitivität der Methoden überprüft und hier schnitt die nuklearmedizinische Diagnostik mit hoher Sensitivität und Spezifität ab. Verbesserungen in der nuklearmedizinischen Diagnostik aus heutiger Sicht resultieren sowohl aus besseren Radiopharmaka als auch verbesserter Aufnahmetechnik. Radioaktive Edelgase wurden verlassen, da mit Technegas (Tc-99m-markierte Kohlepartikel im Argongas) heutzutage eine überlegene Bildqualität bei der Lungenventilationsszintigraphie erzielt werden kann. Für die Lungenperfusionsszintigraphie wird Tc-99m-markiertes makroaggregiertes Albumin (Tc-99m-MAA) verwendet. Standard in der Aufnahmetechnik ist heute SPECT (Single-Photonen-Emissions-Computertomographie als Schnittbilddarstellung der Aktivitätsverteilung), weil hierdurch ein deutlicher diagnostischer Zugewinn gegenüber der lediglich planaren Aufnahmetechnik zu erzielen ist (Roach et al. 2008). Der Endbefund ergibt sich aus der kombinierten Beurteilung von Ventilation und Perfusion. Ein Mismatch als Perfusionsdefekt mit an gleicher Stelle erhaltener Ventilation ist als Lungenembolie zu werten, wobei nach den Howarth-Kriterien ein halbes Segment ausreicht (Howarth et al. 2006). Hierbei wurde eine Sensitivität von 98%, eine Spezifität von 96% und eine diagnostische Genauigkeit von 96,8% beschrieben. Eine Unterscheidung zwischen akuter und chronischer Embolie ist mit der V/QSPECT nicht möglich, eine Unterlegenheit gegenüber der Computertomographie im Hinblick auf die diagnostische Genauigkeit besteht aber nicht. Der Vergleich V/Q-SPECT versus Computertomographie lässt jedoch folgende Aussage zu: Die Computertomographie ist besonders geeignet, eine zentrale Lungenembolie nachzuweisen und ein teilokkludierender zentraler Embo- 39 CHRONISCH THROMBOEMBOLISCHE PULMONALE HYPERTONIE (CTEPH) lus kann dem Nachweis mit der V/Q-SPECT entgehen, weil das Tc-99m-MAA an diesem vorbeifließt. Die V/Q-SPECT weist demgegenüber vor allem periphere Lungenembolien nach, so dass die Sensitivitäten von V/Q-SPECT und Computertomographie gegenläufig sind: eine LE des Truncus pulmonalis oder einer Pulmonalarterie wird besser mit der Computertomographie, eine LE auf Segment- oder Subsegmentebene besser mit der V/Q-SPECT nachgewiesen. Dies erklärt auch, weshalb die Lungenperfusionsszintigraphie in den aktuellen Leitlinien zur pulmonalen Hypertonie einen zentralen diagnostischen Platz in der Diagnostik der CTEPH einnimmt (Galiè et al. 2009). Die bei der CTEPH chronisch-rezidivierend auftretenden kleinen Lungenembolien sind besonders gut mit der V/Q-SPECT nachzuweisen. Tunariu et al. aus dem Hammersmith Hospital in London verglichen bei 227 Patienten mit pulmonaler Hypertonie den diagnostischen Wert der Lungenventilations- und Lungenperfusionsszintigraphie mit der Computertomographie. 78 Patienten hatten im Verlauf die Diagnose einer CTEPH und 149 Patienten eine andere Ursache der pulmonalen Hypertonie. Die Sensitivität der V/Q-Szintigraphie betrug 96% und die Spezifität 95%, demgegenüber lag die Sensitivität der Computertomographie bei 51% und die Spezifität bei 99%. Die diagnostische Genauigkeit der V/Q-Szintigraphie betrug 95% und die der Computertomographie 83%, so dass die Autoren schlussfolgerten, dass die V/QSzintigraphie sensitiver als Multidetektor-CT zum Nachweis einer CTEPH ist. Auch das Befundmuster ist bei der V/Q-Szintigraphie von Bedeutung. Während bei der CTEPH der Mismatch zwischen erhaltener Ventilation und gestörter Perfusion vorliegt, zeigt sich bei der primären pulmonalen Hypertonie eine eher fleckig ungleichmäßige, nicht segmental zuzuordnende Perfusionsstörung (Lisbona et al. 1985). Auch bei der Strahlenexposition schneidet die V/Q-SPECT im Vergleich mit der Computertomographie nicht schlecht ab, da die Lungenventilationsszintigraphie mit ca. 0,3 mSv und die Lungenperfusionszintigraphie mit ca. 2,2 mSv (Jährliche natürliche Strahlenexposition ca. 2,4 mSv) zu den nuklearmedizinischen Unter- suchungen mit niedriger Strahlenexposition zählen und auch die Mammadosis mit 0,8 mSv mindestens um den Faktor 10 unter dem Wert der Computertomographie liegt. Literatur: Bajc M, Neilly JB, Miniati M, Schuemichen C, Meignan M, Jonson B; EANM Committee. EANM guidelines for ventilation/perfusion scintigraphy : Part 1. Pulmonary imaging with ventilation/perfusion single photon emission tomography. Eur J Nucl Med Mol Imaging 2009; 36: 1356 - 70. Bajc M, Neilly JB, Miniati M, Schuemichen C, Meignan M, Jonson B. EANM guidelines for ventilation/perfusion scintigraphy : Part 2. Algorithms and clinical considerations for diagnosis of pulmonary emboli with V/P(SPECT) and MDCT. Eur J Nucl Med Mol Imaging 2009; 36: 1528 - 38 Freeman LM, Stein EG, Sprayregen S, Chamarthy M, Haramati LB. The current and continuing important role of ventilation-perfusion scintigraphy in evaluating patients with suspected pulmonary embolism. Semin Nucl Med 2008; 38: 432 - 40. Galiè N, Hoeper MM, Humbert M, et al. Guidelines for the diagnosis and treatment of pulmonary hypertension: The Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT). Eur Heart J 2009 Aug 27. [Epub ahead of print] Howarth DM, Booker JA, Voutris DD. Diagnosis of pulmonary embolus using ventilation/perfusion lung scintigraphy: more than 0.5 segment of ventilation/perfusion mismatch is sufficient. Int Med J 2006; 36: 281 - 288 Lisbona R, Kreisman H, Novales-Diaz J, Derbekyan V. Perfusion lung scanning: differentiation of primary from thromboembolic pulmonary hypertension. AJR Am J Roentgenol 1985; 144: 27 - 30 Miniati M, Sostman HD, Gottschalk A, Monti S, Pistolesi M. Perfusion lung scintigraphy for the diagnosis of pulmonary embolism: a reappraisal and review of the Prospective Investigative Study of Acute Pulmonary Embolism Diagnosis methods. Semin Nucl Med 2008; 38: 450 - 61. [No authors listed - The PIOPED Investigators] Value of the ventilation/perfusion scan in acute pulmonary embolism. Results of the prospective investigation of pulmonary embolism diagnosis (PIOPED). The PIOPED Investigators. JAMA 1990; 263 : 2753 - 9 Roach PJ, Bailey DL, Harris BE. Enhancing lung scintigraphy with single-photon emission computed tomography. Semin Nucl Med 2008; 38: 441 - 9. Tunariu N, Gibbs SJ, Win Z, Gin-Sing W, Graham A, Gishen P, Al-Nahhas A. Ventilation-perfusion scintigraphy is more sensitive than multidetector CTPA in detecting chronic thromboembolic pulmonary disease as a treatable cause of pulmonary hypertension. J Nucl Med 2007; 48: 680 - 4 Perfusions-SPECT in 3D-Rekonstruktion (RVL), Links: Normalbefund – Rechts: Lungenembolie 41 HERZCHIRURGISCHE INTENSIVMEDIZIN AM HERZZENTRUM KÖLN Herzchirurgische Intensivmedizin am Herzzentrum Köln Ein Überblick über Struktur und Ablaufprozesse oder: Warum heute auch hochbetagte Patienten einer Herzoperation unterzogen werden können ! – FOA Dr. Georg Langebartels Die Intensivstation im Herzzentrum verfügt über 24 Beatmungsbetten, hiervon werden 18 Betten chirurgisch geführt. Über diese Zahl hinaus können bei Bedarf auch Betten der kardiologischen Kooperationspartner belegt werden. Die Patienten werden in Doppelzimmern versorgt und betreut. Zusätzlich besteht die Möglichkeit in 4 Einzelzimmern Patienten mit speziellen Krankheitsbildern zu behandeln. Insgesamt sind etwa 90 Schwestern und Pfleger und 11 Ärztinnen und Ärzte verschiedener Fachdisziplinen rund um die Uhr für die Versorgung der Hoch-Risiko-Patienten verantwortlich. unmittelbar vor der Operation wird von uns übernommen. Die Betreuung kardiochirurgischer Intensivpatienten erfordert ein hohes Maß an Erfahrung und ein ausgeprägtes Verständnis für die hämodynamischen Zusammenhänge. In Abhängigkeit vom kardialen Krankheitsbild sind wechselnde hämodynamische Besonderheiten zu berücksichtigen und auf die postoperative Akutphase des Patienten anzuwenden. Als herzchirurgisches Ausbildungszentrum für transthorakale und transösophageale Echokardiographie, wird diese umfassend und in großer Zahl bei unseren Patienten eingesetzt. Beatmung Für unsere Patienten stehen 24 Beatmungsgeräte zur invasiven und nichtinvasiven Beatmung zur Verfügung, welche indikationsbezogen mit Masken und Beatmungshelmen durchgeführt wird (siehe Abb). Die herzchirurgische Intensivtherapie dient dem Zweck, die operativen Therapiemaßnahmen erfolgreich weiter zu führen und den Patienten in den nächsten Stunden zu stabilisieren. Die Wiederherstellung und Sicherung der lebenswichtigen Organsysteme ist hier von oberster Priorität. Auch die Behandlung von instabilen kardial dekompensierten Patienten 43 PRESSEINFORMATION HERZCHIRURGISCHE INTENSIVMEDIZIN AM HERZZENTRUM KÖLN Behandelt werden alle Formen der respiratorischen Insuffizienz inclusive spezieller Beatmungsstrategien zur Therapie des ARDS, bzw. Entwöhnungsbehandlung von langzeitbeatmeten Patienten unter Verwendung spezieller Weaningprotokolle. Behandlung im Rotationsbett bei ARDS Hämodynamisches Monitoring Organersatzverfahren Unser intensivmedizinisches Monitoring umfasst neben der Messung der gängigen nicht invasiven und invasiven Drücke im großen und kleinen Kreislauf, ein erweitertes aufwendiges Monitoring. Zur Anwendung gelangen neben der Messung der üblichen hämodynamischen Parameter insbesondere folgende Messverfahren: diskontinuierliche und kontinuierliche HZV Messung mittels Swan-Ganz- Katheter, Vigilance II®; Vigileo®, PICCO®. Es wird das komplette Spektrum intensivmedizinischer Behandlungsverfahren und Organersatzverfahren, von der Dialyse bis zum Kunstherzeinsatz, angeboten. Ein Schwerpunkt der kardiochirurgischen intensivmedizinischen Behandlung ist die Betreuung der Patienten mit uni- und biventrikulären Assist-Systemen und die Versorgung an der extracorporaler Membranoxygenierung (ECMO). Dieses Verfahren kann Patienten nach herzchirurgischem Eingriff zur Rekompensation, aber auch Patienten als Ultima ratio Therapie bei kardiopulmonalem Versagen jeglicher Genese angeboten werden. Die Intensivstation ist Ausbildungszentrum für die Zusatzbezeichnung Herzchirurgische Echokardiographie. Damit gehört die Durchführung und Beurteilung des TEE zum Behandlungsstandard. Komplettes Monitoring mit TEE, PAK-CCO bei ECMO und IABP Therapie 45 HERZCHIRURGISCHE INTENSIVMEDIZIN AM HERZZENTRUM KÖLN steigern. Zusätzlich zur Versorgung von über 1200 intensivpflichtigen kardiochirurgischen Patienten wurden 2008 über 400 TEE Untersuchungen, ca. 250 Bronchoskopien, und weitere invasive Eingriffe wie Kardioversionen, Punktionen und Drainagenanlagen durchgeführt. Wir verfügen mittlerweile über eine Behandlungserfahrung von über 150 erfolgreich durchgeführten percutanen Dilatationstracheotomien. Seit 2009 werden alle unsere Daten zusätzlich im Patientendokumentationssystem QIMS verschlüsselt. Qualitätssicherung ECMO und Kühleinheit im Einsatz nach Reanimation Unterstützend zur Therapie auf der Normalpflegestation werden Kardioversionen, transösophageale Echokardiographien, Punktionen von Pleura und Perikard, Pleurodesen und Schrittmacherkontrollen in großer Zahl durchgeführt. Qualitätssicherung und Leistungsstatistik Zur Erfassung unserer Leistungszahlen greifen wir auf das medizinische Controlling zurück. Von hier werden wir mit relevanten Daten zu den Fallzahlen und Behandlungsdaten versorgt. Für unsere eigene Statistik, zur Erhebung klinisch relevanter Daten und zur Erfassung von kostenrelevanten Intensiv-Scoring-Systemen (SAPS, TISS, SOFA) beschäftigen wir studentische Hilfskräfte als Eingabehilfen. Behandlungszahlen 2008 Nach Eröffnung des Herzzentrums im November 2008 konnte die herzchirurgische Intensivtherapie mittlerweile wieder ihre alte Leistungsfähigkeit erreichen und diese weiter Fallzahlen 46 Die intensivmedizinische Behandlung von herzchirurgischen Patienten bewegt sich im Spannungsfeld zwischen medizinischer Machbarkeit, dem wachsenden Behandlungsanspruch eines immer älter und komplexer werdenden Patientenguts und der ethisch moralischen Sinnhaftigkeit medizinischen Handelns. Die Transparenz unseres ärztlichen Handelns und der Dialog mit den Angehörigen ist uns in diesem Zusammenhang ein großes Anliegen. Die Intensivmedizin im Allgemeinen ist mit einer hohen Fehler- und Komplikationsrate behaftet. Das Zusammenspiel von ärztlichem und pflegenden Personal bedarf daher einer engmaschigen Abstimmung und einer guten und lückenlosen Kommunikation zwischen den Beteiligten. Mehrere tägliche Visiten in verschiedener Teamgröße und Zusammensetzung, eine permanente herzchirurgische Facharztund Oberarztpräsenz und die räumliche Nähe zu unseren OP Sälen unterstützen unseren hohen Anspruch an Qualität und tragen zu einer Verbesserung unserer Qualität bei. Regelmäßige Mortalitäts- und Morbiditätskonferenzen, sowie interne Fortbildung und Schulung dienen der Verbesserung unserer Ergebnisse. Für unsere Patienten versuchen wir jeden Tag ein bisschen besser zu werden. HYPERSENSITIVITÄTS-MYOKARDITIS Hypersensitivitäts-Myokarditis – Tobias Plenge Die nichtinfektiöse Myokarditis ist eine seltene, jedoch oft letal verlaufende Herzmuskelentzündung unklarer Genese (2-4). Nach der Pathogenese lassen sie die nichtinfektiösen Myokarditiden weiter in die toxische Myokarditis und die Hypersensitivitätsmyokarditis differenzieren. Initial präsentiert sich die nichtinfektiöse Myokarditis durch unspezifische Symptome wie Fieber, Leistungsknick oder Dyspnoe. Im Verlauf manifestiert sich in bis zu 75 % der Fälle eine rasch progrediente Herzinsuffizienz. In bis zu 14 % treten ventrikuläre Tachykardien und in bis zu 7 % ein akutes Koronarsyndrom oder atrioventrikuläre Überleitungsstörungen auf. Das histologische Korrelat der nichtinfektiösen Mykarditis ist eine lymphozytär- monozytäre Infiltration des Herzmuskelgewebes mit dem Vorkommen von mehrkernigen Riesenzellen. Die Diagnose lässt sich daher mit einer Sensitivität von bis zu 85% durch eine Mykardbiopsie sichern. Kardiotoxische Substanzen und physikalische Noxen, wie z. B. Alkohol und Kokain führen zu einer Schädigung des Myokards und reaktiv zu einer toxischen Myokarditis. Je nach Dauer und Intensität der Exposition führt die Noxe zu einer reversiblen oder irreversiblen Schädigung des Mayokards. Im Verlauf endet dies in einer Myokardfibrose oder in einer dilatativen Kardiomyopathie. Alkohol- und Drogenkonsum spielen als Noxen durch ihre Häufigkeit eine besondere Rolle. Im klinischen Alltag kommt weiterhin der Myokardschädigung durch antineoplastische Wirkstoffe eine besondere Bedeutung zu (1). Beide Erkrankungen werden im Rahmen der spezifischen Kardiomyopathien weiter untersucht und didaktisch aufgearbeitet. Die Hypersensitivitätsmyokarditis ist histologisch durch eine interstitielle Infiltration des Myokards mit Eosinophilen, Lymphozyten und Histiozyten gekennzeichnet (Abb. 1). Eine Infiltration mit Riesenzellen ist hingegen selten zu beobachten (7). Ursachen für nichtinfektiöse Myokarditiden sind systemische Erkrankung wie z. B. Sarkoidose, systemischer Lupus erythematodes, Zöliakie oder chronisch- entzündliche Darmerkrankungen. Neben selteneren Ursachen wie einer Thyreotoxikose oder einem Thymom, ist die Hypersensitivität als Medikamentenreaktion eine klinisch relevante Ursache. Zur Therapie der fulminanten, nichtinfektiösen Myokarditiden werden Immunsuppressiva und monoklonale T- Zellantikörper (OKT- 3 Antikörper) eingesetzt. Als ultima ratio kann eine Herztransplantation erforderlich sein. In diesen Fällen ist die Rezidivhäufigkeit von 25% nach Herztransplantation zu beobachten (7). Abbildung 1: Histologisches Präparat einer Myokardbiopsie bei Hypersensitivitätsmyokarditis. Tabelle 1: Auslöser nichtinfektiöser Myokarditiden (aus Mewis et al.: Kardiologie compact, Thieme Verlag 2004) 47 HYPERSENSITIVITÄTS-MYOKARDITIS Die Hypersensitivitätsmyokarditis ist im Gegensatz zu der toxischen Myokarditis dosisunabhängig. Nach Beendigung der auslösenden Medikation ist sie reversibel, geht jedoch trotzdem mit einer hohen Mortalität einher. Unter Anderem weil die Hypersensitivitätsmyokarditis nicht im zeitlichen Zusammenhang mit dem Beginn der auslösenden Therapie stehen muss, sondern zu jedem Zeitpunkt der Therapie auftreten kann. Neben den schon erwähnten Brustschmerzen und Tachykardien finden sich häufig CRP- Erhöhungen (5). Medikamente, die eine Assoziation mit dem Auftreten einer Hypersensitivitätsmyokarditis zeigen sind insbesondere Sulfonamide, Metyhldopa, Penicillin/Ampicillin, Hydrochlorothiazid, Furosemid, Tetrazykline und Phenytoin (7). Eine Übersicht zeigt Tabelle 1. Ein junger Mann stellte sich kürzlich aufgrund von rezidivierenden Tachykardien und Palpitationen sowie einem Leistungsknick in der Notfallambulanz des Hauses vor. An Vorerkrankungen war ein Morbus Crohn und eine Akne vulgaris bekannt. Beide Erkrankungen zeigten zum Aufnahmezeitpunkt einen stabilen Verlauf. Die körperliche Untersuchung blieb abgesehen von einer Temperaturerhöhung (37,7°C) ohne wegweisenden Befund. Das initiale Elektrokardiogramm und eine Röntgenuntersuchung des Thorax zeigten sich ebenfalls unauffällig. Die laborchemischen Untersuchungen zeigten eine mäßige CRP- Erhöhung (21 mg/l) und ein NT- pro BNP von 125 ng/l. In der Echokardiographie konnte eine gute linksventrikuläre Pumpfunktion, normal dimensionierte Herzhöhlen und ein unauffälliger Klappenstatus gezeigt werden. In der Langzeit- EKG Aufzeichnung wurde dann jedoch ein buntes Bild an Herzrhythmusstörungen nachgewiesen. Es traten Salven ventrikulärer Extrasystolen, supraventrikuläre Extrasystolen mit Couplets und Triplets und ein intermittierender AV- Block II° Typ Mobitz auf (Abb. 2). Diese Befunde wurden im Zusammenhang mit den initialen Symptomen als myokardiale Beteiligung einer Inflammation gedeutet. Mit Hilfe einer kardialen Magnetresonanztomographie sollte die Verdachtsdiagnose Myokarditis bestätigt werden. Ödematöse Wandveränderungen und Zeichnugsvermehrungen als Korrelat der Myokarditis im MRT wurden jedoch ausgeschlossen (Abb. 3-6). Bei dem Patienten war ein Morbus Crohn bekannt. Chronisch entzündliche Darmerkrankungen können sich neben den typischen Manifestationen im Dünn- und Dickdarm auch extraintestinal manifestieren. Eine kardiale Beteiligung kann sich klinisch als nichtinfektiöse Myokarditis mit Tachykardien, atrioventrikulären Überleitungsstörungen und akuten Koronarsyndromen manifestieren (8, 9). Die Medikamentenanamnese ergab eine Therapie des Morbus Crohn mit Mesalazin. Chronisch entzündliche Darmerkrankungen werden häufig mit lokal wirksamen nichtsteroidalen Antirheumatika wie Mesalazin (5-Aminosalizylsäure) behandelt. Das Prodrug Sulfasalazin wird im Darm durch die Azoreduktase zu 5-Aminosalizylsäure und Sulfapyridin gespalten. Beide Substanzen zeigen u. a. einen entzündungshemmenden Effekt. Isolierte 5Aminosalizylsäure, gekoppelt an Acrylharze oder Cellulose, die die Freisetzung im Darm und damit die sonst zu rasche Absorption verzögern, haben ein günstigeres Nebenwirkungsprofil. Dennoch sind beide Substanzen mit dem Auftreten von Hypersensitivitätsreaktion wie Pankreatitis, Pneumonitis oder Myokarditis assoziiert. Die Hypersensitivitätsmyokarditis durch Mesalazin ist eine unerwünschte Arzneimittelwirkung, die schon 1989 durch Agnholt et al. (5) beschrieben wurde. Eine weitere Vorerkrankung des Patienten war eine Akne vulgaris, die mit Minocyclin, einem Tetrazylin, behandelt wurde. Eine erst 2009 erschiene Arbeit von Kerry et al. (6) beschreibt den Zusammenhang einer Minocyclintherapie mit einer lymphozytären und eosinophilen Myokarditis. Nach initial symptomatischer Therapie mit Bisoprolol führte ein Auslassversuch des Mesalazins innerhalb weniger Tage zur Besserung der Beschwerden und zur Normalisierung des Elektrokardiogramms. Dies bestätigte die Verdachtsdiagnose Hypersensitivitätsmyokarditis unter Mesalazintherapie. Abbildung 2: Auszug aus dem LZ- EKG mit ventrikulären Salven 48 HYPERSENSITIVITÄTS-MYOKARDITIS Literatur: 1: Erdmann: Klinische Kardiologie. 7. Auflage, Springer Verlag 2009. 2: Cooper et al.: Idiopathic giant-cell myocarditis- natural history and treatment. N Engl J. Med 1997. 3: Menghini et al.: Combined immunosuppresession for the treatment of idiopathic giant – cell myocarditis. Mayo Clin Proc 1999. 4: Cooper et al.: Giant- cell myocarditis: diagnostic and treatment. Herz 2000 5: Agnholt et al.: Cardiac hypersensitivity to 5-aminosalicylic acid. Lancet 1989. 6: Kerry et al.: Minocycline-induced drug reaction with eosinophilia and systemic symptomS (DRESS) syndrome with persistent myocarditis. A Academy of Dermatology 2009. 7: Mewis et al: Kardiologie compact. Thieme Verlag 2004. 8: Rellecke et al.: Chronic inflammatory bowel disease and cardiovascular complications. Med Klin 2006. 9: Hyttinem et al.: Recurrent myopericarditis in association with Crohn´s disease. J Intern. Med 2003 Abbildung 3-6: Auschluss einer Myokarditis im MRT 49 ANZEIGE Eplerenon (Inspra®) nach akutem Myokardinfarkt Früher Therapiebeginn maximiert den Nutzen Die Überlebenschancen von Myokardinfarktpatienten mit Herzinsuffizienzzeichen sind umso besser, je früher die Therapie mit dem selektiven AldosteronBlocker Eplerenon (Inspra®) begonnen wird. Dies hat die EPHESUS-Studie klar gezeigt, in der die Patienten ab dem dritten Postinfarkttag mit dem selektiven Aldosteron-Blocker behandelt werden konnten.1 „Hätten wir die Studie mit unserem heutigen Wissen geplant, hätten wir die Eplerenon-Therapie noch früher, nämlich umgehend nach dem akuten Ereignis gestartet“, betonte Professor Faiez Zannad, Nancy (Frankreich), Chairman des Symposiums „Emerging Evidence in the Management of Post-Myocardial Infarction Patients with Heart Failure – Understanding the Effects of Aldosterone Blockade“, das im Rahmen des Europäischen Kardiologenkongresses (ESC) stattfand. Der Aldosteron-Spiegel direkt nach dem akuten Myokardinfarkt ist ein unabhängiger Prädiktor einer anhaltend schlechten Prognose: Ein Großteil der Patienten stirbt trotz erfolgreicher Revaskularisierung innerhalb weniger Monate nach dem akuten Ereignis.2,3 Der Grund hierfür: Aldosteron triggert das ischämiebedingte myokardiale Remodelling. Die Folge ist eine linksventrikuläre Dilatation mit Abnahme des Schlagvolumens bis hin zur klinischen manifesten Herzinsuffizienz. „Je früher der AldosteronSpiegel gesenkt wird, desto besser stehen die Chancen, dass dieser fatale Prozess gebremst werden kann“, erklärte Professor Jean-Marie Ketelslegers, Brüssel (Belgien). Eplerenon fördert schon die sehr frühen Heilungsprozesse Eplerenon blockiert den Aldosteron-Anstieg und beeinflusst damit bereits die sehr frühen Heilungsprozesse nach der akuten Myokardischämie positiv.4 Dies ist u.a. an einer ausgeprägten Reduktion von Biomarkern der Kollagensynthese wie z. B. Big-ET1 (Endothelin-1 Precursor) ablesbar, die den Aufbau der extrazellulären Kollagenmatrix im Infarktareal widerspiegeln.5 Wird Eplerenon direkt nach dem akuten Ereignis gegeben, lässt sich der Effekt bereits nach sieben Tagen anhand einer Reduktion des linksventrikulären Volumens objektivieren.6 Klinische Indikatoren des myokardialen Remodellings und Prädiktoren einer schlechten Prognose sind die Abnahme der linksventrikulären Ejektionsfraktion und das Auftreten von Herzinsuffizienzzeichen, stellte Professor Michael Böhm, Homburg, fest. Dies gilt auch dann, wenn die klinischen Zeichen der Herzschwäche nur diskret und vorübergehend waren. Die selektive Aldosteron-Blockade mit Eplerenon unterbindet die schädlichen AldosteronWirkungen am Myokard und unterbricht so den Prozess des myokardialen Remodellings. Experten tendieren deshalb heute dazu, Eplerenon so früh wie möglich einzusetzen: „Jeder Infarktpatient, der bei der Klinikaufnahme Zeichen der Herzschwäche zeigt, ist ein Kandidat für die selektive Aldosteron-Blockade“, so Prof. Zannad. Den hohen Nutzen des möglichst frühen Therapiebeginns untermauerte eine Subanalyse der EPHESUS-Studie (Eplerenone Post-AMI Heart failure Efficacy and Survival Study), in der Patienten, bei denen die Therapie zwischen Tag 3 und Tag 7 begann, eine noch bessere Prognose hatten als die Patienten, bei denen erst zwischen Tag 8 und Tag 14 mit der Behandlung begonnen wurde.7 EPHESUS-Studie: Je früher der Therapiebeginn, desto höher der Nutzen An der randomisierten, plazebokontrollierten Doppelblindstudie hatten 6632 Patienten mit klinischen Zeichen der Herzinsuffizienz in den ersten Tagen nach Myokardinfarkt teilgenommen. Eplerenon (zusätzlich zur Standardtherapie) reduzierte die Gesamtmortalität um 31%, die kardiovaskuläre Sterblichkeit um 32% und die Sterberate am plötzlichen Herztod sogar um 37%. Der günstige Effekt war anhaltend: Nach 16 Monaten lag die Gesamtmortalität in der Eplerenon-Gruppe um 15% niedriger als in der Kontrollgruppe.1 Das Herztodrisiko war um 21% und die Rate stationärer Behandlungen um 23% reduziert.1 Dabei profitierten Hochrisikopatienten mit Nicht-ST-Hebungsinfarkt (NSTEMI) im selben Ausmaß von der Eplerenon-Therapie wie Patienten mit ST-Hebungsinfarkt (STEMI).8 Der größte Gewinn der Eplerenon-Therapie wurde bereits in den ersten 30 Tagen erzielt. Hier kam es zu einer Risikoreduktion um 31% für die Gesamtmortalität (p = 0,004) und um 32% für die kardiovaskuläre Sterblichkeit.9 Zu einem großen Teil beruhte dieser Effekt auf einer Abnahme der Sterberate am plötzlichen Herztod um 37%.9 „Diese Ergebnisse sind einzigartig“, betonte Professor Bertram Pitt, Ann Arbor/Michigan (USA), auf dem Symposium „Managing Patients through the CV Risk Continuum“. Die Postinfarkttherapie mit ACE-Hemmern, AT1-Blockern und Betablockern kann dies nicht leisten, da sie den Aldosteron-Anstieg nicht verhindern kann. Pitt ist überzeugt davon, dass die frühe Aldosteron-Blockade bei Postinfarktpatienten entscheidend dazu beiträgt, die Entwicklung einer Herzinsuffizienz zu verhindern und die Sterblichkeit zu reduzieren, bevor eine klinisch manifeste Herzinsuffizienz entsteht. Ein Therapiebeginn vor dem dritten Postinfarkttag, vielleicht sogar direkt zum Zeitpunkt der Reperfusion, könnte demnach die Prognose dieser Patienten noch stärker verbessern, als dies in EPHESUS der Fall war. Zudem könnten bei einem solchen frühen Therapiebeginn auch die Patienten von Eplerenon profitieren, die bereits in dem „EPHESUS-Zeitfenster“ von drei bis sieben Tagen entlassen werden. 1 Pitt B et al. N Engl J Med 2003;348:1309-21. 2 Palmer BR et al. Eur Heart J 2008;29:2489-96. 3 Beygui F et al. Circulation 2006;114:2604-10. 4 Fraccarollo D et al. Hypertension 2008;51:905-14. 5 Ketelslegers JM et al. presented at ESC Congress 2008, München. 6 Hayashi M et al. Circulation 2003;107:2559-65. 7 Zannad F et al. Clin Cardiol 2007; 30: 414-5. 8 Zannad F et al. Heart Failure Congress 2008, Mailand. 9 Pitt B et al. J Am Coll Cardiol 2005;46:425-31. KORONARANOMALIEN Koronaranomalien – Wann besteht eine Indikation zur Intervention? – Jochen Müller-Ehmsen, Erland Erdmann Koronaranomalien fallen in ca. 1% der durchgeführten Koronarangiographien als Zufallsbefunde auf (nicht mitgerechnet sind getrennte Ostien für RCA und Conusast, die bei 50% der Bevölkerung vorkommen). Die häufigste Anomalie sind dabei getrennte Ostien von LAD und RCX (1%), gefolgt vom Abgang des Ramus circumflexus aus dem Ostium der rechten Koronararterie und vom Abgang aller Koronararterien aus einem Stamm aus dem linken Sinus Valsalvae. Danach folgen der Abgang aller Koronararterien aus dem rechten Sinus Valsalvae (Abbildung) und schließlich der Abgang der LAD aus dem rechten Sinus Valsalvae (ektoper Ursprung von Koronararterien insgesamt in 0,1 - 0,5% der Fälle). Während der RCX bei Abgang aus der RCA ungehindert zur Posterolateralwand ziehen kann, verläuft die LAD nach Abgang aus dem rechten Ostium meist zwischen Aorta und Truncus Pulmonalis nach ventral. Zwischen Aorten- und Pulmonaliswurzel kann es dann zur Kompression des Gefäßes mit Myokardischämie und plötzlichem Herztod kommen. Die Frage ist: Was tun, wenn eine Koronaranomalie entdeckt wird? Muss immer interveniert werden? Es ist nachvollziehbar, dass keine großen randomisierten Studien zu dieser Frage vorliegen, so dass man sich mit Erkenntnissen aus kleineren Untersuchungen und AutopsieStudien behelfen muss: Immerhin sind 15% der plötzlichen Todesfälle von Leistungssportlern auf das Vorliegen einer Koronaranomalie zurückzuführen, welche damit die zweithäufigste Ursache nach der HOCM ist. In 80% dieser Fälle verläuft die betroffene Koronararterie zwischen Aorta und A. pulmonalis. Die Leitlinien der American Heart Association empfehlen, dass Patienten mit einer Koronaranomalie eine chirurgische Koronarkorrektur erhalten sollten, wenn der LCA Hauptstamm zwischen Aorta und Pulmonalarterie verläuft, oder wenn eine Myokardischämie, die durch Kompression einer Koronararterie bedingt ist, diagnostiziert wird. Als sinnvoll wird ein korrigierende OP auch dann angesehen, wenn zwar keine Ischämie aber morphologisch eine Koronararterienkompression nachgewiesen wird (verminderter Fluss, Taillierung des Gefäßes). Und schließlich sollte nach den Leitlinien eine Operation zumindest erwogen werden, wenn die LAD zwischen Aorta und A. pulmonalis verläuft (unabhängig von allen anderen Kriterien) (Warnes et al.: Guidelines for adults with CHD. Circulation 2008; 118: e714-833). Die Operation sollte eine Korrektur-OP und keine einfache Bypass-Operation sein, da bei letzterer konkurrierende Blutflüsse entstehen, so dass in jedem Falle ein für solche Eingriffe erfahrener Chirurg aufgesucht werden muss. Auch wenn die rechte Koronararterie zwischen den beiden großen Arterien verläuft, besteht nach den Leitlinien der AHA eine Indikation zur Operation, zumindest dann, wenn Symptome auftreten oder eine Ischämie nachweisbar ist. Zwar ist grundsätzlich auch ein Stenting des die großen Arterien kreuzenden Koronararterienanteils möglich, jedoch liegen hierzu noch keine Langzeitergebnisse vor (Doorey et al., Am J Cardiol 2000; 86: 580-582). Die Abbildung zeigt die Koronarangiographie eines 68-jährigen Mannes, der sich mit unspezifischen Angina-pectoris-Beschwerden vorstellte. Sowohl LAD als auch RCX entspringen aus dem Ostium der rechten Koronararterie. Die RCA ist das dominierende Gefäß, während LAD und RCX eher klein angelegt sind. Da der Patient in keinem sehr guten Allgemeinzustand war und die Szintigraphie keinen Nachweis einer Ischämie erbracht hat, haben wir uns für ein konservatives Vorgehen entschieden. Gegen eine Operation spricht grundsätzlich auch die Tatsache, dass viele der Daten zur Gefährlichkeit von Koronaranomalien in Untersuchungen an Leistungssportlern gewonnen wurden. Damit bleibt letztendlich unklar, wie gefährlich die Anomalien für die Normalbevölkerung sind, während das OP Risiko bei fehlenden Komorbiditäten bei etwa 1% liegt, bei Vorhandensein von Komorbiditäten jedoch auch deutlich höher. Immerhin muss man bei der Entscheidung für oder gegen eine Operation auch berücksichtigen, dass unser Patient bereits 68 Jahre mit Koronaranomalie und ohne relevante Komplikationen überlebt hat. Abbildung: Koronarangiogaphie in LAO 90° eines 68-jährigen Patienten, bei dem die LAD und der RCX aus dem Ostium der RCA entspringen. 51 PRESSEMITTEILUNG Option für Patienten mit KHK und Angina pectoris-Beschwerden Mehr Möglichkeiten für Procoralan®: Zugelassen auch in Kombination zum Betablocker Die Europäische Arzneimittelagentur (EMEA) hat am 23. Oktober 2009 eine Erweiterung der Indikation für Procoralan® (Ivabradin) von Servier bekannt gegeben. Der /f-KanalHemmer, der erstmals eine selektive Herzfrequenzreduktion ermöglicht, ist seit dem 25. Oktober 2005 in der Europäischen Union für die symptomatische Behandlung der stabilen Angina pectoris bei Patienten mit normalem Sinusrhythmus zugelassen. Mit der Entscheidung der EMEA ist Procoralan® auch in Kombination zum Betablocker bei Patienten indiziert, die mit einer optimalen Betablockerdosis unzureichend eingestellt sind und deren Herzfrequenz >60/Min. liegt. Damit stehen in der Behandlung von KHK-Patienten mit Angina pectorisBeschwerden mehr Möglichkeiten offen. Grundlage der Indikationserweiterung waren die Ergebnisse der ASSOCIATE-Studie1, in der bei 889 bereits auf den Betablocker Atenolol eingestellten KHK-Patienten mit Angina pectoris nicht nur die Sicherheit der additiven Gabe von Procoralan® nachgewiesen wurde, sondern auch eine zusätzliche antianginöse und antiischämische Wirksamkeit. Nach 4 Monaten führte Procoralan® zusätzlich zum Betablocker im Vergleich mit Placebo zu einer signifikanten Senkung der Herzfrequenz und Besserung aller Belastungsparameter. Sowohl die Belastungsdauer, die Zeit bis zum Auftreten einer Angina pectoris sowie die Zeit bis zum Beginn einer STStreckensenkung konnten signifikant verlängert werden. Das Risiko für myokardiale Ischämien wird somit bei guter Therapiesicherheit durch die Kombination von Procoralan® zum Betablocker deutlich reduziert. ten KHK-Patienten mit linksventrikulärer Dysfunktion. Eine aktuelle BEAUT/fUL-Subgruppenanalyse3 von 1.507 Patienten mit Angina pectoris-Beschwerden ergab eine deutliche Reduktion des primären kombinierten Endpunktes aus kardiovaskulärem Tod, Hospitalisierung aufgrund eines akuten Myokardinfarkts sowie Herzinsuffizienz um 24 %. Bei initial höherer Herzfrequenz betrug die Risikoreduktion sogar 31 %. Für Herzinfarktbedingte Hospitalisierungen wurde eine signifikante Risikoreduktion von 42 % ermittelt, bei Patienten mit einer Herzfrequenz >70/Min. waren es sogar 73 %. Das Risiko einer koronaren Revaskularisation wurde um 30 bzw. 59 % gesenkt. Neben den vorliegenden klinischen Studiendaten bestätigt auch die REDUCTION-Studie mit 344 Patienten die Effektivität von Procoralan® in Kombination zum Betablocker in der täglichen Praxis. Sowohl hinsichtlich einer deutlichen zusätzlichen Reduktion der Herzfrequenz, als auch einer Verringerung der Angina-Attacken und des Nitrat-Verbrauchs. Die Verträglichkeit der Therapie wurde zu 99 % als sehr gut oder gut bewertet. Übereinstimmend unterstreichen die vorliegenden Studien, dass die meisten Patienten unter ihrer bisherigen Therapie, einschließlich Betablocker, bezüglich Symptomatik sowie Herzfrequenz-Zielwert (laut Leitlinien 5560/Min) nicht optimal eingestellt sind. Daher erscheint die zusätzliche exklusive Herzfrequenzreduktion mit Procoralan® ideal, um bei mehr KHK-Patienten mit Angina pectorisBeschwerden sowohl die Symptomatik als auch die Prognose zu verbessern. München im Dezember 2009 Dass Procoralan® in Kombination zum Betablocker zur weiteren Reduktion der Herzfrequenz auch hinsichtlich einer Besserung der kardiovaskulären Prognose effektiv ist, zeigte die BEAUT/fUL-Studie2 bei 10.917 zu fast 90 % bereits auf Betablocker eingestell- Literatur 1 Tardif JC et al., Eur Heart J 2009; 30: 540-548 2 Fox K et al., Lancet 2008; 372: 817-821 3 Fox K et al., Eur Heart J 2009; 30: 2337-2345 4 Ebelt H et al., Clin Res Cardiol 2009; 98(Suppl 2): P121 KORONARANOMALIEN Daher war anzunehmen, dass das OP-Risiko größer war als das natürliche Risiko des Patienten. Die prognostische Bedeutung eines Ischämienachweises ist unklar, aber es ist zu vermuten, dass bei positivem Nachweis die Prognose ungünstiger ist. Dieses findet in den Leitlinien entsprechend seinen Niederschlag, auch wenn durch Ischämiescreening und konservative Behandlung von Athleten mit fehlendem Ischämienachweis plötzliche Todesfälle nicht verhindert werden konnten (Warnes et al., Circulation 2008). Welche Methode der Ischämiediagnostik am günstigsten ist, ist dabei vollkommen ungeklärt, so dass jedes gut validierte Verfahren akzeptiert werden kann (Myokardszintigraphie/ SPECT, Stressechokardiographie oder Stress- MRT). Zusammenfassend ist die Datenlage, auf deren Grundlage Therapieentscheidungen für angeborene Koronaranomalien getroffen werden müssen, leider sehr dünn. Bei Verlauf der Koronararterien zwischen den großen Gefäßen (Aorta und A. pulmonalis) sollte bei symptomatischen Patienten über 50 Jahre (und bei allen Patienten unter 50 J.) eine Korrektur-OP an einem spezialisierten Zentrum durchgeführt werden, wenn das Operationsrisiko durch Komorbiditäten nicht relevant erhöht wird. In allen anderen Fällen, kann ein abwartendes Vorgehen mit regelmäßigen Verlaufskontrollen erfolgen. Anschrift der Verfasser: PD Dr. med. Jochen Müller-Ehmsen Prof. Dr. med. Erland Erdmann Klinik III für Innere Medizin der Universität zu Köln Kerpener Straße 62 · 50937 Köln E-mail: [email protected] 53 NEUE KLINISCHE STUDIE: PSYCHOTHERAPIE BEI DEPRESSIVEN KORONARPATIENTEN Neue klinische Studie: Psychotherapie bei depressiven Koronarpatienten – Christian Albus, Frank Lambertus, – Frank Vitinius Zahlreiche prospektive epidemiologische Studien haben gezeigt, dass depressive Symptome ein unabhängiger Prädiktor für die vorzeitige Entwicklung einer KHK und eine höhere kardiovaskuläre Morbidität und Mortalität sind (Ladwig et al., 2008; Lichtman et al., 2008). Als Hintergrund konnten sowohl ungünstige Effekte der Depressivität auf das Gesundheitsverhalten (mehr Rauchen, weniger Bewegung, ungesunde Ernährung, schlechtere Compliance gegenüber Medikation) als auch definierte psychophysiologische Auswirkungen (v. a. dysfunktionale Aktivierung der HPA-Achse und des sympathischen Nervensystems) identifiziert werden. Entsprechend kommt es zu vielfältigen, negativen Auswirkungen auf bekannte pathogenetische Faktoren der KHK, wie z. B. Verminderung der Herzfrequenzvariabilität, Erhöhung der Insulinresistenz und Intensivierung inflammatorischer Prozesse (Rozansky et al., 2005). Aktuelle kardiologische Leitlinien empfehlen von daher bei KHK-Patienten ein routinemäßiges Screening auf depressive Symptome und eine Therapie krankheitswertiger Störungen (z.B. Graham et al., 2007). Allerdings konnte bei KHK-Patienten bislang in keiner der vorliegenden Therapiestudien ein deutlicher Effekt auf depressive Symptome nachgewiesen werden. Ferner konnte bislang kein positiver Effekt auf die kardiale Prognose gesichert werden. Diese Lücken sollen jetzt mit einer multizentrischen, randomisierten klinischen Interventionsstudie geschlossen werden, an der sich auch das Kölner Herzzentrum beteiligt (Stepwise Psychotherapy Intervention for Reducing Risk in Coronary Artery Disease; SPIRR-CAD). Zielsetzung der durch die Deutsche Forschungsgemeinschaft (DFG) finanzierten SPIRR-CAD Studie ist die Evaluation einer gestuften Einzelund Gruppenpsychotherapie zur Behandlung depressiver Koronarpatienten hinsichtlich der Effekte auf Depressivität (Hauptzielkriterium), prädisponierende Persönlichkeitsmerkmale und somatische Risikofaktoren sowie Lebensqualität, Krankheitsverhalten, kardiale Ereignisse und Versorgungskosten. In zehn universitären Zentren sollen dazu im Ganzen mindestens 10.000 KHK-Patienten hinsichtlich depressiver Symptome gescreent und 569 Patienten in eine randomisierte, kontrollierte Interventionsstudie eingeschlossen werden. An der Kölner Universitätsklinik wird die Studie unter Leitung von Priv.-Doz. Dr. med. Christian Albus (Klinik und Poliklinik für Psychosomatik 54 und Psychotherapie) in Kooperation mit der Klinik III für Innere Medizin (Direktor: Univ.Prof. Dr. Erland Erdmann) durchgeführt. Eine Kooperation mit weiteren kardiologischen Kliniken ist geplant. Im Rahmen der Studie sollen über einen Zeitraum von 2 Jahren mindestens 1000 geeignete KHK-Patienten hinsichtlich depressiver Symptome gescreent werden. Bei Vorliegen klinisch-bedeutsamer Depressivität werden nach Ausschluss unmittelbarer Behandlungsindikationen (z. B. akute Suizidalität) vor Ort mindestens 60 Patienten in die klinische Studie einbezogen. In diesem Rahmen wird jeweils die Hälfte der Patienten entweder in den Interventionsarm (3 Einzeltherapiesitzungen, gefolgt von 25 Sitzungen Gruppenpsychotherapie im Falle anhaltender Symptome; Gesamtdauer 1 Jahr) oder in den Kontrollarm (ausführliches Beratungsgespräch zu psychosozialen Faktoren bei KHK) randomisiert. Die kardiologische Betreuung läuft in beiden Gruppen unbeeinflusst weiter. Inklusive einer einjährigen Nachbeobachtungsphase nach Therapieabschluss beträgt die Studiendauer für alle Patienten jeweils 2 Jahre. Nähere Informationen und Möglichkeiten zur Studienteilnahme können gerne beim Autor eingeholt werden. Autor und Ansprechpartner: Priv.-Doz. Dr. med. Christian Albus Klinik und Poliklinik für Psychosomatik und Psychotherapie Universität zu Köln Kerpener Straße 62 50937 Köln Tel.: 0221 478 4365 Fax: 0221 478 6261 e-mail [email protected] Literatur: Graham I, Atar A, Borch-Johnsen, Boysen G, Burell G, Cifkova R, Dallongeville J, De Backer G, Ebrahim S, Gjelsvik B, Herrmann-Lingen C, Hoes A, Humphries S, Knapton M, Perk J, Priori SG, Pyorala K, Reiner Z, Ruilope L, Sans-Menendez S, Scholte op Reimer W, Weissberg P, Wood D, Yarnell J, Zamorano JL. European guidelines on cardiovascular disease prevention in clinical practice: full text. Eur J Cardiovasc Prev Rehab 2007, 14 (Suppl 2): S1-S113. Ladwig KH, Lederbogen F, Völler H, Albus C, HerrmannLingen C, Jordan J, Köllner V, Jünger J, Lange H, Fritzche K. Positionspapier zur Bedeutung von psychosozialer Faktoren in der Kardiologie. Der Kardiologe 2008;4: 274-287. Lichtman JH, Bigger JT, Blumenthal JA, Frasure-Smith N, Kaufmann PG, Lesperance F, Mark DB, Sheps DS, Taylor CB, Froelicher ES. Depression and coronary heart disease. Recommendations for screening, referral, and treatment. A science advisory from the american heart association prevention committee of the council on epidemiology and prevention, and interdisziplinary council on quality of care and outcomes research. Circulation 2008; 118:1768-1775. Rozanski A, Blumenthal JA, Davidson KW, Saab PG, Kuzansky L: The epidemiology, pathophysiology, and management of psychosocial risk factors in cardiac practice: the emerging field of behavioral cardiology. J Am Coll Cardiol 2005;45:637-651. SPENDEN Spenden Unterstützen Sie den Förderverein Herzzentrum Köln e.V. mit einer Spende. Die Realisierung seiner vielfältigen Aufgaben, die der Förderverein e.V. rückblickend bereits finanziert hat und zukünftig zu finanzieren beabsichtigt, ist Dank seiner zahlreichen Mitglieder sowie großzügigen Spender erst möglich. Unterstützen auch Sie unsere Aktivitäten für die Gesundheit der Kölner Bürgerinnen und Bürger, z. B. mit einer Spende per Banküberweisung bzw. Ihrer Mitgliedschaft, die nur 30,00 Euro im Jahr kostet und Ihnen zahlreiche Vorteile bietet. Spendenkonto Als gemeinnütziger Verein ist der Verein der Freunde und Förderer des Herzzentrums des Universitätsklinikums Köln e.V. bei der Finanzierung und Umsetzung seiner Aufgaben und Projekte ausschließlich auf Mitgliedsbeiträge und Spenden angewiesen. Der Verein verfolgt wissenschaftliche Zwecke. Sie können regelmäßig oder gelegentlich spenden. Falls Sie uns zu festgelegten Zeiten eine bestimmte Spende geben wollen, erteilen Sie uns einfach eine Einzugsermächtigung zum Abbuchen des Betrages von Ihrem Konto. Der Verein der Freunde und Förderer des Herzzentrums des Universitätsklinikums Köln e.V. ist gemäß § 5 Abs. 1 Nr. 9 KStG durch Bescheinigung des Finanzamtes Köln-West, Steuer-Nr. 223/5921/0946, vom 06. 11. 2008 von der Körperschaftssteuer befreit. Bis 200,00 Euro gilt die Quittung als Zuwendungsbestätigung. Für Spenden über 200,00 Euro übersenden wir unaufgefordert eine Zuwendungsbestätigung. Spendenkonto: Verein der Freunde und Förderer des Herzzentrums des Universitätsklinikums Köln e.V. Sparkasse KölnBonn · Konto-Nr. 38382974 · BLZ 370 501 98 ✂ Überweisung/Zahlschein Beleg/Quittung für den Auftraggeber Konto-Nr. des Auftraggebers: Empfänger: Verein der Freunde und Förderer des Herzzentrums des Universitätsklinikums Köln e.V. Kerpener Straße 62 · 50924 Köln Konto-Nr. des Empfängers: Verein der Freunde und Förderer des Herzzentrums des Universitätsklinikums Köln e.V 3 8 3 8 2 9 7 4 3 7 0 5 0 1 9 8 Sparkasse KölnBonn 38382974 Sparkasse KölnBonn Verwendungszweck: EUR EUR: Auftraggeber/Einzahler: Datum: ✂ 18 55 VORWORT Zufrieden? Ihre Meinung ist uns wichtig! Fragebogen bitte senden an: Am Wiesengrund 1 40764 Langenfeld Tel.: 02173 1095-100 IPV – Informations-Presse-Verlags Gesellschaft mbH Am Wiesengrund 1 Fax: 02173 1095-111 40764 Langenfeld E-Mail: [email protected] Web: www.ipv-medien.de sehr gut 1. Wie gefällt Ihnen die Fachzeitschrift insgesamt? 2. Wie hat Ihnen die Fachzeitschrift weitergeholfen? 3. Wie beurteilen Sie folgende Teilaspekte? – Informationsgehalt gut weniger gut gar nicht – Themenauswahl – Übersichtlichkeit – Verständlichkeit – Layout Das würde ich mir anders wünschen: Ihre Kontaktdaten: Vielen Dank fürs Mitmachen! 57 DAS KÖLNER HERZZENTRUM / IMPRESSUM Das Kölner Herzzentrum – Fachzeitschrift für den Arzt Initiativ-Partner des Kölner Herzzentrums Daiichi – Sankyo Deutschland GmbH Seite 4, 42, 44, 3.US, 4.US Pfizer Pharma GmbH Seite 2.US, 6, 8, 38, 40, 50 Wir danken folgenden Werbepartnern für ihre Unterstützung: Seite Unternehmen 14 Lilly 10 Medtronic 12 Helios Rehazentrum Bad Berleburg 16 Bust – Steuerberatungsgesellschaft mbH 24 Dr. Schmitz & Partner 24 Fehling Instruments 24 Median Reha-Zentrum Bernkastel-Kues 30, 52 Servier Deutschland GmbH 30 Mitsubishi Pharma Deutschland GmbH 33, 34 B. Braun Melsungen AG IMPRESSUM Das Kölner Herzzentrum – Fachzeitschrift für den Arzt Herausgeber: Klinikum der Universität zu Köln, Vorstand (V.i.S.P.) Redaktion: Prof. Dr. med. Erland Erdmann Universitätsklinikum Köln Herzzentrum Kerpener Straße 62 · 50924 Köln Tel.: 0221 478 32 511 Fax: 0221 478 32 512 E-mail: [email protected] Web: www.herzzentrum-koeln.de 58 Verlag und Anzeigenverwaltung: IPV-Informations-Presse-Verlags Gesellschaft mbH Am Wiesengrund 1 · 40764 Langenfeld Tel.: 02173 1095-100 Fax: 02173 1095-111 Email: [email protected] Web: www.ipv-medien.de Gesamtherstellung: HPH Grafik-Design Syburgweg 44 · 58119 Hagen Tel.: 02334 50 44 75 Fax: 02334 50 44 76 E-mail: [email protected] Web: www.hph-grafik-design.de Auflage: 5.000 Stück – Januar 2010