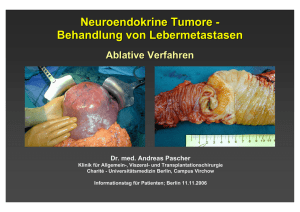
Chirurgische Möglichkeiten und alternative Verfahren
Werbung
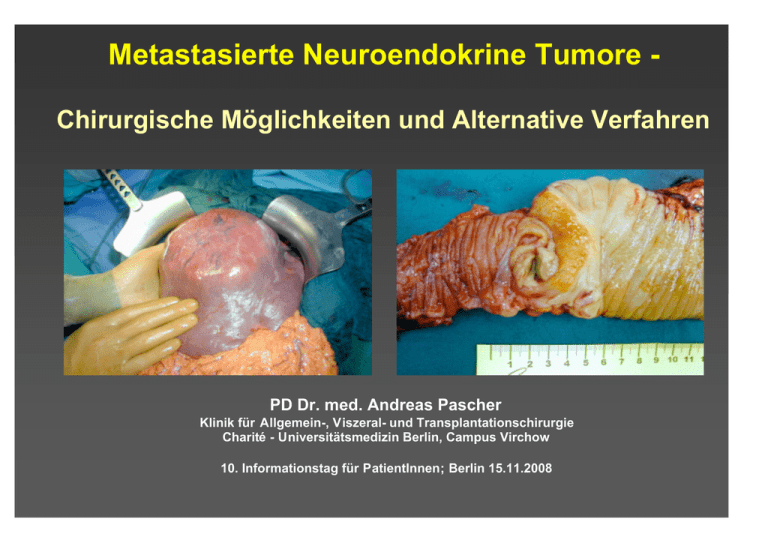
Metastasierte Neuroendokrine Tumore Chirurgische Möglichkeiten und Alternative Verfahren PD Dr. med. Andreas Pascher Klinik für Allgemein-, Viszeral- und Transplantationschirurgie Charité - Universitätsmedizin Berlin, Campus Virchow 10. Informationstag für PatientInnen; Berlin 15.11.2008 Aktuelle klinische Standards Leitlinienkonferenz “Kolorektales Karzinom” 2004 30.06.2004 Patienten mit auf die Leber oder Lunge beschränkten resektablen Metastasen sollten primär reseziert werden (Evidenzstärke 4). Eine Indikation für eine adjuvante Theapie nach R0-Resektion (Evidenzstärke 2-a) oder neoadjuvante Therapie (Evidenzstärke 3-b) außerhalb von Studien besteht nicht. Empfehlungsgrad: A, starker Konsens Anmerkungen: Die Indikation zur primären Resektion von Lebermetastasen hängt ab von Lokalisation der Lebermetastasen in Bezug zu großen Gefäßen, etwaiger vorhandener Vorschädigungen der Leber (z.B. Steatosis) sowie erwartetem Residualvolumen nach Resektion und Erfahrung des Operateurs. Voraussetzung ist, dass eine RO-Resektion grundsätzlich möglich erscheint. Die Patienten sollten ausgewiesenen Zentren vorgestellt werden. Resektion kolorektaler Lebermetastasen Überlebenswahrscheinlichkeit 1.0 Resektion in kurativer Absicht (n = 226) (n = 62) resektabel, unbehandelt (n = 921) nicht resektabel 0.8 0.6 0.4 7 0.2 0.0 0 1 2 3 4 5 6 7 Jahre nach Laparotomie Scheele et al., al Br J Surg 1989 8 9 10 Resektion von neurendokrinen Lebermetastasen Überlebenswahrscheinlichkeit (170 Patienten) 1 0,8 0,6 Überleben Erneute Symptome 0,4 0,2 0 0 6 12 18 24 30 36 42 Monate nach Leberresektion Samiento et al., J Am Coll Surg 2003 48 54 60 ENETS-Empfehlungen zur Behandlung von Lebermetastasen neuroendokriner Tumoren Neuroendocrinology 2008 ENETS-Empfehlungen zur Behandlung von Lebermetastasen neuroendokriner Tumoren Neuroendocrinology 2008 Ergebnisse der chirurgisch-resektiven Therapie bei hepatisch metastasierten NET Autor Jahr Anzahl perioperative (n) Mortalität (%) Que 1995 74 1.6 Dousset 1996 17 5.9 Ahlmann 1996 14 0 Chen 1998 15 0 Chamberlain 2000 34 6 Grazi 2000 19 0 Pascher 2000 25 0 Jaeck 2001 13 0 Nave 2001 31 0 Sarmiento 2003 170 1.2 SymptomÜberleben kontrolle (%) (%) 90 74% (4J) 88 46% (4J) 100 100% (5J) 73% (5J) 90 76% (5J) 92% (4J) 76% (5J) 91% (3J) 47% (5J) 96 61% (5J) Chirurgische Therapie hepatisch metastasierter NET • Primärtumorentfernung • Aussicht auf R0 - Resektion (kurative Therapie) • Bilobäre u./o. multilokuläre Lebermetastasen bei – Aussicht auf R0 - Resektion – Unzureichender medikamentöser Palliation durch große Tumormassen (Debulking - 90% Resektion) – Nichtansprechen auf Therapie „Nonresponder“ – Stable disease / metachronen Lebermetastasen – Vertretbares Operationsrisiko Resektion von neurendokrinen Lebermetastasen Berliner Erfahrung OP vs. konservativ metachron vs. synchron 100 100 P=0.010 60 40 20 0 60 40 20 operiert R0,R2 (n=47) nicht operiert (n=27) 1 2 3 4 5 6 7 Jahre 8 9 10 11 12 13 14 P=0.020 80 Überleben [%] Überleben [%] 80 0 metachron (n=19) synchron (n=55) 1 2 3 4 5 6 7 Jahre 8 9 10 11 12 13 14 Unabhängige positive prognostische Faktoren (Multivariate Analyse) Variable p-Wert Exp B 95% Konfidenzintervall des Exp B metachron vs. synchron 0.020 3.029 1.179 - 7.782 Operative Therapie vs. konservativer Therapie 0.010 3.651 1.699 - 7.848 Wachstumsfraktion ≤/> 10% <0.001 5.265 2.390 - 11.595 Wie erreicht man R0 Resektionen? Limitierend • • • • Ausmaß der Leberresektion Leberfunktion Lokalisation des Tumors Allgemeinzustand des Patienten Wie wird der Befund operationsfähig? CT-gesteuerte Embolisation der rechten Pfortader • Embolisation der Gefäßversorgung tumortragenden Seite • Alternativ: V. porta oder A.hepatica Lebermetastasen Möglichkeiten bei nicht resektablen Lebermetastasen • kombinierte Verfahren: Resektion + art. Chemotherapie Resektion + ablatives Verfahren portal-venöse Embo. + Resektion • intraarterielle Chemotherapie • Transarterielle Chemoembolisierung (TACE) • Laser induzierte Thermotherapie (LITT) • Radiofrequenzablation (RFA; RITA) • Kryotherapie • (Ethanolinjektion) Behandlung nicht operabler Lebermetastasen Lebertransplantation bei hepatisch metastasierten Neuroendokrinen Tumoren Lehnert , Transplantation 1998; 66:1307 Lebertransplantation bei hepatisch metastasierten Neuroendokrinen Tumoren Lehnert , Transplantation 1998; 66:1307 positive prognostische Faktoren prognostische Faktoren negative - Alter < 50 Jahre - Primärtumor: Dünndarm Lunge - Alter > 50 Jahre - extensive Chirurgie , (Whipple - OP, obere abdominelle Exenteration 5-Jahres-Überleben ca. 65% 5-Jahres-Überleben < 30% Lebertransplantation bei hepatisch metastasierten Neuroendokrinen Tumoren Kaplan-Meier Schätzung • 2 günstige prognostische Faktoren • 1 günstiger prognostischer Faktor • kein günstiger prognostischer Faktor Lehnert , Transplantation 1998; 66:1307 Zusammenfassung - Lebertransplantation • Restriktive, individuelle Indikationsstellung • Alter < 50 Jahre • Primärtumor im Dünndarm und Lunge • Ausschluß von regionalen Lymphknotenmetastasen bzw. anderen extrahepatischen Tumormanifestationen • Keine begleitenden, extensiven chirurgischen Eingriffe • (Exenteration/Whipple-OP) • (Ki67 < 5%) • (Reguläre E-cadherin Expression) Alternative - Lokale Tumordestruktion PEI Laser Radiofrequenzablation (RFA/RITA) • Erzeugen von Hitze durch Friktion auf molekularem Level durch hochfrequenten Wechselstrom • Erhitzen Gewebes auf 90-95°C und 100105°C Cryotherapie RFA-Erfahrung in Deutschland Birth M. Chirurg 2004 RFA - Durchführung Birth M. Chirurg 2004 RFA - Durchführung Unterschiedliche RFA - Systeme Unterschiedliche Therapiealgorithmen Berber E. Surg Endosc 2004 Lokale Tumordestruktion Zwerchfell RITA-Sonde Vor Beginn Ultraschallkopf Leber Nach 15 Minuten RFA-Erfahrung in Deutschland 25% der behandelten Patienten hatten resektable Tumormanifestationen ! Birth M. Chirurg 2004 Multivariate Metaanalyse Lokalrezidiv nach RFA bei Lebermetastasen (95 Studien; 5224 Patienten) • • • RFA - Perkutan RFA - Laparoskopie RFA - Laparotomie 68% 12% 20% Rezidivrate • nach 1 Jahr • Perkutan • Laparoskopie • Laparotomie 12,4% 16,4% 5,8% 4,4% (p<0,001) • • • 58,1% 24,5% 14,1% (p<0,001) Tumor > 5cm Tumor 3-5cm Tumor < 3cm Mulier S. Ann Surg 2005 Multivariate Metaanalyse Lokalrezidiv nach RFA bei Lebermetastasen (95 Studien; 5224 Patienten) Multivariate Analyse Signifikante Einflußfaktoren für eine niedrige Rezidivrate: • Tumorgröße (p<0.001) • Chirurgisches vs. Perkutanes Vorgehen (p<0.001) Einfluß der Tumorart auf Rezidivrate (p<0.001) Tumorart Anzahl Leberzell - Carcinom 2369 Dickdarm - Carcinom 763 Nicht näher spezifiziert 1046 Brustkrebs 97 Neuroendokriner Tumor 330 Mulier S. Ann Surg 2005 Rezidivrate 14,9 14,7 9,8 8,2 3,3 Multivariate Metaanalyse Lokalrezidiv nach RFA bei Lebermetastasen (95 Studien; 5224 Patienten) Tumor-abhängige Faktoren, die Rezidivrate positiv beeinflussen (univariat) • Tumorgröße • Neuroendokrine Metastasen • Oberflächenferne Lokalisation • Gefäßferne Lokalisation Behandlungs-abhängige Faktoren, die Rezidivrate positiv beeinflussen (univariat) • Offene Anwendung • Durchblutungsunterbrechung • Intubationsnarkose • 1cm Koagulationsabstand • Erfahrung des Operateurs Mulier S. Ann Surg 2005 Stellenwert der RFA bei Lebermetastasen 1. Nicht-resektable Lebermetastase(n) (nach zeitgemäßen Kriterien) 2. Komorbidität oder zugrunde liegende Erkrankung schließen Leberresektion aus 3. Ungünstig (zentral) lokalisiertes Rezidiv nach Resektion 4. Restbefund nach ausgedehnter Leberresektion Stellenwert der RFA / LITT bei Lebermetastasen 1. Bestandteil von interdisziplinären Behandlungskonzepten nach kompetenter Abschätzung der Resektabilität (durch erfahrenen Leberchirurgen) 2. Kein Ersatz für chirurgische Resektion bei resezierbaren Tumoren 3. Unklare Rolle als Kombinationstherapie mit chirurgischer Resektion 4. Unklare Rolle in der Tumormassenverringerung Behandlung nicht operabler Lebermetastasen Medikamentöse Therapie - Chemotherapie - Antiproliferative Therapie - Biotherapie / Interferon Radionuklidtherapie Therapiealgorithmus für NET - Lebermetastasen Chirurgische Therapie von Lebermetastasen neuroendokriner Tumore Synchron Metachron (oder hepatisches Rezidiv) Einseitig Beidseitig Nicht resektabel * Resektabel Resektion Resektion - Einstufig - Zweistufig - Erweitert - Ggf. mit ablativer Therapie Systemische Therapie Resektion Ablative Therapie (RFA,LITT) -Ggf. mit ablativer Therapie (RFA,LITT) TACE Debulking * Lebertransplantation in Selektierten Fällen Consensus Conference on the ENETS Guidelines for the Diagnosis and Treatment of Neuroendocrine Gastrointestinal Tumors; Frascati, Italy 11/2006