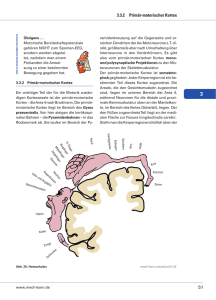
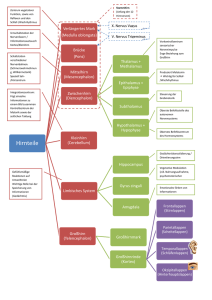
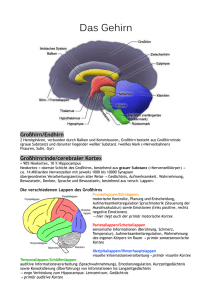
1.2 Strukturelle und funktionelle Anatomie des
Werbung

1.2 Strukturelle und funktionelle Anatomie des Zentralnervensystems BRUNO PREILOWSKI, MARIO PAULIG, MARIO PROSIEGEL Strukturelle Anatomie des Zentralnervensystems BRUNO PREILOWSKI Zusammenfassung Neuroanatomische Kenntnisse sind für den Neuropsychologen unabdingbar und daher auch ein wichtiger Teil des Curriculums: In diesem ersten Unterkapitel werden vor allem die wesentlichen Strukturen des Zentralnervensystems beschrieben, und zwar sowohl in ihrer grobmorphologischen Gliederung und ihrem Aufbau als auch mit ihren Verbindungen untereinander. Dabei geht es nicht nur um das Vokabular in der Benennung von Organteilen und der Orientierung innerhalb des ZNS, sondern auch darum, anzuregen, „die Neuroanatomie ernst zu nehmen“. So sollten beispielsweise die unterschiedlichen Formen der Bauteile des ZNS oder die verschiedenen Verhältnisse von weißer und grauer Substanz innerhalb bestimmter ZNS-Strukturen als Hinweise auf mögliche funktionelle Unterschiede erkannt werden. Die für ein Neuroanatomiekapitel relativ geringe Anzahl von Überblicksabbildungen kann mit Hilfe der im Internet verfügbaren riesigen Mengen an Abbildungen des Gehirns und entsprechenden Atlanten leicht kompensiert werden. Das Kapitel kann somit auch gewissermaßen als ein kommentiertes Inhaltsverzeichnis des Gehirns betrachtet und benutzt werden. Die klinische Neuropsychologie beschäftigt sich mit den veränderten Wahrnehmungsleistungen sowie den kognitiven und affektiven Verhaltensmöglichkeiten von Patienten. Sie versucht diese Veränderungen zu analysieren und Hilfen anzubieten, mit ihnen umzugehen und so die Lebensqualität der Patienten zu maximieren. Die eigentliche Arbeit des Neuropsychologen spielt sich also auf der Verhaltensebene ab. Dennoch sind für ein Verständnis der Probleme des Patienten Kenntnisse der strukturellen und funktionellen Anatomie von großer Hilfe. Dies gilt vor allem für die Einschätzung des möglichen Verlaufs der Beeinträchtigungen sowie für die Kommunikation mit den Patienten und ihren Vertrauenspersonen über Ziele und Möglichkeiten einer Behandlung. Angesichts der Komplexität des menschlichen Gehirns mag man diesen Bezug zur Anatomie in Zweifel ziehen. Immerhin haben wir es hier mit einem System zu tun, das aus 33 Kap. 1.2 Strukturelle Anatomie des Zentralnervensystems Das Nervensystem kann man nach morphologischen und funktionellen Gesichtspunkten unterteilen. In den nachfolgenden Abbildungen Ànden sich, außer den im Text erwähnten, weitere in der Literatur verwendete Bezeichnungen. Hier zeigt sich bereits ein Problem der Anatomie, das uns immer wieder begegnen wird, nämlich die Verwendung einer Vielzahl von Begriffen für ein und die selbe Struktur. Vereinbarungen, wie die Pariser Nomina Anatomica (PNA) von 1955 oder die Terminologia Anatomica (FCAT, 1998) werden leider nur selten beachtet. Bezüglich der Orientierung im Nervensystem, sowohl was die Zuordnung zu bestimmten morphologisch und funktionell deÀnierten Teilbereichen betrifft, als auch bezüglich der räumlich, topographischen Lage, ist die Darstellung der Entwicklung des Nervensystem eine große Hilfe. Aus der embryonalen Neuralplatte entsteht nach der zweiten Entwicklungswoche das Neuralrohr. Die blasenförmigen Aufweitungen dieses Neuralrohres lassen bereits die wichtigsten Strukturen des Zentralnervensystems erkennen. Zur weiteren Verdeutlichung dieser Gehirngliederung bleiben wir erst einmal bei einer Art Modelltier mit einer geradlinigen Neuraxis. Im Vergleich der Wirbeltiere ist diese lineare Ausrichtung dann beispielsweise von den Amphibien zu den Vögeln und den Säugern hin nicht mehr so deutlich, da sich – je nach Tierart – einzelne Hirnbereiche im Verhältnis zu den an- Unterteilungen des Nervensystems nach morphologischen Gesichtspunkten: Unterteilungen des Nervensystems nach funktionellen Gesichtspunkten: geschätzten 100 Milliarden Nervenzellen mit 100 Billionen Verbindungen besteht. Komplizierend kommen noch die EinÁüsse verschiedener Überträgerstoffe an jeder einzelnen Synapse hinzu sowie die Auswirkungen von retrograden Botenstoffen und Transportern auf die Konzentration von Transmittern im synaptischen Spalt und in der präsynaptischen Zelle. Und eigentlich müsste man auch noch die BeeinÁussungen durch 1000 Milliarden Gliazellen sowie die Interaktionen mit dem System der Blutversorgung und dem endokrinen Apparat berücksichtigen. Auf der anderen Seite aber sehen wir gerade in der Entwicklung und im Aufbau des Gehirns sowie in den Auswirkungen von pathologischen und traumatischen Veränderungen auf das Verhalten eine Regelhaftigkeit, die uns die Illusion eines modellhaften Verständnisses der Gehirn-Verhaltenszusammenhänge belässt. Einige der wichtigsten Grundregeln der strukturellen und funktionellen Anatomie des Zentralnervensystems werden im Folgenden beschrieben. Die Unterteilung des Nervensystems und Konventionen zur Orientierung im Nervensystem Zentralnervensystem (ZNS): Nervengewebe, welches im Schädel und im Wirbelkanal der Wirbelsäule eingeschlossen ist. Peripheres Nervensystem (PNS): Nerven des Kopfes, Rumpfes und der Extremitäten nach ihrem Austritt aus dem ZNS. unterteilbar in: Gehirn (Encephalon) und Rückenmark unterteilbar in: 12 Hirnnerven (Nervi craniales) und 31 Spinal- oder Rückenmarksnerven (N. spinales) Vegetatives Nervensystem: auch viszerales, autonomes, idiotropes NS genannt. Nervensystem der inneren Organe (Eingeweide, Blutgefäße, Drüsen, etc.) zur Aufrechterhaltung des inneren Milieus. unterteilbar in: Sympathisches u. Parasympathisches NS Somatisches Nervensystem: auch animalisches, zerebrospinales, oikotropes NS genannt. Nervensystem der Sinnesorgane und gestreiften Muskulatur zur Interaktion mit der Umwelt. 34 B. Preilowski deren stärker entwickeln. Beim höheren Säuger wird das besonders an der Vergrößerung des Telencephalons deutlich. Bei einer solchen geradlinigen Neuraxis ist die eindeutige räumliche Orientierung relativ einfach: Vorn und hinten sind mit Begriffen wie „rostral“ (schnabelwärts) und „caudal“ (schwanzwärts) unverwechselbar zu beschreiben. Ähnliches gilt für „ventral“ (bauchseitig) und „dorsal“ (rückenseitig). Auch zusätzliche Begriffe, wie „frontal“, „oral“ und „anterior“ (für vorn) sowie „posterior“ und „occipital“ (für hinten) lassen sich ebenfalls noch gut in dieses Schema integrieren. Wichtig ist hier aber, dass eine Unverwechselbarkeit nur bezüglich der Neuraxis gegeben ist, d.h. das diese topographischen Begriffe unabhängig von der Lage der Neuraxis, bzw. des dazugehörenden Tieres im Raum verstanden werden müssen. Wenn man sich strikt an diese Vorschrift hält, ist auch die beim Menschen auftretende Komplikation durch einen Knick in der Neuraxis leicht zu meistern. Der Vollständigkeit halber sollten noch die Begriffe für ‚zur Mitte hin‘ = „medial“, ‚zur Seite‘ = „lateral“, ‚weiter entfernt (von der Mittellinie)‘ = „distal“ und ‚näher (zur Mittellinie)‘ = „proximal“ ergänzt werden. Schließ- lich gibt es für die Richtungsangaben bezüglich der Orientierung von Nervenzellen mit ihren Axonen bzw. von Nervenfaserbündeln (im ZNS jeweils als „Tractus“ und im PNS als „Nervus“ bezeichnet) die Bezeichnung von „afferent“ und „efferent“. Erstere bedeutet eine Zuleitung und die zweite eine Wegleitung. In ähnlicher Weise wird der Zusatz „-petal“ bzw. „-fugal“ verwendet. Eine Nervenfaserverbindung zum Thalamus hin ist also eine Afferenz des Thalamus oder eine thalamopetale Verbindung; eine Bahn vom Thalamus beispielsweise zum Kortex, wäre dagegen eine Efferenz des Thalamus oder thalamo-fugal. Darüber hinaus könnte man diese Bahn auch als thalamo-kortikale Verbindung bezeichnen, wobei jeweils der Ursprungsort zuerst und der Zielort zuletzt genannt wird. Bei Hirnschnittdarstellungen werden vor allem drei Schnittebenen unterschieden, die sagittale, horizontale (axiale) und frontale (koronare). Diese Schnittebenen lokalisiert man mit Bezug auf den Nullpunkt eines dreidimensionalen Achsensystems. Positive Zahlenwerte kennzeichnen den Durchgang des Schnittes vor, über oder rechts vom Nullpunkt, negative Werte hinter, unter oder links des Ursprungs des Koordinatensystems (Abb. 1). Sagittal tal on iz or H l ta on Fr Abb. 1. Die drei Schnittebenen durch das Gehirn. Kap. 1.2 Strukturelle Anatomie des Zentralnervensystems Die folgenden Abbildungen sind Darstellungen von Kernspinaufnahmen (Dicom Dateien) mit Hilfe des Programms MRIcro Abb. 2. (Fast) mitt-sagittaler Schnitt. Abb. 3. Horizontalschnitt. 35 (http://www.sph.sc.edu/comd/rorden/mricro. html) (Abb. 2-4). 36 B. Preilowski Abb. 4. Frontal- bzw. Koronarschnitt. Die Bauteile des Nervensystems und Gehirns Neurone Das Nervensystem ist im Wesentlichen aus Nervenzellen (Neuronen) und Gliazellen aufgebaut. Alle Neurone ähneln sich in Struktur und Funktion: Sie schließen alle ihre Zentralund Haushaltsorgane (Zellkern und Organellen) in eine Lipid-Protein-Membran ein, die selektiv durchlässig ist, wobei die Durchlässigkeit durch EinÁüsse von inner- und außerhalb der Zelle verändert werden kann. Und sie sammeln innerhalb eines Einzugsbereichs, der durch die Ausbreitung ihrer Dendriten (afferente Aufnahmeorgane) bestimmt wird, Informationen in Form von De- oder Hyperpolarisationen ihrer Membran; sie summieren diese über eine gewisse Zeit und erzeugen, wenn ein bestimmter Schwellenwert erreicht wird, in ihren Effektororganen, den Axonen, ein Alles-oder-Nichts-Signal. Aber Neurone unterschieden sich auch in vielfältiger Art und Weise. Schon mit der Entdeckung der Tatsache, dass das Nervensystem aus diskontinuierlich gruppierten einzelnen Zellen besteht, wurde von den Neuroanatomen auf die Vielfalt ihrer Formen hingewiesen. Unübertroffen ein- drucksvoll sind die Abbildungen von Santiago Ramon y Cajal, der mit Hilfe einer Färbetechnik, die ausgerechnet von dem ausdrücklichen Gegner der Neuronentheorie, von Camillo Golgi, entwickelt worden war, einzelne Neurone anfärben, in überlagerten Hirnschnitten verfolgen und nachzeichnen konnte (Cajal, 1911). Aus Abbildung 5 wird unmittelbar einsichtig, dass sich hinter den verschiedenen Formen unterschiedliche Spezialisierungen verbergen. Nervenzellen unterscheiden sich auch in ihrer Größe oder im Volumenverhältnis vom Zellkörper zu seinen Fortsätzen oder nach der Ausbreitung der dendritischen Zweige sowie der Länge und Dicke der Axone. Betrachtet man allein die Größe, so kann man beispielsweise Körnerzellen mit 10 μm neben Pyramidenzellen von 800 μm Ànden, sowie Zellen mit einer Axonlänge im Millimeterbereich und solche mit Fortsätzen, die beim Menschen bis zu einem Meter lang sind. Für die Zellen mit längeren Fortsätzen kann man auch systematische Zusammenhänge zwischen Durchmesser und Dicke sowie Art der Myelinisierung und Leitungsgeschwindigkeit errechnen. Dabei zeigt sich eine erstaunlich große Varianz in den Durchmessern von 37 Kap. 1.2 Strukturelle Anatomie des Zentralnervensystems A D B E C F Abb. 5. Unterschiedliche Neuronen aus (A) dem Cortex cerebri, (B) Cerebellum, (C) Hippokampus, (D) Thalamus dorsalis, (E) Pons und (F) Nucleus caudatus (abgeändert nach Cajal, 1911). 0.5 bis 12 μm und entsprechend in der Geschwindigkeit von weniger als 1 m bis zu über 100 m pro Sekunde. Mit der Verbesserung der mikroskopischen Techniken konnte man auch feinere Details an den Nervenzellen unterscheiden. Ein wichtiges Merkmal sind dabei die Spines, kleine Dornen oder Ausstülpungen, die vor allem an den Dendriten zu Ànden sind. Diese Dornen scheinen Kompartimente für bestimmte biochemische Prozesse darzustellen. So könnte die Form der Dornen die Fortleitung der Erregung beeinÁussen und diese Formveränderungen zusammen mit Veränderungen an den Synapsen das Substrat für Plastizität bzw. Lernen und Gedächtnis darstellen (Holmes, 1990). Durch die Möglichkeit, bestimmte Zellen gezielt (d.h. nicht mehr oder weniger zufällig, wie dies bei der Golgi Methode der Fall ist) in ihrer Gesamtheit anzufärben und mit Hilfe des Computers dreidimensional zu rekonstruieren, konnte man immer neue Formen von Neuronen und synaptischen Verbindungen erkennen. Darüber hinaus kann man jetzt Nervenzellen selektiv nach ihrer Affinität für bestimmte Substanzen markieren und damit KlassiÀzierungen nach metabolischen und Transmitter- 38 charakteristika vornehmen. Mittlerweile schätzt man, dass es ungefähr 10.000 unterschiedliche Typen von Nervenzellen gibt. Auf der anderen Seite kommt eine Unterteilung in funktioneller Hinsicht mit sehr viel weniger Kategorien aus, und die alte Unterscheidung von exzitatorischen und inhibitorischen Verbindungen leistet dabei immer noch gute Dienste. Gliazellen Obwohl es im Nervensystem von Wirbeltieren 10 bis 50mal so viele Gliazellen (Glia = Leim, Kitt) wie Neurone gibt, wissen wir vergleichsweise wenig über sie und über ihr in vivo Verhalten fast gar nichts. Der im Zentralnervensystem in größter Zahl auftretende Zelltyp ist die Oligodendroglia, die hier die Aufgabe der im peripheren Nervensystem zu Àndenden Schwannschen Zelle übernimmt. Sie bildet nämlich die Myelinscheiden. Im Unterschied zur Schwannschen Zelle kann sie jeweils mehrere Nervenzellfortsätze gleichzeitig umhüllen. Die Astroglia bzw. die Astrozyten, bilden vielfältige (sternförmige) Fortsätze aus, die zwischen den Blutgefäßen und der weichen Hirnhaut, der Pia mater, wie auch zwischen Nervenzellen Kontakte herstellen. Ependymzellen kleiden die Hohlräume (Hirnventrikel und Spinalkanal) aus und sind an der Bildung der Plexus choroidei (zottige Gebilde der Ventrikel, in denen Liquor zerebrospinalis produziert wird) beteiligt; auch sie stellen Verbindungen mit Blutgefäßen her. Von den Astrogliazellen nimmt man an, dass sie außer an Ernährungs- und Aufräumfunktionen auch an der Regelung der neuronalen Aktivität beteiligt sind. So wird vermutet, dass sie Transmitter aus dem Interstitium aufnehmen sowie das bei erhöhter neuronaler Aktivität im Extrazellulärraum zunehmend anfallende Kalium. Auf diese Weise können sie die benachbarten Neurone vor einer Depolarisation schützen. Gleichzeitig könnten die Astrozyten so die Hirndurchblutung regeln, die ja mit erhöhter neuronaler Aktivität steigt (sog. neurovaskuläre Kopplung; Newman, 1986; Paulson u. Newman, 1987). Am deutlichsten B. Preilowski sieht man Interaktionen zwischen Glia und Nervenzellen während der Entwicklung und nach Verletzungen im Nervensystem. Gliazellen leiten Nervenzellen gewissermaßen während ihrer Migration vom mitotischen Entstehungsort zu ihrem zukünftigen Arbeitsplatz. Dabei haben sie auch einen gewissen EinÁuss auf die Phänotypisierung und die geordnete Zusammensetzung der verschiedenen Neurone zu funktionellen Einheiten. Die GrenzÁächen, die die Gliazellen während der Entwicklung als Ordnungs- und Orientierungsstrukturen aufbauen, verschwinden, nachdem die Nervenzellen ihre synaptischen Verbindungen stabilisiert haben. Sie scheinen aber nach Verletzungen im Gehirn der ausgewachsenen Säuger wieder aufzutauchen. Die Gliaproliferation kann dabei, so vermutet man, an der Verletzungsstelle, wie durch einen Schutzwall, den Verlust von funktionierenden Zellen eingrenzen; eventuell auch – wie zur Embryonalzeit – verhindern, dass reaktiv sprossende Nervenzellen falsche Verbindungen aufbauen. Allerdings scheinen sie damit auch gleichzeitig die strukturelle und funktionelle Regeneration zu verhindern. Schließlich wäre noch die Mikroglia (Mesoglia) zu nennen, die phagozytische Abräumfunktionen übernehmen kann. Sie kann aber auch aktiviert werden, um Substanzen abzusondern, welche ihrerseits insbesondere im spinalen Bereich und dem PNS auf schmerzempÀndliche Neurone wirken. Diese GliaNeuron-Interaktion wird so für neuropathische Schmerzen verantwortlich gemacht. Übrigens ist die Fähigkeit der Gliazellen sich zu vermehren – im Gegensatz zu den nicht mehr teilungsfähigen Nervenzellen – auch für die Bildung der verschiedenen Tumoren verantwortlich. Interstitium Heutige Schätzungen gehen dahin, dass das Interstitium bis zu 10% oder gar 20% des Gewebevolumens ausmacht. Raum genug für eine Vielzahl von neuronal wirksamen Substanzen und möglichen Interaktionen, über die wir nur wenig wissen. Kap. 1.2 Strukturelle Anatomie des Zentralnervensystems Gruppierungen von Nervenzellen und ihren Fortsätzen Der eigentlichen funktionellen Bedeutung der zentralnervösen Zellen kann man sich erst durch die Betrachtung von Zellgruppierungen nähern. Neurone sind Gruppenwesen. Sie entwickeln sich aus lokal gruppierten Vorläufern, sie wachsen in Gruppen aus und positionieren sich in Gruppen. Im peripheren Nervensystem kann man Gruppierungen von Nervenzellkörpern als Verdickung (Ganglion, Nervenknoten) in den Nervensträngen erkennen; im Zentralnervensystem kann man sie aufgrund fehlender Myelinisierung als graue Substanz von der weißen Substanz der myelinisierten Fortsätze unterscheiden. Je nach Formation sieht man klumpenartige Kerngebiete (Nuklei) oder streifenförmige Schichten (Strata, Laminae). Auch die Fortsätze von Nervenzellen verlaufen in Gruppierungen. In der Peripherie ist ein Nerv (Nervus) als ein durch Bindegewebe zusammengefasstes Bündel von Nervenfasern relativ leicht zu identiÀzieren. Im Zentralnervensystem hingegen ist der Verlauf eines Nervenfaserbündels (hier als Tractus bezeichnet) oft nur unter Anwendung neuroanatomischer Tricks zu verfolgen. Das Endhirn (Telencephalon) Zum Endhirn gehört vor allem der Hirnmantel (Cortex cerebri) und sein Marklager sowie die subkortikalen Nuclei der Basalganglien und die Amygdala. Der Hirnmantel (Cortex cerebri) Makromorphologie: Lobi, Gyri und Sulci Die beiden Großhirnhemisphären lassen sich in vier Hirnlappen (Frontal-, Parietal-, Okzipital- und Temporallappen; Lobus frontalis, L. parietalis, L. occipitalis, L. temporalis) und die Insel (Insula) untergliedern. Die Insel ist von außen nicht sichtbar, da sie von den Opercula („Deckeln“) der Frontal-, Parietal- und Tem- 39 porallappen überdeckt wird. Die Frage ist noch nicht eindeutig beantwortet, ob die Lobi sowie die Furchungen und Windungen eine funktionelle Bedeutung haben. Bisher war man eher der Meinung, dass die Faltung nur eine mechanische Konsequenz der Ausdehnung des Kortex sei. Immerhin wird es dadurch möglich, die relativ große Fläche des Hirnmantels von ca. 1600 bis 2500 cm2 (entspricht in etwa der Größe eines DIN A2 Blattes und ist ungefähr dreimal größer als die SchädelinnenÁäche) mit ca. 10 bis 20 Milliarden Zellen in einem Schädel von biologisch vertretbarer Größe unterzubringen. Tatsächlich gibt es aber auch einige Hinweise auf mögliche funktionelle Aspekte. So wurde festgestellt, dass die Organisation und der Reichtum von Nervenfaserverbindungen im Bereich der Gyruskronen – egal, ob an der OberÁäche des Gehirns oder von anderen kortikalen Gyri überlagert – sehr viel größer ist, als in den Wänden oder am Grunde eines Sulcus. Und darüber hinaus wird behauptet, dass sich die Gyri in diesen Verbindungsmustern voneinander unterscheiden. Das wiederum könnte auf spezialisierte Funktionen der verschiedenen Gyri hinweisen (Welker, 1986). In der letzten Zeit sind Theorien, die für die Faltenbildung funktionelle und mechanische Erklärungen miteinander verbinden (Van Essen, 1997), bestätigt worden (Hilgetag u. Barbas, 2006). Danach werden Hirnregionen, die durch viele Nervenfasern miteinander verbunden sind, eher zueinander hingezogen als solche die weniger Verbindungen miteinander haben. Ferner sei auf Unterschiede zwischen weiblichen und männlichen Gehirnen hingewiesen, wobei Frauen im frontalen und parietalen Kortex eine komplexere GyriÀzierung aufweisen als Männer (Luders et al., 2004). Mikromorphologie: Zytoarchitektonische Unterteilungen Der Grundbauplan des zerebralen Kortex. Das Grundschema des kortikalen Bauplans bei den Säugetieren ist der 6-schichtige Aufbau (Abb. 6). (Die Schichten oder Laminae sind von außen nach innen nummeriert) 40 B. Preilowski A B C D E I. I. II. II. I. II. III. IV.b III. 2 mm IV.a IV.c IV. V. III. VI. V. IV. VI. V. VI. Abb. 6. Schichtenaufbau des Cortex cerebri nach Brodmann (1909). (A) Golgifärbung einzelner Neurone. (B) Nisslfärbung (Zellkörper). (C) Weigert Färbung myelinisierter Fasern. (D) Agranulärer Gyrus praecentralis. (E) Granulärer Sulcus calcarinus. I. II. III. IV. V VI. L. zonalis (oder L. molecularis; plexiforme Schicht) L. granularis externa (äußere Körnerschicht) L. pyramidalis (äußere Pyramidenzellschicht) L. granularis interna (innere Körnerschicht) L. ganglionaris (ganglionäre Schicht; innere Pyramidenzellschicht) L. multiformis (polymorphe Schicht, Spindelzellschicht) Schicht- und zellspeziÀsche Funktionen. In der obersten Schicht I Àndet man überwiegend Axone und Dendriten von Zellen aus tieferliegenden Schichten sowie sogenannte Cajalzellen, deren Axone innerhalb dieser Schicht, also horizontal bzw. tangential, verlaufen. Man hat diese Schicht deshalb auch als Assoziationsschicht bezeichnet. Den Schichten II, III und IV hingegen werden rezeptorische (Eingangs-) Aufgaben und den Laminae V und VI effektorische (Ausgangs-) Funktionen zugeschrieben. Entsprechend hat man ursprünglich die Pyramidenzellen als die Effektorzellen und die Körner- oder Sternzellen als die Eingangszellen festgelegt. Tatsächlich enden die Fasern von den thalamischen sensorischen Kernen überwiegend in der Schicht IV. Aber man Àndet auch in geringerem Umfang Kontakte an Zellen der Schicht VI und den Pyramidenzellen der Schichten III und V. In anderen Bereichen des Kortex, beispielsweise im motorischen Kortex, enden thalamische Fasern in den Schichten I und III. Efferenzen kommen aus praktisch allen Schichten, außer Schicht I. Den größten Beitrag dazu liefern die Pyramidenzellen. Kleine und mittelgroße Pyramidenzellen aus den Schichten II, III, IV und VI senden kortiko-kortikale Fasern (Assoziationsfasern) aus, wobei eine gewisse Korrelation zwischen Größe der Zellkörper und der Entfernung, die ihre Fasern überbrücken, festgestellt wurde. Fasern, die homotope Punkte beider Hemisphären ver- Kap. 1.2 Strukturelle Anatomie des Zentralnervensystems binden (Kommissurenfasern) und beispielsweise das Corpus callosum bilden, stammen von Pyramidenzellen in den Schichten III sowie, in geringerem Umfang, aus II, IV, V und VI. Die callosalen Fasern enden in Schicht III und IV. Axone, die den Kortex verlassen, stammen aus den Schichten V und VI. Ein großer Teil dieser Ausgänge geht in Systeme ein, die eine Vielzahl kortikaler Areale mit subkortikalen Strukturen bilden, also zum Beispiel in kortiko-thalamische, kortiko-striatale oder kortiko-klaustro-kortikale Neuronenkreise. Die Fasern, die gewissermaßen in non-reziproker Form Hirnstamm und Rückenmark anstreben, stammen alle aus der Schicht V. Neben den Pyramidenzellen werden auch Sternzellen mit dornenbesetzten Dendriten als Effektorzellen betrachtet. Letztere scheinen die Rolle von Interneuronen innerhalb des Kortex zu spielen und inhibitorische Funktionen auszuüben. Hirnkarten – Untergliederungen in Felder und Areale Regionale Unterschiede im Grundschema des 6-schichtigen Kortex führten dazu, ihn in Felder bzw. Areale aufzuteilen (Brodmann, 1909;Campbell, 1905). Diese neuroanatomischen Unterteilungen bestätigten die in den frühen funktionellen Hirnstimulations- und Läsions-Untersuchungen gefundene Differenzierung des Kortex. Zusammen bildeten sie die Hauptargumente der funktionalen Lokalisationisten (Abb. 7). Die Tatsache, dass diese nunmehr 100 Jahre alte Arealeinteilung auch heute immer noch Verwendung Àndet, ist ein Beweis für die hohe Qualität der frühen anatomischen Arbeiten. Es spricht auch durchaus nicht gegen sie, wenn mittlerweile vieles darauf hindeutet, dass innerhalb der tektonischen Felder weitere Untergliederungen möglich sind (z.B. Amunts u. Zilles, 2001; Zilles, 1990). Bevor diese neueren Entwicklungen beschrieben werden, sollen noch Versuche angesprochen werden, größere funktionelle Gruppierungen auf der Basis von zytoarchitektonischen Gemeinsamkeiten vorzunehmen. Diese Einteilungen sind insofern von Bedeutung, als sie die Grundlage einer Reihe von zu- 41 sammenfassenden funktionellen Beschreibungen des Gehirns bilden, und ihre Bezeichnungen in der neurowissenschaftlichen Literatur häuÀg vorkommen. Isokortex und Allokortex – Die kortikalen Bereiche, die mehr oder weniger dem oben beschriebenen 6-Schichten-Bauplan entsprechen, werden Isokortex (iso- = gleich, derselbe) genannt. Entsprechend unterscheidet man demgegenüber einen Allokortex (all(o)- = heter(o) = anders), der die verschiedensten Formen annehmen kann, mit jeweils unterschiedlicher Anzahl von Schichten und verschieden deutlicher Ausprägung, bis hin zu keiner erkennbaren StratiÀzierung. Da der Isokortex phylogenetisch nach dem Allokortex datiert wird, bezeichnet man ihn auch als Neokortex (neo- = neu). Der Allokortex wiederum wird in einen Palaeokortex (palaios = alt) und einen Archikortex (arche = Anfang) unterteilt. Zur letzteren Form des Kortex wird die Hippokampusformation und das Subiculum gerechnet; zum Palaeokortex gehören der olfaktorische Kortex, die septalen und piriformen Regionen sowie die Amygdala (Mandelkernkomplex). Die Grenz- und Übergangsbereiche, in denen der Aufbau des Kortex graduell von einer zur anderen Form des Kortex wechselt, werden mit den Vorsilben pro- (davor), juxta(iuxta = daneben) oder peri- (um, herum) gekennzeichnet (z.B. Proisokortex, Periallokortex). Die verschiedenen Übergangszonen zwischen Allo- und Isokortex werden auch als Mesokortex (mes(o) = zwischen) zusammengefasst. Hierzu werden der hintere Teil des orbitofrontalen Kortex, der insuläre Kortex, die Spitzen der Temporallappen, der Gyrus parahippocampalis (mit den Areae ento-, pro-, und peri-rhinales, sowie prae- und para-subiculares) und der Cingulumkomplex (Cingulum plus retrospleniale und parolfaktorische Region) gezählt. Die gürtelförmige Anordnung der genannten Strukturen führte auch zu der Bezeichnung dieser Strukturen als paralimbischer Kortex. Zum limbischen Kortex selbst werden die Septalregion, die Substantia innominata, die Amygdala, der piriforme Kortex und die Hip- 42 B. Preilowski Abb. 7. Zytoarchitektonische Karte nach Brodmann (1909). pokampusformation (also allesamt allokortikale Strukturen) gerechnet. Die Liste zeigt, je nach Autor, einige Variationen auf (Mesulam, 1985; Stephan, 1975; Zilles, 1990). Inter- und intrakortikale Verbindungen Wie bereits erwähnt, sind die umfangreichen Faserverbindungen ein wesentliches Merkmal des Cortex cerebri und für eine Interpretation seiner Funktionen von großer Bedeutung. Beim menschlichen Gehirn liegen die Schätzungen beispielsweise für das Verhältnis von Afferenzen zur Gesamtzahl der Neurone im Kortex bei 1:1000; in anderen Worten, nur jeder tausendste Kontakt mit einer kortikalen Zelle hat seinen Ursprung außerhalb des Kortex, alle anderen stammen aus dem Kortex selbst; davon wiederum 99 Prozent aus der gleichen Hemisphäre (Braitenberg u. Schüz, 1991). Diese Vielzahl intra- und interkortikaler Verbindungen können durch Interneurone erfolgen, durch Axonkollaterale kortikaler Neurone oder durch Nervenfasern kortikaler Zellen, die den Kortex verlassen und Kontakte mit unterschiedlich weit entfernten Kortexbereichen herstellen. Diese letzteren Verbin- Kap. 1.2 Strukturelle Anatomie des Zentralnervensystems dungen bilden das Marklager und lassen sich in Projektionsbahnen, Assoziations- und Kommissurenbahnen untergliedern. Projektionsbahnen Zu den Projektionsbahnen gehören die afferenten und efferenten Verbindungen des Kortex mit subkortikalen Bereichen; also beispielsweise mit dem Thalamus und den Basalganglien sowie mit den Kernen im Hirnstamm und mit dem Rückenmark. Die Fasern laufen zum größten Teil durch die Capsula interna und die Hirnschenkel. Aufgrund der topographischen Ordnung ergeben sich bei der makromorphologischen Untersuchung des Gehirns eindrucksvolle Bilder vom Verlauf der Fasern. Besonders imponierend ist die Auffächerung der Fasern über den gesamten Bereich des Kortex oberhalb ihrer Bündelung in der internen Kapsel, was zu der treffenden Bezeichnung Corona radiata führte. Ebenso markant sind die Projektionen vom Thalamus zum visuellen und auditiven Kortex als Sehbzw. Hörstrahlung. Assoziationsbahnen Die Assoziationsbahnen bestehen aus Faserverbindungen zwischen unterschiedlich weit entfernten kortikalen Regionen innerhalb der gleichen Hemisphäre. Es kann sich dabei um kurze Verbindungen zwischen eng benachbarten Bereichen eines Gyrus oder Sulcus handeln, oder aber auch um längere Faserstränge, die Regionen in unterschiedlichen Lobi miteinander verbinden. Nur die wichtigsten seien hier genannt: Der Fasciculus longitudinalis superior verbindet den Frontallappen mit dem Okzipitallappen (F.l.s. brachium posterius) und dem Temporallappen (F. l. s. brachium anterius). Auch zum Parietallappen gibt es Verbindungen durch dieses Bündel. Weitere Verbindungen zwischen Frontal- und Okzipitalkortex bestehen durch den Fasciculus occipitofrontalis superior und den F. occipitofrontalis inferior. Temporo-okzipitale Fasern verlaufen im Fasciculus longitudinalis inferior 43 und fronto-temporale Verbindungen durch den Fasciculus uncinatus. Schließlich sei noch das Cingulum erwähnt, dessen längste Fasern sich im Gyrus cinguli von der subcallosalen Region (unterhalb des Genu und Rostrum des Corpus callosum) bis zum entorhinalen Kortex erstrecken. Kommissurenbahnen Die Kommissurenbahnen des Cortex cerebri schließlich verbinden fast ausschließlich homotope kortikale Regionen beider Großhirnhemisphären. Man vermutet jedoch auch heterotope Projektionen zwischen den Hemisphären. Für diese gibt es bisher nur aus der Tierforschung konkrete Hinweise. Beispielsweise gibt es einseitige (also nicht-reziproke) Verbindungen im somatosensorischen Bereich von SI nach SII und im motorischen Kortex von Area 4 zum sogenannten supplementärmotorischen Kortex. Das größte Faserbündel, das die Großhirnhälften miteinander verbindet, ist das Corpus callosum bzw. der Balken, mit Fasern aus allen neokortikalen Bereichen. Etwa 200 Millionen sehr unterschiedliche, überwiegend dünne (also langsam leitende) Fasern sollen im menschlichen Callosum zu Ànden sein (Tomasch, 1954). Innerhalb des Corpus callosum gibt es eine topographische Ordnung in rostro-caudaler Richtung. Im Bezug auf eine Ordnung in ventro-dorsaler Richtung durch den im Durchschnitt 1 cm dicken Balken gibt es nur wenige Informationen (Pandya u. Rosene, 1985; Schaltenbrand, Spuler u. Wahren, 1970). Eine weitere Kommissurenbahn, die Commissura anterior (vordere Kommissur), steht mit dem olfaktorischen System und darüber hinaus sowohl mit neo- als auch palaeokortikalen Strukturen in Verbindung. Der vordere Teil dieser Kommissur verbindet die beiden Bulbi olfactorii und die Substantiae perforatae anterior. Der hintere, größere Teil führt vor allem Fasern aus Strukturen im Temporallappen. Die Liste aller Gehirnbereiche, die Fasern durch die vordere Kommissur schicken, ist sehr umfangreich und umfasst wesentliche limbische und paralimbische Strukturen. 44 Auch die Hippokampusformationen beider Hemisphären sind durch Kommissuren miteinander verbunden. Diese Kommissurenbahnen steigen parallel mit den Fasern der Fornix auf, kreuzen dann unterhalb des posterioren Endes des Balkens zur anderen Seite und ziehen wiederum entlang der Fornix nach unten. Man bezeichnet diese Verbindung auch als Commissura fornicis. Ein großer Teil dieser Fasern sind aber nicht commissural im eigentlichen Sinne, sondern Kollaterale von ipsilateralen Fasern. Es gibt noch eine Reihe weiterer Kommissuren, über deren Verlauf und Funktion im menschlichen Gehirn wir aber fast nichts wissen (einen Überblick gibt Preilowski, 1987). Intrakortikale Organisation Aufgrund des massiv ausgeprägten Marklagers (weiße Substanz) geraten die Faserverbindungen innerhalb des Cortex cerebri (graue Substanz) leicht aus dem Blickfeld. Aber in einem Kubikmillimeter grauer Substanz beÀnden sich etwa 50.000 Nervenzellen, von denen jede mit ungefähr 1000 anderen Nervenzellen verbunden ist (Braitenberg u. Schüz, 1991). Wenn man die dünnen Faserverbindungen innerhalb dieses Kubikmillimeters aneinander legen würde, ergäbe dies eine Länge von 3 bis 4 Kilometern (Wandell u. Dougherty, 2006). Allerdings ist, wie bereits besprochen wurde, die Zusammensetzung der grauen Substanz nicht überall gleich. Und so wurden Unterschiede in den intrakortikalen Faserverbindungen auch zur histoarchitektonischen Gliederung des Kortex in Areale mit herangezogen. Andererseits weisen diese Verbindungen aber auch überregionale Gemeinsamkeiten auf, deren funktionelle Bedeutung erst in der letzten Zeit etwas einsichtiger geworden ist. Vertikale und horizontale Verschaltungen Bei näherer Betrachtung des Kortex ergibt sich, trotz der sichtbaren horizontalen Schichtung, der Eindruck einer überwiegend vertikal orientierten Struktur. Die Zellfortsätze dringen B. Preilowski senkrecht von unten und parallel zueinander in den Kortex ein und verlassen ihn auch in gleicher Weise. Die meisten Zellen erstrecken sich mit ihren Fortsätzen über die Schichten hinweg, nicht nur, aber doch vorzugsweise in vertikaler Ausrichtung. Besonders prägend sind hierbei die Pyramidenzellen mit ihren langen zur kortikalen OberÁäche gerichteten Apikaldendriten. Daneben aber existieren vielfache horizontale, also parallel zur kortikalen OberÁäche gerichtete sowie schräge, seitlich und über mehrere Schichten reichende Verbindungen. Außer verschiedenen Zellen, die für diese Aufgabe spezialisiert zu sein scheinen, wird ein Großteil des seitlich orientierten GeÁechts von Dendriten der Pyramidenzellen gebildet; zum Beispiel von den Basaldendriten, deren Verzweigungen seitlich, aber nicht ausschließlich horizontal, gerichtet sind. Darüber hinaus verzweigen sich auch die Axone afferenter und efferenter Zellen in horizontaler Richtung. Und neueren Befunden zufolge scheint die horizontale intrakortikale Interaktion über größere Entfernung zu reichen, als ursprünglich angenommen wurde. Auch aus dem Kortex austretende Fasern senden oft Kollaterale in benachbarte Bereiche. Diese seitliche und vertikale VerÁechtung der Nervenzellen im Kortex hat zu den verschiedensten funktionellen Überlegungen Anlass gegeben. Funktionelle Organisation des zerebralen Kortex Primäre und sekundäre Projektions- sowie Assoziationsgebiete Aufgrund von tierexperimentellen und klinischen Erfahrungen identiÀzierte man schon früh sogenannte primäre sensorische und motorische Bereiche. Hier konnten durch Stimulation EmpÀndungen und Bewegungen ausgelöst werden, und Schädigungen waren mit relativ umschriebenen motorischen oder modalitätsspeziÀschen sensorischen Ausfällen verbunden. Diese Bereiche werden auch als primäre Projektionsgebiete bezeichnet, weil sie in direkter Interaktion mit speziÀschen sensorischen und motorischen Kernen des Thalamus stehen. Kap. 1.2 Strukturelle Anatomie des Zentralnervensystems Diejenigen kortikalen Gebiete, in denen Läsionen zu sehr unterschiedlichen und multiplen oder unspeziÀschen Ausfällen führten, nannte man sekundäre und tertiäre Projektionsbereiche oder Assoziationsgebiete. Es gab zuerst relativ wenig experimentelle Daten zu diesen Arealen. Die Nachbarschaft zu den primären Gebieten und die Übergänge zu einem anders strukturiertem Kortex führten zu der Annahme, dass in den sekundären Bereichen die jeweilige modalitätsspeziÀsche sensorische Information aus den primären Gebieten weiterverarbeitet würde. Von den tertiären Gebieten nahm man an, dass sie als multimodale Überlappungsbereiche Assoziationsprozesse ermöglichen. Die Vorstellung von einigen wenigen hierarchisch organisierten Regionen, in denen die Verarbeitung vom Sensorischen zum Psychischen, beispielsweise vom Akustischen zum Auditiven vonstatten geht, hat seine Ursprünge in den bereits erwähnten ersten zytoarchitektionischen Untersuchungen, in denen bereits von auditosensorischen versus auditopsychischen oder von somatosensorischen versus somatopsychischen Arealen die Rede war (Campbell, 1905). In ähnlicher Weise wurden später aufgrund elektrophysiologischer Untersuchungen primäre und sekundäre auditive (AI und AII), somatosensorische (SI and SII) und visuelle Bereiche (V-I und V-II) beschrieben (Woolsey, 1958). Im visuellen Bereich unterschied man auch drei Regionen (V-I, V-II und V-III) (Hubel u. Wiesel, 1965). Insgesamt verblieben damit außerhalb der primären und sekundären sensorischen Areale relativ große Kortexbereiche, von denen man lange Zeit annahm, dass sie nur wenige oder gar keine thalamischen Projektionen erhalten und somit nur Informationen, die von den primären Projektionsgebieten weitergeleitet werden. Die Annahme, dass es sich hierbei um besondere „psychische“ Kortexregionen handelt, schien dadurch bestätigt zu werden, dass sie bei den höheren Säugern immer größere Ausmaße annehmen, also gewissermaßen mit dem Grad der intellektuellen Fähigkeiten korrelieren. Diese Vorstellung wird auch bis heute durch die sehr interessanten Beobachtungen von PenÀeld und seinen Mitarbeitern gestützt. 45 Sie beschrieben die Reaktionen und EmpÀndungen von Patienten, deren Kortex sie bei neurochirurgischen Eingriffen elektrisch stimulierten. PenÀeld unterschied aufgrund der Mitteilungen der wachen Patienten zwischen sensorischen, psychischen und interpretativen Kortexregionen (PenÀeld u. Jasper, 1954; PenÀeld u. Rasmussen, 1952). Während über die bisher genannten kortikalen motorischen und sensorischen Bereiche mittlerweile sehr viele Informationen vorliegen, geraten wir bei den verbleibenden kortikalen Arealen im vorderen Teil der Frontalund der Temporallappen auf relativ unbekanntes Territorium. Vorweg sollte erwähnt werden, dass der frontale Kortex in einen orbitalen Teil sowie in die dorsolaterale Konvexität und einen medialen Bereich untergliedert werden kann. Der orbitale Teil ist der ventrale Teil des Frontallappens, der im Schädel über den Augenhöhlen (Orbitae) liegt. Im Bereich der dorsolateralen Konvexität beÀndet sich der sogenannte präfrontale Kortex. Dieser zeigt beispielsweise unmittelbar vor dem präzentralen Bereich eine dysgranuläre Struktur und erhält Projektionen von einem unspeziÀschen Teil eines ansonsten speziÀschen motorischen Kerngebietes des Thalamus. Damit wird die Bezeichnung als motorisches Assoziationsgebiet gerechtfertigt. Weiter frontal sind die dorsolateralen Bereiche mit lateralen Teilen und der orbitale Kortex mit medialen Bereichen des N. medialis dorsalis thalami verbunden. Über den N. medialis dorsalis ist zumindest der orbitale präfrontale Kortex mit Teilen des limbischen Systems assoziiert, denn dieser Teil des Thalamus erhält Projektionen vom Amygdalakomplex und von olfaktorischen sowie hypothalamischen Strukturen. Ebenfalls Teil des limbischen Systems ist der N. anterior thalami und sein Hauptprojektionsgebiet, der Gyrus cinguli. Damit ergibt sich folgende klassische Vorstellung von einer funktionellen Arbeitsteilung des Kortex: Limbische, also phylogenetisch alte Kortexstrukturen, regulieren, zusammen mit dem Hirnstamm (insbesondere der Formatio retikularis), die Aktivierung sowie die motivationalen und emotionalen Aspekte des Verhaltens. Die primären Projektionsgebiete 46 nehmen die sensorischen Informationen auf, die über die sekundären Regionen weiterverarbeitet werden. In den tertiären oder Assoziationsgebieten bilden die überlappenden Informationen aus den verschiedenen Sinnesarealen die Grundlage für die Organisation des Verhaltens. Die resultierende Aktionen werden über die motorischen Bereiche und die untergeordneten subkortikalen Systeme ausgeführt. Zusammen mit dem Nachweis von immer detaillierteren neuroanatomischen Verbindungen, ergeben sich in der letzten Zeit immer mehr Hinweise für eine notwendige Revision der klassischen Vorstellungen. Die wichtigsten Befunde hierzu sind, neben den biochemischen Typisierungen, die hier nicht diskutiert werden können, die funktionellen Charakterisierungen einzelner Neuronentypen und mittlerweile auch von größeren Zellgruppierungen durch singuläre und multiple Ableitungen der neuronalen elektrischen Aktivität. Dabei spielen zwei Begriffe eine zentrale Rolle: zum einen geht es um das Konzept des „rezeptiven Feldes“, zum anderen um die sogenannten „kortikalen Karten.“ Rezeptive Felder und kortikale Karten Die ersten kortikalen Karten wurden, wie bereits erwähnt, aufgrund von Stimulationsexperimenten bei Tieren und Menschen beschrieben. Diese Karten waren zuerst auf die motorischen Bereiche des Kortex beschränkt, in denen von speziÀschen Punkten bestimmte Bewegungen ausgelöst werden konnten. Bei Menschen konnte man mit Hilfe der Beschreibung ihrer EmpÀndungen während der Stimulation des Gehirns Informationen auch über andere kortikale Bereiche erhalten. Die genauere Bestimmung der sensorischen Repräsentationen im Kortex und in anderen Gehirnstrukturen wurde jedoch erst durch die Ableitung von elektrischen Signalen der Neurone sowie durch funktionelle Markierungen möglich. Die Beschreibung der Besonderheiten der rezeptiven Felder dient der Charakterisierung einzelner Neurone. Gruppierungen von Neuronen mit gleichen Charakteristika bilden un- B. Preilowski terschiedliche funktionelle Einheiten oder Module, beispielsweise Kolumnen oder Hyperkolumnen, die ihrerseits in systematischer Anordnung Karten ergeben. Rezeptive Felder – Ein rezeptives Feld in der klassischen DeÀnition ist der räumliche Bereich, auf der Haut oder auch im Umfeld, beispielsweise im Gesichtsfeld, in dessen Grenzen eine adäquate Stimulation zu einer systematischen Veränderung der Aktivität eines Neurons führt. Mittlerweile unterscheidet man auch sogenannte modulatorische rezeptive Felder, in denen sich die EinÁüsse von Reizen gewissermaßen als Kontext außerhalb des eigentlichen rezeptiven Feld auswirken (Gilbert u. Wiesel, 1990). Daraus ergibt sich schon, dass die funktionelle DeÀnition einer Zelle im Wesentlichen durch die Art der Aktivitätsmessung und die Art der Reizung bestimmt wird. Rezeptive Felder sind zeitlichräumliche Abstraktionen der Aktivitätsmessungen oder operational deÀnierte funktionelle Konstrukte. Veränderungen in Form von exzitatorischen und inhibitorischen postsynaptischen Potentialen (EPSPs und IPSPs), ohne dass die Zelle ein Aktionspotential erzeugt, werden also ein anderes Bild ergeben als Beurteilungen der überschwelligen Aktivität, etwa aufgrund von Veränderung der Feuerrate einer Zelle. Neben der Größe und der Struktur des Feldes werden weitere qualitative Merkmale vor allem durch die Art des Stimulus und die Art der Stimulusdarbietung sowie den Zustand des Organismus und den Kontext bestimmt, in dem die Messung durchgeführt wird. Die Vielzahl der möglichen Faktoren, die bestimmen, ob eine Zelle reagiert, bzw. unter welchen Umständen die Reaktion verändert oder optimiert werden kann, erklärt die verwirrende Vielfalt von Zellkategorisierungen. Intramodale Spezialisierung in Leitungsbahnen, Umschaltstationen und kortikalen Projektionen – Rezeptive Felder können auch für primäre und sekundäre Neurone beschrieben werden, und dies führte letztlich auch zu der immer größeren funktionelle Aufgliederung der Leitungsbahnen und Umschaltstationen. Es Kap. 1.2 Strukturelle Anatomie des Zentralnervensystems wurde bereits mehrfach darauf hingewiesen, dass die serielle Input-Output-Verarbeitung kein adäquates Modell der Funktionen des Zentralnervensystems darstellt. Schon auf der sensorischen Seite wurde gezeigt, dass die Vorstellung von einigen seriell über Relaisnuklei verschalteten Hauptleitungen in die primären Projektionsgebiete falsch ist. In Wirklichkeit bestehen mehrfache, funktionell differenzierte, parallele Bahnen. In die verschiedenen kortikalen Felder können so mehr oder weniger gleichzeitig unterschiedliche Aspekte der verschiedenen Reizgegebenheiten projiziert werden. Wieder andere kortikale Felder erhalten Mischungen dieser verschiedenen Qualitäten bzw. unterschiedlichen Kombinationen von Teilmodalitäten, die durch divergente und konvergente Verschaltungen entstehen. Selbst im visuellen System, das tatsächlich nur eine thalamische Hauptprojektion zur Area V1 des visuellen Kortex liefert, gibt es eine frühe funktionelle Aufteilung. Die X-, Yund W-Ganglionzellsysteme bzw. parvo- und magnozellulären Ganglionzellen zeigen unterschiedliche Verteilungen in der Retina, sind mit unterschiedlichen visuellen Submodalitäten beschäftigt und projizieren zu verschiedenen Schichten des Corpus geniculatum laterale bzw. per Kollaterale zum Colliculus superior. Die Trennung bleibt bis zum Kortex erhalten, wo Zellfortsätze aus unterschiedlichen Schichten des Geniculatum in unterschiedlichen kortikalen Laminae enden. Daneben aber bestehen weitere topographisch (das heißt, retinotop) geordnete Unterteilungen im Pulvinar, mit jeweils eigenen Projektionen in visuell kortikale Bereiche. Auch im akustischen Bereich haben wir eine Aufspaltung der Information, die sich beispielsweise darin äußert, dass man im Corpus geniculatum mediale mindestens sieben Unterteilungen mit jeweiligen Projektionen zum Kortex Ànden kann. Vergleichbares gilt für die Somatosensorik. Repräsentationskarten und rechnerische Karten Aus der topographischen Gruppierung von Zellen mit bestimmten Eigenschaften ergeben sich Abbildungen der Retina bzw. des visuel- 47 len Gesichtsfeldes, der KörperoberÁäche oder der cochleotopen Frequenzaufteilung. Diese Karten spiegeln den geordneten Eingang von Afferenzen wieder, sie bilden gewissermaßen das Sensorium im Gehirn ab. Andere Karten, sogenannte „computational maps“, sind das Ergebnis oder die Grundlage von Transformationen von Informationen. Die Neurone in diesen Karten bilden eine Gruppe von Filtern, von denen jeder etwas unterschiedlich abgestimmt ist. Sie bearbeiten die sensorische Information parallel, d.h. gleichzeitig, und produzieren eine räumlich kodierte Verteilung ihrer Beteiligung, vergleichbar einer Wahrscheinlichkeitsverteilung. Die Aktivitätsspitzen in dieser Karte geben das wesentliche Analyseergebnisse wieder. Nach dieser DeÀnition (z.B. Knudsen, Du Lac u. Esterly, 1987) sind die sich – innerhalb der nicht-rechnerischen, retinotopen Repräsentation – wiederholenden Abbildungen von Orientierungsund okulären Präferenzen in V1 Beispiele für berechnete Karten. Multiplikation kortikaler Repräsentationen In den primären und sekundären Projektionsgebieten wurde früher jeweils eine topographisch geordnete Abbildung des Sensoriums angenommen. Das bekannteste Beispiel ist der Homunculus, der im prä- und postzentralen Gyrus von Patienten beschrieben wurde (PenÀeld u. Boldrey, 1937), sowie der vergleichbare „Simiusculus“ in SI und SII des Affengehirns (Woolsey, 1958). Mittlerweile ergeben sich jedoch aus tierexperimentellen Untersuchungen, wie oben schon angedeutet, immer mehr solcher geordneter Repräsentationen innerhalb der einzelnen Modalitäten. Am detailliertesten sind die Beschreibungen des visuellen Systems. Hier gelangen die Informationen vom Geniculatum zum primären visuellen Kortex V1 (Area 17) und von dort aus in ein Mosaik von 32 Feldern (Felleman u. Van Essen, 1991; Van Essen, Anderson u. Felleman, 1992). Bis dato wurden 305 Verbindungen zwischen den 32 Regionen beschrieben. Das sind 31% aller möglichen Verbindungen. Man vermutet, dass die Rate der 48 Verbindungen untereinander eher bei 40% liegen wird. Die Mehrzahl dieser Verbindungen ist reziprok. Es gibt auch Verbindungen einiger Areale mit Gebieten außerhalb des visuellen Kortex, beispielsweise mit somatosensorischen Bereichen und frontalen sowie temporalen Kortexgebieten. Innerhalb dieses visuellen Systems lassen sich die spezialisierten Kompartimente immer noch in eine Hierarchie mit verschiedenen Stufen einordnen. Aber besonders wichtig sind die deutlich verteilten, parallelen, wenn auch vielfach miteinander verbundenen Verarbeitungsströme in diesem System. Auch im somatosensorischen Bereich wurden mehrfache Repräsentationen gefunden. Anstatt einer einzigen Karte in SI, Àndet man in jeder der vier Regionen (Area 3b, 3a, 1 und 2), die zusammen SI darstellen, eine topographisch geordnete Repräsentation. Im auditorischen Kortex werden ebenfalls mehrfache topographisch geordnete Repräsentationen gefunden. So gibt es in AI der Katze eine Frequenzabbildung und (in der räumlichen kortikalen Dimension) orthogonal zu dieser tonotopen oder cochleotopen Projektion eine Reihe weiterer geordneter Repräsentationen. So beispielsweise für binaurale Interaktionen, für unterschiedliche Frequenzabstimmungen und unterschiedliche zeitliche Auflösung einzelner aufeinander folgender Reize. Mehrere andere auditorische Felder sind bekannt, jedoch konnten ihre Organisationsprinzipien bzw. die Kodierungseigenschaften ihrer Zellen bisher noch nicht entschlüsselt werden. Wie in den anderen sensorischen Bereichen auch, scheint die Verarbeitung im auditiven Bereich über verteilte, aber mit einander verbundene Prozesse zu erfolgen (Schreiner, 1991). Der Hippokampus Nachdem bisher vor allem der iso-, bzw. neokortikale Anteil des Telencephalon besprochen wurde, kommen wir nun zum Allokortex: Wie bereits erwähnt, gehören der Hippokampus und das Subiculum zu den phylogenetisch ältesten kortikalen Bereichen (Archikortex). B. Preilowski Auf den anderen Allokortex, den Paläokortex kommen wir später, im Zusammenhang mit der Amygdala, noch zu sprechen. Der Kortex des ventralen, medialen Temporallappen (parahippokampaler, perirhinaler, rhinaler, und entorhinaler Kortex) bis hin zum Präsubiculum ist noch typischer Isokortex. Im anschließenden Subiculum und dem Hippokampus mit dem Ammonshorn und dem Gyrus dentatus Ànden wir dann eine gänzlich andere Schichtung. Klinisch-neuropsychologische Befunde über anterograde Amnesien expliziter Gedächtnisinhalte nach Schädigung oder Entfernung des medialen Temporalkortex ergaben zusammen mit einer Vielzahl von tierexperimentellen Läsionsergebnissen über Gedächtnis- und räumliche DeÀzite Hinweise auf mögliche Funktionen des Hippokampus. Aber die Bedeutung der besonderen Struktur und der interaktiven, kollateralen Verschaltungen von speziÀschen Nervenfasern im Ammonshorn und dem Gyrus dentatus des Hippokampus wurde erst durch die Untersuchungen zur Langzeitpotenzierung deutlich. Trotz der hier nachgewiesenen synaptischen Plastizität als Modell für Langzeitgedächtnisbildung ist die Interaktion zwischen Hippokampus, Diencephalon und Neokortex für Konsolidierung und Ablage bzw. Abruf von Gedächtnisinhalten weitestgehend ungeklärt. Man geht davon aus, dass der Hippokampus letztlich aus den gesamten neokortikalen Bereichen Informationen erhält. Die efferenten Bahnen vom Hippokampus über die Fornix zu diencephalen Strukturen (Corpora mammillaria und Nuclei anteriores thalami) und telencephalen Bereichen (Gyrus cinguli, Amygdala) sowie die afferenten Verbindungen, die über den entorhinalen Kortex Informationen zurück zum Hippokampus gelangen lassen, sind in groben Zügen seit langem bekannt. Der Hippokampus hat in dem auch als limbisches System bezeichneten Kreisverbund der oben genannten Gehirnstrukturen, immer eine prominente Rolle gespielt. Vor allem wurde ihm zusammen mit der Amygdala oft eine Vermittlerrolle zwischen den bewussten Prozessen des Neokortex und den unbewussten der phylogenetisch alten Gehirnstrukturen zugewiesen. Kap. 1.2 Strukturelle Anatomie des Zentralnervensystems Am bekanntesten sind die Überlegungen von James Papez (1937) und Paul D. MacLean (1955) über das limbische System zur Erklärung von emotionalen Funktionen, die mittlerweile sowohl vielfältig ergänzt, abgeändert wie auch heftig kritisiert wurden. Letztlich aber wissen wir selbst bei dem einfachsten Modell (z.B. Papez Schaltkreis: Hippokampus – Fornix – Mammillarkörper – Anteriore Thalamuskerne – Gyrus cinguli – Cingulum – Hippokampus) sehr wenig über die Details der neuronalen Verschaltung und noch weniger über ihre speziÀschen Funktionen. Beim Affen wurde beispielsweise gefunden, dass die Projektionen zu den vorderen Thalamuskernen über die Fornix und die Mammillarkörper überwiegend aus genau den Teilen des Subiculums (bzw. Praesubiculums) stammen, die gleichzeitig (allerdings von Zellen einer anderen Schicht) direkte Verbindungen zu den selben vorderen Thalamuskernen besitzen (Aggleton, Vann u. Saunders, 2005). Die Funktion dieser parallelen Verschaltung ist unklar. Genauso wenig wissen wir über die Interaktionen mit anderen Schaltkreisen, beispielsweise solchen, in denen die Amygdala eine Schlüsselrolle zu haben scheint. Während der Papezkreis eher mit kognitiven Aspekten der Informationsselektion in Verbindung gebracht wird, soll das sogenannte basolaterale limbische System (Amygdala – mediodorsaler Thalamus – Area subcallosa (basales Vorderhirn) – Bandeletta diagonalis – Amygdala) vor allem für die unbewusste emotionale Bewertung und Selektion zuständig sein. Die Amygdala Die Amygdala (Mandelkern, Corpus amygdaloideum) ist ein sehr komplexes Gebilde, anterior zum Hippokampus im vorderen Teil des Temporallappens gelegen. Als subkortikale Kernstruktur wird sie zu den telencephalen Basalganglien gerechnet. Auf der anderen Seite wird sie auch als paläokortikale Struktur gekennzeichnet. Sie besteht aus (nach letzter Zählung) 13 Einheiten. Die Gruppierungen der einzelnen Strukturen, wie auch ihre weitere Untergliederung und ihre Bezeichnungen vari- 49 ieren in der Literatur. Der einfachste Ansatz unterscheidet zwischen einer basolateralen, einer kortikomedialen und einer zentralen Kerngruppe. Beide ersteren erhalten sensorische Informationen aller Sinnesmodalitäten vom Thalamus, lediglich die olfaktorischen Informationen gehen über Kollaterale aus dem Bulbus olfactorius direkt in die mediale Amygdala. Darüber hinaus projizieren die sensorischen Kortexareale und der Hippokampus zu basolateralen und kortikomedialen Amygdalabereichen. Wichtig wäre noch zu erwähnen, dass die basolaterale Kerngruppe Informationen aus dem präfrontalen Kortex bezieht. Innerhalb des Amygdalakomplexes gibt es vielfältige, vermutlich auch reziproke Verbindungen. Als wesentliches Effektorgebiet gilt die zentrale Kerngruppe. Sie projiziert zu einer Vielzahl von Gehirngebieten, unter anderem zum präfrontalen Kortex sowie zum Hypothalamus und Hirnstamm. Aber auch die kortikomediale Kerngruppe ist effektorisch mit dem Hypothalamus verbunden. Diese Vielzahl von afferenten und efferenten Verbindungen mit Strukturen, die mit Gedächtnis, emotionalem Verhalten und Gefühlen sowie Aktivierung verbunden sind, erklärt, weshalb Läsionen oder Stimulationen in den verschiedensten Teilen der Amydala entsprechend vielfältige Konsequenzen haben können. Alle gemeinsam aber weisen auf eine besondere Bedeutung der Amygdala für Furcht und Angstreaktionen bzw. Reaktionen auf potentielle Gefahren hin. Die positiven Reaktionen auf einen Reiz werden möglicherweise über Verbindung zu einem anderen Teil der Basalganglien, wie dem Nucleus accumbens moderiert. Die Basalganglien Neben der bereits beschriebenen Amygdala im vorderen Temporallappen, werden unter dem Begriff der Basalganglien vor allem die in der Nähe des Thalamus bzw. Hypothalamus gelegenen Kerne verstanden: Claustrum, Nucleus caudatus, Putamen, Globus pallidus und Nucleus accumbens. Die weiße Substanz der Capsula extrema grenzt das Claustrum lateral 50 zum insulären Kortex hin ab. Nach medial trennt die Capsula externa das Claustrum von den übrigen Basalganglien. Nucleus caudatus, Putamen und Globus pallidus werden in verschiedenen Kombinationen mit zusätzlichen Begriffen bedacht: Der Globus pallidus wird zusammen mit dem Putamen als N. lenticularis (Linsenkern; N. lentiformis – linsenförmig) bezeichnet. Eigentlich bilden diese Kernbereiche eher einen Kegel, mit dem Putamen als Basis und dem Globus pallidus als Kegelspitze. Dieser Kegel liegt seitlich mit der Basis lateral und der Spitze nach medial in Richtung Thalamus zeigend. Das Putamen wiederum ist im antererioren Bereich mit dem Kopf (Caput) des N. caudatus verbunden. Die Fasern der internen Kapsel, die zwischen N. caudatus und N. lenticularis verlaufen unterbrechen diese Verbindung stellenweise, was durch sein streifenförmiges Aussehen den Namen Striatum, genauer gesagt Neostriatum, für N. caudatus und Putamen ergab. Der N. caudatus bildet mit Kopf und sich verjüngendem Körper die lateral-ventrale Wand des vorderen und mittleren Teils der Seitenventrikel. Nach posterior geht der Körper des N. caudatus in den weiter dünner werdenden Schweif über, der dann nach ventral und lateral in den Temporallappen und dort zurück nach anterior in Richtung Amygdala zieht. Zu ergänzen ist, dass der Globus pallidus seine blassere Färbung durch die vielfältigen durchlaufenden myelinisierten Fasern erhält und in einen lateralen externen und einen medialen internen Teil (die Kegelspitze) gegliedert ist. Der N. accumbens (septi), wird nicht immer, aber immer öfter zu den Basalganglien gezählt. Er liegt zwischen ventralem Striatum und drittem Ventrikel bzw. Septum. Die Basalgangien sind Teil eines komplexen Systems, mit dessen Hilfe der Cortex cerebri mit dienencephalen und mesencephalen Strukturen interagiert, um letztlich wieder überwiegend seine eigenen Frontalhirnfunktionen zu steuern. Haupteingangstor der Basalganglien ist das Neostriatum, das glutaminerg (d.h. exzitatorisch) aus fast allen Bereichen des Kortex innerviert wird. Von dort B. Preilowski aus gibt es Verbindungen zum Globus pallidus externa (GPe), mit GABA und Enkephalinen als Transmittern (also überwiegend inhibitorischer BeeinÁussung) und separate Innervationen des Globus pallidus interna (GPi). Letztere benutzen GABA und Substanz P als Transmitter. Der GPi projiziert wiederum gabaerg zum ventrolateralen Thalamus, der mit dem frontalen Kortex reziprok verbunden ist. Die Aktivität des GPi kann nun auf unterschiedliche Weise moduliert werden. Zum einen gibt es eine gabaerge Verbindung vom GPe zum Nucleus subthalamicus, der seinerseits eine glutaminerge (also exzitatorische) Projektion zum GPi besitzt. Der Innervationsstrang „Neostriatum => GPe => N.subthal.,=> GPi“, den man auch als indirekte Verbindung zum GPi bezeichnet hat, wird über dopaminerge Innervation aus der Substantia nigra beeinÁusst. Und die gleiche nigro-striäre Innervation beeinÁusst auch (wenn auch durch andere Dopaminrezeptoren) die direkte Verbindung vom Striatum zum GPi. Komplizierend kommt hier noch hinzu, dass die Substantia nigra in einen Pars retikularis und einen Pars compacta unterteilt wird. Beide Teile werden durch den Kortex glutaminerg beeinÁusst und der Pars compacta erhält zudem gabaerge Innervation vom Striatum sowie glutaminerge vom N. subthalamicus. Dieser wird seinerseits auch dopaminerg von diesem Teil der Substantia nigra versorgt. Insgesamt ergibt sich also eine vielfältige VerÁechtung von gegenseitigen unterstützenden sowie exzitatorischen und inhibitorischen EinÁüssen. Vereinfachend könnte man sagen, dass, neben der kortiko-kortikalen Verbindung, die Basalganglien eine weitere automatisierte, unbewusste Möglichkeit bieten, die kognitiven und sensomotorischen Funktionen des Frontalhirns zu beeinÁussen. Der Kortex speist dazu seine Information in das Basalgangliensystem ein. Dieses nimmt dann mit seinem durch komplex ausbalancierte exzitatorische und inhibitorische Interaktionen gewonnenen Ergebnisse EinÁuss auf die frontalkortikal-thalamische Steuerung. Für ein solches Modell sprechen die vielfältigen Auswirkungen von Läsionen oder Degenerationen im Basal- Kap. 1.2 Strukturelle Anatomie des Zentralnervensystems ganglien-subthalamischen System, die recht gut durch Verschiebungen in der Balance zwischen den TransmittereinÁüssen erklärt werden können. Bestätigt werden diese Modelle auch durch die Wirkungen von therapeutischen Versuchen, die Balance wieder herzustellen, indem man entweder die unkontrolliert verstärkten Systeme schwächt (Antagonistische Medikation; Hirnläsion) oder die geschwächten Transmittersysteme stärkt (LDopa Medikation; Hirnstimulation). Das Zwischenhirn (Diencephalon) Der Thalamus Rechter und linker Thalamus bilden die Seitenwände des 3. Ventrikels und die ventralen Wände der Seitenventrikel (im Bereich des Pars centralis). Die eiförmige Struktur wird nach lateral durch die Fasern der Capsula interna von den Basalganglien getrennt. Ein Yförmiges Band weißer Substanz (Lamina medullaris interna) unterteilt den Thalamus grob in eine vordere, eine mediale und eine laterale Kerngruppe. Teile der rechten und linken medialen Kerngruppen verschmelzen manchmal durch den dritten Ventrikel hindurch. Diese Struktur wird als Adhaesio interthalamica (Massa intermedia) bezeichnet und scheint keine kommissurale Funktion zu haben. Lateral liegt, getrennt durch eine weitere Schicht weißer Substanz (Lamina medullaris externa), die graue Schicht des Nucleus retikularis thalami an. Noch kennt man, insbesondere beim Menschen, längst nicht alle Teilstrukturen des Thalamus und kann sich dementsprechend auch noch nicht darüber einigen, in wie viele Kerne der Thalamus wirklich untergliedert werden sollte. Ähnliches gilt für die damit verbundene Frage nach den einzelnen Verbindungen (z.B. Frigyesi et al.,1972). Die im Zusammenhang mit dem Thalamus zu Àndende verwirrende Begriffsvielfalt ist eine Konsequenz dieser unklaren Situation. Die Probleme mit den Bezeichnungen fangen schon damit an, dass man zwischen einem dorsalen und einem ventralen Thalamus unter- 51 scheidet, was aber nicht mit dorsalen und ventralen Kernen des Thalamus verwechselt werden darf. Der Thalamus dorsalis ist der eigentliche Thalamus, mit dem wir uns hier vor allem beschäftigen. Der Thalamus ventralis wird auch Subthalamus genannt. Er umfasst die sogenannte Zona incerta, deren Bedeutung weitestgehend unbekannt ist, sowie eine Reihe von Kernen, deren Funktionen im Zusammenhang mit dem Pallidum und der Formatio retikularis (motorische Aktivierung, Muskeltonus) gesehen werden. Den Thalamus dorsalis kann man vereinfacht in Bereiche der Relay-, Schalt- oder spezifischen Kerne und in Bereiche der unspezifisch oder diffus projizierenden Kerne unterteilen. Den ersteren ist gemeinsam, dass man sie durch tierexperimentelle Degenerationsstudien relativ eindeutig bestimmten Projektionsgebieten im Kortex zuordnen kann. Hierzu gehören die Sensorischen Kerne, die Motorischen Kerne, die Limbischen Kerne – und die Assoziations- oder Integrationskerne. Zu den unspeziÀsch oder diffus projizierenden Kerne gehören die Kerne der Mittellinie und die intralaminären Kerne sowie der N. centromedianus und centrolateralis. Sie erhalten Eingänge aus dem Kortex wie auch aus der Formatio retikularis und dem Rückenmark und entsenden weit streuende, diffuse Projektionen zum Kortex, insbesondere zum Lobus frontalis sowie zu anderen thalamischen Kerngebieten. Der Hypothalamus Ventral vom Thalamus, rechts und links des dritten Ventrikels sowie dessen Boden bildend, liegen die Kernbereiche des Hypothalamus. Leicht zu erkennen sind die Mamillarkörper und die Hypophyse im ventralen Bereich sowie die Epiphyse (Zirbeldrüse) am posterioren Ende des dritten Ventrikels. Alle anderen Kerne sind nur im Schnitt und mit Hilfe besonderer Färbungen nachweisbar. Auch hier gilt, dass wir die Vielfalt an Kernen und ihre Funktionen bislang nur aus Tierversuchen ableiten können. 52 Der Hypothalamus ist für die Aufrechterhaltung von basalen Körperfunktionen zuständig: er ist beispielsweise an der Steuerung der Nahrungs- und Flüssigkeitsaufnahme und der Regelung der Körpertemperatur beteiligt. Er ist Teil des endokrinen Systems und damit insbesondere über die Hypophyse an allen metabolischen Regelprozessen beteiligt. Darüber hinaus besitzt er Kernbereiche, die lichtempÀndlich sind und als innere Uhren zur Synchronisierung des Schlaf-Wach-Rhythmusses beitragen. In Tierversuchen konnten durch Stimulation von Bereichen des Hypothalamus verschiedenste artspeziÀsche Verhaltensweisen (Sexual- und Aggressionsverhalten) ausgelöst werden. Das Mittelhirn (Mesencephalon) Das Mittelhirn besteht vor allem aus dem Tectum mit der Vierhügelplatte im dorsalen Bereich und dem Tegmentum im ventralen Teil. Dazwischen verläuft der Aquäductus sylvii, die Verbindung zwischen dem III. Ventrikel im Zwischenhirn und dem IV. Ventrikel unterhalb des Kleinhirns. Das Tectum ist bei einigen Tierarten, beispielsweise den Amphibien, das visuelle Gehirn. Beim Menschen sind die oberen Hügel (Colliculi superiores) ebenfalls Strukturen, die für das Sehen, vor allem das periphere Sehen und die Augenbewegungen, von großer Bedeutung sind. Sie ermöglichen beispielsweise kortikal Blinden gezielte Zeigebewegungen auf visuelle Reize auszuführen, die sie bewusst nicht wahrnehmen. Die Colliculi inferiores sind Teil des Hörsystems. Ventral vom Aquäductus liegen Kerne der für die Augenbewegungen zuständigen Hirnnerven. Ferner sind hier Kerne des motorischen Systems, der Nucleus ruber und die Substantia nigra zu Ànden. Der N. ruber ist Teil des extrapyramidalen motorischen Systems. Für dieses System ist auch die S. nigra von großer Bedeutung, denn sie ist der Ursprung der dopaminergen Versorgung des Neostriatums (Nucleus caudatus und Putamen). Die an die Substantia nigra anschließenden ventralen Ausbuchtungen, die nach rostral etwas auseinander streben, sind die sogenannten Hirn- B. Preilowski schenkel (Pedunculi cerebrales). In ihnen verlaufen die Projektionsbahnen, die wir auf weiter rostral gelegenen Schnitten in der internen Kapsel sehen. Der Hirnstamm Der Hirnstamm ist eine strukturelle Bezeichnung (im Gegensatz zum Stammhirn als phylogenetischer Charakterisierung) und umfasst das verlängerte Mark, die Pons, das Mittelund Zwischenhirn. Manche deÀnieren ihn auch als das Gehirn ohne den zerebralen Kortex, d.h. sie zählen auch die Basalganglien dazu. Im verlängerten Mark (Medulla oblongata) beÀnden sich lebenswichtige Strukturen zur Regulation von Atmung, Kreislauf und Wachheit, sowie Kerngebiete, die das Gehirn mit wichtigen Transmittern versorgen. Darüber hinaus Ànden sich hier auch Kerne, die Informationen aus dem Rückenmark und von den Hirnnerven empfangen. Die Pons beinhaltet vor allem Verbindungen zwischen dem Kleinhirn und dem restlichen Gehirn sowie dem Rückenmark. Dabei entspringt ein Teil dieser Fasern aus den pontinen Kernen, die beispielsweise auch Informationen aus dem Kortex erhalten. Wie die Kernbereiche der Transmittersysteme, so durchziehen auch neuronale Netze den Hirnstamm. Diese Formatio reticularis moduliert die auf- und absteigenden neuronalen Aktivitäten. Die Hirnnerven (Nervi craniales) ziehen, bis auf den I. (Tractus. olfactorius) und II. (Nervus opticus), durch den Hirnstamm (III. N. oculomotorius; IV. N. trochlearis; V. N. trigeminus [bzw. Ganglion trigeminale] mit N. ophthalmicus, N. maxillaris, N. mandibularis, Radix motoria; VI. N. abducens; VII. N. facialis; VIII. N. vestibulo-cochlearis [stato-acusticus]; IX. N. glossopharyngeus; X. N. vagus; XI. N. accessorius [spinalis]; XII. N. hypoglossus. (On old Olympus towering top a fatarmed girl vends snowy hops). Kap. 1.2 Strukturelle Anatomie des Zentralnervensystems Das Kleinhirn (Cerebellum) Das Kleinhirn liegt dorsal des verlängerten Marks, über dem vierten Ventrikel. Es wird vom posterioren Teil des Temporallappens und dem Okzipitallappen des Endhirns überlagert. Von diesem ist es durch eine Einstülpung der Dura mater, dem Tentorium, getrennt. Das Cerebellum ist über drei massive Faserbündel mit dem Hirnstamm und der Pons verbunden. Über diese Kleinhirnstiele, die Pedunculi cerebelli inferiores, medii und superiores erhält das Cerebellum Informationen aus vielen Teilen des Gehirns und des Rückenmarks, überwiegend nach Umschaltung in den Kernen der Medulla oblongata und der Pons. Aus dem Rückenmark ziehen sensorische Axone aber auch direkt in das Kleinhirn. Ebenso sind die cerebello-fugalen Fasern über Kerne (z.B. den N. dentatus) mit dem Spinalsystem und dem Mittel-, Zwischen- und Endhirn verbunden. Mit dem Vestibularsystem gibt es eigene, direktere reziproke Verbindungen. Das Kleinhirn ist im Prinzip einfach aufgebaut: Die Afferenzen enden als Kletterfasern direkt oder als Moosfasern über nachgeschaltete Körnerzellen mit ihren Parallelfasern an den Dendriten der Purkinjezellen (dazwischen geschaltet beÀnden sich noch innere und äußere Sternzellen). Die Axone der Purkinjezellen sind die einzigen, die den zerebellären Kortex in Richtung der tieferen Kleinhirn- und Vestibulariskerne verlassen. Im Kleinhirn Ànden wir im Vergleich zur Großhirnrinde sehr viel weniger weiße Substanz bei einer riesigen Anzahl insbesondere von Körnerzellen. Die Faltung des aus nur drei Schichten bestehenden zerebellären Kortex ist daher auch sehr dicht. Anstatt von Gyri wird hier von Folien gesprochen. Und wegen seines baumartigen Aussehens im Schnitt spricht man auch vom „Arbor vitae“ des Kleinhirns. Obwohl das Kleinhirn in phylogenetisch unterschiedlich alte Teile gegliedert werden kann und man äußerlich auch eine rechte und linke Hemisphäre unterscheidet, ist der Kortex cerebelli doch durchgängig: also nicht, wie der Cortex cerebri, der am Interhemisphärenspalt unterbrochen und nur über Kommissurenbahnen miteinander verbunden ist. Wenn man die 53 Faltung (rechnerisch) glättet, ergibt sich eine zusammenhängende etwa handtuchartig geformte Fläche. Die Regelmäßigkeit des Aufbaus und der Verschaltungen innerhalb der Kleinhirnrinde haben schon früh zu Spekulationen über mögliche Zeitmessungs-, Taktgebungs- und Automatisierungsfunktionen geführt. Ob und wie diese neben einer automatisierten Verbesserung der Haltungs- und Bewegungssteuerung auch für kognitive Prozesse eine Rolle spielen könnten, ist bisher noch nicht geklärt. Das Ventrikelsystem Die Ventrikel sind mit zerebralspinaler Flüssigkeit gefüllte Hohlräume im Gehirn. Die Seitenventrikel (1. und 2. Ventrikel) reichen in der rechten und linken Hemisphäre mit dem Vorderhorn (Cornu anterius) in den Frontallappen; der mittlere Teil (Pars centralis) beÀndet sich jeweils in der Tiefe des Parietallappens und das Hinterhorn (Cornu posterius) im Okzipitallappen; das Unterhorn (Cornu inferius) reicht in den Temporallappen hinein. Zur Mitte hin sind die Seitenventrikel durch das Septum pellucidum voneinander und vom dritten Ventrikel getrennt. Eine Verbindung zwischen den Seitenventrikeln und dem dritten Ventrikel besteht durch das Foramen interventriculare (Monroi). Der dritte Ventrikel liegt zentral in der Mitte des Gehirns und ist durch eine dünne Röhre im Mittelhirn, dem Aqäductus sylvii mit dem vierten Ventrikel unterhalb des Kleinhirns verbunden. In jedem der Ventrikel beÀndet sich ein Plexus choroideus, in dem die zerebralspinale Flüssigkeit gewissermaßen als Filtrat des Blutplasmas gebildet wird. Diese Flüssigkeit zirkuliert aus den Seitenventrikeln in den dritten, von dort in den vierten Ventrikel und den sich anschließenden Zentralkanal des Rückenmarks. Aber ganz wichtig ist, dass am Ende des vierten Ventrikels eine Austrittsstelle für die Flüsigkeit besteht, die somit in den Subarachnoidalraum, der das gesamte Zentralnervensystem umschließt, eintreten kann. Die zerebralspinale Flüssigkeit zirkuliert hier und wird dann durch Granulationen, die in den Sinus sagittalis superior (ein venöses Haupt- 54 abÁussgefäß) hineinragen, in den venösen Blutkreislauf resorbiert. Eine Idee von der Zirkulation der Zerebralspinalen Flüssigkeit erhält man, wenn man bedenkt, dass etwa ein halber Liter Flüssigkeit pro Tag gebildet wird, aber jeweils nur 150 ml in den Ventrikeln und dem Subarachnoidalraum zu Ànden sind. Ob die Produktion und Zirkulation nur eine Möglichkeit darstellt, eine effiziente und anpassungsfähige innere und äußere Polsterung des Gehirns bereit zu stellen, oder ob die zirkulierende Flüssigkeit speziÀschen Haushaltsprozessen zur Versorgung des Gehirns dient, ist noch unklar. Da die Seitenwände der Ventrikel von verschiedenen Strukturen gebildet werden, verändern sich bei Umgestaltung oder Verschiebungen dieser Strukturen auch die Volumina bestimmter Ventrikel. Mit bildgebenden Verfahren erhält man durch die Verschiebung oder Verkleinerung von Ventrikeln aufgrund von raumfordernden Prozessen oder die Vergrößerung von Ventrikeln bei Degeneration der wandbildenden Strukturen wichtige diagnostische Hinweise. Beispielsweise vergrößern sich die Vorderhörner bei Degenerationen des Kopfes des N. caudatus oder die Unterhörner bei entsprechenden Verkleinerungen des Hippokampus. Der Hirnschädel Viele klinische Neuropsychologen haben ein Gehirnmodell auf ihrem Schreibtisch und einen Atlas mit Hirnschnitten. Sehr hilfreich ist es aber auch, auf ein Schädelmodell zurückgreifen zu können. Zum einen werden hier die Schwachstellen sichtbar, die im Zusammenhang mit Hirnverletzungen durch Schädelbruch von Bedeutung sind. Zum anderen macht die relativ unwirtliche Gestaltung der InnenÁäche des Schädels deutlich, weshalb an bestimmten Stellen, beispielsweise den Kanten der Schädelgruben, besonders häuÀg mechanische Verletzungen des Gehirns auftreten. Schließlich kann man auch die Ein- und Austrittsstellen von Nerven und von Blutgefäßen lokalisieren, die bei Be- und Entschleunigung der Hirnmasse durch Abscherungen und Ab- B. Preilowski risse (bei Blutgefäßen dann mit entsprechenden Blutungen verbunden) gefährdet sind. Und letztlich macht die Geschlossenheit des Schädels auch die normalerweise relativ stabilen Blutdruckverhältnisse (im Vergleich zum restlichen Körper) deutlich, erklärt aber auch die fatalen Folgen von pathologischen, beispielsweise durch Ödembildung erzeugten intrakraniellen Drucksteigerungen, die die Gehirnmasse in die wenigen zur Verfügung stehenden Schädelöffnungen drückt. Letzteres führt dann zuerst zu einer Behinderung der Blutversorgung der Strukturen, die sich in diesen Öffnungen beÀnden, beispielsweise der Sehnerv (N. opticus) und die Arteria ophthalmica im Canalis opticus oder die Medulla oblongata, die Nn. accessorii sowie die Aa. vertebrales im Foramen magnum. Die Hirnhäute Direkt an der inneren Tafel des Schädelknochens und der Wirbelkörper anliegend und teilweise mit dem Periost dieser KnochenÁächen verwachsen ist die sehr zähe Bindegewebsstruktur der Dura mater (harte Hirnhaut). Die Schicht der Pia mater (weiche Hirnhaut) ist direkt mit dem Nervengewebe verbunden. Dazwischen beÀndet sich die Arachnoidea (Spinnegewebshaut), die zur Pia mater hin den Subarachnoidalraum bildet, in dem Blutgefäße verlaufen und die zerebrospinale Flüssigkeit (Liquor cerebrospinalis) nach ihrem Austritt aus dem Ventrikelsystem (auf der Höhe des verlängerten Marks) das Zentralnervensystem umspült. Die Dura mater bildet durch Einstülpungen, die beispielsweise im Interhemisphärenspalt bis fast auf die Höhe des Corpus callosum reicht, Trennwände. Zwischen den Hemisphären ist dies die Falx cerebri; zwischen ventralem Temporallappen bzw. Okzipitallappen und Cerebellum ist es das Tentorium. Die Blutversorgung des Gehirns Obwohl das Gehirngewebe vom Gewicht her nur zwei Prozent des Gesamtkörpers aus- Kap. 1.2 Strukturelle Anatomie des Zentralnervensystems macht, erhält es fast 17 Prozent des gesamten Herzschlagvolumens und ist mit 20 Prozent am gesamten Sauerstoffbedarf beteiligt. Die Unterbrechung der Blutzufuhr oder der Entzug von Sauerstoff führt zu Beschädigungen und zum Absterben von Nervengewebe. Die genaueren Mechanismen und Bedingungen (beispielsweise die Rolle der Bildung von freien Radikalen), unter denen es auch zu Unterschieden zwischen verschiedenen Gehirnstrukturen bezüglich der Auswirkungen einer mangelnden Blutversorgung kommen kann, sind Gegenstand umfangreicher Forschung. Die Blutversorgung des Gehirns erfolgt über die rechte und linke A. carotis interna, und die beiden Aa. Vertebrales, die in die A. basilaris münden. Letztere gabelt sich dann in die beiden Aa. cerebri posteriores, die im Wesentlichen ventrale Bereiche des Temporallappens und den Okzipitallappen versorgen. Die Karotiden gehen mehr oder weniger direkt in die rechte bzw. linke A. cerebri media über. Diese verlaufen dann jeweils in der Lateralfurche (Fissura sylvii) und versorgen den perisylvischen Kortex (Frontal-, Temporal-, Parietal-) sowie den insulären Kortex und die subkortikalen Kernstrukturen. Von der A. cerebri media zweigt das kleinere Gefäß der A. cerebri anterior fast im rechten Winkel ab. Beide Aa cerebri anteriores ziehen im Interhemisphärenspalt über das Corpus callosum und versorgen die medialen Bereiche sowie über die dorsalen Kanten des Kortex (die Mantelkanten) hinweg dorsolaterale Anteile des Frontal- und Parietallappens. Sowohl rechte wie linke A. cerebri media sind über ein kommunizierendes Gefäß (A. communicans posterior) mit den beiden Aa. cerebri posteriores verbunden. Zwischen den beiden Aa. cerebri anteriores gibt es eine Verbindung durch die A. communicans anterior. Damit ergibt sich ein kreisförmiger Zusammenschluss von Gefäßen, der Zirkel von Willis (Circulus arteriosus zerebri [Willisi]), der bis zu einem gewissen Grad Unterschiede in der Blutzufuhr zwischen beiden Karotiden und den Vertebralarterien ausgleichen kann. Dadurch können einseitige Arterienveränderungen (z.B. Stenosen) über längere Zeit unbemerkt bleiben. Die Arterien verlaufen im Subarachnoidalraum, wo sie sich vielfältig verzweigen. Sie bil- 55 den die Piagefäße und dann in der Gehirnsubstanz Arteriolen und Kapillargefäße. Die enorme Dichte der Versorgung wird durch ein paar Zahlen deutlich: Die kapillare Mikroversorgung des Gehirns wird auf eine Gesamtlänge von 650 km geschätzt. Die Gefäße sind im Durchmesser zumeist kleiner als 200 μm, bilden aber eine VersorgungsoberÁäche von 20 m2. Die Kapillaren liegen im Schnitt nur 40 μm voneinander entfernt (Duvernoy et al., 1981). Wie im übrigen Körper sind die Arterien auch in Kopf und Gehirn sehr umfassend neuronal versorgt. Daraus ergeben sich sehr komplexe Interaktionen zwischen zirkulatorischen und neuronalen Prozessen. Diese sind im Zusammenhang mit pathologischen (z.B. Entzündungen; Veränderungen der Blut-HirnSchranke) oder traumatischen EinÁüssen (Gefäßspasmen) von besonderer Bedeutung. Sie sind darüber hinaus auch für die Untersuchung normaler Gehirnfunktionen wichtig, sei es mit Hilfe von elektrophysiologischen Messungen oder insbesondere mit bildgebenden Verfahren, die ja im Prinzip auf der Messung von Durchblutungsveränderungen basieren. Der venöse Abfluss erfolgt durch tiefe und oberflächliche Venen in Hohlräume, die durch Einfaltungen der Dura mater gebildet werden, sogenannte Sinus (z.B. Sinus sagittalis superior, Sinus sagittalis inferior, Sinus rectus, Sinus transversus) und schließlich die Vena jugularis. Die Blut-Hirn-Schranke Die selektiv durchlässige Barriere zwischen Blut und Hirnsubstanz basiert auf besonderen Eigenschaften der Endothelzellen der Blutkapillaren und der perivaskulären Glia. Die Endothelzellen liegen an einer Basalmembran so eng aneinander (so genannte „Tight junctions“), dass sie ein kontinuierliches Gefäß bilden. Für die Aufrechterhaltung dieser engen Bindung sind bestimmte Proteine zuständig. Die Barriere, die auch durch einen relativ hohen elektrischen Widerstand gekennzeichnet ist, hält große Moleküle und bestimmte Stoffe zurück. Die Gefäßwände der Gehirnkapillaren besitzen weder die Öffnungen, noch die physiologischen Mechanismen, die im Blut- 56 gefäßsystem außerhalb des Gehirns den interzellulären Transport erleichtern. Die Ontogenese des menschlichen Gehirns Aus Platzgründen kann hier nur auf einige Grundzüge der ontogenetischen Gehirnentwicklung in und ex utero eingegangen werden. Beschrieben wird die Abfolge von Prozessen, die für ein Verständnis von pathogenen Auswirkungen auf die Entwicklung notwendig sind. Diese Auswirkungen unterscheiden sich nämlich deutlich, je nachdem in welcher Phase die Gehirnentwicklung beeinträchtigt wird. Im ersten und zweiten Trimester der Schwangerschaft steht die „Geburt“ von Nervenzellen und Glia (Proliferation), sowie deren Wanderung (Migration) zu den verschiedenen Gehirnteilen und ihre dortige Ausdifferenzierung im Vordergrund. Die Migration der Zellen erfolgt größtenteils entlang bestimmter vorauswachsender radialer Gliazellen. Die ersten Zellen bilden beispielsweise die tieferen Schichten des Kortex, die späteren wandern durch diese nach oben hindurch und bilden die äußeren Schichten. Einige Zellen wandern aber auch tangential quer zu dem glialen Gerüst. Die Differenzierung der Zellen vor Ort beinhaltet die Entwicklung von Axonen und Dendriten, die Aufnahme von Enzymen zur Bildung von Transmittern und die Ausbildung von Rezeptoren, um synaptische Übertragungen empfangen zu können. Die Zellen können also bereits Informationen senden und empfangen. Die afferenten Informationen, die die Zellen an bestimmten Orten erhalten, bestimmen mit, welche Funktionen die Zellen in diesem Bereich haben werden. Probleme bei der Zellentstehung (zu viele oder zu wenig Zellen, abnormale Zellen) können beispielsweise zu Microcephalie oder Megalencephalie führen. Wird die Migration behindert oder negativ beeinÁusst, können Zellen irgendwo isoliert stehen bleiben oder sie wandern zu Stellen, wo sie nicht hingehören (Ektopien, Heterotopien). Auch die Lissencephalie (glattes Gehirn ohne Gyri und Sulci) und Pachygyrie (breite, plumpe Hirnwindungen) werden mit Migrationsproblemen B. Preilowski in Verbindung gebracht. Andere schwere Missbildungen des Cortex cerebri, wie Schizencephalie, Polymicrogyrie und Hydranencephalie, werden hingegen als Auswirkungen von Störungen der Differenzierung und Organisation angesehen. Einige dieser Störungen sind genetisch bedingt, andere können aufgrund von Durchblutungsstörungen oder Infektionen entstehen. Je nach Ausmaß aller dieser Fehlbildungen unterscheiden sich die weiteren Entwicklungen dieser Gehirne und damit der Kinder, wenn sie denn lebend geboren werden. Selbst bei minimalen Abweichungen, beispielsweise vereinzelten Ektopien, leiden die Kinder später häuÀg unter Epilepsien. Bei umfangreicheren Störungen kommt es zu körperlichen und geistigen Behinderungen. Im dritten Trimester der Schwangerschaft gehen die Differenzierung und das Wachstum des Nervensystems weiter. Es beginnt eine Phase der überschießenden Ausbildung von Synapsen, die sich bis ins zweite Lebensjahr nach der Geburt fortsetzt. Gleichzeitig werden auch immer mehr Zellen und Verbindungen abgebaut, so dass gegen Ende des ersten Lebensjahres die vorher sprunghaft angestiegene Zahl der Synapsen langsam wieder abnimmt. Diese Entwicklung zieht sich durch die gesamte Kindheit und das Jugendalter und ist besonders gut sichtbar in der sich lange hinziehenden Entwicklung des Frontalkortex. Bei der frühen Beschneidung von Zellen und Zellverbindungen spielen offensichtlich trophische (unterstützende, nährende) Stoffe eine Rolle. Um den Zugang zu diesen Stoffen entsteht ein Wettbewerb unter den Zellen. Nur diejenigen, die die effektivsten und intensivsten Kontakte herstellen und aufrecht erhalten, haben die Chance zu überleben. Das bedeutet, dass sich im Rahmen gewisser genetisch bestimmter Vorgaben, aktivitätsabhängige Erfahrungen auf die normale Hirnentwicklung auswirken. Bei den pathogenen EinÁüssen im letzten Drittel der Schwangerschaft unterscheidet Krägeloh-Mann (2004) zwischen Einwirkungen zu Anfang des dritten Trimesters und zum Ende dieser pränatalen Periode. Insgesamt kommt es ab dem dritten Trimester eher zu Läsionen als zu Fehlbildungen. In der frühen Phase des letzten Trimesters ist insbesondere die weiße Sub- Kap. 1.2 Strukturelle Anatomie des Zentralnervensystems stanz betroffen. Intracraniale und periventrikuläre Infarkte sind die Hauptursachen und führen, je nach Lokalisation und Ausdehnung, zu postnatalen spastischen bzw. motorischen Störungen oder visuell perzeptiven sowie – bei sehr großen Läsionen – auch zu kognitiven DeÀziten. In der späten Phase dieses Trimesters sind vor allem kortikale und subkortikale Strukturen der grauen Substanz betroffen. Zumeist sind hierfür prä- und perinatale Hypoxien bzw. Ischämien verantwortlich. Es wird vermutet, dass insbesondere Strukturen, die in dieser Phase der Gehirnentwicklung eine besonders hohe metabolische Aktivität zeigen (Chugani, 1999), in Mitleidenschaft gezogen werden. Die dann auftretenden Schädigungen der Basalganglien oder Thalamusläsionen führen zu gravierenden motorischen Störungen. Wenn zusätzlich andere zentrale Bereiche und der Hippokampus betroffen sind, kann es zu schweren Entwicklungsstörungen im Bereich der Motorik und der kognitiven Funktionen sowie zu ausgeprägten bilateralen spastischen Behinderungen kommen. Bei der Geburt wiegt das Gehirn ca. 300400 g. Das weitere Wachstum der Nervenzellen, ihre Ausdifferenzierung in axonalen und dendritischen Bereichen sowie die Zunahme an Gliazellen und die Myelinisierung der Axone führen zur Vergrößerung und Gewichtszunahme des Gehirns, welches dann im Mittel im 14. Lebensjahr dem des Erwachsenen ähnelt. Die Entwicklung einer Reihe von Strukturen, beispielsweise des frontalen Kortex geht aber noch weiter, bis in das Jugendalter hinein, und die volle Ausbildung des Corpus callosum reicht sogar bis in das zweite Lebensjahrzehnt. Da ein recht verlässlicher Zusammenhang zwischen dem Ausmaß an neuronalen Verschaltungen und der metabolischen (vor allem Glukose) Aktivität nachgewiesen wurde, konnte man in der Folge durch Messungen des Glukosestoffwechsels mit Hilfe der Positronen-Emissions-Tomographie (PET) Hinweise auf die Unterschiede in der Entwicklungsgeschwindigkeit verschiedener Hirnbereiche erhalten (Chugani, 1998): Hier bestätigte sich der Zeitplan der prä- und perinatalen Entwicklung: Primäre sensorische und motorische Kortizes, Hippokampus und cingulärer Kortex 57 behalten einen Vorsprung in der Entwicklung vor den assoziativen Kortexbereichen. Plastische Veränderungen im Nervensystem Untersuchungen von Jugendlichen und Erwachsenen mit kernspintomographisch nachgewiesenen pränatalen unilateralen Hirnschädigungen ergaben interessante Befunde bezüglich der Kompensation von Ausfällen, die aufgrund der Lokalisation der Läsionen zu erwarten gewesen wären: Sprachliche Funktionen wurden ohne offensichtliche Einbußen vollständig von homolateralen Arealen der unbeschädigten rechten Hemisphäre übernommen. Auch in motorischen Funktionen zeigten sich Kompensationen. Hier schien, nach unilateralen Läsionen in der frühen und mittleren pränatalen Periode, die Aufrechterhaltung von ipsilateralen Bahnen eine Rolle zu spielen. Für das visuelle System wurde nur eine begrenzte kompensatorische Kapazität gefunden (Krägeloh-Mann, 2004). Die Kompensation während der Entwicklung des Gehirns beruht also auf einer gewissen Plastizität in der Ausformung eines genetisch vorgegebenen Bauplanes. Diese Plastizität ist für die verschiedenen Gehirnstrukturen und Phasen der Entwicklung sehr unterschiedlich. Ferner ist zu bedenken, dass die für die normale Entwicklung vorgesehene Plastizität, im Falle einer Reaktion auf abnormale Zustände, langfristig durchaus zu einer negativen Entwicklung führen kann. Margret A. Kennards Empfehlung (1936) „wenn schon eine Hirnschädigung, dann diese möglichst früh“ zu haben, sollte also mit Vorsicht genossen werden; die in der frühen Entwicklung gegebene größere Plastizität kann auch zu größeren Abweichungen führen. In den letzten Jahren hat sich nun die Ansicht durchgesetzt, dass plastische erfahrungsabhängige Veränderungen nach ähnlichen Prinzipien wie während der Entwicklung ebenso im erwachsenen Gehirn stattÀnden. Wenn auch in sehr viel engeren Grenzen bleibt die Struktur des Gehirns zumindest funktionell anpassungsfähig und spiegelt somit jeweils einen augenblicklichen Zustand ständiger dynamischer Interaktionen im Nervensystem wider. Funktionelle Anatomie des Zentralnervensystems Geschichte und Methoden der funktionellen Neuroanatomie MARIO PAULIG Zusammenfassung Aussagen zur Funktion umschriebener Hirnregionen basieren heute im Wesentlichen auf klinischen Daten, d.h. Verletzungsfolgen in Korrelation zur morphologischen Bildgebung, oder auf funktionell bildgebenden Daten im Sinne von aufgabenspeziÀschen Aktivierungsmustern überwiegend bei gesunden Probanden. Dabei ergibt sich nicht in jedem Fall eine 1:1 Korrelation. Eine Aktivierung eines Hirnareals in der funktionellen Bildgebung in Abhängigkeit von einer bestimmten Leistung lässt nicht notwendig darauf schließen, dass diese Leistung im Falle einer isolierten Schädigung dieses Areals auch beeinträchtigt sein muss. Manche klinischen Symptome besitzen eine sehr hohe neuroanatomische SpeziÀtät, wie z.B. sensomotorische Störungen, während andere, wie z.B. Aufmerksamkeitsstörungen, nach recht unterschiedlichen Hirnläsionen beobachtet werden können. Nach derzeitigem Verständniss sind vor allem komplexe kognitive Leistungen durch neuronale Netzwerke mit regional verteilten Epizentren repräsentiert. Die Tradition der Lokalisation sogenannter höherer Hirnfunktionen reicht weit zurück. Im 18. Jahrhundert war es die Phrenologie des Franz Joseph Gall, die erstmals solche Funktionen auf den Großhirnkortex bezog und in weite Gesellschaftsbereiche hinein rezipiert wurde. Durch die irrige Annahme, kortikale Merkmalsausprägungen würden sich in einer veränderten Schädelmorphologie zeigen, wurde es zu einem Gesellschaftsspiel, sich gegenseitig den Kopf zu betasten und die geistigen und persönlichen Eigenschaften des Gegenüber einzuschätzen. Wenn auch letztlich keine der vermuteten kortikalen Funktionslokalisationen aus heutiger Sicht haltbar ist, so ist doch ein erhebliches Interesse an der Anatomie höherer Hirnfunktionen geweckt worden. Es war auch ein von der Phrenologie inspirierter Arzt, John M. Harlow, der Mitte des 19. Jhdts. den aufsehenerregenden, und seitdem in vielen neurowissenschaftlichen Schriften immer wieder als paradigmatisch für die funktionelle Hirnanatomie erwähnten Fall des amerikani- schen Eisenbahnarbeiters Phineas Gage untersuchte und publizierte. Gage hatte eine Penetrationsverletzung vorderer Hirnregionen durch eine Eisenstange viele Jahre überlebt, jedoch mit dem Preis einer schwersten Wesensänderung und sozialem Abstieg. Den hirnlokalisatorischen Sektionswünschen Harlows kam allerdings der amerikanische Bürgerkrieg dazwischen. Harlow, der viel zu spät vom Ableben des Herrn Gage erfuhr, konnte nur noch eine Exhumierung des knöchernen Schädels mit den Trepanationsmalen und der Eisenstange erreichen. Diese übten jedoch eine ungebremste Faszination auf Neurowissenschaftler aus. In jüngerer Zeit rekonstruierten Damasio und Mitarbeiter per Computeranimation den Weg der Eisenstange durch das Gehirn von Gage und nahmen eine Läsion des ventromedialen präfrontalen Kortex als Ursache für die Verhaltensstörung an (Damasio et al., 1994). Allerdings sind bei kritischer Prüfung die primären Datenquellen zweifelhaft und Gage diente wohl eher als ProjektionsÁäche für Kap. 1.2 Funktionelle Anatomie des Zentralnervensystems Eigenschaften, die man gerne dem Frontalhirn zuschrieb (MacMillan, 2000). Der Fall zeigt auch, dass man vorsichtig sein sollte, bei überwiegend diffusen Schädigungsätiologien wie dem Schädelhirntrauma Rückschlüsse auf umschriebene Hirnfunktionen zu ziehen. Die postmortale Hirnpathologie in Bezug gesetzt zu den vorbestehenden neurologischen bzw. neuropsychologischen Auffälligkeiten stellte lange Zeit zusammen mit der tierexperimentellen Grundlagenforschung die wesentliche funktionell anatomische Informationsquelle dar. Bekannte Beispiele sind die Arbeiten von Paul Broca und Carl Wernicke zur Lokalisation der Sprachfunktion. Erst die Verfügbarkeit der modernen bildmorphologischen Diagnostik, im wesentlichen ComputertomograÀe und KernspintomograÀe, erlaubten eine in vivo Darstellung von Hirnläsionen und lieferten eine Fülle von klinischen Daten zur funktionellen Neuroanatomie. Bahnbrechend für die Lokalisation von Hirnfunktionen waren auch Mitte des 20. Jhdts. Befunde von Wilder PenÀeld, der durch umschriebene elektrische Stimulationen am menschlichen Kortex eine vorübergehende Störung bestimmter Leistungen hervorrief und somit eine Kartographie vieler Funktionen des Gehirns vornehmen konnte. Diese Methode hat bis heute Bedeutung wenn es darum geht, vor neurochirurgischen Eingriffen Funktionen mit hoher interindividueller anatomischer Varianz zu lokalisieren. Beispielhaft sei hier das intraoperative Sprachmonitoring erwähnt. Eine neue Dimension tat sich Ende des letzten Jahrhunderts durch die funktionelle Bildgebung (PET, fMRT) auf. Über die Darstellung von Änderungen des regionalen Blutflusses war es erstmals indirekt möglich aufgabenspezifische Hirnaktivierungen bei Gesunden darzustellen. Viele Aussagen zur Lokalisation bestimmter kognitiver Leistungen basieren heute auf Ergebnissen der funktionellen Bildgebung. Allerdings bleibt in einigen Bereichen die Frage offen, inwieweit von der leistungsspezifischen Aktivierung einer bestimmten Hirnregion tatsächlich auf die Störung dieser Leistung im Falle einer Läsion dieses Bereichs geschlossen werden kann. 59 Eine direkte Darstellung elektrischer Potentialänderungen durch neuronale Aktivität gelingt durch elektrophysiologische Verfahren wie ElektroenzephalograÀe und für die funktionelle Neuroanatomie bedeutsamer die Magnetenzephalographie. Letztere vermag mit hoher zeitlicher AuÁösung Aktivitätsänderungen bestimmter Hirnzentren darzustellen, allerdings ist das Verfahren sehr aufwändig, artefaktanfällig und seine räumliche AuÁösung ist nur mäßig. Großhirnkortex: Konnektivität, Netzwerke und Verarbeitungwege M. Mesulam nahm aufbauend auf der zytoarchitektonischen Kartierung in 47 BrodmannAreale (BA) eine funktionelle Einteilung des Kortex in fünf Bereiche vor (Mesulam, 1985). Primäre Rindenfelder sind „Eingangsstationen“ der Sinnesafferenzen bzw. „Ausgangsstation“ der Motorik, wie z.B. die primäre Sehrinde an den Ufern des Sulcus calcarinus (BA 17) oder der primär motorische Kortex im Gyrus präzentralis (BA 4). Ausfälle in diesen Bereichen gehen mit einer basalen sensorischen oder motorischen Störung einher, etwa mit einer Hemianopsie oder einer zentralen Parese. Unimodale Assoziationsfelder nehmen bereits eine komplexe Informationsverarbeitung vor, aber nur bezogen auf eine Modalität. Hierzu zählt z.B. der visuelle Assoziationskortex (BA 18-21 und 37). Im Falle einer Läsion können komplexere und variablere Ausfälle wie z.B. eine Störung der visuellen Objekterkennung resultieren. Heteromodale Assoziationsfelder dienen der komplexen Informationsverarbeitung unter Einbeziehung verschiedener Modalitäten. So können Verletzungen des präfrontalen Kortex (BA 9-12, 45-47 und Teile von 8) multimodale Syndrome wie eine Exekutivfunktionsstörung bewirken. Die paralimbischen Areale beinhalten folgende Hirnstrukturen: den orbitofrontalen Kortex (hintere BA 11 und 12), den Temporalpol (BA 38), die vordere Insel (BA 14-16), den Gyrus parahippokampalis (BA 27, 28, teilweise BA 35) und den retrosplenialen zingulär-parolfaktorischen Komplex (BA 23-26 und 29-33). Die 60 paralimbischen Areale stellen einen Übergangsbereich zwischen dem sechsschichtigen Isokortex und den primitiveren limbischen Arealen ( Allokortex) dar. Zu letzteren zählen die Hippokampusformation, die Amygdala, der präpiriforme olfaktorische Kortex, die Septalregion und die Substantia innominata (siehe hierzu auch das vorangehende Kapitel von B. Preilowski). Nach der Vorstellung von Mesulam sind die limbischen Bereiche vor allem mit dem internen Milieu befasst und werden mit Emotion und Motivation in Verbindung gebracht. Dagegen sind die uni- und heteromodalen Rindenfelder in erster Linie in Geschehnisse der Außenwelt involviert. Die kolumnare Organisation in Säulen von neuronalen Zellverbänden als kleine funktionelle Einheiten ist tierexperimentell für viele Systeme nachgewiesen (Mountcastle, 1997). Kolumnen im sensiblen Kortex z.B. umfassen einige hundert Mikrometer mit Hunderttausenden von Neuronen und werden durch speziÀsche Stimuli wie z.B. eine umschriebene Hautberührung oder Gelenkpositionen aktiviert. Die Kolumnen als kleinste funktionelle Einheiten können aber nur dann komplexes Verhalten steuern, wenn sie auf komplexe Weise miteinander verbunden sind. Die Konnektivität zwischen kortikalen Arealen ist also von herausragender Bedeutung. So hat sich in der Evolution des Primaten die weisse Substanz, also der Ort der subkortikalen Verbindungen, gegenüber der kortikalen grauen Substanz exponentiell entwickelt (Allman, 1999), und das menschliche Frontalhirn unterscheidet sich von dem des Affen vor allem durch ein Zunahme des frontalen Marklagers (van Hoesen et al., 1996). Erkenntnisse über Konnektivität und räumliche Schwerpunktbildungen führten zur Modellvorstellung von neuronalen Netzwerken als Substrat „höherer Hirnfunktionen“. Danach sind komplexe Verhaltensbereiche wie Aufmerksamkeit, Sprache, Gedächtnis oder räumliche Leistungen nicht in isolierten Arealen, sondern in einem funktionellen System aus integrierten, räumlich verteilten Zentren repräsentiert (Mesulam, 1998). Damit lässt sich erklären, dass z.B. eine Sprachstörung nach unterschiedlich lokalisierten Läsionen auftreten kann, die entweder die kortikalen M. Paulig Epizentren oder die subkortikalen Verbindungen des sprachrelevanten Netzwerks betreffen. Einzelne kortikale Zentren können auch mehreren überlappenden Netzwerken angehören. Der Thalamus ist für viele kognitionsrelevante kortiko-kortikale, aber auch sensorische und motorische Verbindungen eine wichtige Flaschenhalsstruktur. Schädigungen des Thalamus können deshalb „kortikale Syndrome“ wie z.B. einen Neglekt zur Folge haben. Die Netzwerke stehen unter dem EinÁuss weitverzweigter Projektionssysteme aus dem Hirnstamm und Hypothalamus, die einen aktivierenden bzw. modulierenden EinÁuss auf sie haben. Sie sind teilweise identisch mit dem Konzept des aufsteigenden retikulär-aktivierenden Systems (ARAS). Dabei spielen cholinerge, dopaminerge, noradrenerge, serotonerge und histaminerge Transmittersysteme eine Rolle. Sie entspringen aus Kerngebieten im oberen Hirnstamm (z.B. Locus coeruleus, Raphekerne) oder dem basalen Vorderhirn (z.B. Nucleus basalis Meynert). Mittlerweile sind für mehrere funktionelle Systeme Informationsverarbeitungspfade des Kortex identiÀziert worden, die jeweils von hinteren Großhirnbereichen nach rostral verlaufen (Abb. 8). Ursprünglich wurde von Mishkin und Mitarbeitern (1983) aus tierexperimentellen Untersuchungen für das visuelle System ausgehend vom visuellen Kortex ein dorsaler Pfad zum Parietallappen mit Prozessierung räumlicher Informationen und ein ventraler Pfad am unteren okzipito-temporalen Abb. 8. Pfade der Informationsverarbeitung im Gehirn. Kap. 1.2 Funktionelle Anatomie des Zentralnervensystems Übergang mit Verarbeitung objektbezogener Informationen beschrieben. Dies passt gut zu der klinischen Erfahrungen beim Menschen, dass visuell räumliche Störungen überwiegend mit parietalen Läsionen und Objektagnosien besonders mit Schädigungen des inferioren temporo-okzipitalen Übergangsbereichs vergesellschaftet sind. In jüngerer Zeit wurden auch für den dorsolateralen präfrontalen Kortex Einbindungen in den dorsalen und ventralen Pfad postuliert (Rao et al., 1997). Dabei ist wiederum der obere präfrontale Kortex mehr in raumbezogene, der untere mehr in objektbezogene Operationen involviert. Auch für die Verarbeitung akustischer Systeme wurden getrennte Pfade identiÀziert (Romanski et al., 1999). Dabei steht in Analogie zum visuellen System ausgehend von der Hörrinde der dorsale Pfad für die räumliche Verarbeitung akustischer Reize und der ventrale Pfad für die IdentiÀkation akustischer Reize. Jüngst wurden sogar für die Sprachverarbeitung zwei Wege beschrieben (Hickok u. Poeppel, 2004). In einem dorsalen Fluss von temporoparietal bis zum oberen präfrontalen Kortex werden phonologische Aspekte, in einem ventralen Pfad von temporal bis zum unteren präfrontalen Kortex konzeptuelle Sprachaspekte prozessiert. Abb. 9. Funktionelle Neuroanatomie der Insel. 61 Crossmodale Gehirnstrukturen im Wandel der Sicht: das Beispiel der Inselrinde Während die funktionelle Bedeutung z.B. des Frontalhirns als Konvergenzzone des Gehirns schon lange großes Interesse erweckte, gibt es auch crossmodale Hirnstrukturen, die erst in jüngerer Zeit vermehrt in das Bewusstsein der Neurowissenschaft rückten. Dazu zählt der Inselkortex, dessen funktionelle Anatomie hier exemplarisch erläutert werden soll (Abb. 9). Der insuläre Kortex wird durch den Sulcus centralis insulae in eine vordere und eine hintere Insel geteilt. Die vordere Insel umfasst in der Regel drei kurze Gyri (Gyri breves), die hintere ein oder zwei längere Gyri (Gyri longi). Eigentlich können vorderer und hinterer Inselkortex auch als eine Fortsetzung der motorischen (Gyrus praecentralis) und sensiblen (Gyrus postcentralis) Rinde angesehen werden, die sich in ihrem unteren Bereich als frontoparietales Operculum (Operculum = Deckel) über die Insel wölben. In gewisser Analogie zur Architektonik des sensomotorischen Kortex ist die vordere Insel agranulär, die hintere granulär. Die vordere Insel wird zu den paralimbischen Arealen gerechnet. Der insuläre Kortex weist vielfache Verbindungen zu ande- 62 ren Hirnteilen auf. Die vordere Insel unterhält u.a. ausgeprägte Verbindungen mit der Amygdala und dem orbitofrontalen Kortex, während die hintere Insel u.a. mit sensorischen Kortexbereichen verbunden ist. Da die vordere Insel gustatorische und olfaktorische Eingänge erhält wurde sie traditionell im Wesentlichen mit Geschmacks- und Geruchsverarbeitung, aber auch mit autonomen Funktionen in Verbindung gebracht. Bei elektrischen Stimulationsversuchen dieser Region konnten Veränderungen autonomer Körperfunktionen wie Herzschlag oder Atmung ausgelöst werden. Es spricht viel dafür, dass die Insel eine viszerosensorische bzw. viszeromotorische Konvergenzzone im Gehirn darstellt. Jüngere Daten, unter anderem aus funktionell bildgebenden Untersuchungen, führten zu der Vorstellung einer zentralen Rolle der Inselrinde bei emotionalen Vorgängen. Dabei ist sie vor allem bei der Wahrnehmung (Interozeption) wie auch bei der autonomen Steuerung von Vorgängen im Körperinnern beteiligt (Craig, 2003). So Àndet man Aktivierungen der Insel bei emotionsgeladenen Rückmeldungen von körperlichen Veränderungen wie Schmerzreizen, Harndrang oder Lufthunger. Eng assoziiert sind auch Mitaktivierungen des anterioren Gyrus cinguli und des medianen orbitofrontalen Kortex. Letzterer spielt in der Theorie der somatischen Marker eine große Rolle, die eine Störung der unbewussten, emotionalen EntscheidungsÀndung durch einen mangelnden interozeptiven Zugriff auf die assoziierten autonomen Körperzustände, also einem „Bauchgefühl“, annimmt (Bechara et al., 2000). Damasio hebt die Bedeutung der Insel in diesem System besonders hervor (Damasio, 2003). Auf weitere Funktionen der Insel weisen neuere klinische Daten zu Läsionsfolgen hin. Der vorderen Insel scheint eine besondere Kompetenz bei der Steuerung von Sprechund von Schluckbewegungen zuzukommen. So konnte das Auftreten von Schluckstörungen in Assoziation von Infarkten der vorderen Insel gezeigt werden (Daniels u. Foundas, 1997). Auch in der funktionellen Bildgebung ist die Insel bei Schluckvorgängen aktiviert M. Paulig (Hamdy et al., 1999). Speziell der linken vorderen Insel wird eine Kompetenz bei der artikulatorischen Planung zugeschrieben. In einer größeren Läsionsstudie wurden Betroffene mit einer chronischen Sprechapraxie, die mindestens seit einem Jahr bestand, mit nicht Sprechapraxien, aber ebenfalls linkshirnig geschädigten Personen bezüglich der Läsionsmuster verglichen (Dronkers, 1996). Es zeigte sich eine doppelte Dissoziation bezüglich der linken anterioren Insel, die regelhaft bei der Sprechapraxie, aber nie bei den Patienten ohne Sprechapraxie betroffen war. Dies wurde in einer jüngst publizierten Studie repliziert (Ogar et al., 2006). Möglicherweise gilt dies jedoch nicht für akute Infarktpatienten, da eine weitere Untersuchung von Sprechapraxien nach frischen Hirninfarkten die benachbarte Brocaregion und nicht die Insel als kritischen Läsionsort hervorhebt (Hillis et al., 2004). In den letzten Jahren hat die rechtsseitige Insel in Bezug auf den Neglekt Interesse erweckt. Während traditionell der inferiore parietale Kortex als kritischer Läsionsort für die halbseitige Vernachlässigung angesehen wurde, fand die Arbeitsgruppe um Karnath in einer kürzlich durchgeführten Untersuchung eine Schädigung der rechten Insel, sowie der oberen Temporalwindung und des Striatum, als signiÀkant häuÀgsten Befund bei Neglektpatienten (Karnath et al., 2004). In diesem Zusammenhang ist interessant, dass der hintere Anteil der Insel und die umgebenden Kortexstrukturen möglicherweise dem vestibulären Kortex als Homolog des beim Affen identiÀzierten parieto-insulären vestibulären Kortex entspricht (Brandt et al., 1994). Störungen des vestibulären Systems können ähnlich wie bei einem Neglekt zu einer systematischen Verschiebung von subjektiven Raumkoordinaten führen. Andererseits ist bekannt, dass sich die Neglektsymptomatik durch vestibuläre Manipulationen (Labyrinthreizung durch kalorische Ohrspülungen) vorübergehend beeinÁussen lässt. Überlappungen von vestibulären und neglektassoziierten Phänomenen werden aktuell mit Blick auf die neuroanatomische Koinzidenz in der Insel diskutiert (Karnath u. Dieterich, 2006). Kap. 1.2 Funktionelle Anatomie des Zentralnervensystems Klinische Hirnanatomie: die Beziehung von Symptom und Läsionslokalisation Spezifität der Symptom-Läsion-Beziehung Bekanntermaßen ist weder eine rein lokalisationistische noch eine generell holistische bzw. äquipotentielle Sichtweise für die Funktion unseres Gehirns zutreffend. Die klinische Erfahrung zeigt, dass manche Störungsbilder eine feste Beziehung zu Läsionen genau umschriebener Hirnregionen aufweisen, wie z.B. die Assoziation einer spastischen Lähmung mit einer Schädigung des motorischen Kortex und seiner absteigenden Bahnen. Diese hohe beiderseitige SpeziÀtät, also dass von einem Symptom auf die Läsion einer bestimmten Hirnstruktur geschlossen werden kann und umgekehrt bei einer sichtbaren Schädigung dieser Struktur in der Bildgebung dieses Symp- 63 tom prädiktiv angenommen werden kann, betrifft in erster Linie motorische und sensorische Systeme (Abb. 10). Andererseits gibt es Symptome, die nach sehr unterschiedlichen Hirnverletzungen auftreten können, was für viele kognitive Syndrome wie z.B. Aufmerksamkeitsstörungen gilt. DeÀzite bei der Aufmerksamkeitstestung können praktisch nach Hirnschädigungen jeglicher Lokalisation beobachtet werden. Bei näherer Betrachtung zeigt sich, dass auf die Ausprägung von Aufmerksamkeitsstörungen offenbar sowohl quantitative als auch regionale Faktoren EinÁuss haben. So treten schwere Beeinträchtigungen der Aufmerksamkeit vor allem dann auf, wenn quantitativ relevante diffuse Verletzungen des subkortikalen Marklagers oder des Großhirnkortex, z.B. nach Schädelhirntrauma oder Hypoxie, vorliegen. Andererseits können auch schon kleine Läsionen zu gravierenden Abb. 10. T2-gewichtetes MRT. Man sieht einen linkshirnigen Mediateilinfarkt (hell), der den lateralen sensomotorischen Kortex betrifft. Es resultierte eine rechtsseitige sensomotorische Hemiparese, die entsprechend der somatotopischen Gliederung armbetont war. Die Stelle der Repräsentation der distalen oberen Extremität lässt sich meist gut an einer knopfartigen Ausbeulung des Gyrus präcentralis nach hinten erkennen („hand knob“). Sie ist im Gegensatz zum medial davon gelegenen Beinareal (im Anteriorstromgebiet) offensichtlich durch den Infarkt betroffen. Läsionen primärer sensomotorischer Rindenfelder weisen eine enge Korrelation zu bestimmten klinischen Ausfallsmustern auf. 64 DeÀziten der Aufmerksamkeitsintensität bzw. des skalaren Bewusstseins führen, wenn das Tegmentum des oberen Hirnstamms oder der Thalamus betroffen ist, also Strukturen, die dem ARAS (aufsteigendes retikuläres aktivierendes System) zugeordnet werden (Plum u. Posner, 1980). Eine besondere Vulnerabilität bestimmter „Flaschenhalsstrukturen“ ist auch für das deklarative Gedächtnis bekannt. Hier sind es der Hippokampus und mit ihm assoziierte Komponenten wie der anteriore Thalamuskern, der Mammillarkörper oder der Fornix, die als kritische Läsionsorte für amnestische Syndrome angesehen werden können (Mayes, 2000). Die Beiderseitigkeit der Beziehung Symptom zu Läsionsort und Läsionsort zu Symptom ist nicht immer gegeben. Ein Beispiel hierfür sind visuelle Agnosien, also herausragende Störungen der visuellen Erkennens- M. Paulig leistungen von Objekten oder Gesichtern, die nicht durch basale visuelle DeÀzite hinlänglich erklärbar sind (Abb. 11). So Àndet man bei Patienten, die unter einer Prosopagnosie leiden, regelhaft eine beidseitige oder rechtsseitige Schädigung des basalen temporo-okzipitalen Übergangsbereichs. Neuere Untersuchungen mit der funktionellen Bildgebung unterstützen diesen Befund durch die IdentiÀkation eines auf die Gesichtererkennung spezialisierten Areals im Gyrus fusiformis, der „fusiform face area (FFA)“ (Loffler et al., 2005). Läsionen in diesem Bereich, etwa im Rahmen eines Posteriorinfarkts, sind sehr häuÀg, Prosopagnosien im klinischen Alltag aber sehr selten. Dies bedeutet, dass bei einer in der Bildgebung sichtbaren Schädigung dieser Strukturen nicht mit hinlänglicher Wahrscheinlichkeit auf das Vorliegen einer Prosopagnosie geschlossen werden kann, obwohl man umgekehrt bei Vor- Abb. 11. In den Flair-gewichteten MRT Bildern kommt ein ausgedehnter Posteriorinfarkt linkshirnig und ein kleinerer rechts zur Darstellung (jeweils hell). Der linksseitige betrifft die primäre Sehrinde, hintere Anteile des Hippokampus und Gyrus parahippocampalis, sowie den inferioren okzipito-temporalen Übergang (Gyrus occipitotemporalis medialis und lateralis). Neben einer rechtsseitigen Hemianopsie und einer leichten Gedächtnisstörung stand klinisch vor allem eine ausgeprägte visuelle Agnosie im Vordergrund. Die inferiore okzipito-temporale Läsion ist typisch für die Agnosie, die sich jedoch nicht mit hinlänglicher Wahrscheinlichkeit vorhersagen lässt, wenn man nur die Bilder sieht. Kap. 1.2 Funktionelle Anatomie des Zentralnervensystems liegen einer Prosopagnosie mit hoher Wahrscheinlichkeit auf diese Pathologie schließen kann. Die Ursache könnte in einer interindividuellen Variabilität liegen, oder darin, dass für das Auftreten einer Prosopagnosie neben dem beidseitigen oder rechtsseitigen ventralen temporo-okzipitalen Kortex noch weitere Epizentren eines Netzwerks geschädigt sein müssen, die bis jetzt noch nicht identiÀziert sind. Man muss in diesem Zusammenhang auch einwenden, dass trotz der enormen Fortschritte in den bildgebenden Untersuchungen des Gehirns einschließlich der hohen AuÁösung moderner Kernspintomografen eine Hirnstruktur, die nur einen teilweisen Zelluntergang erlitten hat, im Bild nicht als pathologisch verändert zur Darstellung kommen muss. Andererseits lässt sich in der Bildgebung z.B. in einem gliotisch umgebauten Infarktareal nicht sicher ausschließen, dass noch funktionstüchtige Neuronen erhalten sind. Dieses Dilemma kommt auch bei Phänomenen der Diaschisis (Auseinanderklaffen) zum Tragen. Mit Diaschisis ist gemeint, dass bei Läsion einer bestimmten Hirnstruktur eine mit ihr verbundene, aber räumliche entfernte Hirnstruktur aufgrund mangelnden Inputs eine verminderte Aktivität aufweist, obwohl sie selbst nicht geschädigt ist. Dies wird meist über den regionalen BlutÁuss oder Metabolismus durch PET oder SPECT dargestellt. So konnte als robuster Befund nach einseitigen Mediainfarkten eine verminderte Aktivierung der kontralateralen Kleinhirnhemisphäre gezeigt werden (Srinivasan et al., 2004). Bei subkortikalen Aphasien z.B. bestehen jedoch kontroverse Diskussionen darüber, ob eine häuÀg begleitende Diaschisis scheinbar nicht betroffener sprachrelevanter Kortexbereiche wirklich auf eine Diskonnektion oder nicht doch auf eine bildmorphologisch nicht fassbare Teilinfarzierung des Kortex durch einen passageren Mediahauptstammverschluss verursacht ist (Nadeau u. Crosson, 1997). Die Ausprägung der klinischen Folgen einer Hirnläsion wird nicht nur durch das Ausmaß des lokalen Zelluntergangs, sondern auch durch die Zeitdauer der Schädigungsausbildung bestimmt. So Àndet man bei unbehandelten Hirntumorpatienten oft geringere klinische Symptome als bei Patienten mit Hirninfarkten 65 oder -blutungen vergleichbarer Lokalisation. Die Ursachen dafür liegen in der Neuroplastizität bzw. der funktionellen Reorganisation des ZNS, die durch den langsamen Raumforderungsprozess ermöglicht wird, sowie im inÀltrativen Charakter mancher Tumoren, die funktionsfähige Neuronen innerhalb der Tumorausdehnung belassen. In einer Studie aus der Arbeitsgruppe um Damasio wurden Hirntumorpatienten jeweils mit Hirninfarktpatienten verglichen, die ähnliche Läsionslokalisationen aufwiesen und sich einer ausführlichen neuropsychologischen Testung unterzogen (Anderson et al., 1990). Unter der Annahme, dass das Läsionsausmaß in der Bildgebung bei Hirntumoren wegen Begleitödem und Verdrängung tendenziell überschätzt wird, erfolgte bereits eine Zuordnung von jeweils etwas kleineren Hirninfarktmustern. Bei den Tumorpatienten fanden sich geringere DeÀzite und eine deutlich größere Variabilität als in der Vergleichsgruppe. Auch Duffau et al. (2003) fanden bei Patienten mit niedriggradigen Gliomen in eloquenten Hirnarealen geringere DeÀzite als erwartet. Läsionsfolgen in Abhängigkeit von Lateralität und interhemisphärischem Transfer Die wohl bekannteste funktionelle Lateralisierung betrifft die Sprache. Sprachstörungen (Aphasien) einschließlich herausragender schriftsprachlicher DeÀzite (Dyslexien, Dysgraphien) treten weit überwiegend nach linkshemisphärischen Läsionen auf. Dabei spielt die Händigkeit nur eine begrenzte Rolle, denn über 95% aller Rechtshänder und etwa zwei Drittel der Linkshänder entwickeln eine Aphasie, wenn die eloquenten Bereiche ihrer linken Hemisphäre durch eine Schädigung betroffen sind. Gekreuzte Aphasien, d.h. Aphasien bei Rechtshändern mit rein rechtshemisphärischen Läsionen, sind mit 1-2 % aller rechtshändigen Aphasiker sehr selten. Auch die Sprechapraxie ist ein linkshemisphärisches Syndrom. Apraxien, die den Mund- und Gesichtsbereich oder die Gliedmassen betreffen, sind häuÀg mit Aphasien vergesellschaftet und ebenfalls ein Störungsbild, das mit sehr hoher Wahrschein- 66 lichkeit auf eine linkshemisphärische Pathologie verweist. Dies trifft vor allem auf Fehlhandlungen im Umgang mit realen Objekten (ideatorische Apraxie) und die Imitation bedeutungsloser Handstellungen (ideomotorische Apraxie) zu. Dagegen konnte für die Imitation von Finger- und Fußstellungen eine Beeinträchtigung vor allem bei rechtshemisphärisch geschädigten Patienten gezeigt werden (Goldenberg u. Strauss, 2002). Ein Neglekt tritt weit häuÀger, ausgeprägter und anhaltender nach rechts- als nach linkshemisphärischen Läsionen auf. Passend dazu, dass beim Neglekt phänomenologisch auch Störungen der Aufmerksamkeit für bzw. der Wahrnehmung von Körper- und Aussenraum zum Tragen kommen, Àndet sich bei Beeinträchtigungen perzeptiver visuo-spatialer Leistungen ebenfalls eine Dominanz rechtshemisphärischer Schädigungen. Dagegen sind DeÀzite bei räumlich-konstruktiven Aufgaben entgegen früherer Ansichten neuroanatomisch relativ unspeziÀsch (Kerkhoff, 2006). Dies hat wohl auch damit zu tun, dass Fehler bei diesen Tests nicht nur durch räumliche, sondern auch durch viele andere kognitive Beeinträchtigungen bedingt sein können. HäuÀg, aber keinesfalls ausnahmslos mit einem Neglekt assoziiert ist eine gelegentlich in der Frühphase nach einer rechtshemisphärischen Schädigung zu beobachtende fehlende Bewusstheit für eine Lähmung, eine Anosognosie für Hemiplegie. Selten kann diese auch mit wahnhaften oder illusionären Verkennungen der betroffenen Körperseite einhergehen (Somatoparaphrenie). Auch für diese Störungsbilder einschließlich „misidentiÀcation syndromes“ Àndet sich ein klares Überwiegen rechtshemisphärischer Läsionen (Paulig, 2002). Auch bei Prosopagnosien, so die Pathologie nicht bilateral ist, zeigt sich typischerweise eine rechtsseitige Schädigungen des ventralen temporo-okzipitalen Übergangs. Aus zahlreichen funktionellen Untersuchungen bei Gesunden ergibt sich das Bild einer führenden Rolle der rechten Hemisphäre bei der emotionalen Verarbeitung. Dies ist jedoch mit klinischen Befunden nicht so klar belegt. So konnte z.B. für das häuÀge Auftreten einer Depression nach Schlaganfall (post-stroke depression) in zahlreichen Untersuchungen M. Paulig letztendlich keine Korrelation zu einer Hemisphäre oder einer kritischen Hirnstruktur hergestellt werden (Carson et al., 2000). Als Folge der hemispheriellen Spezialisierung ergeben sich bei längerstreckigen Diskonnektionen des Balkens (split brain) einseitige Funktionsstörungen der Körperseiten. Diese Patienten weisen u.a. eine isolierte Apraxie der linken Körperseite und eine Benennstörung für Gegenstände auf, die ihnen in die linke Hand gegeben werden. Ursache dafür ist der fehlende Informationstransfer von der praxiedominanten linken Hemisphäre zum rechten sensomotorischen Kortex bzw. von der rechten Hemisphäre zum sprachrelevanten Kortex der linken. Ein hemispherielles Diskonnektionssyndrom spielt auch bei der reinen Dyslexie oder Wortformdyslexie eine Rolle. Hier liegt meist ein linksseitiger Posteriorinfarkt mit Läsion der linken Sehrinde (homonyme Hemianopsie rechts), zusätzlich aber noch eine Läsion des hinteren Balkens (Splenium) vor. Dadurch kann die visuelle Information der einzig noch intakten rechten Sehrinde nicht in die sprachdominante linke Hemisphäre transferiert werden. Bei taktilem Zugriff auf Buchstaben kann aber oft besser gelesen werden. Denn diese Informationen werden direkt von der rechten Hand in die linke Hemisphäre oder – bei Einsatz der linken Hand – zur rechten Hemisphäre und von dort über erhalten gebliebene mittlere Anteile des Balkens zum linken Großhirn transferiert. Bilaterale Schädigungen homologer Hirnstrukturen Als Faustregel kann gelten, dass bilaterale Zerstörungen funktionskritischer Hirnstrukturen besonders ausgeprägte und prognostisch ungünstige Störungen zur Folge haben. Manche Syndrome sind fast nur nach einer bilateral homologen Läsion zu beobachten. Hierzu zählt das Balint-Syndrom, das durch eine massive Einengung des Explorationsfeldes, eine Simultanagnosie und eine optische Ataxie gekennzeichnet ist. Meist Àndet man ursächlich eine Schädigung beidseits im parieto-okzipitalen Übergangsbereich, meist Grenzzoneninfarkte Kap. 1.2 Funktionelle Anatomie des Zentralnervensystems 67 Abb. 12. Flair-gewichtetes MRT mit den Folgen einer Herpes-Encephalitis. Man sieht sehr deutlich, dass diese virusbedingte Entzündung (hell) die benannten limbischen und paralimbischen Kortexareale bevorzugt. Als Beispiel für eine bilaterale Schädigung homologer Hirnareale führte sie in diesem Fall zu einem schweren amnestischen Syndrom, sowie zu erheblichen emotionalen Veränderungen und Verhaltensauffälligkeiten. zwischen dem Posterior- und Mediastromgebiet (watershed lesions) (Rizzo u. Vecera, 2002). Zu den neuropsychologischen Störungen, die zwar auch nach einseitigen Pathologien, besonders ausgeprägt aber nach homolog beidseitigen Läsionen vorkommen gehört das amnestische Syndrom. Bereits der vielfach publizierte Fall des Henry M., der in den 50er Jahren des letzten Jahrhunderts nach einem epilepsiechirurgischen Eingriff mit beidseitiger Hippokampektomie für den Rest seines Lebens unter einer schwersten Amnesie litt, verweist auf die Vulnerabilität deklarativer Gedächtnisleistungen durch bilaterale Schädigungen des Hippokampus und assoziierter Strukturen. Typische Schädigungsätiologien mit bilateraler Signatur sind Hypoxien, bei denen es u.a. zu einer Nekrose des CA1-Sektors des Hippokampus beidseits mit der Folge eines schweren amnestischen Syndroms kommen kann. Aber auch durch symmetrische Infarktmuster können schwere neurologische bzw. neuropsychologische DeÀ- zite resultieren. Abgangsvarianten der Gefäßversorgung, bei denen die jeweiligen Arterien aus einem gemeinsamen Hauptstamm entspringen, leisten solchen Infarkten Vorschub. Bilaterale Thalamusinfarkte im Versorgungsgebiet der sog. polaren Thalamusarterie können auf dieser Basis zu schweren Amnesien führen. Besonders ausgeprägt scheinen diese zu sein, wenn kombiniert der jeweils anteriore und dorsomediale Thalamuskern betroffen ist und damit sowohl der Papez-Kreis als auch die basolaterale Gedächtnisschleife diskonnektiert ist (Perren et al., 2005). Ein weiteres Beispiel einer beidseitigen Schädigungsätiologie stellt die Herpes-Enzephalitis dar (Abb. 12). Sie befällt überwiegend limbische und paralimbische Kortexstrukturen bilateral, auch wenn der Befund häuÀg asymmetrisch ausgeprägt ist. Ebenso basieren neurodegenerative Erkrankungen, die u.a. mit einem dementiellen Abbau einhergehen können, typischerweise auf einem bilateralen Zelluntergang in homologen Strukturen.