Friedrich Loeffler Institut für Medizinische Mikrobiologie
Werbung

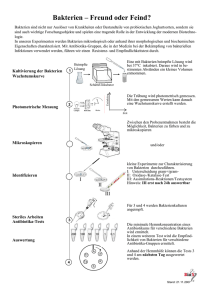
Friedrich Loeffler Institut für Medizinische Mikrobiologie Universitätsmedizin Greifswald KdöR Leitfaden zum Praktikum Pharmazeutische Biologie/Mikrobiologie Wintersemester 2013/14 Über die durchgeführten Analysen ist im Praktikumsheft ein Kurzprotokoll (ggf. inkl. Zeichnungen) anzufertigen. Die Unterlagen sind an jedem Praktikumstag mitzubringen. Experimente gehen z. T. über mehrere Praktikumskomplexe. Praktikumsordnung Das Praktikum besteht aus seminaristischer Einführung in die vorgegebenen Themen und zugehörigen praktischen Übungen. Dazu wird eine Anwesenheitskontrolle durchgeführt. Regeln für den Ablauf des Praktikums: 1. Während des Praktikums ist das Tragen von weißen Schutzkitteln Pflicht. Diese werden dem Kursteilnehmer vom Institut zur Verfügung gestellt. Nach Beendigung jeder Übung werden sie am zugewiesenen Ort aufbewahrt. Nach Abschluss des gesamten Kurses werden die Kittel gewaschen. 2. Rauchen, Essen und Trinken sind im Praktikumsraum streng untersagt. Infektionsgefahr! 3. Entstandene Kontaminationen von Personen (Mund, Gesicht, Augen oder Hände) bzw. Kontaminationen von Sachen (Kleidung oder Arbeitsplatz) nicht verheimlichen, sondern sofort melden, damit geeignete Maßnahmen (Desinfektion und „Erste Hilfe“) ergriffen werden können. 4. Nach Beendigung der Arbeiten sind die Arbeitsplätze aufgeräumt zu verlassen. Die zur Verfügung gestellten Geräte, insbesondere die Mikroskope, und die Materialien sind pfleglich zu behandeln. Für fahrlässige Beschädigungen hat der Verursacher finanziell aufzukommen. 5. Bei Bedarf, aber immer vor Verlassen des Praktikumsraumes sind die Hände gründlich zu desinfizieren. Dazu lässt man etwa 3 ml Desinfektionsmittel aus den Spendern neben der Wascheinheit im Kurssaal in die Handfläche laufen. Anschließend erfolgt eine Einwirkzeit über 30 Sekunden. Während dieser Zeit werden im Wechsel Handfläche und Handrücken der beiden Hände, Finger und Fingerkuppen mit dem Desinfektionsmittel eingerieben. Grundausrüstung auf den Arbeitsplätzen: - - Mikroskop mit 3 Objektiven. Objektiv „Achromat 100/1,25 Oil“ darf nur mit Immersionsöl benutzt werden. Nach Gebrauch Objektive mit weichem Lappen reinigen! Achten Sie bitte darauf, dass die übrigen Objektive nicht mit Immersionsöl verschmutzt werden. Immersionsöl Objektträger und Deckgläschen physiologische NaCl-Lösung (0,9%) in Ampullen Impfösen (für Einmalgebrauch: zur Entsorgung sofort nach Gebrauch in die gelben Abfallbehälter geben) Pinzette Filterpapier zum Trocknen der Präparate Bleistift Glasschreiber Gefäße zum Entsorgen infizierter Materialien einschließlich gebrauchter Präparate. Die Färbebank mit den benötigten Utensilien befindet sich über einer Abflusswanne. Bitte nur an den bezeichneten Plätzen Färbungen ausführen! Der Institutsdirektor Greifswald, Mai 2013 2 Mikroskopischer und kultureller Nachweis von Bakterien Kurs 1 1.) Mikro-Morphologie von Bakterien (Darstellung mit Methylenblaufärbung) Fixierte Fertigpräparate werden mit Methylenblau nach Loeffler gefärbt (ab Punkt 6). Nach der Färbung einen Tropfen Immersionsöl auf den Objektträger geben (auf die getrockneten Präparate) Mikroskopieren mit dem Objektiv 100x (mit schwarzem Ring) speziell für Ölimmersion Bakterien u. a. Zellen blau Morphologie (Skizze, Beschreibung) Präparat 1 Präparat 2 Präparat 3 Präparat 4 2.) Mikro- und Makro-Morphologie von Bakterien 2.1 Analyse eines Rachenabstriches 2.1.1 Anlegen einer Kultur Entnehmen Sie sich gegenseitig mit Abstrichtupfern Material aus dem Rachen des Praktikumpartners und streichen dieses auf Blutplatten fraktioniert aus: mit dem Abstrichtupfer über die Blutplatte streichen (1), mit einer Impföse parallele Impfstriche in 1. Hälfte der Blutplatte ausstreichen (2), dann Platte um 90° drehen und die 2. Hälfte beimpfen (3). Jeweils neue Impföse verwenden (siehe Skizze). Inkubation: 24 h 36°C, dann werden die Platten bis zum nächsten Praktikum kühl aufbewahrt. Auswertung im Praktikum Teil II. 1. Tupfer auf Blutplatte ausstreichen 2. mit Impföse das ausgestrichene Material „ausdünnen“ 3. mit neuer Impföse Material weiter „ausdünnen“ Ziel: Einzelkolonien 3 2.1.2 Darstellung mittels Differentialfärbung nach Gram Entnehmen Sie mit einem 2. Tupfer erneut Material (mehrmals abstreichen!!), bringen dieses Material auf einen Objektträger aus und färben das getrocknete und hitzefixierte Präparat nach Gram. Mikroskopieren und zeichnen Sie (+ kurze Beschreibung). 2.2 Subkultivierung und Differenzierung von Bakterien 2.2.1 Anlegen einer Subkultur Entnehmen Sie etwas Material von den Schrägagar-Kulturen (K1, K2, K3, K9) und streichen es auf einer Blutplatte fraktioniert aus (s. 2.1.1). Pro Keim wird eine halbe Blutplatte beimpft. Inkubation für 24 h bei 36°C 2.2.2 Differenzierung mittels Gramfärbung Fertigen Sie Präparate von den Bakterienkulturen K1, K2, K3 und K9 und färben diese nach Gram - Objektträger beschriften - sehr kleinen Tropfen physiologische NaCl auf Objektträger geben - sehr kleine Menge einer Kolonie von Schrägagar mit sterilem Spatel entnehmen - vorsichtiges Verrühren in der NaCl-Lösung - Lufttrocknen - Fixierung des Objektträgers: mit Pinzette festhalten und 3x sehr kurz durch die Flamme ziehen - Durchführung der Gramfärbung nach Vorschrift Mikroskopieren Sie Ihre Präparate. Beachten Sie das Gramverhalten (grampositiv, gramnegativ) sowie die Morphologie der Bakterien. Nr Gramverhalten / Morphologie Nr K1: K3: K2: K9: Gramverhalten / Morphologie Zeichnen Sie nach dem mikroskopischen Bild (Tab. S. 16 + 17) Welche Aussagen ergeben sich aus dieser Zuordnung bezüglich des Zellaufbaus der Bakterien? 3.) Differenzierung von verschiedenen Keimgruppen Differenzieren Sie die vorgegebenen Keime mittels Gramfärbung, Katalase-Test und Hämolyseverhalten 3.1 Mikroskopieren Sie die vorgegebenen Fertigpräparate (Zeichnung und kurze Beschreibung im Protokoll, Tab. S. 16 + 17) 4 Kurs 2 5. Desinfektion Zur Keimreduktion werden abhängig vom Material unterschiedliche Desinfektionsmethoden angewendet: Physikalische Verfahren (trockene und feuchte Hitze) Chemische Verfahren UV-Strahlen Ionisierende Strahlen Sterilisations- und Vergleichen Sie verschiedene Möglichkeiten zur Keimreduktion (waschen mit Wasser, desinfizieren mit alkoholhaltiger Lösung). Legen Sie die Fingerkuppen der rechten Hand nach folgendem Schema auf eine Petrischale mit Blut-Agar: a) Auflegen der Tageshand *vor, *nach dem Reinigen / Desinfizieren. b) Kontamination der Fingerkuppen mit einer Bakterienkultur Auflegen der Fingerkuppe auf den Nährboden *vor, *nach dem Reinigen / Desinfizieren Die Auswertung erfolgt in Kurs 3 (siehe Schema S. 18) Fortsetzung: Differenzierung von Bakterien 3.2 Werten Sie die Kulturen K4, K5, K6 und K7 aus, beziehen Sie dabei die Merkmale: Koloniegröße, Hämolyseverhalten, Verhalten im Katalase-Test u.a (s.unten) mit ein Hämolyse Die Zerstörung der Erythrozyten der Blutplatten und die Zersetzung des Hämoglobins führen zu Veränderungen, die als Hämolyse bezeichnet werden. Hämolyse ist ein wichtiges diagnostisches Merkmal, vor allem für Streptokokken und für Staphylococcus aureus. -Hämolyse ß-Hämolyse (-Hämolyse) nur partielle Hämolyse, Grünfärbung durch Met- und Sulfhämoglobin klarer, durchsichtiger Hof um die Kolonien Ursache: Reduktion des Hämoglobins Ursache: Zerstörung der Erythrozyten (Hämolysine) anhämolytische Keime -> keine Veränderung des Hofes um die Kolonien Katalasetest Das eisenporphyrinhaltige Enzym Katalase wird von vielen Spezies gebildet, Anaerobier und Mikroaerophile (Streptococcus, Lactobacillus) bilden es nicht. Katalase wandelt im Energiestoffwechsel gebildetes Wasserstoffperoxid (bei Akkumulation toxisch) in Wasser und molekularen Sauerstoff um. Plasmakoagulasereaktion a) Freie Koagulase (extrazelluläres Enzym) bindet an Prothrombin und aktiviert die Entstehung von Fibrin aus Fibrinogen Nachweis im Röhrchen-Agglutinations-Test: - in NaCl aufgeschwemmte Staphylokokken werden in EDTA-Plasma vom Kaninchen eingebracht - ist freie Koagulase vorhanden, agglutiniert das Kaninchenplasma innerhalb von 4 h 5 b) Clumping Faktor (zellwandgebundenes Protein) = Fibrinogenrezeptor Nachweis mittels Latex-Agglutinationstest - Latexpartikel sind mit Fibrinogen, IgG und spezifischen monoklonalen Antikörpern gegen Kapselpolysaccharide von Staph. aureus sensibilisiert - Stämme mit starken Polysaccharid-Kapseln werden von den monoklonalen antiPolysaccharidantikörpern agglutiniert - schwach bekapselte Stämme und Stämme, die ihre Kapsel verloren haben, werden durch das Fibrinogen und IgG agglutiniert - Material von einer Staphylokokken-Kolonie wird in das Latexreagenz eingerieben, Staph. aureus-Stämme (Clumping-Faktor positiv) agglutinieren (verklumpen) 3.3 Ordnen Sie die Stämme K2, K3, K4 und K7 entsprechend den oben beschriebenen Merkmalen zu (Strepto- oder Staphylococcus) (Tabelle S. 16) Nutzen Sie auch die Ergebnisse der mikroskopischen Analyse (2.2 / 3.2) Differenzierung: Micrococcaceae (Staphylococcus, Stomatococcus mucilaginosus) vs Streptococcus Gramverhalten grampositiv grampositiv Katalase positiv negativ Differenzierung: Staphylococcus Katalase Koagulase Positiv positiv Positiv negativ Staphylococcus Streptococcus Staphylococcus aureus [sowohl invasive (z.B. Abszeß) als auch toxinbedingte (z.B. Enteritis) Erkrankungen] "Koagulasenegative Staphylokokken" [z.B. S. epidermidis (nosokomiale Infektionen, „Plastikinfektionen“) , S. saprophyticus (Harnwegsinfektionen)] Differenzierung: Streptococcaceae (Streptococcus, Enterococcus) Beispiele: Mikroskop. Bild Hämolyse Ketten ß-Typ S. pyogenes (Scharlach, Pharyngitis, eitererregende Streptokokken, Lancefield-Serogruppe A) Diplokokken / Ketten -Typ „vergrünende Streptokokken“ S. pneumoniae (Pneumonie, Meningitis) S. sanguis (auch anhämolytisch) (Karies) Ketten S. salivarius meist -Typ (z.T.anhämolytisch) orale Streptokokken, z.B. S. mutans (Plaque, Karies) S. milleri (Endokarditis) / ß/ anhämolytisch Diplokokken Enterokokken, z.B. Enterococcus faecalis, / anhämolytisch E.faecium (Lokalinfektionen, Harnwegsinfektionen) 3.4 Differenzierung enteropathogener gramnegativer Stäbchen Durch Nutzung der angebotenen Substrate (Kohlenstoff-, Stickstoffquelle) kann sich der pH-Wert des Mediums ändern. Über den Zusatz von Indikatoren zu den einzelnen Nährmedien ist diese Änderung als Farbumschlag erkennbar 6 3.4.1 Differenzierung mittels MacConkey II-Agar Mit ausgewählten Medien können Bakterien anhand bestimmter Eigenschaften selektiert werden. Selektivmedium: Wachstum von Mikroorganismen, die besondere Eigenschaften aufweisen Bsp.: Medien, die mit Antibiotika angereichert sind es wachsen nur die Mikroorganismen, die gegen das verwendete Antibiotikum resistent sind Differentialmedium: Wachstum von verschiedenen Mikroorganismen mit unterschiedlicher Koloniemorphologie erlaubt eine Differenzierung MacConkey-Agar: - enthält Gallensalze und Kristallviolett (Selektivmedium) Wachstum von gram-positiven Bakterien wird weitgehend verhindert Wachstum verschiedener gramnegative Darmbakterien wird gefördert - enthält Laktose als C-Quelle und Neutralrot als pH-Indikator (Differentialmedium) Laktose fermentierende (vergärende) Bakterien werden über den Farbumschlag von Neutralrot identifiziert (Kolonien laktosepositiver Bakterien färben sich rot; Kolonien laktosenegativer Organismen bleiben farblos). Überprüfen Sie das Wachstum Ihres zu identifizierenden Stammes auf MacConkey Agar (Reinheitskontrolle zur biochemischem Differenzierung). Handelt es sich um einen laktose-positiven oder –negativen Stamm? Stimmt diese Reaktion mit der Reaktion in der „Bunten Reihe“ überein (Tab. S. 17)? 3.4.2 Analyse des biochemischen Profils von Bakterien-Stämmen Werten Sie die im Mikrostrip befindlichen Reaktionen (Inkubation 24 h, 36°C) mit Hilfe der Tabellen aus und identifizieren Sie die Ihnen vorgegebenen Keime. Enterobakterien: biochemische Leistungsprüfung (klassisches Identifizierungverfahren) Substrat Glukose u.a. Zucker Ammoniumzitrat Reaktion Säurebildung, Gasbildung Alkalisierung durch Verwertung von A.-Zitrat als einzige Stickstoffquelle S-haltige Aminosäuren H2S-Bildung Harnstoff Tryptophan NH3-Freisetzung Indolspaltung Nachweis über Indikation Bromthymolblau, grün gelb Bromthymolblau, grün blau Zugabe von Fe3+Sulfid-Bildung: Schwarzfärbung Phenolrot gelb rot Zugabe von Dimethylaminobenzaldehyd Rotfärbung Biochemische Reaktionen Nachweis von … Enzymen der Atmungskette Verwertung von Kohlenhydraten (Assimilation und Fermentation) Abbau von organische Säuren Enzymen des Proteinstoffwechsels Desaminasen und Decarboxylasen weiteren Enzymen (Pathogenitätsfaktoren) Beispiele Cytochromoxidase, Katalase, Nitratreduktase Zucker,.Zuckeralkohol-,Glykosid-Verstoffwechslung (Säurebildung) unter aeroben und anaeroben Bedingungen Citratverwertung Bildung von Schwefelwasserstoff Abbau von Tryptophan (Indolbildung) Spaltung von Aminosäuren ( Ornithin, Lysin) Ureasebildung Plasmakoagulase Hämolysine 7 Auswertung 2.1.1 Rachenabstrich Werten Sie Ihre Blutagarplatte aus ist eine Reinkultur gelungen (sind unterschiedliche Einzelkolonien erkennbar? Wie sehen die Kolonien aus? Welche Keimgruppen erwarten Sie im Rachenraum? Welche dieser Keimgruppen können Sie bei optimalen Bedingungen auf Ihrer Agarplatte erwarten, welche nicht? 4. Prüfung der Resistenz von Bakterien zur vollständigen Diagnostik gehört neben der Identifizierung der Mikroorganismen auch die Empfindlichkeitsprüfung der Keime gegen verschiedene Antibiotika (erfolgt im Kurs bei Frau Dr. Wurster) Kurs 3 Auswertung 5 Desinfektionsversuch (s. Tabelle S18) Welche Aussagen lassen sich aus den Ergebnissen ableiten? 6. Differenzierung von sporenbildenden Bakterien - mikroskopieren Sie die Fertigpräparate P4, P5, P6, P7 - Identifizieren Sie die Bakterien nach Lokalisation der Spore - beziehen Sie den Sauerstoffbedarf (aerobes/anaerobes Wachstum) mit ein - Protokollieren Sie die jeweils assoziierten Krankheitsbilder Nr Sporenform und –lokalisation (Zeichnung), O2Bedarf Keim-Name assoz. Erkrankung P4 P5 P6 P7 8 7. Differenzierung weiterer Erreger über Kultur und Präparat Mikroskopieren Sie die Fertigpräparate P16 und P17, die von den Kulturen K16 und K17 angefertigt vorliegen (Methylenblaufärbung). Beurteilen Sie die Koloniemorphologie. Vergleichen Sie makroskopisches und mikroskopisches Ergebnis. Ziehen Sie Ihre bereits vorhandenen Protokolle von identifizierten Erregern hinzu Nr Präparat (Zeichnung) Koloniemorphologie Keim 16 17 8. Demonstration von Pilzkulturen Mikroskopieren und zeichnen Sie die vorgegebenen Pilzpräparate, arbeiten Sie die Unterschiede zwischen den Gattungen heraus. P8 Name: Merkmale: Bedeutung: P9 Name: Merkmale: Bedeutung: P10 Name: Merkmale: Bedeutung: P11 Name: Merkmale: Bedeutung: 9 Kurs 4 Virologie 10. Quantitative Virusbestimmung mit dem Hämagglutinationstest (HA) Prinzip des Testes: EinigeViren (Influenza, Röteln, Adeno) besitzen Antigene mit hämagglutinierenden Eigenschaften. Erythrozyten werden durch das Hämagglutinin zu einem Netz verknüpft. Material auf den Arbeitsplätzen PBS: isotone phosphatgepufferte Kochsalzlösung AG: Virusantigen wird einzeln ausgeteilt ER: Erythrozyten Durchführung: Teil 1: Virusverdünnungsreihe auf der log Basis 2 erstellen. - 50 µl PBS pro well in eine Querreihe (insgesamt 12 wells) der Mikrotiterplatte pipettieren (jeder Student setzt eine Reihe an!). - 50 µl Virusantigen AG in well 1 geben, mischen - 50 µl aus well 1 in die zweite Vertiefung geben, überpipettieren u.s.w bis well 12 - 50 µl Erythrozytensuspension (ER) in jede der 12 Vertiefungen - mischen durch leichtes Klopfen an die Platte - Inkubation ca 1 Std. bei Raumtemperatur Teil 2: Auswertung Die höchste Virusverdünnung, bei der eine Hämagglutination erkennbar ist, ist als eine hämagglutinierende Einheit festgelegt.(1HE) Welche Verdünnung der Virussuspension entspricht in der Analyse einer hämagglutinierenden Einheit? ______________________ Welche Verdünnung muss eingesetzt werden um 4 hämagglutinierende Einheiten zu haben? ____ 4 HE werden bei der Durchführung des Hämagglutinations-Hemmtestes eingesetzt zur quantitativen Bestimmung von Antikörpern Prinzip Serumverdünnungsreihe 4 HE ( quantifizierte Virussuspension) Erythozyten Hemmung der Hämagglutination wenn Antikörper vorhanden sind. 10 11. Nachweis viraler Nukleinsäuren mit Hilfe der Polymerasenkettenreaktion 11.1 Qualitativer Nachweis von Virusnukleinsäure Prinzip der Methode : Amplifikation eines spezifischen DNA-Abschnittes von Viren (bei RNA-Viren ist vorherige Umschreibung in cDNA erforderlich). Durchführung: Die nachfolgenden Arbeitsschritte 1. bis 3. wurden bereits im Labor durchgeführt 1. Reaktionsansatz (z.B.): Mastermix [Aqua dest + dNTP-Mix (dATP, dCTP, dGTP, dTTP) + 10x Taq-Reaktionspuffer (Tris-HCL, MgCl2, KCl) + Primer 1 + Primer 2 + Taq-DNA-Polymerase (= 1 Einheit) 49µl DNA 1µl 2. Amplifikationsschritte im Thermocycler: Enzymaktivierung (95°C, 5 min) 30 Zyklen [Denaturierung ( 95°C, 45 sec), Annaeling (55°C, 90 sec), DNA-Synthese (72°C; 90 sec)] 3. Nachweis der Amplifikate 3µl Probenpuffer vorlegen 5µl Amplifikat (nach 30 Zyklen) zugeben auftragen auf 3%iges Agarose-Gel mit Ethidiumbromid (10µg/ml) Elektrophorese 30 min 120V, Auswerten unter UV-Licht. Die Beurteilung der Reaktion erfolgt anhand der Banden-Laufweite Werten Sie die vorgegebenen Gel-Bilder aus. Ordnen Sie den einzelnen Lauf-Spuren den jeweiligen Erreger zu. Erwartete Amplifikatlänge: Hepatitis B – Virus Adenovirus Herpes simplex – Virus Enterovirus 11.2 400 bp 198 bp 150 bp 119 bp DNA-Längenstandard Quantitativer Nachweis von Virusnukleinsäure In der real-time PCR kommen zusätzlich zum klassischen Reaktionsansatz Detektionssysteme (hier fluorogene Sonden) bereits während der PCR zum Einsatz. Diese Kombination im one-tube Verfahren ermöglicht die simultane Amplifikation und Detektion. Über Kontroll-Material mit definierter Kopienzahl ist neben der Detektion auch eine Quantifizierung positiv gemessener Proben möglich. Werten Sie die vorgegebenen Real-time PCR Protokolle aus. Die Kontrollen sind auf ~1000 Kopien/ml eingestellt. Wie hoch ist die viral load der positiv gemessenen Proben (die Differenz von 4 Ct-Werten entspricht etwa dem Faktor 10). 11 12. Virusanzucht in der Zellkultur, Nachweis und Quantifizierung über zytopathischen Effekt (CPE) Prinzip der Methode Viren als obligate Zellparasiten verändern die Zellen in ihrer Morphologie, z.T. virusspezifisch Material auf den Arbeitsplätzen: Objektträger mit zwei verschiedenen Zellarten nach Virusinfektion und nichtinfizierten Zellen als Kontrolle Durchführung Im Labor wurde eine Virus-Verdünnungsreihe von 10-1 bis 10-7 hergestellt, aus der die verschiedenen Zellkulturen (obere und untere Reihe) mit der jeweiligen Virusverdünnung infiziert und bei 37°C für 4 Tage inkubiert wurden Well 1 bis 7: Zellen mit Virus infiziert Well 8: Zellen nicht infiziert Mediumzusammensetzung: Anorganische Salze Ca, K, Mg, Na BME-Eagle Aminosäuren 12 verschiedene Vitamine 9 verschiedene Andere Komponenten Glukose, Phenolrot Auswertung Für die Auswertung im Praktikum wurde der Objektträger mit Azeton fixiert Mikroskopieren mit kleiner Vergrößerung (kein Öl verwenden) Welcher Zelltyp liegt in der oberen bzw unteren Verdünnungsreihe vor a) epitheloid oder b) fibroblastoid - Mikroskopieren Sie die Ihnen bereitgestellte virusinfizierte Zellkultur - bestimmen Sie den Virustiter über den zytopathischen Effekt (virusbedingte Zellveränderung) (Der Endpunkt ist definiert durch das Zellkulturareal, in dem noch ein zytopathischer Effekt im Vergleich zur Kontrolle zu beobachten ist). 10-1 10-2 10-3 10-4 10-5 10-6 10-7 Zellkontrolle Zelltyp 13. Nachweis von Antikörpern im Serum mit verschiedenen Methoden 13.1 ELISA Testprinzip: Der im Humanserum vorhandene Antikörper bildet mit dem auf der Mikrotiterplatte fixierten ErregerAntigen einen Immunkomplex. Mit diesem Komplex verbindet sich ein enzymmarkierter sekundärer Antikörper = [(anti-human) Ziege-Meerrettich Peroxidase Konjugat]. Nach Zugabe von Substratlösung TMB (farblos) wird durch die Enzymaktivität (Peroxidase) ein blauer Farbstoff entwickelt, der durch Zugabe der Stopplösung (stark sauer) in gelb umschlägt. 12 Benötigte Materialien: PBS (Probenverdünnungsmittel), Kontrollen (negativ, schwach positiv = cut-off, positiv), Konjugat [(antihuman) Ziege-Meerrettich-Peroxidase Konjugat], Substratlösung, Stopplösung Patientenserum Durchführung: Kontrollen und Patientenseren 1 : 100 in PBS verdünnen und nach folgendem Schema 100 µl in den Mikrotiterstreifen pipettieren. 1 2 3 4-8 - Negativ-Kontrolle (nK) cut off (schwach positiv) (co) Positiv-Kontrolle (pK) Pat. 1 bis Pat . 5 1 h Inkubation 37°C Waschprozeß 50 µl Konjugat bis hier vom Labor vorbereitet 100 µl Substratlösung B (TMB=Tetramethylbenzidin-Substratlösung) 5 min Reaktionszeit 100 µl Stopplösung (Stop = Citratlösung) Umwandlung von blau nach gelb Visuelle Auswertung Werten Sie den ELISA-Test für HCV aus. Bei welchen Proben muss ein Bestätigungstest in Form eines Immunoblots (IBL) durchgeführt werden? nK co pK Pat.1 Pat. 2 Pat. 3 Pat. 4 Pat. 5 Ergebnis IBL (j/n) 13.2 Immunoblot (IBL): Nachweis von Antikörpern spezifisch gegen einzelne Proteine Testprinzip: Im humanen Serum vorhandene erregerspezifische Antikörper binden an membran-gebundene ErregerAntigene und bilden Immunkomplexe. Daran bindet ein sekundäres enzymmarkiertes Anti-HumanImmunglobulin (Anti-IgG, Anti-IgM, Anti-IgA), durch Substratumsatz (s. ELISA) werden die Reaktionen sichtbar und so die entsprechenden Antikörpersubgruppen nachgewiesen. – die Besonderheit jedes IBL liegt in der Art und Menge der an die Membran gebundenen Antigene – Erregerproteine werden nach ihrem Molekulargewicht aufgetrennt und anschließend auf NitrocelluloseMembran übertragen (Erregerlysat vs. rekombinant gewonnene Antigene) Immunoblots werden meist als Bestätigungs-Tests vorhergehender Suchtests (ELISA) eingesetzt. Werten Sie das Bandenmuster der Immunoblots für die Seren aus, die im Versuch 13.1 im HCV-ELISA reaktiv waren (s. Abb. S. 18). Welche Aussagen können Sie für die einzelnen Patienten treffen? Nr. Strept. C1 C2 E2 NS3 NS4 NS5 Interpretation 01 15 9 17 04 13 Färbeverfahren für Bakterien Übersichtsfärbung (Methylenblau) nach Loeffler: 1. Objektträger putzen. 2. 1 Tropfen Kochsalz-Lösung aufbringen. 3. Bakterienhaltiges Material im Tropfen verreiben (Vorsicht! Nicht zu viel Material einsetzen) 4. Lufttrocknen (Die Präparate müssen völlig trocken sein). 5. Fixieren: 5mal durch die Gasflamme ziehen (bakterienhaltige Fläche nach oben). 6. Loeffler`s Methylenblaulösung, 2 Min. (Objektträger vollständig bedecken). 7. Mit Wasser spülen. 8. Zwischen Fließpapier trocknen. Bakterien u.a. Zellen blau Differentialfärbung nach Gram = Gramfärbung: 1.-5. wie Übersichtsfärbung. 6. Gentianaviolett-Phenol-Lösung, 1 Min. 7. Mit Wasser spülen. 8. Lugol`sche Lösung (Jod-Kaliumjodid), 1 Min. 9. Mit Wasser spülen. 10. 96% Ethanol (Küvette): schwenken, bis keine Farbwolken mehr herausgelöst werden. 11. Fuchsin-Phenol-Lösung, 1 Min. 12. Wie Übersichtsfärbung 7.-8. grampositive Bakterien blauviolett, gramnegative Bakterien rot Färbung zur Darstellung metachromatischer Granula nach Neisser: 1.-5. Wie Übersichtsfärbung 6. Neisser I, 25 Sek. 7. Farbstoff abgießen und Objektträger zwischen Fließpapier trocknen. 8. Neisser II, 15 Sek. 9. Wie 7. (nicht spülen!) gelbbraune Bakterien, Polkörperchen fast schwarz Färbung zur Darstellung säurefester Stäbchen nach Ziehl-Neelsen: 1.-5. Wie Übersichtsfärbung. 6. Karbol-Fuchsin-Lösung: Objektträger vollständig bedecken, 3mal bis zur Dampfbildung erhitzen. 7. Mit Wasser abspülen. 8. Salzsäure-Alkohol: bis keine Farbwolken mehr herausgelöst werden. 9. Mit Wasser spülen. 10. Loeffler`s Methylenblau-Lösung, 1 Min. 11. Mit Wasser spülen. 12. Zwischen Fließpapier trocknen. säurefeste Stäbchen rot, übrige Bakterien u.a. Zellen blau Tusche-Färbung zur Kapseldarstellung nach Burri: 1. 1 Öse Tusche (evt. 1:2 verdünnt mit A.dest) auf gründlich gereinigten Objektträger aufbringen 2. sehr kleine Menge einer jungen Bakterienkultur einbringen 3. bakterienhaltigen Farbstoff mit einem Objektträger wie beim Blutausstrich verteilen 4. nach Trocknen mikroskopieren Bakterien = helle Aussparungen auf dunklem Grund Sporenfärbung: 1.-5. Wie Übersichtsfärbung 6. mit Malachitgrünlösung Objektträger vollständig bedecken, ca. 1 Min. bis zur Blasenbildung erhitzen 7. 10 Sekunden wässern. 8. 15 Sek. gegenfärben mit Safraninlösung oder Fuchsinlösung 9. Wie Übersichtsfärbung 7.-8. grüne Sporen in bräunlich / rötlichem Sporangium 14 Differenzierung von Bakterien Teil 1 Keim Kolonie morphologie (Größe, Randbeschaffenheit, Schleimbildung) mikroskopisches Bild (Zeichnung) Gram-Verhalten Katalase-Test Clumpingfaktor Hämolyse-Typ Identifizierung K2 K3 K4 K5 K6 K7 Differenzierung von Bakterien Teil 2 Keim Koloniemorphologie (Größe, Randbeschaffenheit, Farbe, Schleimbildung) mikroskopisches GramBild Verhalten (Zeichnung) Wachstum auf „Bunte Reihe“ MacConkeyLactoseAgar (+Lactose- fermentation fermentation) Identifizierung K8 K9 K10 K11 K12 K13 K14 K15 16 Zu Aufgabe 3.4.2: Identifizierung von gramnegativen fakultativ anaeroben Stäbchen (Enterobacteriaceae) mit Hilfe von biochemischen Reaktionsprofilen („Bunte Reihe“) Glukose Laktose AmmoniumZitrat H2S Urease / Indol Ornithin Rhamnose negativ grün grün grün hell hell grün positiv orange orange blau schwarz hell Urease: pink Indol: roter Ring Urease / Indol violett orange E. coli + + - - - / + d d Enterobacter cloacae + d + - - / - + + Klebsiella pneumoniae + + + - (+) / - - + Klebsiella oxytoca + + + - (+) / + - + Citrobacter spp. + (+) + + - / - d + Proteus mirabilis + - d + + / - + - Proteus vulgaris + - d + + / + - - Morganella morganii + - - - + / + + - Providencia rettgeri + - + - + / + - d Serratia marcescens + - + - - / - + - Salmonella spp. + - + + - / - (+) + Pseudomonas aeruginosa - - + - -/- - - Spezies: Eigenes Isolat + (+) d = = = = negativ positiv positiv, langsame Spaltung kann sowohl + als auch – sein, verschiedene biochemische Typen zu Aufgabe 5 Ablaufschema: Desinfektionsversuch Test 1 Test 2 Tageshand Tageshand mit E. coli nach Desinfektion nach dem Waschen mit Wasser kurzes Auflegen der Fingerkuppe auf den Nährboden kurzes Auflegen der Fingerkuppe auf die vorgegebene Bakterienkultur, dann auf den Nährboden Hände desinfizieren mit „STERILLIUM“, dann kurzes Auflegen der Fingerkuppe auf den Nährboden normales Händewaschen nur mit Wasser, dann kurzes Auflegen der Fingerkuppe auf den Nährboden 1. Gruppe X 2. Gruppe X X X 3. Gruppe X 4. Gruppe X X X 1) 1) danach Hände desinfizieren mit „Sterillium Virugard“ Auswertung: 1. Gruppe 2. Gruppe 3. Gruppe 4. Gruppe zu Aufgabe 13.2: Nachweis und Differenzierung von Antikörpern (Bsp. HCV) 18