Folie 1 - Extras Springer
Werbung

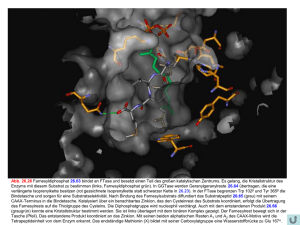
Abb. 25.2 Es ist gelungen, eine Kristallstruktur von MMP-12 mit den beiden Spaltprodukten zu bestimmen (Abb. 25.1 c). Das Spaltprodukt des ehemaligen N-Terminus (links, Kohlenstoffatome hellrot) koordiniert mit seiner neu entstandenen Carbonsäurefunktion über ein Sauerstoffatom an das Zinkion, bildet aber keine Wasserstoffbrücke zum Enzym aus. Das aus dem C-Terminus entstandene Spaltprodukt (rechts, Kohlenstoffatome hellgrün) bildet vier H-Brücken zur Hauptkette des Proteins und bindet mit seinem P1’-Rest in die tief ausgebildete S1’-Tasche. Die freigesetzte Aminogruppe koordiniert an Glu 219 und das Wassermolekül, das an das Zinkion bindet.