Übungen zur VL Chemie für Biologen und Humanbiologen 21.01
Werbung

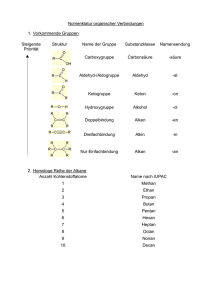
Übungen zur VL Chemie für Biologen und Humanbiologen 21.01.2011 1. Benennen Sie die folgenden Verbindungen nach IUPAC-Nomenklatur: a) 3-Methyl-4-propylhexan Erklärung: Es liegt keine funktionelle Gruppe vor, weshalb die längste Kette zur Hauptkette ernannt wird. Es gibt zwei Möglichkeiten für eine längste Kette. Die horizontale Kette ist zu bevorzugen, da hier der erste Substituent schon an Position 3 (Kriterium: früheste Substituenten Position) steht. Hier gibt es wiederum zwei Möglichkeiten die Kette durchzunummerieren. Korrekt ist die Nummerierung von rechts nach links, da hier die niedrigste Nummer zuerst im Namen auftaucht. b) 2-Hexen (trivial) bzw. Hex-2-en (korrekt nach IUPAC) Erklärung: Die Kette besitzt 6 Kohlenstoffatome und enthält eine Doppelbindung. Deshalb muss die Endung –an geändert werden zur Endung –en. Die Position der Doppelbindung wird durch eine Nummer (möglichst niedrig) direkt vor dem Suffix en angezeigt. c) 4,5,5-Trimethyl-Non-1-en Erklärung: Die Hauptkette muss die funktionelle Gruppe enthalten, hier die Doppelbindung. Die Nummerierung der Hauptkette erfolgt so, dass die Doppelbindung an möglichst niedrieger Position auftaucht, hier Nummer 1. Es gibt nur eine Art von Substituenten, nämlich Methylgruppen. Diese werden zusammengezählt und mit dem entsprechenden Präfix versehen, hier sind es drei ( Präfix = tri). Die Methylgruppen stehen einmal an Position 4 und zweimal an Position 5. Dies wird durch die entsprechenden Nummern angezeigt. 2. Zeichnen Sie die Valenzstrichformeln von folgenden Verbindungen: a) cis-2-Hexen Hex- verrät, dass die Kohlenstoffkette 6 Kohlenstoffatome lang ist. Die Endung –en bedeutet, dass das Molekül eine C-C-Doppelbindung besitzt und zwar an zweiter Stelle (2-Hexen). Die Rotation um eine Doppelbindung ist nicht möglich, deshalb gibt es zwei Diastereoisomere. Cis- und trans- bei nur zwei Substituenten bzw. Z- und E- bei mehreren Substituenten zeigen dies an. b) 2,3-Dimethyl-1-buten But- verrät, dass die Kohlenstoffkette 4 Kohlenstoffatome lang ist. Die Endung –en bedeutet, dass das Molekül eine C-C-Doppelbindung besitzt und zwar an erster Stelle (1-buten). 2,3Dimethyl heißt, dass zwei Methyl-Substituenten enthalten sind. Sie befinden sich an Kohlenstoff Nummer 2 und 3. c) 2,4-Hexadiin (trivial) bzw. Hexa-2,4-diin (korrekt nach IUPAC) Hex- verrät, dass die Kohlenstoffkette 6 Kohlenstoffatome lang ist. Diin bedeutet, dass das Molekül zwei C-C-Dreifachbindungen besitzt. Die Zahlen zeigen die Position in der Kette an. 3. Ordnen Sie die folgenden Stoffe nach der Höhe Ihres Siedepunktes und begründen Sie Ihre Entscheidung: Wasser, Ethan, Hexan Höhe des Siedepunkts: Ethan (-89 °C) < Hexan (69 °C) < Wasser (100 °C) Der Siedepunkt hängt von zwei Parametern ab: Molekülmasse und Stärke der Wechselwirkungen zwischen den Molekülen. Die Alkane Ethan und Hexan sind unpolare Moleküle und haben deshalb nur geringe anziehende Wechselwirkungen untereinander. Deshalb ist beim Vergleich der beiden die Molekülmasse entscheident. Hexan hat die fast dreifache Masse und deshalb einen höheren Siedepunkt als Ethan. Wasser hat zwar eine geringere Molekülmasse als Hexan, aber zwischen den Wassermolekülen herrschen starke anziehende Wechselwirkungen. Zum einen ist Wasser ein Dipol ( Dipol-DipolWechselwirkungen) zum anderen kann Wasser zusätzlich Wasserstoffbrückenbindungen ausbilden. Deshalb hat Wasser trotz der geringen Molekülmasse einen sehr hohen Siedepunkt. 4. Zeichnen Sie die Valenzstrichformel von 2,2,5,5-Tetramethylhexan. Prinzipiell ist die Rotation um eine Einfachbindung möglich. Zeichnen Sie die Newman-Projektionen entlang der C-C-Bindung zwischen C3 und C4 des Moleküls und beschreiben Sie die potentielle Energie in Abhängigkeit der Konformation. Welches Konfomer ist am stabilsten? Weshalb? Valenzstrichformel: Newman-Projektion: tBu = tert-Butylgruppe Ordnung der Konformationen nach Stabilität: > = > = > Die gestaffelte anti-Konformation ist am stabilsten, da die tert-Butylreste sich sterisch am wenigsten behindern. Dann kommen die gestaffelten gauche-Konformationen. Die drei ekliptischen Konformationen (Reste stehen exakt auf einer Linie; das kann man nicht exakt so zeichnen und ist deshalb nur angedeutet durch den kleineren Winkel) sind ungünstiger. Die ekliptische Konformation, in der beide tert-Butylreste exakt übereinander liegen, ist am ungünstigsten. 5. Zeichnen Sie die Valenzstrichformeln von Cyclopropan, Cyclobutan und Cyclohexan. In allen Fällen wird die Oktettregel erfüllt. Trotzdem sind die Verbindungen unterschiedlich stabil. Ordnen Sie die Verbindungen nach Stabilität und begründen Sie. Cyclopropan: Cyclobutan: Cyclohexan: Stabilität: Cyclopropan < Cyclobutan < Cyclohexan Die Kohlenstoffatome in diesen Verbindungen sind alle sp3-hybridisiert. Die vier Hybridorbitale sollten im Idealfall einen Tetraeder um das Kohlenstoffatom bilden, so dass zwischen jedem Hybridorbital ein Winkel von 109,5° eingeschlossen ist. Bei den Ringen Cyclopropan und Cyclobutan kann dieser Winkel jedoch nicht eingehalten werden. Es treten große Ringspannungen auf, weshalb diese Verbindungen nicht sehr stabil sind. 6. Zeichnen Sie die zwei Diastereoisomere von 1,2-Dimethylcyclohexan. a) Benutzen Sie die Keilschreibweise (ausgefüllter Keil aus der Papierebene hinaus, gestrichelter Keil in die Papierebene hinein). b) Zeichnen Sie beide Isomere sowohl in Wannen- als auch Sesselkonformation. a) trans cis b) trans Sessel (zwei Konfomere) axiale Stellung der Methylgruppen equatoriale Stellung Wanne (zwei Konfomere) cis Hier gibt es jeweils nur ein Konformer, denn wenn es zu einem Umklappen des Sessels oder der Wanne kommt wird die axiale Methylgruppe equatorial und umgekehrt. Das jeweils entstehende Konformer wäre identisch. Sessel Wanne 7. Ordnen Sie folgende Radikale nach Ihrer Stabilität: Lösung: > > Erklärung: Radikale werden durch Alkylsubstituenten stabilisiert (Fachwort: Hyperkonjugation). Deshalb ist das Radikal am tertiären Kohlenstoffatom am stabilsten, dann am sekundären und zuletzt am primären. 8. Die Verbrennungsprodukte Ihres Turnschuhs sind energieärmer als Ihr Turnschuh. Wieso gehen Ihre Turnschuhe nicht spontan in Flammen auf? Bei allen Reaktionen muss zunächst eine Aktivierungsenergie überwunden werden, bevor Sie ablaufen. Glücklicherweise ist diese bei Verbrennungen mit Sauerstoff meist relativ hoch (sonst würde so einiges spontan verbrennen). Energiediagramm Gibbs Energie G Übergangszustand Aktivierungsenergie ∆E Turnschuhe Verbrennungsprodukte der Turnschuhe (Reaktionsverlauf) Bildliche Vorstellung: Eine Kugel würde nicht von selbst über den Berg im in der Mitte des Diagramms rollen. Man müsste Sie zunächst mit viel Energieaufwand über die Spitze des Berges (Aktivierungsenergie) rollen. 9. Wie ist die Gibbs-Energie definiert? (Formel) Was sagt die Enthalpie aus? Was sagt die Entropie aus? G=H–T· S mit T = Temperatur Die Enthalpie H beschreibt den Energiegehalt von Materie bezüglich chemischer Bindungen und zwischenmolekularen Wechselwirkungen. Die Entropie S beschreibt die Unordnung des eines Systems (wie viele Zustände kann ein System einnehmen). 10. Die Synthese von Proteinen aus einzelnen Aminosäuren ist endergon. Was bedeutet endergon und weshalb können endergone Prozesse ablaufen? Endergon bedeutet, dass die Änderung der Gibbs-Energie eines Prozesses positiv ist. ∆G = ∆H – T · ∆S > 0 Streng genommen laufen im Universum nur exergone Prozesse ab. Ein endergoner Prozess kann deshalb nur gekoppelt mit einem exergonen Prozess ablaufen, sodass der Prozess in Summe betrachtet wieder exergon ist. Beispiel Proteinsynthese: Für den endergonen Prozess der Proteinsynthese muss Energie aus dem exergonen Prozess der Adenosintriphosphatspaltung (ATP) geliefert werden. 11. Zeichnen Sie die Valenzstrichformeln der Produkt(e) folgender Reaktionen a) Propen wird mit Wasserstoff reduziert b) Propen reagiert mit Bromwasserstoff a) b) Beide Reaktionen sind Additionen an eine Doppelbindung. Im Fall b gibt es zwei Möglichkeiten, wie Bromwasserstoff an die Doppelbindung addieren kann, so dass eine Mischung aus zwei Produkten entsteht. 12. Was passiert wenn Wein zu Essig wird? Beschreiben Sie die Umwandlung des entscheidenden Inhaltsstoffs durch Zeichnen der Valenzstrichformeln von Ausgansverbindung, Zwischenstufe und Produkt. (keine Reaktionsmechanismen gefordert)