Grundwissen 10. Klasse NTG - Leibniz
Werbung
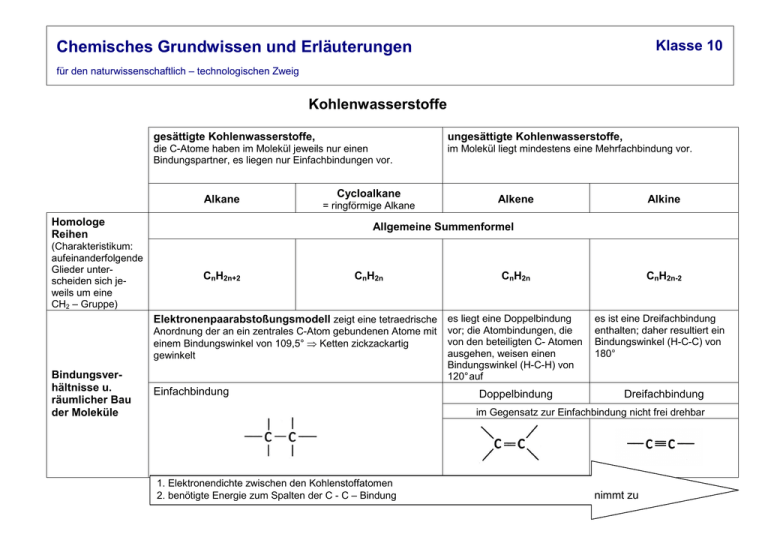
Klasse 10 Chemisches Grundwissen und Erläuterungen für den naturwissenschaftlich – technologischen Zweig Kohlenwasserstoffe gesättigte Kohlenwasserstoffe, ungesättigte Kohlenwasserstoffe, die C-Atome haben im Molekül jeweils nur einen Bindungspartner, es liegen nur Einfachbindungen vor. im Molekül liegt mindestens eine Mehrfachbindung vor. Alkane Homologe Reihen (Charakteristikum: aufeinanderfolgende Glieder unterscheiden sich jeweils um eine CH2 – Gruppe) Cycloalkane = ringförmige Alkane Alkene Allgemeine Summenformel CnH2n+2 CnH2n CnH2n Elektronenpaarabstoßungsmodell zeigt eine tetraedrische es liegt eine Doppelbindung Anordnung der an ein zentrales C-Atom gebundenen Atome mit einem Bindungswinkel von 109,5° ⇒ Ketten zickzackartig gewinkelt Bindungsverhältnisse u. räumlicher Bau der Moleküle Alkine Einfachbindung vor; die Atombindungen, die von den beteiligten C- Atomen ausgehen, weisen einen Bindungswinkel (H-C-H) von 120° auf Doppelbindung CnH2n-2 es ist eine Dreifachbindung enthalten; daher resultiert ein Bindungswinkel (H-C-C) von 180° Dreifachbindung im Gegensatz zur Einfachbindung nicht frei drehbar 1. Elektronendichte zwischen den Kohlenstoffatomen 2. benötigte Energie zum Spalten der C - C – Bindung nimmt zu C6H14 C6H12 C6H12 C6H10 Hexan Cyclohexan Hex – 1 - en Hex – 1 – in Endung - an Vorsatz Cyclo ; Endung - an Positionsnummer der Doppelbindung + Endung - en Positionsnummer der Dreifachbindung + Endung – in Typische Vertreter Benennung Name des Grundgerüstes: Stammname + Genaueres siehe IUPAC – Nomenklatur! Isomerie: bei gleicher Summenformel gibt es verschiedene Verbindungen = Isomere Struktur- oder Konstitutionsisomere haben bei gleicher E/Z- Isomere können z.B. Summenformel eine unterschiedliche Atomverknüpfung ⇒ Existenz von ketten- und ringförmigen sowie verzweigten Molekülen. Moleküle mit Doppelbindung sein. Aufgrund der fehlenden Drehbarkeit um die C – C – Achse kann es bei den anhängenden so genannten Substituenten (da Ersatz von Wasserstoffatomen) zu zwei möglichen Anordnungen kommen. ⇒ eindeutige Nomenklatur nötig Benennung von Alkanen: IUPAC Nomenklatur Vorgehensweise: 1. längste Kette aus Kohlenstoffatomen ermitteln und benennen. Aus der Zahl der Kohlenstoffatome ergibt sich der Name der Hauptkette: Alkane mit einem bis vier Kohlenstoffatomen im Benennung von ungesättigten Kohlenwasserstoffen: 1. einfach ungesättigt Alkene und Alkine werden analog zu den Alkanen benannt, allerdings mit anderen Endungen (siehe oben). Die Positionsnummer der Doppel- bzw. Dreifachbindung wird durch eine möglichst kleine Zahl angeben und vor die Molekül erhalten Trivialnamen (Methan, Ethan, Propan, Butan); ab fünf Kohlenstoffatomen im Molekül leitet sich der Name von griechischen oder lateinischen Zahlwörtern ab: Pentan, Hexan, Heptan, Octan, Nonan, Decan … 2. Seitenketten benennen und alphabetisch ordnen. Seitenketten erhalten ebenfalls ihren Namen nach der Zahl der Kohlenstoffatome. An Stelle der Endung – an erhalten die Seitenketten die Endung – yl. Die Namen der Seitenketten werden dem Namen der Hauptkette vorangestellt. 3. Anzahl der gleichen Seitenketten ermitteln und das entsprechende griechische Zahlwort (di, tri. tetra …) kennzeichnen. 4. Verknüpfungsstellen zwischen Haupt- und Seitenketten ermitteln, dabei die Hauptketten so durchnummerieren, dass die Verknüpfungsstellen kleinstmögliche Zahlen erhalten. Beispiel: physikalische Eigenschaften Reaktionsverhalten Endung geschrieben. Beispiel: Pent-2-en 2. mehrfach ungesättigt Hier setzt man vor die Endung – en bzw. – in den Vorsatz di, tri, tetra usw.; Positionsnummern werden durch Kommata getrennt. Die Doppelbindung erhält eine niedrigere Positionsnummer als die Dreifachbindung; - en steht im Namen vor – in. Beispiel: Hex – 1 – en – 5 – in Spezialfall: Benennung von E/Z – Isomeren Wenn sich die beiden Substituenten mit Priorität 1 auf der gleichen Seite der Doppelbindung befinden ⇒ Anordnung Z (= zusammen); wenn sie einander diametral gegenüber stehen ⇒ Anordnung E (= entgegengesetzt). Prioritätsregeln: Atom mit höchster Ordnungszahl hat höchste Priorität • sind die gebundenen Atome identisch, betrachtet man die an diese Atome gebundenen Atome usw. Beispiel: Innerhalb der homologen Reihen nehmen wegen der Zunahme der zwischenmolekularen Wechselwirkungen (Van – der – Waals – Kräfte) die Schmelz- und Siedetemperaturen sowie die Viskosität (Zähflüssigkeit) zu. Alkan-, Alken- und Alkinmoleküle sind unpolar, daher lösen sich die entsprechenden Kohlenwasserstoffe nur in Stoffen, die ebenfalls aus unpolaren Molekülen aufgebaut sind, also lipophile Substanzen darstellen. vollständig (genügend Sauerstoff), Reaktionsprodukte CO2 und H2O Alle Kohlenwasserstoffe können verbrannt (also oxidiert) werden unvollständig (zu wenig Sauerstoff), Reaktionsprodukte C, CO, CO2, niedermolekulare Kohlenwasserstoffe und H2O Mit zunehmender Kettenlänge wird die Flamme leuchtend oder rußend. Da innerhalb der homologen Reihen der Kohlenstoffanteil der Verbindungen zunimmt, verbrennen sie bei gleichbleibendem Sauerstoffangebot zunehmend unvollständig. Stoffklassen Alkane und Cycloalkane Alkene Alkine funktionelle Gruppe: C = C Doppelbindung funktionelle Gruppe: C ≡ C Dreifachbindung Anmerkung: Die funktionelle Gruppe bestimmt weitgehend die physikalischen und chemischen Eigenschaften einer Verbindung radikalische Substitution = Ersatz von Atomen oder elektrophile Addition : Anlagerung eines Stoffs an die Atomgruppen durch andere Atome und Atomgruppen. Beispiel: Halogenierung Mehrfachbindung von ungesättigten Kohlenwasserstoffen. Beispiel: Hydrierung charakteristischer Reaktionstyp 4 – Bromheptan Radikal = Teilchen mit mindestens einem ungepaarten Elektron Halogenierung (Reaktionsmechanismus siehe Anhang Nr. 1) Hex-1-en 1,2 – Dibromhexan nukleophiles Teilchen = Elektronendonator elektrophiles Teilchen = Elektronenakzeptor (Reaktionsmechanismus siehe Anhang Nr. 2) Allgemeinwissen: 1. Erdöl/Erdgas/Kohle sind Quellen für Kohlenwasserstoffverbindungen; Vorkommen auf der Erde ist begrenzt 2. Ozonschicht: • Herausfiltern von großen Teilen der UV-Strahlung geeignete Lebensbedingungen auf der Erdoberfläche • „Ozonloch“ entsteht durch Ausdünnung der Ozonschicht: vom Menschen produzierte und freigesetzte FCKWs bewirken den Abbau von Ozon 3. Treibhauseffekt: • Treibhausgase (Wasserdampf, Methan, CO2 etc.) vermindern die Wärmeabstrahlung ins Universum geeignete Lebensbedingungen auf der Erde • Verstärkte Verbrennung von fossilen C-haltigen Energieträgern durch den Menschen Gehalt an CO2 in Atmosphäre steigt Treibhauseffekt nimmt zu globale Erderwärmung klimatische Konsequenzen Sauerstoffhaltige organische Verbindungen Stoffklasse Alkohole Aldehyde Ketone Carbonsäuren Allgemeine Formel Funktionelle Gruppe Benennung: Name des Grundgerüstes + Carbonylgruppe Hydroxygruppe Positionsnummer + Endung – ol 1 2 R = organischer Rest oder H; R , R = organischer Rest, z. B. Alkylrest endständig mittelständig Endung - al Positionsnummer + Endung – on Carboxygruppe + Endung - säure Physikalische Eigenschaften: Allgemeine Gesetzmäßigkeit: Siedetemperatur (ϑb) steigt mit zunehmender Länge der Alkylreste und der Anzahl an funktionellen Gruppen im Molekül. ϑb (Carbonsäuren) > ϑb (Alkohole) Zwischenmolekulare Wechselwirkungen: Van – der – Waals - Kräfte + Wasserstoffbrücken > ϑb (Carbonylverbindungen) bei vergleichbarer Masse Zwischenmolekulare Wechselwirkungen: Van – der – Waals - Kräfte + Dipol - Dipol – Wechselwirkungen Erklärung: Auf Grund des Elektronensogs der Carbonylgruppe sind im Fall der Carbonsäuren die Wasserstoffbrücken stärker als bei vergleichbaren Alkoholen. Zusatzeffekt: Je zwei Moleküle Carbonsäure bilden ein so genanntes Carbonsäuredimer: Diese Dimerbildung erklärt auch, warum alle Vertreter der Alkansäuren in unpolaren Lösungsmitteln löslich sind. Wasserlöslichkeit: Je größer der Anteil der polaren Gruppen im Molekül ist, um so besser ist die Wasserlöslichkeit der entsprechenden Verbindung ⇒ bei den sauerstoffhaltigen Verbindungen sind kurzkettige und/oder mehrwertige Vertreter ( = solche, die mehr als eine funktionelle Gruppe besitzen) wasserlöslich. Reaktionen - der Alkohole nach der Anzahl der Hydroxygruppen unterscheidet man einwertige und mehrwertige Alkohole, nach der Stellung der Hydroxygruppen primäre, sekundäre und tertiäre Alkohole. Letztere unterscheiden sich in ihrem Reaktionsverhalten gegenüber Oxidationsmitteln, wie z. B. CuO, KMnO4, K2Cr2O7: Oxidation bedeutet hier Elektronenabgabe unter Erhalt der Grundstruktur des jeweiligen Moleküls. - der Carbonylverbindungen Unterscheidung von Aldehyden und Ketonen: im Gegensatz zur Ketogruppe besitzt die Aldehydgruppe eine reduzierende Wirkung, deswegen können die beiden Stoffklassen durch geeignete Nachweisreaktionen unterschieden werden: Fehling – Probe + Ketone Aldehyde Silberspiegelprobe + Gemeinsamkeit: nukleophile Addition = häufigste Reaktion der Carbonylbverbindungen, da die Doppelbindung der Carbonylgruppe polar ist. Angriffsziel für Nukleophile (Teilchen Angriffsziel für Elektrophile mit Elektronenüberschuss (Teilchen mit Elektronenmangel ⇒ ⇒ Elektronendonator) Elektronenakzeptor) Beispiel: Elektronenakzeptor Aldehyd bzw. Keton + Elektronendonator Alkohol im Stoffmengenverhältnis 1:1 Produkte Halbacetal bzw Halbketal (Reaktionsmechanismus siehe Anhang Nr.3) Elektronenakzeptor Aldehyd bzw. Keton + Elektronendonator Alkohol im Stoffmengenverhältnis 1:2 Produkte Vollacetal bzw. Vollketal - Carbonsäuren • Carbonsäuremoleküle sind Protonendonatoren. Die Acidität der Carbonsäuren hat zwei Ursachen: 1. Das Wasserstoffatom der Carboxygruppe ist aufgrund des Elektronensogs der enthaltenen Carbonylgruppe stark positiv polarisiert. Richtung der Elektronenverschiebung 2. Das entstehende Carboxylation ist ziemlich stabil, da die negative Ladung der Carboxylatgruppe über die gesamte funktionelle Gruppe verteilt (= delokalisiert) ist. …. vier Elektronen Carbonsäuren sind relativ schwache Säuren, ihre Säureanionen (= korrespondierende Basen) sind dementsprechend relativ stark. • Carbonsäuren reagieren mit Alkoholen unter Säurekatalyse in einer Kondensationsreaktion zu Carbonsäureestern. Bei einer Kondensationsreaktion vereinigen sich zwei Moleküle zu einem größeren unter Abspaltung eines kleineren Moleküls. Die Esterbildung ist eine umkehrbare oder reversible Reaktion ⇒ Verwendung eines Doppelpfeils in der Reaktionsgleichung Ester Es liegt ein chemisches Gleichgewicht vor: Hin- und Rückreaktion laufen gleichzeitig ab. Modellmäßige Beschreibung des Gleichgewichtszustandes: Esterkondensation und Esterhydrolyse laufen zwar weiterhin ab, aber mit gleicher Reaktionsgeschwindigkeit, so dass sich die Zusammensetzung des Gemisches nicht mehr ändert ⇒ dynamischer Gleichgewichtszustand Eine möglichst vollständige Esterhydrolyse erreicht man nur im Basischen. (Reaktionsmechanismen für Esterkondensation und Esterhydrolyse siehe Anhang Nr.4+5) Biomoleküle - Fette sind Gemische von Estern aus Glycerin und drei Fettsäuren Fettsäuren sind langkettige Carbonsäuren; diese können gesättigt oder ungesättigt sein. Fette sind in Wasser nicht löslich. Der Schmelzbereich der Fette liegt umso höher, je länger die Kohlenstoffketten der enthaltenden Carbonsäuren sind ⇒ steigende Van – der – Waals – Kräfte zwischen den Molekülen ⇒ Existenz von festen Fetten und fetten Ölen Wichtige chemische Reaktion der Fette: Verseifung = basische Esterspaltung niedriger, je höher der Anteil an ungesättigten Fettsäuren ist (Z-Konfiguration an der Doppelbindung ⇒ Knick ⇒ schlechtere Einordnung in ein Molekülgitter möglich) Beispiel für eine Verseifung: - Kohlenhydrate (Saccharide) • Monosaccharide (Einfachzucker) Prototyp: Glucose (C6H12O6) Das Glucosemolekül liegt sowohl in offenkettiger als auch in Ringform (Halbacetal) vor: Nucleophile Addition ⇒ Ringschluss; die Hydroxygruppe am C5 – Atom reagiert mit der Aldehydgruppe zu einem spannungsfreien Ring. offenkettige Form Ringform Aus Monosacchariden (Einfachzuckern) können durch Kondensation Disaccharide (Doppelzucker), Trisaccharide (Dreifachzucker) usw. gebildet werden. Die Verknüpfung zwischen den einzelnen Molekülbausteinen (Monomeren) nennt man glykosidische Bindung: Vereinigen sich sehr viele Monosaccharideinheiten, entstehen Polysaccaride (Vielfachzucker), wie z.B. Stärke (Reservestoff der Pflanzen und zugleich wichtigster Kohlenhydratlieferant der Tiere), die aus Hunderten von Glucosemonomeren besteht und mit Iod nachgewiesen wird (⇒ intensive Blaufärbung). Teilchenebene: Iodmolekül - Proteine Bausteine: Aminosäuren Sie sind bifunktionell, das heißt ihre Moleküle enthalten eine Carboxy- und eine Aminogruppe. Durch eine intramolekulare Protolyse (Donator – Akzeptor – Reaktion) entstehen Zwitterionen. Wegen des zwitterionischen Baus sind Aminosäuren bei Raumtemperatur kristalline Feststoffe. Aminosäuren können untereinander in einer Kondensationsreaktion über Di-, Tripeptide usw. zu Proteinen reagieren, die z. B. als Enzyme, Hormone oder Antikörper in Organismen eine wichtige Rolle spielen. Die Verknüpfung der Aminosäuren erfolgt über die sog. Peptidbindung: Die Reihenfolge ihrer Verknüpfung (= Aminosäuresequenz) ist für ein Protein charakteristisch und bestimmt letztlich dessen dreidimensionale Struktur: Beispiel: Myoglobin (Muskelfarbstoff) Anhang: Reaktionsmechanismen 1. radikalische Substitution 2. elektrophile Addition 3. nukleophile Addition an die Carbonylgruppe 4. säurekatalysierte Esterkondensation 5. basische Esterhydrolyse