als Powerpoint-File
Werbung
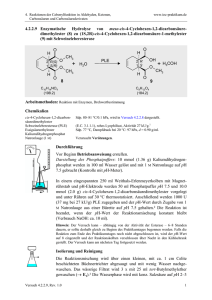
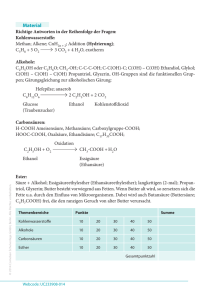
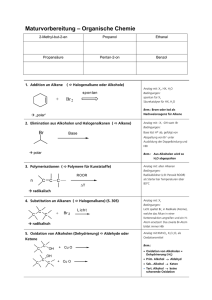
Organic Chemistry 4th Edition Paula Yurkanis Bruice Chapter 17 Carbonyl Verbindungen I Nucleophile Acyl Substitution Irene Lee Case Western Reserve University Cleveland, OH ©2004, Prentice Hall Carbonylverbindungen mit Gruppen, die durch Nucleophile ersetzt werden können Carbonsäure Säurechlorid Carbonsäureester Säurebromid Carbonsäureanhydrid Säureamid Nomenklatur von Carbonsäuren Methansäure Ameisensäure Pentansäure Valeriansäure Ethansäure Essigsäure Hexansäure Capronsäure Propansäure Propionsäure Propensäure Acrylsäure Butansäure Buttersäure Benzolcarbonsäure Benzoesäure Cyclohexancarbonsäure trans-3-methylcyclopentancarbonsäure 1,2,4-Benzoltricarbonsäure Ester Carbonylsauerstoff Carboxylsauerstoff Essigsäureethylester Ethylacetat Propansäurephenylester 3-Brombutansäuremethylester Cyclohexancarbonsäureetylester Salze der Carbonsäuren Natriummethanoat Natriumformiat Kaliumethanoat Kaliumacetat Natriumbenzolcarboxylat Natriumbenzoat Zyklische Ester = Lactone Zyklische Amide = Lactame O NH g-butyrolactam Resonanzformeln in Ester, Carbonsäuren und Amiden Carbonsäuren haben relativ hohe Siedepunkte Amide haben die höchsten Siedepunkte Polarisierung der Carbonylgruppe erlaubt den Angriff von Nucleophilen Z– wird herausgeworfen wenn es eine schwächere Base (bessere Abgangsgruppe) als Y– (k–1 >> k2) Y– wird herausgeworfen wenn es eine schwächere Base ist (k2 >> k–1) Reaktionsablauf (a) Nu– ist eine schwächere Base (b) Nu– ist eine stärkere Base (c) Nu– und die Abgangsgruppe haben ähnliche Basizität Alle Carbonsäurederivate reagieren nach dem gleichen Mechanismus Das tetraedrische Intermediat eliminiert die schwächste Base Wasser als neutrales Nucleophil Reaktionen von Säurechloriden Amide aus Säurehalogeniden Tertiäre Amide können keine Amide bilden Reaktionen von Säureanhydriden Säureanhydride reagieren nicht mir Natriumchlorid oder Natriumbromid Reaktionen von Estern Hydrolyse Umesterung Aminolyse Säure-katalysierte Esterhydrolyse Keine negativ geladene Spezies im Reaktionsmechanismus formulieren! Überschuss an Wasser treibt das Gleichgewicht nach rechts Alkohole haben einen niedrigen Siedepunkt und können durch Destillation aus dem Gleichgewicht entfernt werden Säurekatalyse Basen-katalysierte Esterhydrolyse Die Reaktion is irreversibel Mechanistische Studien Fette und Öle: Triester des Glycerols Nucleophile Acyl-substitution an Carbonsäuren Carbonsäuren gehen mit Aminen keine Acyl-Substitutionen ein Hydrolyse von Amiden Amide können nur in Gegenwart eines sauren Katalysators hydrolysiert werden Durch Protonierung kann eine bessere Abgangsgruppe entstehen Hydrolyse eines Imids Gabriel Synthese Hydrolyse von Nitrilen (drastische Bedingungen nötig) Synthese von Zyklischen Verbindungen Bildung von Lactonen Intramolekulare Friedel-Crafts-Acylierungen Bildung von zyklischen Ethern Aktivierung von Carbonsäuren Die OH-Gruppe der Carbonsäure wird in eine bessere Abgangsgruppe umgewandelt. Das Carboxylat ist ein gutes Nucleophil Säurechloride sind Ausgangspunkt für andere Acylderivate Aktivierte Carbonsäure in lebenden Organismen Dicarbonsäuren