Nomenklatur - Ihre Homepage bei Arcor
Werbung

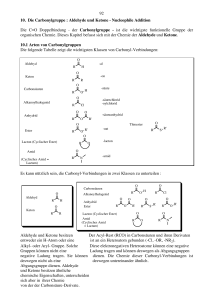
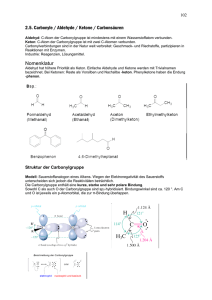
Ketone, auch als Alkanone bezeichnet, sind chemische Verbindungen, die als funktionelle Gruppe eine Carbonylgruppe (-C=O) enthalten. Im Gegensatz zu den Aldehyden ist der Carbonylkohlenstoff bei den Ketonen mit zwei anderen Kohlenstoffatomen, also zwei organischen Resten verbunden: R - CO - R Einfachstes Aldehyd ist das Aceton (Propanon). Nomenklatur Aldehyde erhalten das Suffix -on nach IUPAC-Nomenklatur. Dementsprechend heißt das vom Propan abgeleitete CH3-CO-CH3 Propanon (Trivialname Aceton) Eigenschaften Ketone mit niedriger Kettenlänge sind aufgrund der Polarisierung des C-Atoms der Carbonylgruppe mit Wasser mischbar. Reaktionen Ketone gehen ähnlich wie Aldehyde Additions- und Kondensationsreaktionen ein. Aldehyde sind chemische Verbindungen, die als funktionelle Gruppe eine Carbonylgruppe (-C=O) enthalten. Bei den Ketonen ist der Carbonylkohlenstoff mit zwei C-Atomen verbunden, bei den Aldehyden nur mit einem C-Atom und einem Wasserstoff-Atom. Einfachstes Aldehyd ist das Methanal (Formaldehyd). Aldehyde sind reaktive Verbindungen. Die Polarisierung des C-Atoms am Carbonylsauerstoff ist Ansatzpunkt für den nucleophilen Angriff. Aldehyde liegen in der Keto- und Enolform vor. Siehe: Keto-Enol-Tautomerie Bei Aldehyden tritt CH-Acidität auf, d.h. die positive Partialladung des Carbonylkohlenstoffatoms wirkt sich auf das benachbarte C-Atom aus. Trägt dieses ein Wasserstoff-Atom wird es leichter als Proton abgegeben. Nomenklatur Aldehyde erhalten das Suffix -al nach IUPAC-Nomenklatur. Dementsprechend heißt das vom Methan abgeleitete H-CHO Methanal, das vom Ethan abgeleitete CH3-CHO Ethanal. Reaktionen Nucleophile Addition Nach Angriff des Nukleophils geht das pi-Elekronenpaar gänzlich zum nun negativ geladenen Sauerstoff. Im protischen Lösungsmittel wird dies durch Protonenaufnahme ausgeglichen, wodurch eine OH-Gruppe anstelle der Carbonylgruppe entsteht. Addition von Alkoholen Alkohol + Aldehyd => Hemiacetal Hemiacetal + Alkohol => Acetal Beispiel: Ringschluss der Zucker Addition von Stickstoff-Nucleophilen Prim. Amin + Aldehyd => Imin (Schiff'sche Base) + Wasser Oxidation zur Carbonsäure (wichtig für Nachweise) Aldolreaktion Das CH-acide H-Atom kann durch Basen vom Aldehyd abgespalten werden. Das entstandene Enolat-Anion reagiert mit einem weiteren Aldehyd-Molekül weiter. Es entsteht ein Aldol, ein Kondensationsprodukt aus Alkohol (OH-Gruppe) und Aldehyd. Auf diese Weise können C-C-Bindungen geknüpft werden. Gemischte Aldolreaktion Reagiert ein aromatisches Aldehyd, (siehe: Benzaldehyd), das kein CH-acides HAtom besitzt, mit einem weiteren CH-aciden Aldehyd, entsteht ein "gemischtes" Aldol. Auf diese Weise wird in der Knoevenagel-Kondensation Zimtaldehyd, ein wichtiger Duftstoff, gewonnen. Nachweise Tollens-Probe Fehling-Probe Physiologische Bedeutung Im Stoffwechsel der Zellen finden sich eine Reihe von Aldehyden. Eine besondere Rolle spielt das Ethanal (Trivialname Acetaldehyd), das im Verlauf des Alkoholabbaus entsteht und für den so genannten Kater verantwortlich ist. Carbonsäuren sind organische Säuren. Sie tragen die funktionelle Gruppe R-COOH (Carboxylgruppe). Nach der Anzahl der Carboxylgruppen unterscheidet man Monocarbonsäuren mit einer Carboxylgruppe (z.B. Ethansäure = Essigsäure) Dicarbonsäuren mit zwei Carboxylgruppen (z.B. Ethandisäure = Oxalsäure) Tricarbonsäuren mit drei Carboxylgruppen u.s.w. Monocarbonsäuren sind einprotonige Säuren, die anderen mehrprotonige Säuren. Nach Art des Restes R unterscheidet man auch aliphatische Carbonsäuren und aromatische Carbonsäuren. Die einfachsten Monocarbonsäuren sind: Methansäure (Trivialname: Ameisensäure) HCOOH / pKs = 3.68 Ethansäure (Essigsäure) CH3COOH / pKs = 4.74 Propansäure (Propionsäure) CH3CH2COOH / pKs = 4.84 Butansäure (Buttersäure) CH3CH2CH2COOH / pKs = 4.80 Die kurzkettigen Carbonsäuren sind farblose, stark riechende Flüssigkeiten. Sie haben polaren Charakter, was zu relativ hohen Siedetemperaturen aufgrund der Wasserstoffbrückenbindungen führt. Mit zunehmender Kettenlänge nimmt der fettartige Charakter zu. Das gilt auch für die Salze der Carbonsäuren. Die häufigsten Fettsäuren haben 16 bis 18 Kohlenstoffatome. Ihre Trigylcerid-Ester sind die Fette. Die Natrium- und Kalium-Salze der Fettsäuren werden als Kernseife und Schmierseife verwendet. Acidität der Carbonsäuren Der saure Charakter der Carbonsäuren entsteht durch die Mesomerie-Stabilisierung des Carboxylat-Anions, welches durch Resonanzstrukuren beschrieben werden kann. Die Stabilität des Anions begünstigt die deprotonierte Form der Carbonsäure. Die Acidität kann noch gesteigert werden, indem am alpha-C-Atom ein Substituent mit einem elektronenziehenden, induktiven Effekt (-I-Effekt) eingefügt wird, da dieses dem C-Atom der Carboxyl-Gruppe eine positivere Partialladung zuführt, welche die negative Ladung stärker ausgleichen kann. Beispiel dafür wäre Trichloracetat im Gegensatz zum "einfachen" Acetat. Herstellung Oxidation von primären Alkoholen oder Aldehyden Verseifung von Estern Reaktion von Grignard-Verbindungen mit Kohlenstoffdioxid Hydrolyse von Cyaniden Oxidation von alkylierten Aromaten