Carbonylverbindungen
Werbung
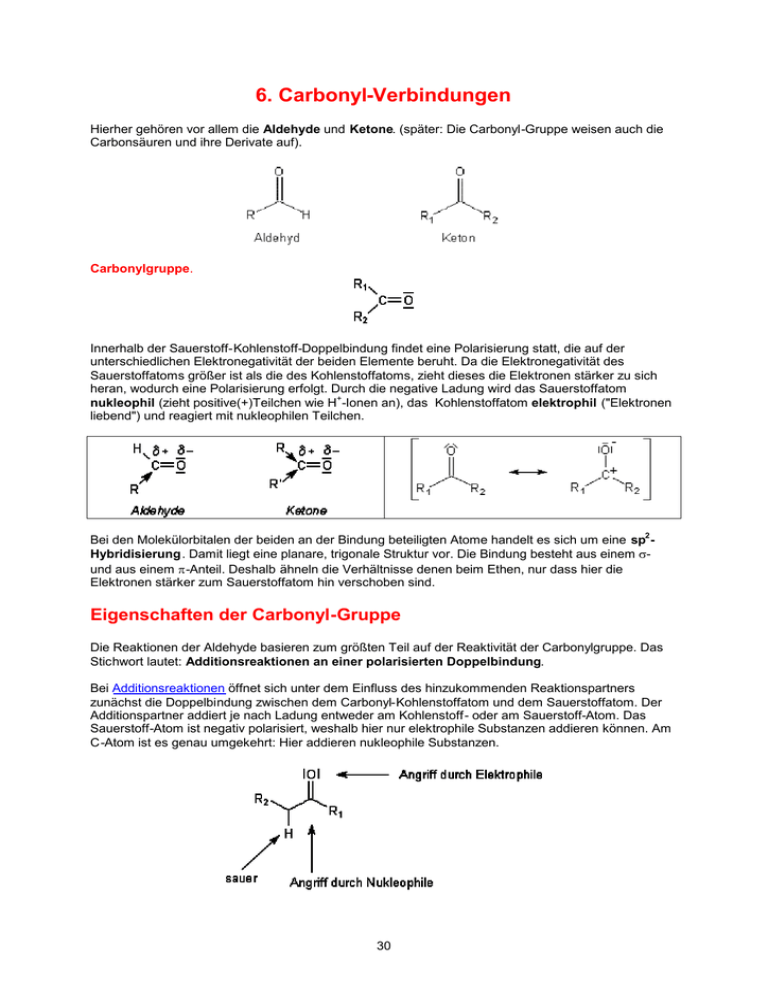
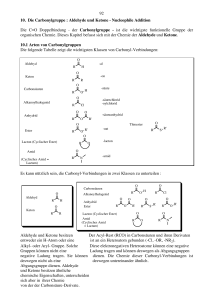
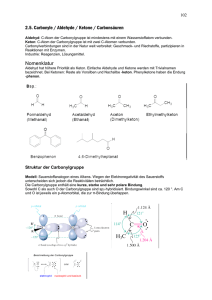
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung findet eine Polarisierung statt, die auf der unterschiedlichen Elektronegativität der beiden Elemente beruht. Da die Elektronegativität des Sauerstoffatoms größer ist als die des Kohlenstoffatoms, zieht dieses die Elektronen stärker zu sich heran, wodurch eine Polarisierung erfolgt. Durch die negative Ladung wird das Sauerstoffatom + nukleophil (zieht positive(+)Teilchen wie H -Ionen an), das Kohlenstoffatom elektrophil ("Elektronen liebend") und reagiert mit nukleophilen Teilchen. 2 Bei den Molekülorbitalen der beiden an der Bindung beteiligten Atome handelt es sich um eine sp Hybridisierung. Damit liegt eine planare, trigonale Struktur vor. Die Bindung besteht aus einem und aus einem -Anteil. Deshalb ähneln die Verhältnisse denen beim Ethen, nur dass hier die Elektronen stärker zum Sauerstoffatom hin verschoben sind. Eigenschaften der Carbonyl-Gruppe Die Reaktionen der Aldehyde basieren zum größten Teil auf der Reaktivität der Carbonylgruppe. Das Stichwort lautet: Additionsreaktionen an einer polarisierten Doppelbindung. Bei Additionsreaktionen öffnet sich unter dem Einfluss des hinzukommenden Reaktionspartners zunächst die Doppelbindung zwischen dem Carbonyl-Kohlenstoffatom und dem Sauerstoffatom. Der Additionspartner addiert je nach Ladung entweder am Kohlenstoff- oder am Sauerstoff-Atom. Das Sauerstoff-Atom ist negativ polarisiert, weshalb hier nur elektrophile Substanzen addieren können. Am C-Atom ist es genau umgekehrt: Hier addieren nukleophile Substanzen. 30 Carbonylverbindungen können sauer reagieren Das Wasserstoffatom am benachbarten C-Atom der Carbonylgruppe besitzt einen sauren Charakter. Der Grund ist der starke Elektronenzug der CO-Gruppe. Man spricht von CH-Acidität. Diese macht sich allerdings erst in Gegenwart von starken Basen bemerkbar - wie bei der Aldolreaktion. Bemerkenswert ist aber auch der saure Charakter von Ketonen. Es bildet sich ein Gleichgewicht aus, die Keto-Enol-Tautomerie. Ein bekanntes Beispiel ist der Acetessigester. 6.1 Nomenklatur der Aldehyde und Ketone Die Vertreter dieser Klasse von Verbindungen werden, mit systematischen und mit Trivialnamen benannt. Aldehyde Die systematischen Namen der Aldehyde leiten sich von denen der entsprechenden Alkane durch Hinzufügung der Endung -al ab. Die Position der C=O-gruppe wird nicht spezifiziert. Definitionsgemäss ist ihr C-Atom C-1. Solange die Aldehydfunktion der längsten Kohlenstoffkette angehört,ist auch die Numerierung der anderen C-Atome eindeutig festgelegt : Systeme die nicht so einfach durch die Endung -al benannt werden können, werden als Carbaldehyde bezeichnet. Entsprechend den IUPAC-Regeln bekommen Ketone die Endung –on. Die Position der Carbonylgruppe in der längsten Kette bekommt die niedrigste Nummer. Bei komplizierten Strukturen wird die Vorsilbe oxo oder keto benutzt, um die Gegenwart einer Carbonylgruppe deutlich zu machen. 31 6.2 Reaktionen der Carbonyl-Gruppe Nukleophile Addition von Alkoholen Vom Aldehyd zum Acetal - vom Keton zum Ketal Aldehyde und Ketone reagieren mit Alkoholen. Es bilden sich im Fall der Aldehyde Halbacetale und Acetale (auch Vollacetale genannt). Mit Ketonen bilden sich Halbketale und Ketale. Man spricht aber in beiden Fällen von Acetalen. Die Reaktion zum Halbacetal findet in saurem Millieu statt. Die Protonen der Säure dienen hier lediglich als Katalysator. Zu Beginn reagiert ein Proton mit dem Sauerstoff des Acetons; das C-Atom der Carbonylgruppe bekommt eine positive Ladung. Setzt man diese Verbindung nun mit Ethanol um, so bindet das partial negativ geladene Sauerstoffatom des Ethanols an das positiv geladene C-Atom der Carbonylgruppe. Durch die Abspaltung des an das Sauerstoffatom gebundenen Protons entsteht das Halbacetal. - Halbacetalbildung ist reversibel. Bildung von Vollacetalen Liegt Alkohol im Überschuss vor, so geht diese Reaktion über die Halbacetal-Stufe hinaus, und es bildet sich ein Vollacetal. Die saure Katalyse ist hierfür eine notwendige Voraussetzung. Acetalbildung und -spaltung werden von Säuren (besser: durch Protonen) katalysiert. Eine Reaktion mit großer Bedeutung Die (Halb-)Acetalbildung ist in von großer Bedeutung. In der Natur findet man die Halbacetalbindung beispielsweise in Kohlenhydraten: Die beiden Acetalbildungsreaktionen ermöglichen erst die typische Ringbildung. Vollacetale liegen bei der Verknüpfung von Monosacchariden zu Oligo- oder Polysacchariden vor. 32 Aldoladdition - Aldolkondensation Die Aldoladdition ermöglicht - ausgehend von Ketonen und Aldehyden - die Synthese von β-HydroxyDerivaten. Die Reaktion findet unter Basen- (oder Säure)-Katalyse statt. Mechanismus Durch Zugabe von Base werden Enolate gebildet, welche mit einem zweiten Äquivalent Aldehyd oder Keton abreagieren: Danach erolgt häufig eine Aldolkondensation als Folgereaktion, da β-Hydroxycarbonylverbindungen gerne zu α,β-ungesättigten Verbindungen eliminieren (besonders bei hohen Temperaturen). 33 6.3 Darstellung von Aldehyden und Ketonen Es gibt zahlreiche Methoden zur Darstellung von Aldehyden und Ketonen, von denen einige der wichtigsten bereits im Zusammenhang mit der Besprechung anderer funktionellen Gruppen erwähnt wurden. Zum Beispiel : Synthese von Aldehyden : 1) OXIDATION primärer Alkohole Synthese von Ketonen 1) OXIDATION sekundärer Alkohole) 34