CHE 151.1: Organische Chemie für die Biologie
Werbung

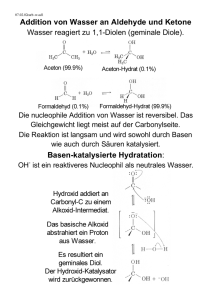
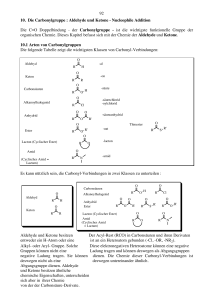
Inhalt Index 10. Die Carbonylgruppe : Aldehyde und Ketone - Nucleophile Addition Die C=O Doppelbindung der Carbonylgruppe ist die wichtigste funktionelle Gruppe der organischen Chemie. Dieses Kapitel befasst sich mit der Chemie der Aldehyde und Ketone. 10.1 Arten von Carbonylgruppen Die folgende Tabelle zeigt die wichtigsten Klassen von Carbonyl-Verbindungen: Aldehyd -al Keton -on Carbonsäure -säure Alkanoylhalogenid -säurechlorid -oylchlorid Anhydrid säureanhydrid Ester -oat Lacton (Cyclische Ester) -lacton Amid (Cyclisches Amid = Lactam) -amid Es kann nützlich sein, die Carbonyl-Verbindungen in zwei Klassen zu unterteilen : Carbonsäure Aldehyd Alkanoylhalogenid Keton Anhydrid Ester Aldehyde und Ketone besitzen entweder ein H-Atom oder eine Alkyl- oder Aryl-Gruppe. Solche Gruppen können keine negative Ladung tragen. Sie können deswegen nicht als Abgangsgruppe dienen. Aldehyde und Ketone besitzen ähnliche chemische Eigenschaften, unterscheiden sich aber in ihrer Chemie von den Carbonsäurederivaten. Lacton (Cyclische Ester) Amid (Cyclisches Amid = Lactam) Der Acyl-Rest(RCO) in Carbonäuren und ihren Derivaten ist an ein Heteroatom gebunden (-Cl, -OR, -NR2). Diese elektronegativen Heteroatome können eine negative Ladung tragen und können deswegen als Abgangsgruppen dienen. Die Chemie dieser Carbonylverbindungen ist deswegen untereinander ähnlich. 10.2 Struktur und chemische Eigenschaften der Carbonylgruppe Sowohl das Sauerstoff- als auch das Kohlenstoffatom der Carbonylgruppe sind sp2-hybridisiert und liegen daher in der gleichen Ebene wie die beiden anderen Nachbaratome des Kohlenstoffatoms ; die Bindungswinkel am C-Atom betragen etwa 120o : Der Vergleich mit der elektronischen Struktur der Doppelbindung in Alkenen zeigt zwei wesentliche Unterschiede ; Das Sauerstoffatom trägt zwei freie Elektronenpaare und ist auch stärker elektronegativ als C. Das letztere beeinflusst die π-Elektronenwolke so, dass eine nennenswerte Polarisierung der C=O-Bindung zu beobachten ist : Auf diese Weise wird das Kohlenstoffatom elektrophil und das Sauerstoffatom nucleophil und leicht basisch : 10.3 Nomenklatur der Aldehyde und Ketone Die Vertreter dieser Klasse von Verbindungen werden, mit systematischen und mit Trivialnamen benannt. Aldehyde Die systematischen Namen der Aldehyde leiten sich von denen der entsprechenden Alkane durch Hinzufügung der Endung -al ab. Die Position der C=O-gruppe wird nicht spezifiziert. Definitionsgemäss ist ihr C-Atom C-1. Solange die Aldehydfunktion der längsten Kohlenstoffkette angehört,ist auch die Numerierung der anderen C-Atome eindeutig festgelegt : Systeme die nicht so einfach durch die Endung -al benannt werden können, werden als Carbaldehyde bezeichnet. Entsprechend den IUPAC-Regeln heissen Ketone Alkanone, dabei wird die Endung -on an den Namen des entsprechenden Alkans angehängt. Die Position der Carbonylgruppe in der längsten Kette wird durch Numerierung in der Weise festgelegt, dass das Kohlenstoffatom der Carbonylgruppe die niedrigste mögliche Nummer erhält: Bei komplizierten Strukturen wird die Bezeichnung oxo benutzt, um die Gegenwart einer Carbonylgruppe deutlich zu machen. Zahlreiche Substituenten, die eine Carbonylgruppe enthalten, haben spezielle Namen, z.B.: 10.4 Reaktionen von Aldehyden und Ketonen : Nucleophile Additonsmechanismen Die Carbonylgruppe ist stark polarisiert, und demzufolge greifen Elektrophile das Sauerstoffatom und Nucleophile das Kohlenstoffatom an. Eine der wichtigsten Reaktionen, die Aldehyde und Ketone eingehen, ist die Nucleophile Addition an der Carbonylgruppe : Wir können die folgenden allgemeinen Mechanismen schreiben : 10.4.1 Nucleophile Addition von Wasser Wasser kann sich als ein Nucleophil benehmen, obwohl seine Nucleophilie gar nicht so stark ist (vgl. Kapitel 8.4.2). In der Wasserlösung ensteht also ein Gleichgewicht zwischen der Carbonylverbindung und dem entsprechenden geminalen Diol, das auch als Carbonylhydrat bezeichnet wird : Carbonylhydrate entstehen nur langsam im Wasser bei pH 7, werden aber in Gegenwart von Säuren oder Basen beträchtlich schneller gebildet. Die Reaktion wird also durch Säure oder Base katalysiert - Die Gleichgewichtskonstante bleibt identisch, die Reaktion erreicht die Gleichgewichtslage aber schneller. Warum? Im Fall einer Basenkatalyse, bei pH >7, ist OH- vorhanden, was gegenüber Wasser ein viel besseres Nucleophil ist : Basenkatalysierte Addition Im basenkatalysierten Mechanismus agiert das Hydroxid-Ion als Nucleophil . Wasser fängt dann das intermediäre Addukt unter Bildung des geminalen Diols ab, wobei der Katalysator wieder frei wird. Im säurekatalysierten Mechanismus erfolgt zuerst eine Protonierung auf das Lewis-basische Carbonyl-O. Dadurch wird die C=O Gruppe stärker polarisiert, und die Carbonyl-C-Atomgruppe ein stärkeres Elektrophil. Jetzt greift ein Wassermolekül, obwohl es immer noch ein schwaches Nucleophil ist, auch sehr rasch an : Säurekatalysierte Addition Es ist zu bemerken, dass der basen-katalysierte Prozess rascher abläuft, weil das OH--Ion ein viel besseres Nucleophil ist als ein Wassermolekül. Der säure-katalysierte Prozess hingegen läuft rascher ab, weil durch Protonierung der Carbonylgruppe ein besseres Elektrophil für den Nucleophil-Angriff gebildet wird. Allgemein finden Additionen an C=O-Gruppen umso schneller statt, je elektrophiler das Carbonyl-C-Atom ist : Reihenfolge der Reaktivität von C=O-Gruppen bei eine nukleophile Addition: Man kann die elektrophile Kraft dieses Zentrums grob mit der Stabilität des in der dipolaren Resonanzstruktur formulierten Carbeniumions korrelieren. Das höher (mit Alkylgruppen) substituierte Carbeniumion ist das stabilere, und seine Reaktivität sinkt in dieser Reihenfolge. Elektronenziehende Substituenten destabilisieren das positiv polarisierte C-Atom, weswegen es bei einem nucleophilen Angriff reaktiver ist. Den Reaktionsgleichungen ist zu entnehmen, dass die Hydratisierung von Aldehyden und Ketonen reversibel ist. Für Ketone liegt das Gleichgewicht normalerweise auf der linken Seite, für Formaldehyde und Aldehyde mit elektronenziehenden Substituenten rechts. Aldehyde weisen Gleichgewichtskonstanten um 1 auf, z.B.: 10.4.2 Nucleophile Addition von Alkoholen Aldehyde und Ketone reagieren mit Alkoholen in Gegenwart eines Säure-Katalysators und geben Acetale und Ketale als Produkte, z.B.: Es sollte nicht überraschen, dass auch Alkohole an Aldehyde und Ketone addieren, wobei der Mechanismus dem der Hydratisierung praktisch gleicht. Die so erhaltenen Produkte nennt man Halbacetale oder Halbketale : Diese Additionsreaktionen werden ebenfalls von einem Gleichgewicht beherrscht, das normalerweise auf der Seite der Carbonylverbindung liegt. In Gegenwart eines Überschusses an Alkohol geht die säurekatalysierte Reaktion mit Aldehyden oder Ketonen über die Halbacetal-Stufe hinaus : Dieser zweite Schritt kann als eine SN1 Substitutionsreaktion (sp3 -Zentrum) gesehen werden : Dabei ist jeder Schritt reversibel. Die gesamte Reaktionsfolge von der Carbonylverbindung bis zum Acetal ist ein Gleichgewichtsprozess. Durch Manipulation der Reaktionsbedingungen kann das Gleichgewicht nach rechts oder nach links verschoben werden: Acetal/Ketal Bildung benötigt einen Alkoholüberschuss Acetal/Ketal Hydrolyse benötigt einen Wasserüberschuss 1,2-Ethandiol (Glycol) und ähnliche Diole reagieren mit Aldehyden und Ketonen in Gegenwart katalytischer Mengen Säure zu cyclischen Acetalen und Ketalen : Eine wichtige Eigenschaft der Acetale und Ketale ist ihre relative Inertheit gegenüber Basen, Grignard-Reagenzien, Hydrid-Reduktionsmitteln und anderen Nucleophilen. Dies ist nicht allzu überraschend, wenn man sie als Ether auffasst. Man kann Acetale und Ketale als "maskierte" Aldehyde oder Ketone betrachten. Insbesondere die cyclischen Systeme werden als Schutzgruppen für die Carbonylfunktion in Aldehyden und Ketonen verwendet. Halbacetale und Halbketale sind meist nicht isolierbar. Man kann aber Halbacetale oder Halbketale von Hydroxyaldehyden oder Hydroxyketonen isolieren, wenn ein Ringschluss zur Bildung von relativ spannungsfreien Fünf- oder Sechsringen führt : Dies kann man mit Hilfe der Entropie erklären. In intermolekularen Reaktionen kombinieren 2 Moleküle unter Bildung einer neuen Struktur. Dies ist entropisch ungünstig. Entsprechend ist die umgekehrte Reaktion entropisch begünstigt. Im Gegensatz dazu wandelt sich bei der intramolekularen Reaktion ein Molekul in ein neues um. Jetzt ist die Entropieänderung viel geringer, und dementsprechend liegt das Gleichgewicht mehr auf der Produktseite, da die Enthalpiebilanz günstig ist. Die intramolekulare Bildung von Halbacetalen hat in der Chemie der Zucker (Kohlenhydrate) grosse Bedeutung. 10.4.3 Nucleophile Addition von Grignard Reagenzien Grignard Reagenzien addieren an Aldehyde und Ketone in gleicher Weise wie andere Nucleophile unter Bildung von Alkoholen (siehe Kapitel 9.5) : Durch diesen Mechanismus können alle im Kapitel 9.5 angegebenen Reaktionen zwischen Grignard- Reagenzien und Aldehyden oder Ketonen erklärt werden. 10.4.4 Die nucleophile Addition von Aminen an Aldehyde und Ketone Kondensation zu Iminen, Oximen und Hydrazonen Man kann Amine als die N-Analoga der Alkohole betrachten. Das N-Atom ist jedoch stärker nucleophil als das OAtom, und daher addieren Amine sehr effektiv an Carbonylgruppen von Aldehyden und Ketonen zunächst unter Bildung von Halbaminalen und dann von Iminen: Mechanismus : Die Bildung eines Imins ist auch reversibel und durch Behandlung von wässeriger Säure wird das Imin wieder zu einem Aldehyd oder Keton hydrolysiert. Eine Reihe von anderen Imin-ähnlichen Derivaten können auch durch die Reaktion zwischen einem Aldehyd oder Keton und einem Amin-Derivate (H2N-X) hergestellt werden : 10.4.5 Die Addition von Kohlenstoff-Nucleophilen an Aldehyde und Ketone Cyanhydrine Neben Alkoholen und Aminen können zahlreiche andere Nucleophile die Carbonylgruppe angreifen. Besonders wichtig sind Kohlenstoff-Nucleophile, da man auf diesem Wege neue C-C-Bindungen bilden kann. HCN, zum Beispiel, addiert an Carbonylverbindungen, wodurch Hydroxyalkannitrile gebildet werden, die auch Cyanhydrine genannt werden: Der Mechanismus der Cyanhydrinbildung beginnt mit einem nucleophilen Angriff des Cyanid-Ions und endet mit einer Protonierung des O-Atoms : Die Reaktion kann durch Basen leicht umgekehrt werden, da sie das Gleichgewicht durch Entzug der Protonen auf die Seite der freien Cyanid-Ionen verschieben. Da die Nitrilgruppe durch weitere Reaktionen umgewandelt werden kann, sind Cyanhydrine wichtige Zwischenprodukte : 10.4.6 Die nucleophile Addition von Hydrid - die Reduktion von Aldehyden und Ketonen Wir haben in Kapitel 9.5 gesehen wie Aldehyde und Ketone zu Alkoholen reduziert werden können : Metallhydriden wie NaBH4 und LiAlH4 übertragen ein Äquivalent Hydrid (H-) auf die C=O-Doppelbindung. Ein Aldehyd oder Keton wird so zu einem Alkohol reduziert : LiAlH4 ist reaktiver als NaBH4 und kann nur in aprotischen Lösungsmitteln wie Ether eingesetzt werden. Insgesamt werden alle vier Wasserstoffatome von AlH4- auf vier Carbonylgruppen übertragen. Auch mit Lithiumaluminiumhydrid lassen sich Hydrid-Ionen nucleophil an Carbonylgruppen addieren : 10.4.7 Beispiele aus der biologischen Chemie Viele der Reaktionen, die man im Labor verwendet, kommen auch in der Natur vor. Ein Biosyntheseweg zu gewissen α-Aminosäuren verläuft zum Beispiel über eine Nucleophile Addition von Ammoniak an eine αKetocarbonsäure (hier Pyruvinsäure = Pyruvic acid) : (vgl. Kapitel 6.2) Andere Beispiele kommen oftmals in der Kohlenhydrat-Chemie vor. Glucose zum Beispiel ist eine Hexose und kann in einer Fischer-Projektion als ein Aldehyd geschrieben werden. Aber wenn man Glucose mit spektroskopischen Methoden untersucht, stellt man fest, dass keine Aldehydgruppe vorhanden ist ! Der Grund dafür ist, dass Glucose als ein cyclisches Halbacetal vorliegt : (vgl. Kapitel 15) Auch Cyanohydrine kommen in der Natur vor. Sie spielen eine interessante Rolle in einem chemischen Verteidigungsmechanismus, den gewisse Tausendfüssler (Millepede) benutzen, z.B. Apheloria corrugata. Wenn sie angegriffen werden, wird Mandonitril sowie ein Enzym, das die Zersetzung von Mandonitril zu Benzaldehyd und HCN katalysiert, abgesondert. HCN wird dadurch "auf die Angreifer geschossen" ! 10.5 Die Darstellung von Aldehyden und Ketonen Es gibt zahlreiche Methoden zur Darstellung von Aldehyden und Ketonen, von denen einige der wichtigsten bereits im Zusammenhang mit der Besprechung anderer funktionellen Gruppen erwähnt wurden. Zum Beispiel : Synthese von Aldehyden : 1) OXIDATION primärer Alkohole (vgl. Kapitel 9.7.3) Synthese von Ketonen 1) OXIDATION sekundärer Alkohole (vgl. Kapitel 9.7.3) 2) Aromatische Ketone durch Friedel-Crafts Acylierung (vgl. Kapitel 5.5) 10.6 Oxidation von Aldehyden mit CrO3 - Mechanismus Wir haben früher gesehen, dass Alkohole mit CrO3 oxidiert werden können. Primäre Alkohole ergeben zuerst Aldehyde. Weitere Oxidation führt zu Carbonsäuren. Die Mechanismen für solche Oxidations-Prozesse können folgenderweise formuliert werden : Ausgehend von einem Aldehyd kann in Gegenwart von Wasser ein Carbonyl-Hydrat gebildet werden, was dann über einen analogen Mechanismus oxidiert werden kann. Sekundäre Alkohole können aber mit diesem Verfahren nur bis zu Ketonen oxidiert werden. Inhalt Index