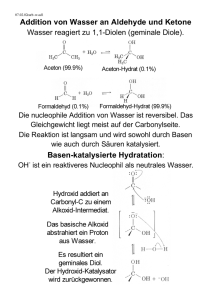
Aldehyde sind
Werbung

Organische Sauerstoff Verbindungen z Die Carbonylgruppe z Aldehyde und Ketone Carbonylgruppe z C=O Doppelbindung z wichtigste funktionelle Gruppe auch Oxo-Derivate Oxidationsprodukte der Alkohole z z z z z 2 Carbonylklassen Carbonsäuren mit ihren Derivaten Aldehyde und Ketone Carbonylgruppe Struktur und chemische Eigenschaften Doppelbindung ist von zentraler Bedeutung Bindungswinkel vom Kohlenstoff Carbonylgruppe Sp2-hybridisiert z Sauerstoff- und Kohlenstoffatom π σ C O σ-Bindung: Entsteht wenn Orbitale normal zueinander überlappen π-Bindung: Die p-Orbitale überlappen parallel Sp2-hybridisiert O trägt 2 freie e- -Paare, stärker elektronegativ als C, e- näher bei O Elektronegativitätstendenz führt zu starker Polarisierung Sauerstoffatom z Auswirkung stärker auf die p-Bindung als auf die s-Bindung z Formelmäßig Partialladung z Carbonyl-C-Atom: + positive Partialladung z Carbonyl-O-Atom: - negative Partialladung z Kohlenstoffatom elektrophil z Sauerstoffatom nucleophil Oxidationsprodukte von Alkoholen z z z mittlere Oxidationsstufe Produkt abhängig an welchem C-Atom die Hydroxylgruppe hängt Oxidation von Alkoholen zu Aldehyden, Ketonen oder Carbonsäuren ist möglich Primärer Alkohol OH-Gruppe an einem primären Kohlenstoff einständig Sekundärer Alkohol OH-Gruppe an einem sekundären Kohlenstoff zweiständig Tertiärer Alkohol OH-Gruppe an einem tertiärem Kohlenstoff dreiständig z z z Oxidationsmittel: chem. Elemente und Verbindungen die durch Aufnahme von Elektronen in einen energetisch stabileren Zustand übergehen Oxidation bedeutet hier Reaktion mit Erhaltung des C-Gerüsts, von dem man ausgegangen ist Produkt von den Reagenzien und Reaktionsbedingungen Aldehyde z Aldehyde sind Oxidationsprodukte von primären Alkoholen z „ alcohol dehydrogenautus“, von Liebig 1835 Benennung z z Carbonylgruppe endständig, CHO, 1 H direkt am O Endung „al“ oder auch „oxo“ – z z.B.: H-CHO Methanal Trivialnamen für arom. Aldehyde – daraus entstehenden Säure und der Endung - aldehyd – z.B.: Methanal daraus Ameisensäure (amicidum formicicum) → Formaldehyd. Eigenschaften der Aldehyde: Es gibt: z niedere Aldehyde: – – z flüchtig unangenehm stechenden, Schleimhaut reizenden Geruch höhere Aldehyde: – – flüssig bis fest Obstartigen , blumenartigen Geruch Aldehyde sind: z z polare - reaktionsfreudige Verbindungen neigen zu – – – z z z z z Polymerisationsreaktionen Kondensationen Addition Bei der Synthese bei Kunststoffen und Kunstharzen genützt e- anziehende Wirkung von O → Alpha-H-Atome → Basenanwesenheit → leichte Bildung von Carbanionen Zwischenprodukte bei Herstellung von Parfümen, Gerbereibedarfsmitteln, Farbstoffen, Kunststoffen Moleküle können untereinander keine Wasserstoffbrücken bilden daher tieferer Siedepunkt als bei entspr. Alkoholen Niedrige Aldehyde können mit Wasserstoff-Brücken Additionsverbindungen bilden Starke Reduktionsmittel Nachweis von Aldehyden z 1. Fehlingsche Lösung z 2. Tollens Reagens z 3. Schiff Reagens 1. Fehlingsche Lösung Fehling I: Kupfersulfatlösung Fehling II: Natronlauge mit K-Na-Tartrat ( Salz der Weinsäure) z Vermischen beider Lösungen -> tiefblaues Kupfer-(II)-Hydroxid, durch Tartrat („Seigenettesalz“) komplex in Lösung gehalten z Beim Erwärmen mit Aldehyd entsteht durch Reduktion ein ziegelrotes unlösliches Kupfer(I)-oxid Cu2O. z Probe war früher in Medizin Für den Nachweis reduzierender Glucose im Harn von Diabetikern von großer Bedeutung. 2. Tollens - Reagens z frisch zubereitende Lösung des Silberdiamminkomplexes: Silbernitratlösung mit Natronlauge versetzt und das Ag2O in Ammoniak gelöst. z Durch geringe Menge eines Reduktionsmittels → elementares Silber als schöner Silberspiegel an der Gefäßwand abgeschieden. z Diese Reaktion wird großtechnisch zur Spiegelproduktion verwendet z 1 + 2 auch von anderen Stoffen gezeigt 3. Schiff Reagens z z z z Aldehydgruppe nachgewiesen rotvioletten Triphenylmethan - Farbstoff Fuchsin, durch schwefelige Säure entfärbt schwefelige Säure wird durch den Aldehyd gebunden Ergebnis: ursprüngliche Farbe Vorkommen z Organismen: Zwischenprodukte des Stoffwechsels z Natur: gebunden in Polysachariden z Freier Form: nur gering, va. in ätherischen Ölen Anwendung und Verwendung z z z z z z z z Technik, Bauwesen und Haushalt Somit auch in Atmosphäre vorhanden niederen Aldehyde: chemischen Industrie Ausgangsstoffe bei Synthesen und der Kunststoffherstellung Lösungs-, Desinfektionsmittel, Konservierung biologischer Harze höheren + aromatischen Aldehyde: Riechstoffen (z.B. Vanillin in Schoten der Vanillestaude) Aromen, Pharmazeutika, Pflanzenschutzmitteln und Farbstoffen verarbeitet. Gesundheitsgefährdung z z z z z Erbrechen mit Bauchschmerzen Gesundheitsschädlich beim Einatmen, Verschlucken und Berührung mit der Haut Kann Allergien hervorrufen Reizt die Augen und Atmungsorgane Vorübergehende Beschwerden wie Schwindel, Übelkeit, Kopfschmerzen etc. Wichtiges Aldehyde Formaldehyd (Methanal) z z z z z z z z farbloses, brennendes, giftiges stechend riechendes Gas Gut löslich Wasser -> Formalin Hohe Reaktionsfreudigkeit Schadstoff Krebserregende Wirkung -> aber wenig Erkrankungen bei Ärzten Kontaktvermeidung Virentöter und reagiert mit Eiweiß Verwendung • • • • • • • • • • • verleimte Produkte aus Holzwerkstoffen, Korkplatten Dämmstoffe und Ausschäummaterial (F.-Harnstoff-Schäume) Anstrichstoffe, Farben, Lacke, Parkettsiegel (F. im Konservierungs- oder Bindemittel) Glas- + Steinwolle, Fasermatten (für Bindemittel) Textilien und textile Bodenbeläge (Veredelung mit HarnstoffFormaldehyd-Harzen) Reinigungs-, Pflege- und Desinfektionsmittel Kosmetika, z.B. Mundspülmittel oder Nagelhärter Tabakrauch Emissionen von Gasherden Auch als Gerbstoff da Formaldehyd Eiweiß härtet Kunststoffindustrie ! Gesundheitsgefährdung z z z z z z z Wegen der Geruchsgewöhnung besteht selbst bei hohen Konzentrationen keine Warnwirkung Giftig: Einatmen, Verschlucken, Berührung mit Haut Irreversibler Schaden möglich Allergien Schädigung von Leber und Nieren möglich krebserzeugende Wirkung Verätzungen Acetaldehyd (Ethanal) z z z z z z z z Flüssigkeit: stechend obstartig Entsteht: Oxidation von Ethanol Geruch von gebrochenem Wein darauf zurückzuführen, die bei Luftzutritt von Essigsäurebakterien erzeugt Wichtiges Zwischenprodukt bei Synthesen. Einfluss starker Säuren: Bildung von cyclischen Polymeren: Paraldehyd: früher Schlafmittel Metaldehyd: als Trockenspiritus und Schneckenvertilgungsmittel Aldolkondensation z z Wichtige Reaktion bei Synthesen Erklärung: Alpha-H-Atome können leicht abgegeben werden so tritt bei Basenanwesenheit folgende Reaktion auf: Aldolkondensation z z z Das entstandene positive Carbanion kann ein weiteres Aldehydmolekül am positiven C- Atom angreifen: Es entsteht ein Aldol Sie ermöglicht die Knüpfung von C-C Bindungen, deshalb wichtige Reaktion bei Synthesen. Cannizzaro Reaktion Bei Aldehyden , die kein Alpha ständiges H-Atom besitzen (Benzaldehyd), kann keine Aldolkondensation eintreten. Sie bilden unter dem Einfluss einer Base einen Alkohol oder eine Säure Weitere wichtige Aldehyde: Citronella Ketone z z z Ketone sind Oxidationsprodukte von sekundären Alkoholen Carbonylgruppe im Inneren (-CO-) Bennennung Endung „ON“oder auch Vorsilbe „OXO“ R, R* =/ H Propanon Eigenschaften z z z farblose Flüssigkeiten mit aromatischen Geruch Lösungsmittel weniger reaktionsfähig als Aldehyde •Acidität der Alpha-H-Atome>Gleichgewicht. Keto- Enol -Tautomerie von Bedeutung biologischen Systemen Vorkommen und Verwendung z Naturstoffen z.B. Hormone, Stoffwechselzwischenprodukte Ölen, Duftstoffen (z.B. Campher) z Lösungsmittel für Lacke, Farben und Klebstoffe z z z z z Ausgangsstoff für Herstellung anderer Stoffe !!! Gesundheitsgefährdung Entfettet die Haut +Entzündung Gesundheitsschädlich beim Einatmen, Verschlucken und Berührung mit der Haut. Lungenödem Wichtiges Keton: Aceton (Propanon) z z z z z z z Angenehm riechende Flüssigkeit Lösungsmittel: Fette +Kunststoffe Mit Wasser mischbar Mit Luft explosiv Hauptbestandteil im Nagellackentferner Diabetiker: Auftreten von Aceton im Harn Stoffwechselentgleisung Herstellung: Petrochemisch durch Oxidation von 2-Propanol Iodoformreaktion: z z z z z z z Reaktion (anderer Methylketonen + Ethanol) Zusatz von Iod zu Natronlauge -> Bildung von Hypoiodit: J2 + 2 OH- ==> JO- + J- + H2O Hypoiodition greift am positiven Alpha- C Atom an Durch die Elektronegativität des Halogens wird das C Atom noch stärker für die Substitutionsreaktionen aktiviert. Es kommt zu einer völligen Halogenierung der Halogengruppe CH3COCH3 + 3 JO- ==> CH3COCJ3 + 3 OH- z Das Hydroxidion der Base greift am Carbonylkohlenstoff an: CH3COCJ3 + OH- ==> CHJ3 + CH3COO- z Dadurch zerfällt das Triiodaceton letztlich in Iodoform und ein Acetation. z Promierung von Aceton z z z Beweis für die Aktivität der Alpha Position Bromaceton bildet sich rasch: früher verwendet als Tränengas: CH3-CO-CBr3 Dämpfe greifen Schleimhäute an. Tränengas heute: meist Chloracetophenon Naturstoffe, die Ketogruppen enthalten z Campher , Kampfer z hydroaromatische Verbindung Wasser kaum, Alkohol+ Ether leicht löslich Grauweiße Masse, stechender Geruch Stammpflanze natürlichen Camphers: Kampferbaum z z z z Menthon mit Menthol in der z Veilchen Pfefferminze Fichtennadelöl und Campher