Grundwissen Chemie für die 10. Jgst. des NTG
Werbung
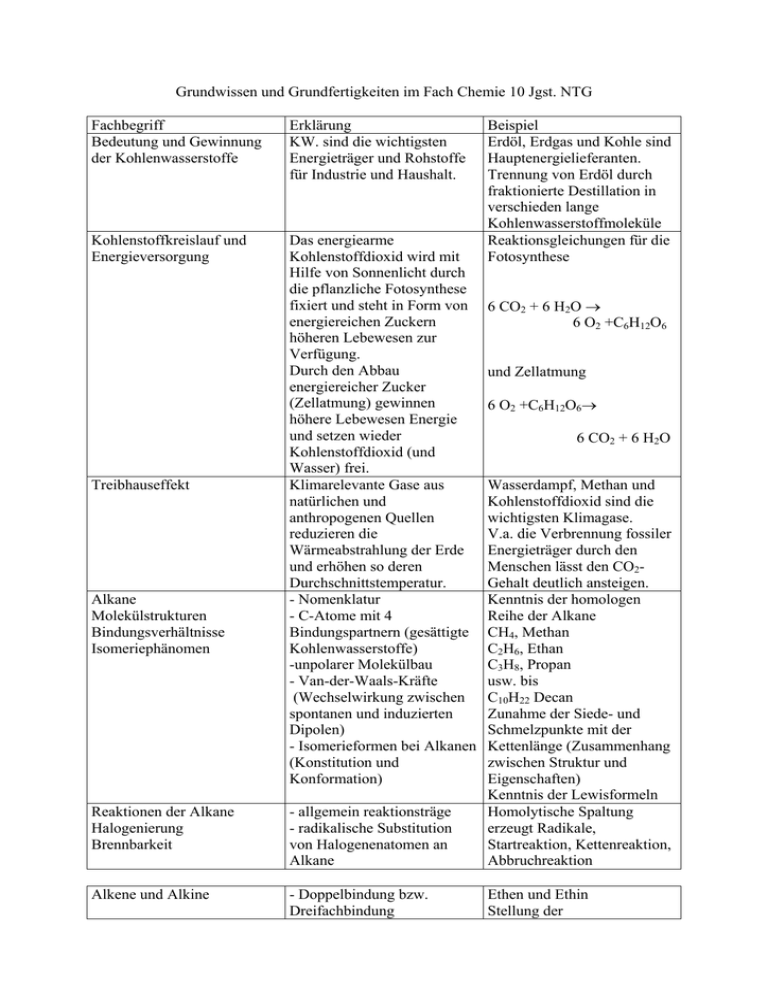
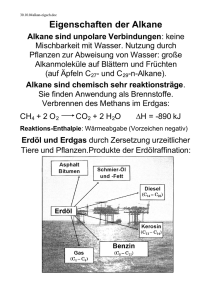
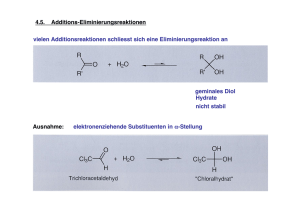
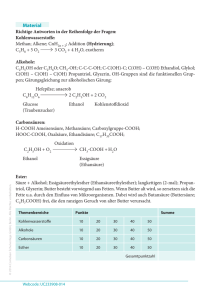
Grundwissen und Grundfertigkeiten im Fach Chemie 10 Jgst. NTG Fachbegriff Bedeutung und Gewinnung der Kohlenwasserstoffe Erklärung KW. sind die wichtigsten Energieträger und Rohstoffe für Industrie und Haushalt. Kohlenstoffkreislauf und Energieversorgung Das energiearme Kohlenstoffdioxid wird mit Hilfe von Sonnenlicht durch die pflanzliche Fotosynthese fixiert und steht in Form von energiereichen Zuckern höheren Lebewesen zur Verfügung. Durch den Abbau energiereicher Zucker (Zellatmung) gewinnen höhere Lebewesen Energie und setzen wieder Kohlenstoffdioxid (und Wasser) frei. Klimarelevante Gase aus natürlichen und anthropogenen Quellen reduzieren die Wärmeabstrahlung der Erde und erhöhen so deren Durchschnittstemperatur. - Nomenklatur - C-Atome mit 4 Bindungspartnern (gesättigte Kohlenwasserstoffe) -unpolarer Molekülbau - Van-der-Waals-Kräfte (Wechselwirkung zwischen spontanen und induzierten Dipolen) - Isomerieformen bei Alkanen (Konstitution und Konformation) Beispiel Erdöl, Erdgas und Kohle sind Hauptenergielieferanten. Trennung von Erdöl durch fraktionierte Destillation in verschieden lange Kohlenwasserstoffmoleküle Reaktionsgleichungen für die Fotosynthese 6 CO2 + 6 H2O → 6 O2 +C6H12O6 und Zellatmung 6 O2 +C6H12O6→ 6 CO2 + 6 H2O Reaktionen der Alkane Halogenierung Brennbarkeit - allgemein reaktionsträge - radikalische Substitution von Halogenenatomen an Alkane Wasserdampf, Methan und Kohlenstoffdioxid sind die wichtigsten Klimagase. V.a. die Verbrennung fossiler Energieträger durch den Menschen lässt den CO2Gehalt deutlich ansteigen. Kenntnis der homologen Reihe der Alkane CH4, Methan C2H6, Ethan C3H8, Propan usw. bis C10H22 Decan Zunahme der Siede- und Schmelzpunkte mit der Kettenlänge (Zusammenhang zwischen Struktur und Eigenschaften) Kenntnis der Lewisformeln Homolytische Spaltung erzeugt Radikale, Startreaktion, Kettenreaktion, Abbruchreaktion Alkene und Alkine - Doppelbindung bzw. Dreifachbindung Ethen und Ethin Stellung der Treibhauseffekt Alkane Molekülstrukturen Bindungsverhältnisse Isomeriephänomen Nichtwasserstoffatome oder Atomgruppen an der Doppelbindung (cis = Z = zusammen, trans = E = entgegengesetzt) Elektrophiler Angriff an die - reaktive Verbindungen - Nachweis durch π-Elektronen der DoppelBromwasserprobe bzw. Dreifachbindung Unterscheidung von Hin- und Carbonsäure und Alkohol Rückreaktion bilden unter Wasseraustritt einen Ester (Kondensation). Durch Wasser kann ein Ester wieder in Carbonsäure und Alkohol gespalten werden (Hydrolyse). sog. fossile Energieträger als Durch Inkohlungsprozesse bildeten sich Erdöl-, ErdgasMotorentreibstoffe neben regenerativen Energieträgern, und Kohlelagerstätten. Es handelt sich jeweils um nur wie Holz, Pflanzenölen, (begrenzt verfügbare) Bioethanol u. a. Stoffgemische aus verschiedenen Kohlenwasserstoffen Ethenmoleküle reagieren aus kurzkettigen Alkenen unter geeigneten könne langkettige Moleküle Bedingungen miteinander zu entstehen langkettigem Polyethen(Kunststoffherstellung) Molekülen (PE) Zerstörung der Ozonschicht Halogenierte (Ozonloch) in der Kohlenwasserstoffe sind Stratosphäre durch ökologisch sehr problematisch und z. T. auch Halogenierte KW, die in Halogenradikale zerfallen giftig Alkohole: Hydroxylgruppe Kenntnis der jeweiligen Aldehyde und Ketone: funktionellen Gruppen und Carbonylgruppe der daraus resultierenden physikalischen Eigenschaften Säuren: Carboxylgruppe (Siede- und Schmelzpunkte, Löslichkeit) Stufenweise Oxidierbarkeit zu Redoxgleichungen mit Kaliumpermanganat oder Aldehyden /bzw. Ketonen Dichromat formulieren und weiter zu Carbonsäuren können Aldehyde werden zur Silberspiegelprobe und Fehlingreaktion beschreiben Carbonsäuren oxidiert, dabei wird Ag+ zu Ag reduziert und als Reaktionsgleichung formulieren können. (Silberspiegel) bzw. kann auch Cu2+ zu Cu+ reduziert werden (Fehling). Der Kohlenstoff der Aldehyde reagieren mit Carbonylgruppe wird leicht Alkoholen unter Bildung von - ungesättigter Charakter - Z/E-Isomerie (Konfiguration) Reaktionen der Alkene und Alkine elektrophile Addition chemische Reaktionen sind umkehrbar (chemisches Gleichgewicht, kein MWG) Erdöl, Erdgas und Kohle Polymer Halogenalkane Sauerstoffhaltige organische Verbindungen: Alkohole, Aldehyde und Ketone, Carbonsäuren Reaktionen der Alkohole Nachweis der Aldehyde Reaktionen der Carbonylgruppe Carbonylverbindungen Acidität der Carboxylgruppe Veresterung und Ester Gärung chemisches Gleichgewicht Fette Bedeutung der Fette Das Kohlenhydrat Glucose von nukleophilen Teilchen angegriffen (nukleophile Addition). Wichtige Bedeutung als Lösemittel und Zwischenprodukt der chemischen Industrie Halbacetalen. Kenntnis wichtiger Vertreter: Formaldehyd (Methanal), Acetaldehyd (Ethanal), Aceton (Dimethylketon = Propanon) Essigsäure (Ethansäure) ist Das H-Atom ist polar eine schwache Säure, die in gebunden und kann wässeriger Lösung Protonen abgespalten werden abspaltet und mit (Protolyse). Es entstehen Wassermolekülen H3O+ Ionen Salze. bildet. Acetate heißen die Salze der Essigsäure. Propansäureethylester entsteht Ester entstehen in einer aus Ethanol und Propansäuer reversiblen Reaktion aus unter Wasser austritt. Carbonsäure- und Alkoholmolekülen. Kenntnis (Kondensation). Ester sind z. B. als der Nomenklatur und der Lösungsmittel, technischen Bedeutung der Konservierungsmittel und Ester Aromastoffe von Bedeutung Unter Sauerstoffausschluss C6H12O6 →2C2H5OH + 2CO2 können verschieden physiologische Wirkung des Organismen Traubenzucker Alkohols: Organschäden, zu Ethanol und Beeinträchtigung der Kohlenstoffdioxid abbauen Sinneswahrnehmung und und gewinnen so Energie. Reaktionsfähigkeit Hinreaktion: Die Esterbildung ist Ester bildet sich unter reversibel, d.h. umkehrbar. Wasserabspaltung Viele chemische Reaktion (Kondensation) sind umkehrbar. Rückreaktion: Spaltung des Esters durch Hydrolyse Ester aus Glycerin und drei Bildung durch Kondensation, langkettigen Carbonsäuren Verseifung mit Lauge liefert neben Glycerin die Na+/K+Salze der Fettsäuren („Seifen“) Energieträger, hoher Ernährung des Menschen Brennwert, essentielle Fettsäuren besitzen Vitamincharakter Pflanzenöle als Rohstoffe für nachwachsende Rohstoffe Kraftstoffherstellung und Industrie Glucose in offenkettiger Form mehrfunktionelle Verbindung, mit Aldehydgruppe und die unter Wasseraustritt Alkoholgruppen in Fischer(Kondensation) eine Projektion zeichnen können Stärke Aminocarbonsäuren Proteine (Eiweiße) biologische Bedeutung der Proteine Glucosebausteine (Monomere) treten unter Wasseraustritt zum Polysaccharid Stärke zusammen Amino- und Carboxylgruppe am α-C-Atom Durch Kondensation bilden Aminosäuren langkettige Proteine (Makromoleküle) Proteine sind als Bau- und Gerüststoffe sowie als Biokatalysatoren (Enzyme) von Bedeutung Ringform bildet (nukleophile Addition) Nähr- und Speicherstoff bei Pflanzen Basizität der Aminogruppe, Bildung der Zwitterionenstruktur Struktur der Peptidbindung Kollagen und Keratin als Baustoffe Katalase als „Protein“-Enzym Grundfertigkeiten Kenntnis wichtiger Alkane, Alkene und Alkine und ihrer Benennung Beschreibung der Bindungsverhältnisse und der Isomerieformen Formulieren von radikalischer Substitution sowie von elektrophiler und nukleophiler Addition Kenntnis von der Umkehrbarkeit vieler Reaktionen Kenntnis des Kohlenstoffkreislaufs und Vorstellungen von der Rohstoff- und Energieversorgung der Menschheit Kenntnis wichtiger sauerstoffhaltiger Verbindungen und ihres Reaktionsverhaltens Kenntnis der Grundstruktur von Kohlenhydraten, Fetten und Proteinen und ihrer Bedeutung als Biomoleküle